2. 中国兽医药品监察所国家动物布鲁氏菌病参考实验室, 北京 100083
2. National Reference Laboratory for Animal Brucellosis, China Institute of Veterinary Drug Control, Beijing 100083, China
布鲁菌病(简称布病)是由布鲁菌(Brucella)引起的一种人畜共患病,其主要表现为波浪热、关节炎以及生殖系统障碍[1],危害公共安全,并且给畜牧业造成严重的经济损失[2-3]。布鲁菌属有6个经典菌种,包括羊种布鲁菌(B. melitensis)、牛种布鲁菌(B. abortus)、猪种布鲁菌(B. suis)、犬种布鲁菌(B. canis)、绵羊附睾种布鲁菌(B. ovis)与沙林鼠种布鲁菌(B. neotomae),随后又陆续发现6个新布鲁菌变种:海洋哺乳动物分离到的鳍种布鲁菌(B. pinnipedialis)和鲸种布鲁菌(B. ceti),从红狐狸和土壤中分离到的田鼠型布鲁菌(B. microti),以及还未有中文命名先例的B. inopinata、B. papionis和B. vulpis[4-7]。其中以羊种、牛种和猪种布鲁菌最为常见且危害性较高[8]。
牛种布鲁菌分为8个生物型,包括1、2、3、4、5、6、7和9型[9],其中主要的流行株为1型、3型和5型[10]。牛种布鲁菌自然宿主为牛、野牛和麋鹿,其毒力强,易感染人[11]。牛种布鲁菌在麋鹿中最初被发现是在1998年美国的爱达荷州[12],起初布鲁菌病被认为是从牛传染给麋鹿和野牛的一种外溢性传染病,而后被证实麋鹿也可以传染给牛[13]。鹿的布鲁菌病在世界各地广泛流行,我国关于鹿感染布鲁菌的报道较少,尚无针对鹿源布鲁菌分离株鉴定与测序分析的相关文章。本文对一株从患病麋鹿上分离到的布鲁菌(BJ1株)进行了系统的生化鉴定、毒力测定以及全基因组测序分析,为鹿的布鲁菌病的研究提供参考和依据。
1 材料与方法 1.1 主要菌株和试剂牛种布鲁菌参考强毒株B. abortus 2308、疫苗株B. abortus A19由本实验室保存;B. abortus BJ1株,本实验室于2018年5月从北京某鹿场一流产麋鹿的流产物中分离;单因子血清A、M、R由本实验室保存;Premix Taq(Ex Taq Version 2.0 plus dye)、DL1000 DNA Marker购自宝生物工程(大连)有限公司;QIAamp DNA Mini Kit购自QIAGEN;硫堇和碱性品红染料购自Sigma公司;胰大豆肉汤(TSB)和胰大豆琼脂(TSA)购自美国BD公司;结晶紫染色液、醋酸铅培养基购自北京索莱宝科技有限公司。
1.2 生化鉴定 1.2.1 生化特性将B. abortus BJ1株在固体培养基中划线培养后,挑取单个菌落接种到2块新鲜的TSA平板上,分别置于普通生化培养箱和含5% CO2的培养箱,37 ℃培养72 h后,观察细菌生长情况;取100 μL菌液接种到含硫堇(1:25 000)和碱性品红(1:25 000)的TSA平板上,37 ℃培养72 h,观察细菌生长情况;挑取少许细菌培养物接种到醋酸铅培养基中,37 ℃培养72 h,观察培养基表面是否有呈黑色[14]。
1.2.2 S/R型鉴定用结晶紫染色液对菌落染色20 s后观察,粗糙型菌落边缘着色,界限不清晰。光滑型菌落边缘不着色,整齐,圆润[15];取培养菌液用生理盐水配成浓度为1×109CFU·mL-1的菌悬液,取菌悬液5 mL加入试管中,置80 ℃水浴加热,2 h后观察结果。管底出现明显凝集者为粗造型菌株,不出现明显凝集者为光滑型菌株[16]。
1.3 特异性鉴定 1.3.1 血清学特异性取布鲁菌单因子血清A、M、R各20 μL,分别与等体积的B. abortus BJ1株菌悬液充分混匀进行玻片凝集试验,1~2 min内观察结果。
1.3.2 PCR特异性将B. abortus BJ1灭活,按照QIAamp DNA Mini Kit说明书步骤,提取基因组DNA作为后续PCR反应的模板。参照文献[14]合成AMOS-PCR引物。PCR反应程序:95 ℃预变性5 min;95 ℃ 30 s,54 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃延伸10 min。然后对PCR产物进行凝胶电泳分析。
1.3.3 16S rRNA测序参照文献[17]合成细菌通用16S引物,F:5′-AGTTTGATCCTGGCTCAG-3′,R:5′-ACCTTGTTACGACTT-3′,以B. abortus BJ1基因组为模板,扩增出目的片段后测序。
1.4 毒力测定350~400 g雌性豚鼠,分为3组,5只·组-1,以1×109CFU·只-1的剂量分别感染B. abortus BJ1株、牛种布鲁菌参考强毒株2308和疫苗株A19,14 d后剖检各组豚鼠,观察脾肿胀情况并称重。研磨脾组织,倍比稀释后接种TSA平板测定每克脾组织含菌量。
1.5 全基因组测序分析挑取单菌落涂板连续传两代后,使用无菌生理盐水洗下菌苔,离心并洗三遍后,于80 ℃水浴2 h灭活。按照QIAamp DNA Mini Kit说明书提取细菌DNA基因组。测定核酸浓度和纯度,送至上海烈冰生物科技公司测序。
2 结果 2.1 生化特性生化特性试验结果显示B. abortus BJ1株对CO2无依赖性,醋酸铅培养基培养后,菌落呈黑色,表明产H2S,在含有硫堇(1:25 000)和碱性复红(1:25 000)的TSA培养基上能生长(表 1)。结晶紫染色不着色,80 ℃水浴2 h后管底未出现明显凝集(图 1)。鉴定B. abortus BJ1为光滑型布鲁菌。
|
|
表 1 B.abortus BJ1生化特性 Table 1 The biochemical characters of B. abortus BJ1 |

|
A.结晶紫染色;B.热凝集试验 A. Cystal violet staining; B. Heat agglutination test 图 1 B.abortus BJ1表型鉴定 Fig. 1 Identification of bacterial phenotype |
B. abortus BJ1只与M因子血清呈现明显凝集反应,与A、R因子血清无凝集反应;AMOS-PCR结果扩增出牛种(494 bp)的特异性条带(图 2);16S rRNA测序显示B. abortus BJ1株和牛种布鲁菌有100%的相似性。
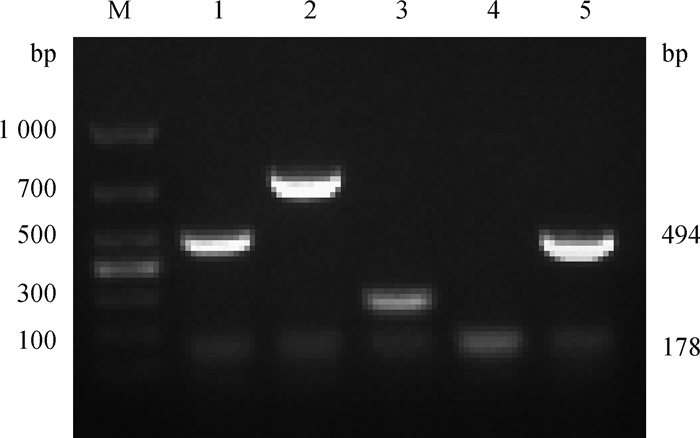
|
M. Marker 2000; 1. B. abortus 2308; 2. B. menlitensis M28; 3. B. suis S2; 4. B. canis RM6/66; 5. B. abortus BJ1 图 2 B.abortus BJ1的AMOS-PCR鉴定 Fig. 2 AMOS-PCR identification for B. abortus BJ1 |
用B. abortus BJ1菌液以1×109 CFU·只-1的剂量感染豚鼠14 d后,豚鼠脾均发生肿胀,每克脾组织含菌量为1.17×106~2.05×106 CFU,低于强毒菌株2308感染组(1.74×106~6.52×106 CFU),极显著高于A19免疫组(2.83×104~6.34×106 CFU)。具体结果见图 3。
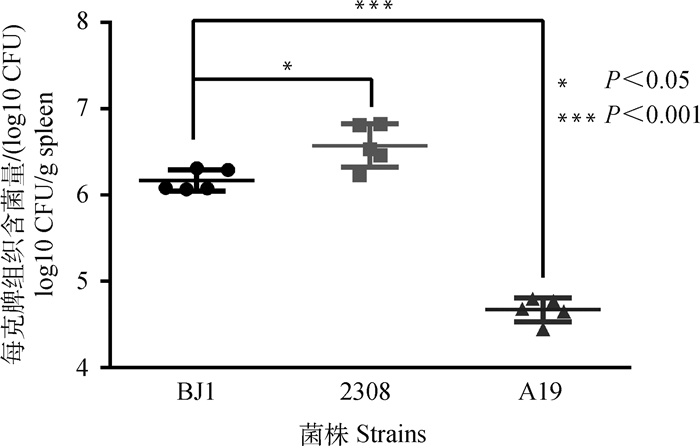
|
图 3 B.abortus BJ1感染14 d豚鼠脾含菌量测定 Fig. 3 Spleen bacteria in guinea pigs infected by B. abortus BJ1 for 14 days |
组装得到的B.abortus BJ1基因组大小为3 270 584 bp,GC含量为57.23%,有2个scaffolds,2个contigs。经预测BJ1株有3 343个基因,3 275个CDS,其中编码基因3 113个,rRNA 9个,tRNA 55个,ncRNA 4个。全基因组序列已上传NCBI(染色体1:NZ_CP033079.1、染色体2:NZ_CP033080.1)。
2.4.2 B. abortus BJ1预测基因的COG数据库注释结合COG数据库对B. abortus BJ1株全基因组序列进行注释,3 113个基因可以分到22类聚类中,其中占比最多的功能为氨基酸的转运和代谢(amino acid transport and metabolism)以及预测到的通用功能(general function prediction only)。具体分类情况见表 2。
|
|
表 2 布鲁菌BJ1基因功能注释COG功能分类 Table 2 COG function classification of B. abortus BJ1 |
通过与KEGG数据库比对分析,发现B. abortus BJ1株有1 339个基因分布于207个信号通路,其中占比最多的信号通路为代谢途径(metabolic pathways)、次生代谢产物的生物合成(biosynthesis of secondary metabolites)、微生物在不同环境中的代谢(microbial metabolism in diverse environments)、ABC转运蛋白(ABC transporters)和抗生素生物合成(biosynthesis of antibiotics)等。具体分布情况见图 4。
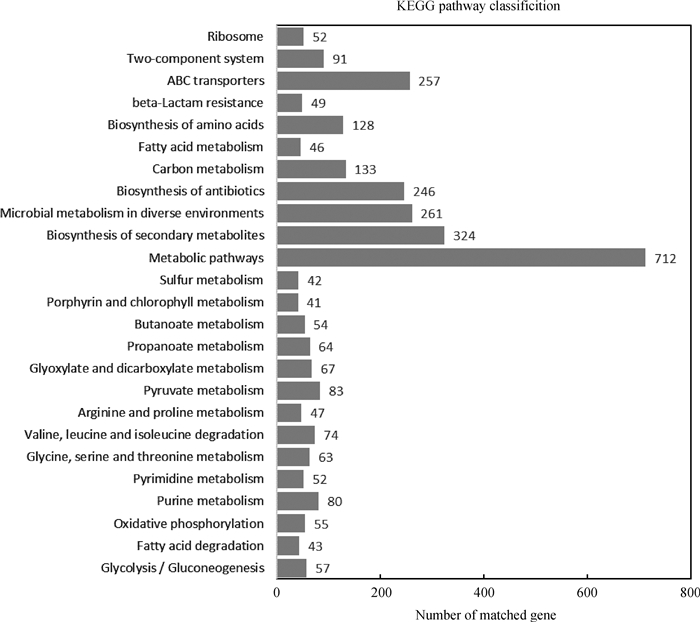
|
图 4 布鲁菌BJ1基因功能注释KEGG代谢通路二级图 Fig. 4 KEGG pathway classification of B. abortus BJ1 |
通过对布鲁菌B. abortus BJ1株与2308株全基因组的基因比对,发现在基因编码区共86处Indel差异,针对这些位置设计引物,PCR扩增后测序比对,确认共46处差异,均位于染色体1,主要表达ATP结合蛋白和代谢相关的酶。详细信息见表 3。
|
|
表 3 B.abortus BJ1与B.abortus 2308在基因区的基因突变 Table 3 Gene mutation results of B. abortus BJ1 and B. abortus 2308 in genetic region |
系统发育树可以用来表示系统发生研究的结果,并描述物种之间的进化关系。从NCBI基因组数据库中选取了国内外10株牛种布鲁菌的全基因组序列,根据Mauve软件[18]绘制了B. abortus BJ1的系统进化树(图 5)。
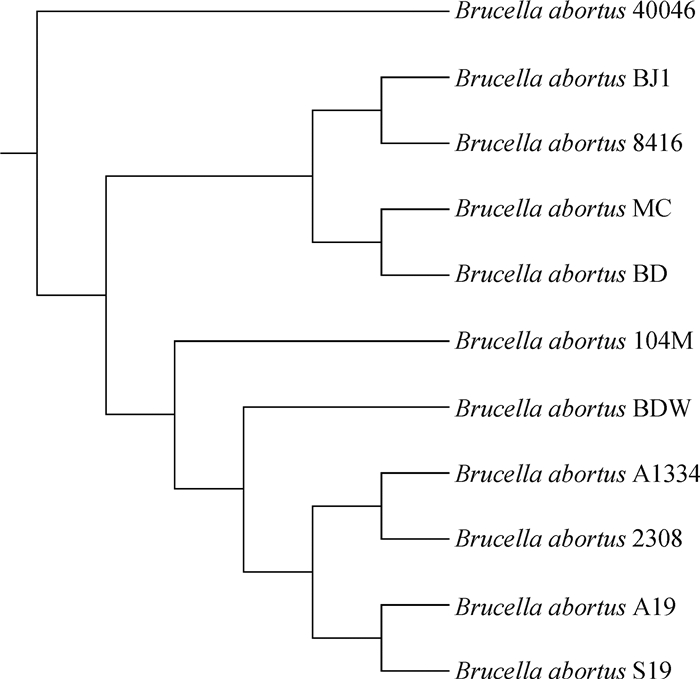
|
图 5 基于全基因组序列的系统进化树 Fig. 5 Phylogenetic tree based on whole genome sequences |
由图 5可知,B. abortus BJ1株全基因组与从内蒙古包头一奶牛场清洁工分离出的B. abortus 8416和河北满城区流产奶牛中分离出两株菌B. abortus MC和B. abortus BD有较高的同源性。
3 讨论布鲁菌病作为一种重要的人畜共患病,给人和动物的健康都带来巨大威胁,而且近年来,布病在国内呈反弹的趋势[14]。布鲁菌主要感染牛、羊、猪、犬等,但是越来越多的其他动物感染陆续被发现[19]。由于麋鹿品种的独特性,相关研究较少,而我国至今没有麋鹿群布病流调及鹿源布鲁菌鉴定分析的相关报道。
麋鹿归属于鹿科,随着我国养鹿业的发展,鹿感染布病越来越常见,阳性率有不断上升的趋势[20]。但与养殖业不同的是,麋鹿的生长环境更类似于野生环境,其传播途径难以追溯。曾有学者对美国麋鹿群体进行布病血清学调查研究,数据显示从20世纪70年代至今,美国麋鹿血清阳性率大致在0%~0.2%[21-23]。据推测可能与感染个体与家畜密切接触有关[24],与美国野生动物生长环境相比,我国由于地理和社会环境的原因,加上存在放牧的饲养方式,野生动物与家畜接触的可能性非常大,这加大了野生动物感染布鲁菌的风险[25]。而对于野生动物实施布病监测非常困难,故而我国野生动物的真实布病流行情况无法完全掌握,这给我国的布病防控带来一些困难。本研究旨在全面鉴定从麋鹿上分离到的B.abortus BJ1株的生化特性,并分析其全基因组,为我国野生动物布病流调及防控奠定基础。
牛种布鲁菌在我国广泛流行,32个省份均有报道。根据20世纪末从21个省内的人和动物中分离出的3 425株布鲁菌的鉴定,牛种布鲁菌占13.64%[10]。目前,国内牛种布鲁菌的流行株主要为1型、3型和5型。根据OIE手册的判定标准,B. abortus BJ1的生化特性和单因子血清反应性表明其为牛种9型。全基因组系统进化树的结果显示,它与B. abortus 8416有着很高的同源性。经查阅相关文献得知,B. abortus 8416是从内蒙古包头一牛场清洁工身上分离出来的,其常规生化特性和表性特征属于牛种生物9型,但MLVA分型结果却显示B. abortus 8416与牛种生物3型最密切相关,鉴于其表型和分子分型之间存在差异,推测其可能为牛种生物9型的新变体[26]。B. abortus BJ1的MLVA分型还需进一步确认。国内对于9型的相关报道和研究较少,牛种9型的生物学特征与其他生物型均有差异[27]。目前牛种9型已在我国陆续被分离鉴定[28],是否已成为我国牛种的重要流行株,需要作进一步的调研。
豚鼠对布鲁菌有较高的敏感性,是研究布鲁菌毒力的良好试验模型[29],因此本试验选择豚鼠来测定B. abortus BJ1的毒力。BALB/c小鼠虽然也经常被用作布鲁菌的毒力试验,且为OIE推荐布鲁菌毒力的方法,但是根据本实验室前期研究发现,不同小鼠个体之间有时差异较大,而豚鼠则差异很小。《兽医生物制品规程》[30]中对布病疫苗种毒的毒力规定,豚鼠每克脾含菌量应不超过2×105CFU,本研究测定的B.abortus BJ1为1.17×106~2.05×106CFU,高于《兽医生物制品规程》对疫苗毒力规定的上限,我们把它归为强毒株范畴。
本研究中,B. abortus BJ1通过与COG数据库注释得到3 113个基因,这些基因主要参与氨基酸和碳水化合物的转运和代谢、能量产生及传递、翻译、核糖体和生物膜合成等生物学过程。研究发现氨基酸和碳水化合物对布鲁菌至关重要,是其主要的能量和碳源来源[31],在B. abortus BJ1中共有625个基因参与氨基酸和碳水化合物的转运和代谢,占了大约1/5,表明了氨基酸和碳水化合物对B. abortus BJ1的重要性。随后对其进行KEGG数据库注释发现,B. abortus BJ1株有1 339个基因分布于207个信号通路,其中大多数和代谢相关。布鲁菌是胞内寄生菌,需要应对胞内复杂的环境[32],这些基因可能和布鲁菌适应胞内生存有关。通过B. abortus BJ1和B. abortus 2308的全基因组比对分析与验证,发现在基因编码区内存在46个Indel差异,这些存在小片段插入与缺失的基因大多和代谢相关。ABC转运蛋白是一种膜蛋白,在细菌中,ABC转运体催化必需营养物质的摄取或有毒物质的排出[33],ABC转运蛋白的突变是否会对BJ1株该方面的功能产生影响还需要进一步的研究。UreE是脲酶辅助蛋白,脲酶催化尿素水解,产生氨和二氧化碳,研究发现产生脲酶的菌株在尿素存在下对强酸具有抗性,有助于布鲁菌通过胃肠道感染[34],UreE的突变是否对BJ1株抗酸性造成影响有待进一步的研究。其他代谢基因的差异是否与毒力相关,还是由于分离株因适应机体环境而产生变化尚需进一步验证。
4 结论通过生物学特征、全基因组测序等方式全面鉴定了一株鹿源牛种布鲁菌B. abortus BJ1,鉴定其为布鲁菌牛种9型,为深入了解我国布病发生情况和野生动物布病防控提供参考。
| [1] | MEGID J, MATHIAS L A, ROBLES C A. Clinical manifestations of brucellosis in domestic animals and humans[J]. Open Vet Sci J, 2010, 4(1): 119–126. DOI: 10.2174/1874318801004010119 |
| [2] | ADONE R, PASQUALI P. Epidemiosurveillance of brucellosis[J]. Rev Sci Tech, 2013, 32(1): 199–205. DOI: 10.20506/rst.32.1.2202 |
| [3] | VAN DER HENST C, DE BARSY M, ZORREGUIETA A, et al. The Brucella pathogens are polarized bacteria[J]. Microbes Infect, 2013, 15(14-15): 998–1004. DOI: 10.1016/j.micinf.2013.10.008 |
| [4] |
陈军, 崔步云, 赵鸿雁, 等. 应用多重PCR鉴别布鲁氏菌种及猪种5个生物型研究[J]. 中国病原生物学杂志, 2013, 8(2): 126–130.
CHEN J, CUI B Y, ZHAO H Y, et al. Evaluation of the ability of two multiplex PCR assays (Bruce-ladder and Suis-ladder) to distinguish six Brucella species and Brucella suis at the biovar level[J]. Journal of Pathogen Biology, 2013, 8(2): 126–130. (in Chinese) |
| [5] | SCHOLZ H C, NÖCKLER K, GÖLLNER C, et al. Brucella inopinata sp. nov., isolated from a breast implant infection[J]. Int J Syst Evol Microbiol, 2010, 60(4): 801–808. DOI: 10.1099/ijs.0.011148-0 |
| [6] | WHATMORE A M, DAVISON N, CLOECKAERT A, et al. Brucella papionis sp. nov., isolated from baboons (Papio spp.)[J]. Int J Syst Evol Microbiol, 2014, 64(12): 4120–4128. |
| [7] | SCHOLZ H C, REVILLA-FERNÁNDEZ S, AL DAHOUK S, et al. Brucella vulpis sp. nov., isolated from mandibular lymph nodes of red foxes (Vulpes vulpes)[J]. Int J Syst Evol Microbiol, 2016, 66(5): 2090–2098. |
| [8] | CHAIN P S G, COMERCI D J, TOLMASKY M E, et al. Whole-genome analyses of speciation events in pathogenic Brucella[J]. Infect Immun, 2005, 73(12): 8353–8361. DOI: 10.1128/IAI.73.12.8353-8361.2005 |
| [9] | OCAMPO-SOSA A A, AGVERO-BALBÍN J, GARCÍA-LOBO J M. Development of a new PCR assay to identify Brucella abortus biovars 5, 6 and 9 and the new subgroup 3b of biovar 3[J]. Vet Microbiol, 2005, 110(1-2): 41–51. DOI: 10.1016/j.vetmic.2005.06.007 |
| [10] | SHANG D Q, XIAO D L, YIN J M. Epidemiology and control of brucellosis in China[J]. Vet Microbiol, 2002, 90(1-4): 165–182. DOI: 10.1016/S0378-1135(02)00252-3 |
| [11] | MORENO E. Retrospective and prospective perspectives on zoonotic brucellosis[J]. Front Microbiol, 2014, 5: 213. |
| [12] | ETTER R P, DREW M L. Brucellosis in elk of eastern Idaho[J]. J Wildl Dis, 2006, 42(2): 271–278. DOI: 10.7589/0090-3558-42.2.271 |
| [13] | RHYAN J C, NOL P, QUANCE C, et al. Transmission of brucellosis from elk to cattle and bison, Greater Yellowstone area, USA, 2002-2012[J]. Emerg Infect Dis, 2013, 19(12): 1992–1995. DOI: 10.3201/eid1912.130167 |
| [14] |
丁家波, 王芳, 杨宏军, 等. 一株中等毒力牛种布鲁氏菌的鉴定和毒力测定[J]. 中国农业科学, 2014, 47(13): 2652–2658.
DING J B, WANG F, YANG H J, et al. Identification and virulence assessment for a strain of Brucella abortus[J]. Scientia Agricultura Sinica, 2014, 47(13): 2652–2658. DOI: 10.3864/j.issn.0578-1752.2014.13.017 (in Chinese) |
| [15] |
张贺, 徐磊, 王苗苗, 等. 一株犬种布鲁氏菌的鉴定及毒力测定[J]. 中国兽药杂志, 2017, 51(9): 1–6.
ZHANG H, XU L, WANG M M, et al. Isolation and identification for a virulent strain of Brucella cains[J]. Chinese Journal of Veterinary Drug, 2017, 51(9): 1–6. (in Chinese) |
| [16] |
田明星.流产布鲁氏菌毒力基因筛选鉴定及其功能研究[D].北京: 中国农业科学院, 2014.
TIAN M X. Identification and functional study of Brucella abortus virulence genes[D]. Beijing: Chinese Academy of Agricultural Sciences, 2014. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-82101-1014326355.htm |
| [17] | GEE J E, DE B K, LEVETT P N, et al. Use of 16S rRNA gene sequencing for rapid confirmatory identification of Brucella isolates[J]. J Clin Microbiol, 2004, 42(8): 3649–3654. DOI: 10.1128/JCM.42.8.3649-3654.2004 |
| [18] | DARLING A C E, MAU B, BLATTNER F R, et al. Mauve:multiple alignment of conserved genomic sequence with rearrangements[J]. Genome Res, 2004, 14(7): 1394–1403. DOI: 10.1101/gr.2289704 |
| [19] | MAIO E, BEGEMAN L, BISSELINK Y, et al. Identification and typing of Brucella spp. in stranded harbour porpoises (Phocoena phocoena) on the Dutch coast[J]. Vet Microbiol, 2014, 173(1-2): 118–124. DOI: 10.1016/j.vetmic.2014.07.010 |
| [20] |
李晓华, 于立业, 林萍. 鹿布氏杆菌病的防治[J]. 吉林畜牧兽医, 2013, 34(6): 68–69.
LI X H, YU L Y, LIN P. Prevention and treatment of brucellosis in deer[J]. Jilin Animal Husbandry and Veterinary Medicine, 2013, 34(6): 68–69. DOI: 10.3969/j.issn.1672-2078.2013.06.028 (in Chinese) |
| [21] | ROUG A, SWIFT P, TORRES S, et al. Serosurveillance for livestock pathogens in free-ranging mule deer (Odocoileus hemionus)[J]. PLoS One, 2012, 7(11): e50600. DOI: 10.1371/journal.pone.0050600 |
| [22] | MYERS W L, FOREYT W J, TALCOTT P A, et al. Serologic, trace element, and fecal parasite survey of free-Ranging, female mule deer (Odocoileus hemionus) in eastern Washington, USA[J]. J Wildl Dis, 2014, 51(1): 125–136. |
| [23] | MERRELL C L, WRIGHT D N. A serologic survey of mule deer and elk in Utah[J]. J Wildl Dis, 1978, 14(4): 471–478. DOI: 10.7589/0090-3558-14.4.471 |
| [24] | MUMA J B, SAMUI K L, SIAMUDAALA V M, et al. Prevalence of antibodies to Brucella spp. and individual risk factors of infection in traditional cattle, goats and sheep reared in livestock-wildlife interface areas of Zambia[J]. Trop Anim Health Prod, 2006, 38(3): 195–206. DOI: 10.1007/s11250-006-4320-9 |
| [25] | PAPPAS G. The changing Brucella ecology:novel reservoirs, new threats[J]. Int J Antimicrob Agents, 2010, 36 Suppl 1: S8–S11. |
| [26] | KANG Y X, LI X M, PIAO D R, et al. Typing discrepancy between phenotypic and molecular characterization revealing an emerging biovar 9 variant of smooth phage-resistant B. abortus strain 8416 in China[J]. Front Microbiol, 2015, 6: 1375. |
| [27] | MORENO E, CLOECKAERT A, MORIYÓN I. Brucella evolution and taxonomy[J]. Vet Microbiol, 2002, 90(1-4): 209–227. DOI: 10.1016/S0378-1135(02)00210-9 |
| [28] |
邰振国, 王海本, 范植南, 等. 巴州牦牛布鲁氏菌病流行病学调查与病原分离和鉴定[J]. 中国兽医杂志, 2001, 37(7): 24–25.
TAI Z G, WANG H B, FAN Z N, et al. Epidemiological investigation and pathogen isolation and Identification of Brucellosis in buffalos in Bazhou county[J]. Chinese Journal of Veterinary Medicine, 2001, 37(7): 24–25. DOI: 10.3969/j.issn.0529-6005.2001.07.014 (in Chinese) |
| [29] | HENSEL M E, ARENAS-GAMBOA A M. A neglected animal model for a neglected disease:guinea pigs and the search for an improved animal model for Human Brucellosis[J]. Front Microbiol, 2018, 9: 2593. DOI: 10.3389/fmicb.2018.02593 |
| [30] |
中华人民共和国农业部.
中华人民共和国兽用生物制品规程(2000年版)[M]. 北京: 化学工业出版社, 2000: 154-160.
The Ministry of Agriculture of the People's Republic of China. The veterinary biological products regulations of the people's republic of China (2000 edition)[M]. Beijing: Chemical Industry Press, 2000: 154-160. (in Chinese) |
| [31] | BARBIER T, NICOLAS C, LETESSON J J. Brucella adaptation and survival at the crossroad of metabolism and virulence[J]. FEBS Lett, 2011, 585(19): 2929–2934. DOI: 10.1016/j.febslet.2011.08.011 |
| [32] | RAMBOW-LARSEN A A, PETERSEN E M, GOURLEY C R, et al. Brucella regulators:self-control in a hostile environment[J]. Trends Microbiol, 2009, 17(8): 371–377. DOI: 10.1016/j.tim.2009.05.006 |
| [33] | HOLLENSTEIN K, DAWSON R J P, LOCHER K P. Structure and mechanism of ABC transporter proteins[J]. Curr Opin Struct Biol, 2007, 17(4): 412–418. DOI: 10.1016/j.sbi.2007.07.003 |
| [34] | SANGARI F J, SEOANE A, RODRÍGUEZ M C, et al. Characterization of the urease operon of Brucella abortus and assessment of its role in virulence of the bacterium[J]. Infect Immun, 2007, 75(2): 774–780. DOI: 10.1128/IAI.01244-06 |



