2. 河南科技大学宏翔生物饲料实验室, 洛阳 471023
2. Hongxiang Biological Feed Laboratory, Henan University of Science and Technology, Luoyang 471023, China
副猪嗜血杆菌(Haemophilus parasuis, HPS)是正常猪群上呼吸道的一种常在菌,在感染其他疾病或应激情况下会引发或继发感染副猪嗜血杆菌病,临床上以纤维素性多发性浆膜炎、关节炎和脑膜炎为主要特征[1]。该病原菌可存在于猪群的各个年龄阶段,且发病率高、死亡率高、传染性强,常与病毒性疾病、免疫抑制性疾病混合感染,从而更加重了猪群的病情,也给治疗带来了更多的困难[2-3],给世界养猪业造成了极大的经济损失,所以必须重视该病的防控。
自1910年首次被发现以来,HPS已呈世界性分布。据我国部分省份流行病学调查报道,近年来山东、上海、天津、广东、江西等省市的HPS阳性率分别为7.63%、19.51%、19.76%、22.74%和33.1%[4-5],其他省份也基本在此范围。由此可见,随着我国养猪规模的不断扩大,该病呈流行趋势,所以对该病流行血清型的调查将有助于指导各地对该病的防控。据报道HPS至少有15个血清型,我国主要流行的是4型、5型、12型、13型和14型,不同血清型菌株间毒力有明显差异,同时也存在同一血清型不同分离株毒力不同[6-8]。该病感染中后期会引起比较严重的肺炎,临床治疗效果较差,且会造成群体传染。因此,早期诊断和血清型定型对该病的防治非常关键。因为ELISA无法区分疫苗抗体和野毒抗体,所以PCR法是早期诊断最好的选择。HPS毒力的强弱往往决定于其毒力因子,而HPS的毒力又与其血清型存在一定的关联性[9],所以分子诊断往往选择毒株的毒力基因为靶位点进行检测。HPS的毒力因子主要有外膜蛋白(outer membrane protein, OMP)、荚膜(capsule)、转铁结合蛋白(transferrin)、三聚体自转运蛋白(trimeric autotransporter, VtaA)、脂寡糖(lipo-oligo-saccharide, LOS)、细胞致死性膨胀毒素(cytolethal distending toxin, CDT)等[9-13]。其中外膜蛋白是HPS最主要的毒力蛋白及重要的致病因子之一,具有良好的免疫原性。Tadjine等[14]研究表明15个血清型的HPS均能与一个主要的OMP反应,表明该蛋白可作为诊断标记的候选蛋白。近年来,河南省猪场HPS病频频发生,且多数猪场采用疫苗免疫效果并不理想,笔者认为这可能是所使用疫苗的血清型与猪场感染的副猪嗜血杆菌的血清型或基因型不一致造成的。因此,近年来本实验室从河南省不同地区采集了大量的疑似HPS病料并进行了分离,本研究就是在前期分离的基础上进行鉴定及分型,以期为河南省猪场HPS病及其流行血清型进行确证,为该病防控的疫苗选择等方面提供参考依据。
1 材料与方法 1.1 样品采集2014年4月—2017年5月自河南省商丘、洛阳、开封、周口、郑州、汝州、郸城、太康、信阳、新乡等10个县、市采集发病猪的脑组织、肺、气管、心、胸腔积液、关节液等样品共计813份(样品详情在结果部分介绍分离率时一并列出)。病料均来自疑似感染副猪嗜血杆菌病猪,病猪患有明显的肺炎、心包炎,以及胸腔有纤维素性样渗出的症状。
1.2 主要试剂TaKaRa Ex Taq DNA Polymerase、DL2000 DNA Marker、pMD18-T等试剂,购自大连宝生物公司。大豆酪蛋白琼脂培养基(TSA)、胰蛋白胨大豆肉汤(TSB)培养基,购自英国OXOID公司。NAD购自邦泰生物工程(深圳)有限公司,Gold View(10 000×)核酸染料购自北京索莱宝公司;细菌基因组DNA提取试剂盒,购自天根生化科技有限公司。
1.3 病原的分离纯化无菌蘸取发病猪的脑组织、肺、气管、心、胸腔积液、关节液等病料,划线于TSA培养基上,置37 ℃培养36~48 h,挑选典型的单个疑似菌落,二次划线纯化,进行细菌涂片,革兰染色,观察细菌的显微形态特征。
1.4 引物设计与合成根据GenBank中已发表的HPS 16S rDNA序列,采用DNAStar6.0软件中的MegAlign,确定副猪嗜血杆菌高度保守区域,设计一对种特异性PCR引物,目标产物为1 090 bp;根据HPS外膜蛋白OMP基因序列(GenBank登陆号:JDSO01000001),设计一对特异性引物,扩增HPS OMP基因;根据文献报道的型特异性基因序列[15-16],合成15对型特异性引物,进行PCR分型鉴定;引物均由生工生物工程(上海)股份有限公司合成。引物序列见表 1。
|
|
表 1 PCR引物序列 Table 1 PCR primers sequences |
根据细菌基因组DNA提取试剂盒说明书进行操作,提取已纯化疑似副猪嗜血杆菌的总DNA,将提取的基因组DNA于-20 ℃保存。
1.6 分离菌株16S rDNA鉴定以“1.5”中提取的基因组DNA为模板,采用副猪嗜血杆菌的16S rDNA基因特异性靶基因序列合成一对引物对分离菌株进行PCR鉴定;反应条件:94 ℃ 4 min;94 ℃ 45 s、56 ℃ 45 s、72 ℃ 1 min,34个循环;72 ℃ 10 min,PCR产物经1.0%琼脂糖中进行电泳检测,同时将其送至生工生物工程(上海)股份有限公司测序,并将测序结果提交到GenBank中进行同源性比较。
1.7 副猪嗜血杆菌的分子分型鉴定以“1.6”中已鉴定为副猪嗜血杆菌的基因组DNA为模板,采用分型引物分别对阳性分离菌株进行PCR分型鉴定,反应体系同“1.6”,反应条件:94 ℃ 5 min;94 ℃ 30 s、55 ℃ 30 s、72 ℃ 1 min 30 s,30个循环72 ℃ 5 min。PCR产物于琼脂糖中进行电泳检测。
1.8 OMP基因的PCR扩增及测序以分离的4型、5型、14型HPS的DNA为模板,采用OMP基因的引物对分离菌株进行PCR扩增。反应条件:95 ℃ 3 min;95 ℃ 30 s、50 ℃ 30 s、72 ℃ 80 s,34个循环;72 ℃ 10 min,PCR产物预期为1 351 bp。将PCR产物回收纯化,分别克隆于pMD19-T中,由生工生物工程(上海)股份有限公司测序。
1.9 OMP基因序列同源性比较及进化树分析将副猪嗜血杆菌血清4型、5型、14型的OMP基因测序结果提交至NCBI上进行同源性比较,选取与测序结果相似性较高的菌株,利用DNAStar6.0软件包中的MegAlign将所测定的基因及其推导的氨基酸序列与国内外已发表的相应片段进行同源性比较,采用MEGA5.0软件包中的Kimura2-parameter法计算遗传距离,采用Neighbor-joining法构建系统发育树,同时利用DNAman7.0软件对其差异位点进行统计,分析其与血清型的关系。
2 结果 2.1 病原的分离纯化根据菌落形态从不同来源发病猪的脑、肺、气管、心、胸腔积液、关节液等病料的分离培养基上共分离纯化得到63株细菌,在TSA培养基中生长较好,可见圆形、无色透明、光滑湿润、边缘整齐的菌落。从菌落特征和显微形态来看,分离菌株为疑似副猪嗜血杆菌。
2.2 分离菌株的16S rDNA鉴定提取纯化的63株分离菌基因组DNA,采用副猪嗜血杆菌16S rDNA引物(表 1)进行PCR扩增。结果显示, 63个菌株均能扩增得到约为1 090 bp的条带,与预期条带大小相符(图 1)。经测序表明各扩增序列均为1 090 bp,通过在GenBank中进行Blast,结果表明所扩增序列与副猪嗜血杆菌的16S rDNA序列的相似性均在98%以上,因此可鉴定该63株菌均为副猪嗜血杆菌。所以样品阳性检出率为7.75%(63/813),不同年份的分离率介于5.49%(13/237)~11.31%(19/168)之间(表 2),表明河南地区猪场存在副猪嗜血杆菌病,且不同年份分离率有差异。
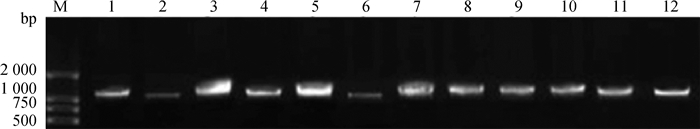
|
M. DL2000 DNA相对分子质量标准; 1~12.分离菌株16S rDNA基因PCR产物 M. DL2000 DNA marker; 1-12. Amplication of 16S rDNA gene of partial isolates 图 1 部分分离菌株16S rDNA基因PCR扩增结果 Fig. 1 The PCR amplification results of 16S rDNA gene of partial isolates |
|
|
表 2 HPS的分离结果及时间分布 Table 2 Isolation results and time distribution of HPS |
选取15种HPS分型引物(表 1)同时对上述63株已鉴定为副猪嗜血杆菌的分离菌株进行PCR扩增,除13株未显示条带不可分型(NT)外,其余菌株的扩增产物分别约为320、450、730 bp(图 2),根据目的条带的大小共鉴定出4型、5型和14型3种血清型。且4型、5型、14型、NT分离率分别为38.10%(24/63)、33.33%(21/63)、7.94%(5/63)、20.63%(13/63)。统计分析表明副猪嗜血杆菌总分离率为7.75%,在河南的10个县市均能够分离出副猪嗜血杆菌,分离率为5.21%~11.25%,其中新乡、周口和汝州三个地区分离率相对较高(表 2)。另外,不同年份副猪嗜血杆菌的分离率也有差异,且自2015年以来有逐年增高的趋势。结果表明河南地区副猪嗜血杆菌4、5型较为流行,其次是14型,同时也存在不可分型毒株。
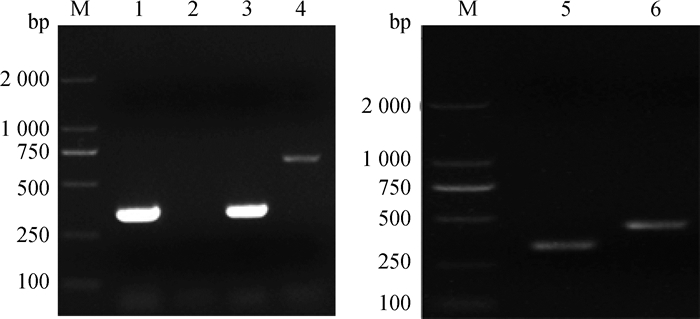
|
M. DL2000 DNA相对分子质量标准; 1、3、5. HPS血清4型引物扩增产物; 2.不可分型HPS扩增产物; 4. HPS血清14型引物扩增产物; 6. HPS血清5型引物扩增产物 M. DL2000 DNA marker; 1, 3, 5. PCR products of HPS-4; 2. PCR product of nontypeable strain; 4. PCR products of HPS-14; 6. PCR products of HPS-5 图 2 分离菌株型特异性基因PCR扩增结果 Fig. 2 PCR amplification results of different isolates based on serotype specific priemers |
自上步骤HPS的分型结果,仅针对4型、5型和14型三类毒株,随机各选择一株作为代表毒株,分别命名为Henan-HPS-KF4和Henan-HPS-ZK5、Henan-HPS-LY14。结果显示,三个血清型的代表毒株均能扩增出约1 155 bp的目的条带,与预期结果一致(图 3)。测序结果表明OMP基因长度为1 155 bp,其中开放阅读框(ORF)为1 071 bp,编码356个氨基酸。
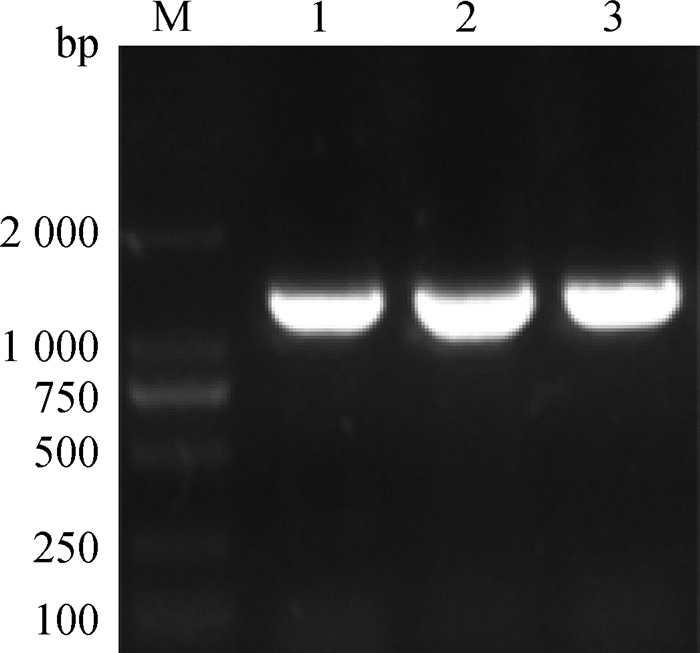
|
M. DL2000 DNA相对分子质量标准; 1.副猪嗜血杆菌4型OMP扩增产物; 2.副猪嗜血杆菌5型OMP扩增产物; 3.副猪嗜血杆菌14型OMP扩增产物 M. DL2000 DNA marker; 1. Henan-HPS-KF4 OMP; 2. Henan-HPS-ZK5 OMP; 3. Henan-HPS-LY14 OMP 图 3 副猪嗜血杆菌4型、5型、14型代表株OMP基因PCR扩增结果 Fig. 3 PCR amplification of OMP gene of HPS serotype 4, 5 and 14 representative strains |
采用DNAStar6.0软件中的MegAlign将所测定的三种血清型HPS的OMP基因的核苷酸序列及其推导氨基酸序列与GenBank中国内外已提交的HPS OMP的核苷酸序列及其推导氨基酸序列进行相似性比较分析,结果表明这三株HPS的OMP基因相似性为98.8%~99.0%,氨基酸相似性为99.0%~99.7%;与国内外HPS OMP基因的核苷酸相似性为98.6%~99.9%,氨基酸相似性为99.0%~100.0%。系统进化树分析表明Henan-HPS-ZK5和Henan-HPS-KF4、Henan-HPS-LY14分别处于A、B两个分支,其中代表 4型和14型的强毒菌株Henan-HPS-KF4、Henan-HPS-LY14位于同一亚支,遗传距离较近,而代表 5型的Henan-HPS-ZK5与前两者距离较远(图 4)。
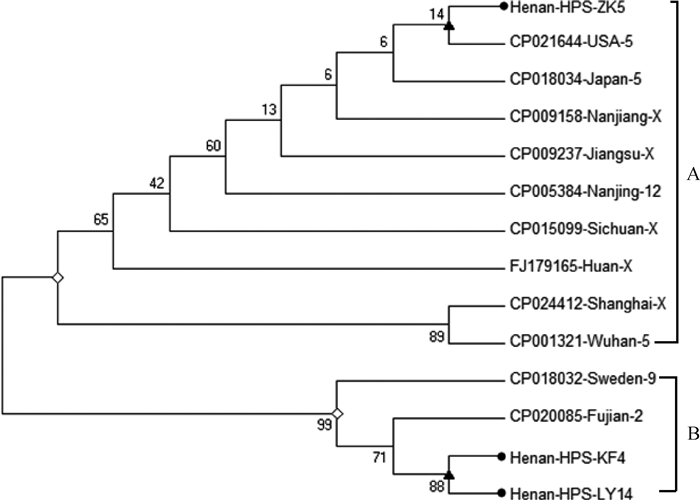
|
●.HPS分离株;◇.一级分支;▲.亚支。菌株名称最后的数字或字母表示血清型(X代表未定型) ●.The three HPS isolates from Henan province; ◇.The primary branch; ▲.The sub-branch. The last number or letter represents serotype (X represents non-type) 图 4 基于Neighbor-joining法构建OMP毒力基因核苷酸序列遗传进化树 Fig. 4 Phylogenetic tree analysis based on OMP gene sequence from isolates and other reference strains by Neighbor-joining methods |
将这3个毒株的OMP基因推导氨基酸序列与GenBank中国内外已发表的相应序列进行氨基酸位点比较,发现不同血清型毒株之间有5个位点具有差异,分别位于OMP氨基酸的57、89、115、233、239等5个位点(表 3),其中Henan-HPS-ZK5分离株在第57位氨基酸为Ala(A),而其他毒株均为Thr(T)。4型、9型和14型第89位、115位、233位和239位氨基酸分别为Gln(Q)、Glu(E)、Arg(R)和Gly(G),而其他血清型分别为Arg(R)、Lys(K)、Gly(G)和Arg(R)(未定型菌株除外)。
|
|
表 3 3株HPS河南分离株OMP氨基酸位点差异分析 Table 3 Amino acid mutation sites of OMP of three HPS isolates from Henan |
HPS病是各类猪场最常见的传染性疾病之一,该病易在管理水平较低、环境卫生条件较差的猪场发生,尤其是在应激条件(如过冷、过热,或长途运输等情况)下,猪更容易发病,尤其是中青年猪。该病既容易随其他疾病继发,也可造成其他疾病的并发,具有较高的发病率和死亡率,严重危害了我国养猪业的健康发展[1-2, 4-5]。HPS血清型复杂多样,除了已报道的15个血清型外,至少还存在20%的菌株不可分型,不同血清型间的致病力差异较大、交叉免疫保护效果较差,这使HPS病的防控更加困难[8-9, 17]。因此,对本地区猪场HPS进行分离及分型,筛选HPS流行株,针对本区域流行株选择疫苗进行免疫,对于HPS的有效防控具有重要意义。
本试验通过对疑似病料进行病原菌的分离鉴定,自2014—2017年的813份病料样品中共分离鉴定出63株HPS,但从临床血清学检测判断,阳性病例远高于这一分离率,这是因为HPS对分离条件要求较为苛刻。本试验表明,病料新鲜度对病原的分离最重要,脑、心包液和关节液样品分离率较高,这与Lancashire等[18]和Castilla等[19]的研究结论一致。本试验采用Jia等[16]报道的HPS型特异性引物对分离菌株进行血清分型,仅鉴定出有4型、5型、14型及不定型,且分离率分别为38.10%、33.33%、7.94%和20.63%,揭示了近年来河南省HPS病的流行血清型以4型、5型为主,其次是14型,该结果与徐惠娟等[20]于2014年以前河南省HPS分离结果一致,说明多年来河南省一直流行这几个血清型。另外还有约20%的不定型菌株,这可能也是部分猪场免疫失败而屡屡发生副猪嗜血杆菌病的原因之一。据本研究统计分析发现,2014年HPS分离率最高,2015—2017年的HPS分离率整体呈逐渐上升趋势,结合这几年的国内猪价行情较好,致使中小养殖户增加,但由于其养殖水平和养殖环境较差,而规模化猪场为追求效益,盲目扩大生产,存栏密度增加,这都是导致HPS病发病率上升的主要原因。
笔者认为不同血清型HPS之间必然存在一定的内在联系,各血清型HPS均是毒株长期进化的结果,血清型的不同意味着其基因组、氨基酸及其蛋白表达上存在差异。但由于HPS基因组较大,目前GenBank中仅提交有11条含有该OMP基因完整的HPS基因序列,且仅有血清2型、5型、9型、12型及未定型菌株的信息,所以很难较为全面地分析不同血清型之间在基因组上的差异。众所周知,OMP是HPS细胞壁外膜的主要结构蛋白,相对比较保守,也是HPS的主要毒力因子,致病株具有良好的免疫原性[7, 21-22]。所以本课题组推测在不同血清型或亚型之间,OMP的基因或氨基酸在序列上可能存在差异,基于OMP的核苷酸和氨基酸同源性的比较结果也证明三个分离毒株与国内外不同血清型HPS的OMP存在不同程度的差异。进化树分析表明不同血清型HPS可分为A、B两个分支,其中Henan-HPS-ZK5分离株位于A分支,且与美国分离株CP021644(5型)亲缘关系最近;Henan-HPS-KF4与Henan-HPS-LY14均位于B分支,且两者处于同一终亚支,与福建分离株CP20085(2型)和瑞典分离株CP018032(9型)亲缘关系较近。因此,从总体上看,该三个分离株没有明显的地缘关系,同时也说明目前HPS病已发展成为了一种世界性的传染性疾病。
尽管以往报道称HPS在血清型、毒力、基因型表现高度异质性,但笔者认为菌株的毒力主要与其侵袭力和毒素有关,而侵袭力和毒素的强弱与毒株的相关蛋白结构有关,同时毒株的不同血清型也是由于其不同亚蛋白结构发生构象改变而引起的,所以归根结底还是毒株在基因水平上发生了变化才引起血清型、毒力及基因型的改变。因此为进一步研究不同血清型HPS在氨基酸序列上的差异,以探寻不同血清型HPS在OMP上是否存在特征性氨基酸,以期为通过分子技术鉴定不同血清型HPS提供靶位点。本研究克隆三个代表血清型——4型、5型和14型HPS毒株的OMP基因并测序,与GenBank中所提交的所有11条OMP序列进行氨基酸同源性分析,发现在第57、89、115、233、239位等5个位点,不同血清型毒株之间存在一定差异,且有一定的规律。在第57位,仅Henan-HPS-ZK5分离株发生了Thr(T)→Ala(A)的变异,即使同是血清5型的CP021644毒株也与其不同,这可能是该分离株在该位点发生了突变造成的,其对毒株的毒力影响有待进一步研究。表 3显示血清4型、9型、14型HPS在第89、115、223和239氨基酸位点具有相同的氨基酸,而血清5型、12型及未定型HPS则具有相同的氨基酸,推测可作为其特征性氨基酸进行血清分型分类。但由于数据库信息有限,还需要进一步统计确认。另外,据报道HPS血清1型、5型、10型、12型、13型、14型的毒株为强毒株,血清2型、4型、15型的毒株为中等毒株,血清3型、6型、7型、8型、9型、11型的毒株为无毒株[23-24],所以第89、115、223和239位点的氨基酸不能作为HPS强弱毒株的区分标准,该试验结果也证明了HPS血清型与毒力没有明显的直接相关性,与以往的研究报道一致[25]。本研究明确了河南省HPS的流行毒株,为该病的疫苗研发及防控奠定了基础。
4 结论通过对2014—2017年间河南省不同地区疑似HPS病的病原进行分子分型鉴定,揭示了近年来河南省HPS病的主要流行毒株以血清4型、5型为主,其次是14型,以及不定型毒株。OMP氨基酸序列分析表明在第89、115、223和239位点,不同血清型HPS具有不同的特征性氨基酸,有望作为HPS血清分型分类的特征性位点。
| [1] |
姚焱彬, 陈章, 储霞飞, 等. 副猪嗜血杆菌TbpA对仔猪的免疫效力评价[J]. 畜牧兽医学报, 2018, 49(3): 588–596.
YAO Y B, CHEN Z, CHU X F, et al. Immune efficacy of transferrin-binding protein A of Haemophilus parasuis in piglets[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(3): 588–596. (in Chinese) |
| [2] | ZHANG P, ZHANG C Y, ARAGON V, et al. Investigation of Haemophilus parasuis from healthy pigs in China[J]. Vet Microbiol, 2019, 231: 40–44. DOI: 10.1016/j.vetmic.2019.02.034 |
| [3] | KAVANOVÁ L, MATIAŠKOVÁ K, LEVÁ L, et al. Concurrent infection of monocyte-derived macrophages with porcine reproductive and respiratory syndrome virus and Haemophilus parasuis:a role of IFNα in pathogenesis of co-infections[J]. Vet Microbiol, 2018, 225: 64–71. DOI: 10.1016/j.vetmic.2018.09.016 |
| [4] |
杨杰, 李建达, 曾昊, 等. 山东省副猪嗜血杆菌分子流行病学调查及其外膜蛋白P2基因的表达纯化[J]. 中国动物传染病学报, 2018, 26(5): 40–47.
YANG J, LI J D, ZENG H, et al. Molecular epidemiological investigation of Haemophilus parasuis in Shandong province and expression, purification of OMPP2 gene[J]. Chinese Journal of Animal Infectious Diseases, 2018, 26(5): 40–47. (in Chinese) |
| [5] |
佟铁铸, 贾爱卿, 樊惠英. 广东省副猪嗜血杆菌的流行病学调查[J]. 中国动物传染病学报, 2017, 25(5): 42–46.
TONG T Z, JIA A Q, FAN H Y. Epidemiological investigation of Haemophilus parasuis in Guangdong province[J]. Chinese Journal of Animal Infectious Diseases, 2017, 25(5): 42–46. (in Chinese) |
| [6] | YU J, WU J Q, ZHANG Y Y, et al. Identification of putative virulence-associated genes among Haemophilus parasuis strains and the virulence difference of different serovars[J]. Microb Pathog, 2014, 77: 17–23. DOI: 10.1016/j.micpath.2014.10.001 |
| [7] | WANG L Y, MA L N, LIU Y A, et al. Multilocus sequence typing and virulence analysis of Haemophilus parasuis strains isolated in five provinces of China[J]. Infect Genet Evol, 2016, 44: 228–233. DOI: 10.1016/j.meegid.2016.07.015 |
| [8] |
赵倩, 汤承, 杨发龙, 等. 副猪嗜血杆菌ompP2基因的结构特征及其与毒力的联系[J]. 中国科学:生命科学, 2010, 40(6): 522–532.
ZHAO Q, TANG C, YANG F L, et al. The correlation between structural characterization of ompP2 gene and virulence of Haemophilus parasuis[J]. Scientia Sinica (Vitae), 2010, 40(6): 522–532. (in Chinese) |
| [9] |
杨洋, 于爽, 徐晓阳, 等. 血清以及基因分型技术在副猪嗜血杆菌流行病学和毒力鉴定中的研究进展[J]. 中国预防兽医学报, 2014, 36(10): 820–824.
YANG Y, YU S, XU X Y, et al. Advances in the research of serum and genotyping technology in the epidemiology and virulence identification of Haemophilus parasuis[J]. Chinese Journal of Preventive Veterinary Medicine, 2014, 36(10): 820–824. DOI: 10.3969/j.issn.1008-0589.2014.10.20 (in Chinese) |
| [10] | COSTA-HURTADO M, ARAGON V. Advances in the quest for virulence factors of Haemophilus parasuis[J]. Vet J, 2013, 198(3): 571–576. DOI: 10.1016/j.tvjl.2013.08.027 |
| [11] | CURRAN D M, ADAMIAK P J, FEGAN J E, et al. Sequence and structural diversity of transferrin receptors in Gram-negative porcine pathogens[J]. Vaccine, 2015, 33(42): 5700–5707. DOI: 10.1016/j.vaccine.2015.07.097 |
| [12] | PINA-PEDRERO S, OLVERA À, BENSAID A. The extended leader peptide of Haemophilus parasuis trimeric autotransporters conditions their protein expression in Escherichia coli[J]. Protein Expr Purif, 2017, 133: 15–24. DOI: 10.1016/j.pep.2017.02.012 |
| [13] | ZHANG B, HE Y B, XU C G, et al. Cytolethal distending toxin (CDT) of the Haemophilus parasuis SC096 strain contributes to serum resistance and adherence to and invasion of PK-15 and PUVEC cells[J]. Vet Microbiol, 2012, 157(1-2): 237–242. DOI: 10.1016/j.vetmic.2011.12.002 |
| [14] | TADJINE M, MITTAL K R, BOURDON S, et al. Development of a new serological test for serotyping Haemophilus parasuis isolates and determination of their prevalence in North America[J]. J Clin Microbiol, 2004, 42(2): 839–840. DOI: 10.1128/JCM.42.2.839-840.2004 |
| [15] | HOWELL K J, PETERS S E, WANG J H, et al. Development of a multiplex PCR assay for rapid molecular serotyping of Haemophilus parasuis[J]. J Clin Microbiol, 2015, 53(12): 3812–3821. DOI: 10.1128/JCM.01991-15 |
| [16] | JIA A Q, ZHOU R Y, FAN H Y, et al. Development of serotype-specific PCR assays for typing of Haemophilus parasuis circulating in southern China[J]. J Clin Microbiol, 2017, 55(11): 3249–3257. DOI: 10.1128/JCM.00688-17 |
| [17] | LIU H S, XUE Q, ZENG Q Y, et al. Haemophilus parasuis vaccines[J]. Vet Immunol Immunopathol, 2016, 180: 53–58. DOI: 10.1016/j.vetimm.2016.09.002 |
| [18] | LANCASHIRE J F, TURNI C, BLACKALL P J, et al. Rapid and efficient screening of a representational difference analysis library using reverse southern hybridisation:identification of genetic differences between Haemophilus parasuis isolates[J]. J Microbiol Methods, 2007, 68(2): 326–330. DOI: 10.1016/j.mimet.2006.09.011 |
| [19] | CASTILLA K S, DE GOBBI D D S, MORENO L Z, et al. Characterization of Haemophilus parasuis isolated from Brazilian swine through serotyping, AFLP and PFGE[J]. Res Vet Sci, 2012, 92(3): 366–371. DOI: 10.1016/j.rvsc.2011.04.006 |
| [20] |
徐惠娟, 薛云, 赵战勤, 等. 副猪嗜血杆菌国内流行血清型菌株的生物学特性比较研究[J]. 中国兽医学报, 2014, 34(5): 729–735.
XU H J, XUE Y, ZHAO Z Q, et al. Comparative study on biological characterization of the epidemic serotypes Haemophilus suis in China[J]. Chinese Journal of Veterinary Science, 2014, 34(5): 729–735. (in Chinese) |
| [21] | ZHOU M G, GUO Y, ZHAO J P, et al. Identification and characterization of novel immunogenic outer membrane proteins of Haemophilus parasuis serovar 5[J]. Vaccine, 2009, 27(38): 5271–5277. DOI: 10.1016/j.vaccine.2009.06.051 |
| [22] |
何欢, 陈新诺, 曾泽, 等. 副猪嗜血杆菌OmpP2刺激猪肺泡巨噬细胞炎性因子mRNA转录及致炎机制初步分析[J]. 畜牧兽医学报, 2016, 47(7): 1428–1434.
HE H, CHEN X N, ZENG Z, et al. The initial research of OmpP2 in Haemophilus parasuis induces pro-inflammatory cytokine mRNA transcription and inflammatory mechanism in porcine alveolar macrophages[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(7): 1428–1434. (in Chinese) |
| [23] | LI M, SONG S, YANG D X, et al. Identification of secreted proteins as novel antigenic vaccine candidates of Haemophilus parasuis serovar 5[J]. Vaccine, 2015, 33(14): 1695–1701. DOI: 10.1016/j.vaccine.2015.02.023 |
| [24] | CAI X W, CHEN H C, BLACKALL P J, et al. Serological characterization of Haemophilus parasuis isolates from China[J]. Vet Microbiol, 2005, 111(3-4): 231–236. DOI: 10.1016/j.vetmic.2005.07.007 |
| [25] |
ZIMMERMAN J J, KARRIKER L A, RAMIREZ A, 等.猪病学[M].赵德明, 张仲秋, 周向梅, 等, 译.北京: 中国农业大学出版社, 2014.
ZIMMERMAN J J, KARRIKER L A, RAMIREZ A, et al. Diseases of swine[M]. ZHAO D M, ZHANG Z Q, ZHOU X M, et al, trans. Beijing: China Agricultural University Press, 2014. (in Chinese) |



