非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒(African swine fever virus,ASFV)引起的猪的一种急性、高度接触性传染病。急性病例临床症状以高热、病程短、死亡率高、内脏器官广泛性出血以及呼吸系统和神经系统功能紊乱为主要特征[1]。该病是世界动物卫生组织(World Organisation for Animal Health)所列的必须报告的动物疫病之一,受到世界各国的高度重视,我国将其列为一类动物疫病[2]。2018年8月3日国家外来动物疫病研究中心在国内首次确诊辽宁省沈阳市沈北区的非洲猪瘟疫情[3]。截至2019年3月25日,全国共发生114起疫情,涉及28个省(市、自治区)。据世界动物卫生组织通报,2018年除我国外,还有13个国家报告发生3 800多起疫情。
ASFV是双链DNA病毒,属于双链DNA病毒目,非洲猪瘟病毒科,非洲猪瘟病毒属,也是ASFV家族中的唯一成员。病毒基因组末端以共价键闭合,长度170~190 kb,含有151个开放性阅读框,可以编码150~200种蛋白质,其中构成病毒粒子的主要结构蛋白有P72、P54、P220、P62、CD2V等[4-12]。P72蛋白是ASFV的主要结构蛋白,由B646L基因编码。P72蛋白是病毒粒子二十面体衣壳的重要组成部分,产生于病毒感染的晚期,约占整个病毒粒子蛋白的32%[4]。P72蛋白的作用主要体现在两方面:一方面在ASFV结合并进入受体细胞过程中,P72抗体能够抑制病毒与细胞的结合,另一方面在病毒粒子衣壳的产生过程中[4-5]。研究表明,不同区域ASFV毒株诱导产生的P72抗体的相应抗原表位均相当保守[5-6]。P72蛋白具有稳定的抗原性,是血清学检测和免疫制剂常用蛋白[7]。P72参与病毒的吸附过程,针对P72的抗体可以阻断病毒与巨噬细胞的结合。此外P72还参与病毒装配过程中pp220和pp62的加工。另外,P72蛋白能够被猪CTL所识别[8]。王清华等[3]报道,国内分离株B646L/p72基因序列417个碱基与俄罗斯毒株100%匹配,与俄罗斯和东欧目前流行的格鲁吉亚毒株(Georgia 2007)属于同一进化分支。
由于ASFV的抗感染机制十分复杂、基因型多,故ASF疫苗一直未研究成功。目前基因缺失弱毒疫苗、活病毒载体疫苗、DNA疫苗等不同类型的疫苗均处于实验室研究阶段,每种疫苗均有缺陷和不足之处[9]。先前的多项研究报道指出ASFV产生的抗体在免疫保护中能起到一定的作用,但其诱导的细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL)可能是机体发挥完全保护作用的一个至关重要的因素[8, 10-11, 13]。因此,开发一种能够识别CTL靶点的疫苗可激发大量的CTL效应淋巴细胞,用于消除被ASFV感染的细胞并且可提供长久的免疫保护作用[14]。腺病毒载体疫苗与痘病毒载体疫苗、DNA疫苗单独或者两者联合使用相比能够激发更强的CTL反应[15],并且该系统具有较高的安全性和高效的外源基因表达能力[16-19]。因此,本研究选用人复制缺陷型腺病毒载体Ad5作为ASFV抗原蛋白P72的呈递表达系统。该研究获得的能够表达P72蛋白的重组腺病毒(Ad5-ASFV-P72),可用于后续ASFV腺病毒载体疫苗开发工作中。另外,由于当前国内ASFV的分离工作尚未完全放开,相应工作仅局限在农业农村部畜牧兽医局指定的实验室。因此,Ad5-ASFV-P72还可作为ASFV的假病毒感染细胞后制备抗原板,用于间接免疫荧光(indirect immunofluorescence assay,IFA)、免疫过氧化物酶单层试验(immunoperoxidase monolayer assay,IPMA)等ASFV血清学诊断方法的建立。
1 材料与方法 1.1 参考毒株、细胞及血清参考China-SY18株病毒的基因序列(GenBank登录号:MH766894.1),合成B646L基因(起始密码子ATG前添加CACC四个碱基,便于后续与pENTR/D-TOPO载体连接),并将密码子和mRNA二级结构进行优化,基因合成由北京华大基因公司完成;293A细胞及Vero细胞均由中国动物卫生与流行病学中心国家外来动物疫病研究中心保存;ASFV标准阳性及阴性血清购自西班牙INGENASA公司。
1.2 主要试剂pAd/CMV/V5-DEST腺病毒载体、pENTR/D-TOPO过渡载体、Gateway LR ClonaseII Enzyme Mix、Anti-V5-FITC抗体、Anti-V5-HRP抗体、Lipofectamine 3000转染试剂均购自Invitrogen公司,PacⅠ限制性内切酶购自New England Biolabs公司,Adeno-X Rapid Titer Kit购自TaKaRa公司,质粒提取试剂盒购自QIAGEN公司,Goat Anti-Pig IgG H&L (HRP)购自Abcam公司,SuperSignal West Pico PLUS Chemiluminescent Substrate购自Thermo Scientific公司。
1.3 基因扩增及测序引物依据合成的China-SY18株病毒B646L基因序列,使用Primer premier 5.0软件设计扩增引物,上游引物B646L-up: 5′-CACCATGGCATCAGG-3′;下游引物B646L-down: 5′-GGTACTGTAACGCA-3′,扩增长度为1 942 bp。pAd/CMV/V5-DEST腺病毒载体测序引物为T7:5′-TAATACGACTCACTATAGGG-3′;V5(C-term):5′-ACCGAGGAGAGGGTTAGGGAT-3′。以上引物均由北京华大基因公司合成。
1.4 重组腺病毒的构建先将合成的B646L基因通过TOPO连接直接克隆到过渡载体pENTR/D-TOPO中,得到过渡载体重组质粒pENTR/D-TOPO-ASFV-P72,并进行测序验证(该部分委托北京华大基因公司完成)。将测序正确的pENTR/D-TOPO-ASFV-P72质粒使用Gateway LR ClonaseII Enzyme Mix与pAd/CMV/V5-DEST腺病毒载体进行重组,得到pAd-ASFV-P72重组质粒,将PCR鉴定为阳性的质粒,再进行测序验证。
1.5 重组腺病毒的包装及鉴定将经测序验证的pAd-ASFV-P72重组质粒使用PacⅠ进行酶切,将重组质粒进行线性化。再将线性化的pAd-ASFV-P72重组质粒用Lipofectamine 3000转染试剂按使用说明转染293A细胞,待转染后8~10 d细胞出现典型“葡萄串样”细胞病变时收集细胞和培养液,反复冻融三次,5 000 r·min-1离心5 min,收集上清液。该上清液作为拯救出重组腺病毒Ad5-ASFV-P72的第一代种毒。取100 μL种毒感染直径10 cm培养皿的293A细胞,待细胞出现约80%细胞病变时,进行收毒。继续传代扩增或置于-80 ℃冰箱中保存。
1.6 重组腺病毒滴度的测定使用Adeno-X Rapid Titer Kit试剂盒按照使用说明对第二代Ad5-ASFV-P72重组腺病毒的滴度进行快速测定,取三个视野的褐色阳性信号数量计算平均数,代入公式计算滴度。病毒的滴度用“每毫升感染单位(infectious units,IFU)”表示,即“IFU·mL-1”。计算公式如下:病毒滴度(IFU·mL-1)=[(感染细胞/视野)×(视野/孔)]÷[病毒液体积(mL)×稀释系数]。
1.7 ASFV P72蛋白表达情况鉴定 1.7.1 免疫荧光方法鉴定使用Vero细胞铺制24孔细胞培养板,待细胞生长至80%时,进行细胞计数。按100 moi病毒量接种Ad5-ASFV-P72重组腺病毒,37 ℃维持培养48 h。使用70%预冷丙酮固定Vero细胞10 min,弃去固定液,将细胞培养板自然晾干。每孔加入Anti-V5-FITC Antibody(1:200稀释)200 μL,同时设立非洲猪瘟标准阴性血清的阴性对照孔。置于37 ℃湿盒中孵育1 h,PBS缓冲液洗涤三次,置倒置荧光显微镜观察结果。
1.7.2 Western blot鉴定使用Vero细胞铺制6孔细胞培养板,待细胞生长至80%时,进行细胞计数。按100 moi病毒量接种Ad5-ASFV-P72重组腺病毒,37 ℃维持培养48 h。将细胞培养液弃去,经RIPA细胞裂解液裂解后进行SDS-PAGE电泳并将蛋白转印至PVDF膜,5%脱脂乳封闭过夜。分别利用Anti-V5-HRP抗体(1:5 000)和ASFV标准阳性血清(1:100)为一抗,Goat Anti-Pig IgG H&L (HRP)(1:5 000)为ASFV标准阳性血清的二抗,对重组腺病毒P72蛋白的表达情况进行Western blot鉴定。
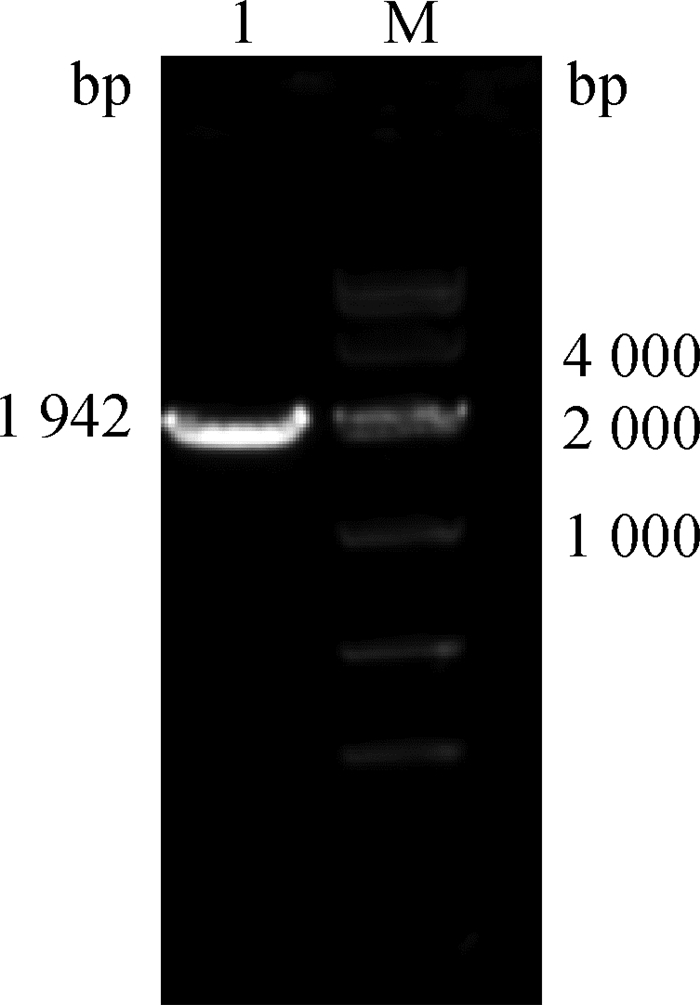
2 结果 2.1 重组质粒的鉴定将pAd-ASFV-P72重组质粒使用B646L-up、B646L-down引物进行PCR扩增,电泳结果显示扩增出大小为1 942 bp的片段(图 1),表明B646L基因已成功重组到pAd/CMV/V5-DEST腺病毒载体中。进一步以T7、V5为引物对重组质粒进行测序验证,结果表明插入的B646L基因序列与原始合成序列完全一致(数据未显示)。
|
M. DNA DL10000相对分子质量标准;1. B646L基因片段(1 942 bp) M. DL10000 DNA marker; 1. B646L gene (1 942 bp) 图 1 B646L基因的PCR扩增 Fig. 1 Amplification of B646L gene by PCR |
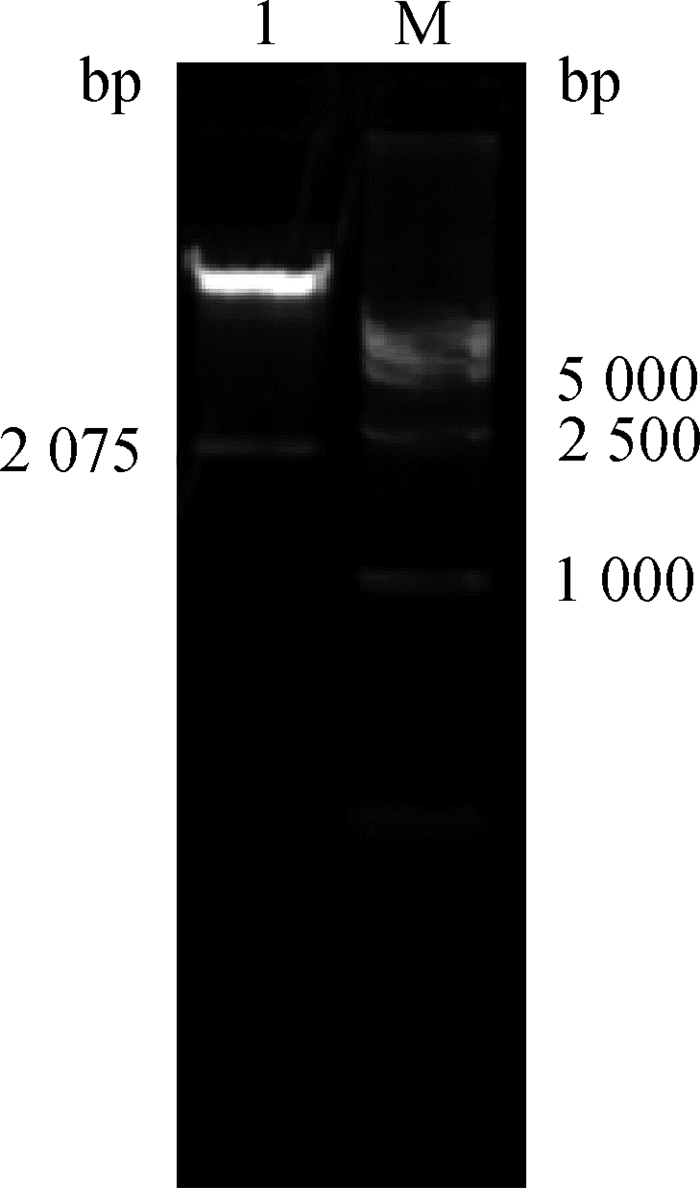
pAd-ASFV-P72重组质粒使用PacⅠ进行酶切后,电泳结果显示出现两个条带,约36 kb的线性化重组质粒pAd-ASFV-P72和2 075 bp的PacⅠ酶切带(图 2)。线性化pAd-ASFV-P72重组质粒转染293A细胞6 d后开始出现细胞病变,转染后第8天出现典型“葡萄串样”细胞病变(图 3A),空白对照细胞形态正常(图 3B)。
|
M. DNA DL15000相对分子质量标准;1. Pac Ⅰ酶切产物 M. DL15000 DNA marker; 1. Products from the recombinant plasmid digested by Pac Ⅰ 图 2 重组质粒pAd-ASFV-P72酶切鉴定 Fig. 2 Identification of the recombinant plasmid pAd-ASFV-P72 by enzymatical digestion |

|
A.重组质粒pAd-ASFV-P72转染组;B.对照组 A. The group transfected by recombinant plasmid pAd-ASFV-P72; B. Control group 图 3 转染后第8天细胞形态 Fig. 3 Cell morphology on day 8 after transfection |
DAB显色后,第二代重组腺病毒Ad5-ASFV-P72各稀释度细胞孔均出现阳性的褐色信号,以10-5稀释度细胞孔阳性信号数量最为适中(图 4A),用于计算滴度;阴性对照无阳性褐色信号(图 4B)。依照公式(见“1.6”),病毒滴度= (16×79) / (0.05×10-5)=2.53×109 IFU·mL-1。

|
A.重组腺病毒感染组;B.对照组 A. The group infected by recombinant adenovirus; B. Control group 图 4 重组腺病毒Ad5-ASFV-P72滴度测定 Fig. 4 Titer determination of the recombinant adenovirus Ad5-ASFV-P72 |
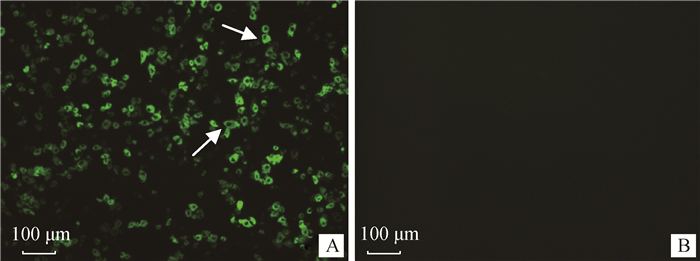
感染Ad5-ASFV-P72重组腺病毒的Vero细胞能够观察到细胞质内有特异性的绿色荧光信号(图 5A),对照孔细胞观察不到荧光信号(图 5B)。初步说明Ad5-ASFV-P72重组腺病毒能够表达P72蛋白。
|
A.重组腺病毒感染组;B.对照组 A. The group infected by recombinant adenovirus; B. Control group 图 5 P72重组蛋白免疫荧光方法鉴定 Fig. 5 IFA identification of the recombinant P72 protein |
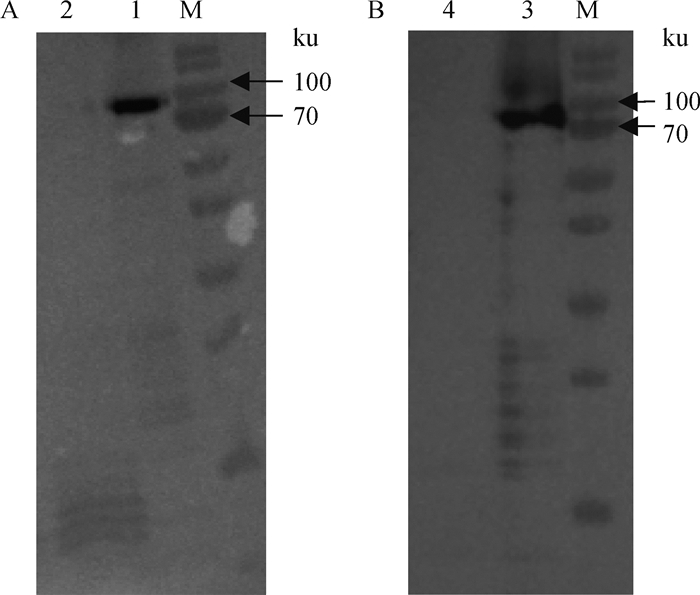
感染Ad5-ASFV-P72重组腺病毒细胞孔提取的蛋白,将Anti-V5-HRP作为一抗,经Western blot检测,在约73 ku的位置可见一条特异性的曝光条带(图 6A);将ASFV标准阳性血清作为一抗,Goat Anti-Pig IgG H&L (HRP)作为二抗,经Western blot检测,在约73 ku的位置也可见一条特异性的曝光条带(图 6B)。这说明P72蛋白得到有效表达,并且与V5标签抗体和ASFV标准阳性血清均可以发生特异性反应。
|
A. V5标签抗体Western blot鉴定ASFV p72蛋白;B. ASFV标准阳性血清Western blot鉴定ASFV P72蛋白;M.蛋白质相对分子质量标准;1、3. Ad5-ASFV-P72重组腺病毒感染组细胞;2、4.人5型腺病毒感染对照组细胞 A. Western blot identification of ASFV p72 by V5-tag antibody; B. Western blot identification of ASFV P72 by ASFV positive serum; M. Protein marker; 1, 3. The group infected by Ad5-ASFV-P72 recombinant adenovirus; 2, 4. The control group infected by human adenovirus type 5 图 6 P72重组蛋白的Western blot鉴定 Fig. 6 Western blot identification of the recombinant P72 protein |
非洲猪瘟疫情在世界范围内不断蔓延。国内外科学家在非洲猪瘟疫苗研究方面进行了不断的尝试和探索,但至今仍没有商业化的ASFV疫苗[9, 20]。多项研究表明CTL反应可能是机体发挥保护作用的一个至关重要的因素。因此,开发一种能够识别CTL靶点的疫苗可激发大量的CTL效应淋巴细胞,用于消除被ASFV感染的细胞, 并且可提供长久的免疫保护作用[8, 10-11, 13]。研究表明,将ASFV保护性抗原重组入腺病毒或痘病毒载体,可获得比较好的细胞免疫和CTL反应[14, 21-22];ASFV P72蛋白能够被猪CTL所识别[8]。因此,本研究选取腺病毒作为载体对ASFV P72蛋白进行表达,所构建的重组腺病毒可用于后续ASFV腺病毒载体疫苗开发工作中。
目前,腺病毒载体已被广泛应用于基因工程疫苗、体外基因转导和体内基因治疗等领域[15-19]。本研究使用的人复制缺陷型腺病毒载体Ad5缺失了负责编码腺病毒早期蛋白的E1区和E3区,缺失E1区的腺病毒不能有效地复制和产生各种病毒蛋白,必须在能够提供E1基因功能的细胞内(293A细胞)进行复制。该载体系统还引入CMV启动子,使得外源基因可以高水平表达,且表达的蛋白质能够进行翻译后修饰和折叠。腺病毒载体能够携带多种抗原,并刺激机体产生很强的体液免疫或细胞免疫。由于腺病毒载体能感染呼吸道和肠道细胞,可以方便地通过黏膜进行免疫并诱导机体产生黏膜和系统免疫应答,腺病毒载体还可以同其他载体联合免疫。
制缺陷型腺病毒在临床应用是通过一次性注射来完成的,注射后病毒并不能繁殖,因此验证其在不能繁殖情况下外源蛋白的表达能力是必要的。本研究选用Vero细胞来进行重组病毒Ad5-ASFV-P72外源蛋白表达情况的验证。IFA和Western blot的试验结果表明Ad5-ASFV-P72复制缺陷型腺病毒在不能繁殖的情况下,可以有效表达P72蛋白。
4 结论成功获得能表达ASFV P72蛋白的重组腺病毒Ad5-ASFV-P72,不仅为ASFV其他基因重组腺病毒的构建提供参考,还可为ASFV相关血清学诊断方法的建立提供安全有效的抗原。
| [1] | BLOME S, GABRIEL C, BEER M. Pathogenesis of African swine fever in domestic pigs and European wild boar[J]. Virus Res, 2013, 173(1): 122–130. DOI: 10.1016/j.virusres.2012.10.026 |
| [2] |
王志亮. 非洲猪瘟研究进展[J]. 中国动物检疫, 2011, 28(6): 70–74.
WANG Z L. Advances in research of African swine fever[J]. Chinese Journal of Animal Health Inspection, 2011, 28(6): 70–74. DOI: 10.3969/j.issn.1005-944X.2011.06.030 (in Chinese) |
| [3] |
王清华, 任炜杰, 包静月, 等. 我国首例非洲猪瘟的确诊[J]. 中国动物检疫, 2018, 35(9): 1–4.
WANG Q H, REN W J, BAO J Y, et al. The first outbreak of African swine fever was confirmed in China[J]. China Animal Health Inspection, 2018, 35(9): 1–4. DOI: 10.3969/j.issn.1005-944X.2018.09.001 (in Chinese) |
| [4] | LOPEZ-OTIN C, FREIJE J M P, PARRA E, et al. Mapping and sequence of the gene coding for protein p72, the major capsid protein of African swine fever virus[J]. Virology, 1990, 175(2): 477–484. DOI: 10.1016/0042-6822(90)90432-Q |
| [5] | ZSAK L, ONISK D V, AFONSO C L, et al. Virulent African swine fever virus isolates are neutralized by swine immune serum and by monoclonal antibodies recognizing a 72-kDa viral protein[J]. Virology, 1993, 196(2): 596–602. DOI: 10.1006/viro.1993.1515 |
| [6] | GÓMEZ-PUERTAS P, RODRÍGUEZ F, OVIEDO J M, et al. Neutralizing antibodies to different proteins of African swine fever virus inhibit both virus attachment and internalization[J]. J Virol, 1996, 70(8): 5689–5694. |
| [7] | GARCÍA-BARRENO B, SANZ A, NOGAL M L, et al. Monoclonal antibodies of African swine fever virus:antigenic differences among field virus isolates and viruses passaged in cell culture[J]. J Virol, 1986, 58(2): 385–392. |
| [8] | LEITAO A, MALUR A, COMELIS P, et al. Identification of a 25-amino acid sequence from the major African swine fever virus structural protein VP72 recognised by porcine cytotoxic T lymphocytes using a lipoprotein based expression system[J]. J Virol Methods, 1998, 75(1): 113–119. DOI: 10.1016/S0166-0934(98)00105-0 |
| [9] |
戈胜强, 吴晓东, 张志诚, 等. 非洲猪瘟疫苗研究进展[J]. 畜牧兽医学报, 2016, 47(1): 10–15.
GE S Q, WU X D, ZHANG Z C, et al. Progress in development of African swine fever vaccine[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(1): 10–15. (in Chinese) |
| [10] | TAKAMATSU H H, DENYER M S, LACASTA A, et al. Cellular immunity in ASFV responses[J]. Virus Res, 2013, 173(1): 110–121. DOI: 10.1016/j.virusres.2012.11.009 |
| [11] | ALONSO F, DOMIÍNGUEZ J, VIÑUELA E, et al. African swine fever virus-specific cytotoxic T lymphocytes recognize the 32 kDa immediate early protein (vp32)[J]. Virus Res, 1997, 49(2): 123–130. DOI: 10.1016/S0168-1702(97)01459-7 |
| [12] |
龚振华, 王丽萍, 臧京帅, 等. 非洲猪瘟病毒p54蛋白的高效表达及在ELISA中的应用[J]. 畜牧兽医学报, 2013, 44(11): 1832–1837.
GONG Z H, WANG L P, ZANG J S, et al. Studies on the efficient expression of African swine fever virus p54 protein and its antigenic analysis in ELISA[J]. Acta Veterinaria et Zootechnica Sinica, 2013, 44(11): 1832–1837. (in Chinese) |
| [13] | MARTINS C L V, LAWMAN M J P, SCHOLL T, et al. African swine fever virus specific porcine cytotoxic T cell activity[J]. Arch Virol, 1993, 129(1-4): 211–225. DOI: 10.1007/BF01316896 |
| [14] | LOKHANDWALA S, WAGHELA S D, BRAY J, et al. Induction of robust immune responses in swineby using a cocktail of adenovirus-vectored African swine fever virus antigens[J]. Clin Vaccine Immunol, 2016, 23(11): 888–900. DOI: 10.1128/CVI.00395-16 |
| [15] | MAEDA K, WEST K, HAYASAKA D, et al. Recombinant adenovirus vector vaccine induces stronger cytotoxic T-cell responses than recombinant vaccinia virus vector, plasmid DNA, or a combination of these[J]. Viral Immunol, 2005, 18(4): 657–667. DOI: 10.1089/vim.2005.18.657 |
| [16] | TATSIS N, ERTL H C J. Adenoviruses as vaccine vectors[J]. Mol Ther, 2004, 10(4): 616–629. DOI: 10.1016/j.ymthe.2004.07.013 |
| [17] | KAMEN A, HENRY O. Development and optimization of an adenovirus production process[J]. J Gene Med, 2004, 6(S1): S184–S192. DOI: 10.1002/jgm.503 |
| [18] | GOGEV S, VANDERHEIJDEN M, LEMAIRE M, et al. Induction of protective immunity to bovine herpesvirus type 1 in cattle by intranasal administration of replication-defective human adenovirus type 5 expressing glycoprotein gC or gD[J]. Vaccine, 2002, 20(9-10): 1451–1465. DOI: 10.1016/S0264-410X(01)00458-3 |
| [19] | ZHU J G, HUANG X P, YANG Y P. Innate immune response to adenoviral vectors is mediated by both Toll-like receptor-dependent and -independent pathways[J]. J Virol, 2007, 81(7): 3170–3180. DOI: 10.1128/JVI.02192-06 |
| [20] | REVILLA Y, PÉREZ-NÚÑEZ D, RICHT J A. African swine fever virus biology and vaccine approaches[J]. Adv Virus Res, 2018, 100: 41–74. DOI: 10.1016/bs.aivir.2017.10.002 |
| [21] | LOKHANDWALA S, WAGHELA S D, BRAY J, et al. Adenovirus-vectored novel African swine fever virus antigens elicit robust immune responses in swine[J]. PLoS One, 2017, 12(5): e0177007. DOI: 10.1371/journal.pone.0177007 |
| [22] | LOPERA-MADRID J, OSORIO J E, HE Y Q, et al. Safety and immunogenicity of mammalian cell derived and modified vaccinia Ankara vectored African swine fever subunit antigens in swine[J]. Vet Immunol Immunopathol, 2017, 185: 20–33. DOI: 10.1016/j.vetimm.2017.01.004 |



