2. 甘肃省家畜繁育改良管理站, 武威 733000
2. Station of Domestic Animal Improving and Management of Gansu Province, Wuwei 733000, China
精液品质的高低是评判种公牛种用价值大小的依据,正常精液是由精子和精浆构成的黏稠液体混合物。精浆是运送精子的主要载体,主要由前列腺液、精囊液、附睾液和尿道球腺等分泌的少量液体构成,精浆中的糖类、脂类、蛋白质、肽类激素、胺类、氨基酸和有机酸等在精子输送过程中给精子提供能量和营养物质,它们在精子的成熟过程中起缓冲作用[1-2]。精液活力是影响精液品质的主要因素之一。目前对于精液品质的研究主要集中在生殖激素及精子生成等方面[3-4],精浆作为精液的重要成分对于精子的保护有着重要的作用,但对于精浆方面的研究很少,尤其缺乏系统性的研究。
代谢组学是一种运用高通量、高灵敏度的现代分析技术,主要研究生物体在受到惊扰后,生物体液中相对分子质量小于1 000的代谢物的动态变化,是了解机体整体生理状态的一门新兴学科,它是系统生物学的重要构成部分之一[5]。GC-MS、LC-MS和NMR是目前代谢组学常用的检测方法,而由于LC-MS具有高分辨率和高灵敏度的优点,因此被广泛应用于代谢组学研究[6]。代谢组学被广泛应用于包括转基因动物在内的疾病动物模型的确证、药物筛选、药效及毒性评价、作用机制和临床评价等方面。近年来,代谢组学方法已被成功应用于奶牛疾病诊断和生理机制研究等方面[7-10]。并且在雄性生殖领域也开展了大量的研究,Gupta等[11]利用NMR技术对60名可育男性的精液样品和125名不育男性的精液样品进行分析,结果10种差异代谢物被鉴定,然后利用多元线性判别函数分析处理,发现丙氨酸、柠檬酸、甘油磷酸胆碱、酪氨酸和苯丙氨酸均可用于确定不孕不育。Hamamah等[12]使用1H-HMR技术检测人精浆中的代谢产物,结果发现,患有生精障碍和阻塞性无精子症人群的胆碱和柠檬酸及胆碱与乳酸的峰面积比值均有极显著差异(P < 0.01)。
在肉用种公牛精液生产中,常常出现精液活力差的个体,研究其发生机理对解决或预防这种情况的发生,提升精液品质有重要意义。本试验运用UPLC-Q-TOF MS技术,结合单变量统计分析方法筛选显著性差异代谢物,为研究肉牛精液品质变化机制提供理论依据。
1 材料与方法 1.1 样品采集与分组样品采集严格按照中华人民共和国实验动物保护与利用标准,所有的操作均被宁夏大学动物保护协会批准。试验精液样品均采集于甘肃省家畜繁育中心年龄为(4.9±0.8)岁的西门塔尔种公牛,每头种公牛1周采精2次,每次采集2遍,间隔时间为30 min,采精时间为2018年4月。精液采集后应用相差显微镜成像,目测确定精液活力,应用密度仪测定精液密度,并测定采精量。以所检测样品的精子活力为标准进行分组,精子活力大于0.65的为正常组(对照组,N),包括13份生物学样品。精子活力小于0.65的为异常组(试验组,Ab),包含11份生物学样品。4 ℃ 3 000 r·min-1离心10 min,同时,为了平衡色谱-质谱系统及测定仪器状态,客观评价整个试验过程中系统的稳定性,又制备了4个质控样本(QC01、QC2、QC3、QC4),即将所有样品等量混合而成,用TIC图反映样品整体的信息,将制备好的试验组置于-80 ℃保存,以备后续分析。
1.2 牛精液样品预处理分别取每例样本100 μL,加入400 μL甲醇/乙腈(2:2,v/v)后涡旋混匀,然后在低温下进行超声破碎30 min,2次,在-20 ℃孵育1 h沉淀蛋白质,在13 000 r·min-1,4 ℃离心15 min,取上清液,冻干后存于-80 ℃备用。质谱分析时,100 μL乙腈水溶液(乙腈:水=1:1,v/v)被加入进行复溶,涡旋震荡后,再次在4 ℃条件下,14 000 g离心15 min,上清液被用于进样分析。预处理完成后,将样品送至上海拜谱生物科技有限公司进行UPLC-Q-TOF MS检测。
1.3 牛精液的UPLC-Q-TOF MS分析整个分析过程中样品一直处于4 ℃的自动进样器中,使用Agilent 1 290 Infinity LC超高效液相色谱系统HILIC色谱柱对样品进行分离。其中进样量为2 μL,此时柱温为25 ℃,流速为0.3 mL·min-1;色谱流动相A:水+25 mmol·L-1乙酸铵+25 mmol·L-1氨水,B:乙腈;色谱梯度洗脱程序:0~0.5 min,95% B;0.5~7 min,B从95%线性变化至65%;7~8 min,B从65%线性变化至40%;8~9 min,B维持在40%;9~9.1 min,B从40%线性变化到95%;9.1~12 min,B维持在95%。QC样品被插入到样本队列中用于监测和评判系统的稳定性和试验数据的可靠性。
使用电喷雾电离(ESI)方法分别对每例样品进行正、负离子模式检测。样品经过UPLC方法分离后使用Triple-TOF 5600质谱仪进行质谱分析。其ESI源条件:离子源气体1(Gas1)为60,离子源气体2(Gas2)为60,帘气(CUR)为30,电喷雾离子源温度为600 ℃,电离层电压浮动为(ISVF)±5 500 V(正离子和负离子2种模式);TOF MS扫描的m/z范围为60~1 200 Da,产品离子扫描的m/z范围为25~1 200 Da,TOF MS扫描累计时间为0.15 s/spectra, 产品离子扫描累积时间为0.03 s/spectra;二级质谱从information dependent acquisition(IDA)获得,结合使用高灵敏度模式,去簇电压(DP)为±60 V(正离子和负离子两种模式),碰撞能量为30 eV,IDA中不包括在内的同位素为4 Da,每个周期监测的候选离子为6。
1.4 数据处理及统计分析采用ProteoWizard将原始数据转换成mzXML格式,然后采用XCMS程序进行峰对齐、保留时间校正和提取峰面积。使用精确质量数匹配(< 25 ppm)结合二级谱图匹配的方法对代谢物进行结构鉴定,检索实验室自建数据库。对从XCMS中获取得到的数据进行处理,组内缺失值>50%的离子峰被删除,然后使用软件SIMCA-P 14.1(Umetrics,Umea,Sweden)对离子峰进行模式识别,数据经过Pareto-scaling预处理后,进行多维统计分析,主要包含无监督的主成分分析(PCA)和有监督的正交偏最小二乘法判别分析(OPLS-DA)。PCA主要反映组内聚集和组间分离趋势,而OPLS-DA进一步表达组间的变化差异。然后建立比较组的OPLS-DA模型,经过7次循环交互验证得到模型的评判参数R2Y(模型解释率)和Q2(模型预测率),使用R2Y和Q2对正、负离子的OPLS-DA模型分别进行交叉验证和置换测试(Q2 intercept)。如果R2 Y和Q2均大于等于0.5时, 表明模型稳定可靠;此外,如果置换检验图的Q2 intercept < 0时,表明本试验正、负离子模式数据建立的OPLS-DA模型未过度拟合。然后采用单变量分析方法对2组样本进行组间差异代谢物分析,常用的单变量分析方法主要有变异倍数分析(fold change analysis,FC analysis)、T检验。数据分析前先检查数据的完整性,然后再删除或补充缺失值。
1.5 牛精液异常组与正常组精浆样品差异代谢物的筛选与鉴定VIP(variable importance for the projection)即变量投影重要度,是根据OPLS-DA模型得到的变量权重值,用来衡量各代谢物的表达模式对各组样本分类判别的影响强度和解释能力,以及辅助标志代谢物的筛选。VIP值大于1的变量被视为对分类具有重要意义的变量。在本研究中,以VIP>1为筛选标准,各组间的差异代谢物被初步筛选。进一步运用单变量统计分析验证代谢物是否具有显著性差异。选择同时具有多维统计分析VIP>1和单变量统计分析P < 0.05的代谢物,作为具有显著性差异的代谢物。通过质荷比(m/z)精确匹配(误差小于25 ppm)和二级质谱图检索比对本地数据库的方法鉴定差异化合物。然后使用定性的显著性差异代谢物表达量对2组样本分别进行层次聚类(hierarchical clustering),层析聚类结果用树型热图表示,红色组代表异常组,绿色组代表正常组,热图中每一行分别代表所筛选出的候选标志物,每一列分别代表不同的样本。ROC曲线可以进一步考察差异代谢物对2组精浆分类的识别能力。将已经筛选出VIP>1、P < 0.05的差异代谢物导入Origin Pro 8.0软件,结合统计学检验进行分类识别能力分析。ROC曲线以特异性为横轴,灵敏性为纵轴,横轴与纵轴长度相等,形成正方形,在图中将ROC相邻的工作点用直线连接构建ROC曲线。根据ROC曲线下的面积(AUC)进行判别,代谢物AUC>0.5时,说明此代谢物具有较好的识别能力,代谢物AUC>0.8时,说明此代谢物是识别2组精浆样品的主要指标。
2 结果 2.1 牛精液样品品质检测结果测定数据经Excel初步整理后,数据采用SPSS 19.0做方差分析,所测得的数据用“平均值±标准差”表示。差异显著时用LSD法做多重比较。显著性水平为P<0.05。由表 1分析结果可知,测得的正常组和异常组精子活力表现为差异极显著,密度和采精量均表现为差异不显著。
|
|
表 1 异常组与正常组精液品质参数 Table 1 The parameters of semen samples in abnormal and normal groups |
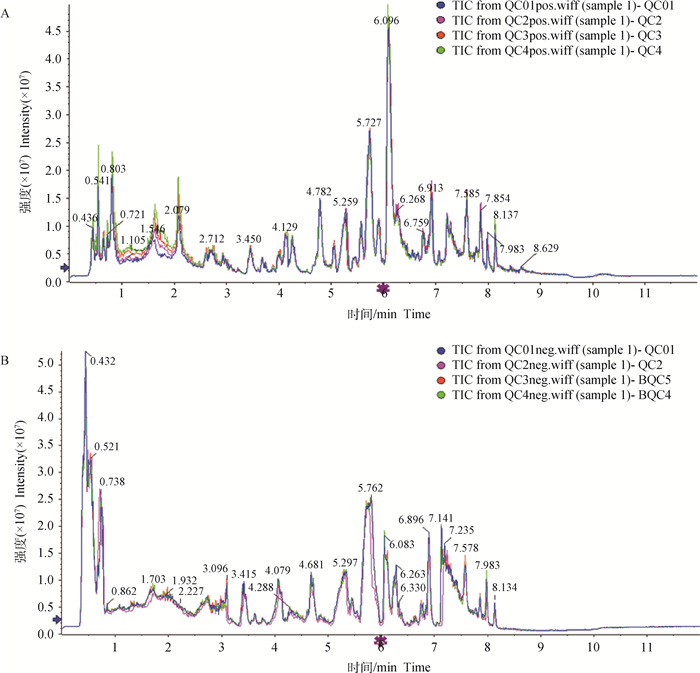
将QC样本在正、负离子检测模式下的质谱总离子流图(TIC)分别进行谱图叠加比较(图 1),结果表明,各色谱峰的响应强度和保留时间基本重叠,TIC峰形状完整,相邻峰之间分离明显,说明整个试验过程中仪器误差引起的变异较小,数据质量可靠。
|
代谢物在质控样本QC01、QC2、QC3、QC4的峰面积反映出该代谢物在该样本中的表达量,一般在样本中插入QC用于监测检测系统的稳定性和重复性 The peak area of a metabolite in QC01, QC2, QC3 and QC4 reflects the expression level of the metabolite in the sample. Generally, QC is inserted into the sample to monitor the stability and repeatability of the detection system 图 1 QC样品在正离子(A)、负离子(B)模式下TIC重叠图谱 Fig. 1 TIC overlap map of QC sample under positive ion(A), negative ion(B) modes |
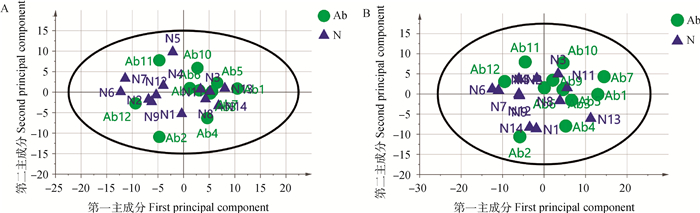
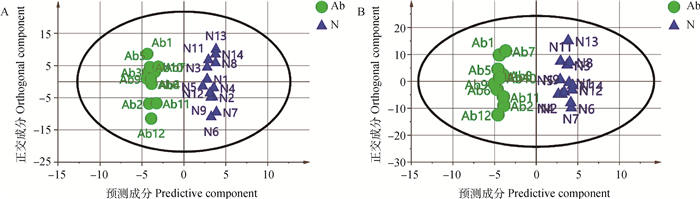
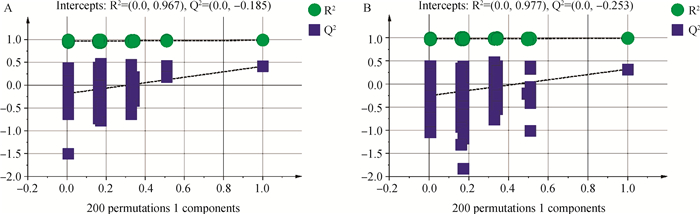
PCA模型得分图(图 2)表明,正、负离子模式下异常组和正常组的模型解释率(R2X)分别为0.370和0.482。在正、负离子模式数据下,此样本间没有呈现明显的分离趋势,见图 2。用有监督正交偏最小二乘法来评估组间样本差异,在正离子模式下,OPLS-DA得分图R2Y=0.984、Q2=0.413;在负离子模式下OPLS-DA得分图R2Y=0.985,Q2=0.319,此模型R2Y均大于0.5,Q2均小于0.5,表明此模型的解释率高,预测能力偏低,见图 3。继续对正、负离子模式数据OPLS-DA模型进行置换检验,见图 4。由图 4可知,在正离子模式下Q2截距=-0.185(Q2intercept < 0),负离子模式下Q2截距=-0.253(Q2intercept < 0),表明OPLS-DA模型未过度拟合,说明正常组与异常组精浆代谢物存在差异。
|
图 2 正(A)、负(B)离子模式下PCA-X得分图 Fig. 2 PCA-X score map under positive(A), negative(B) ion modes |
|
图 3 正(A)、负(B)离子模式下OPLS-DA得分图 Fig. 3 OPLS-DA score map under positive(A), negative(B) ion modes |
|
R2intercept和Q2intercept表示R2和Q2回归直线与Y轴的截距,Q2 intercept < 0表明OPLS-DA模型未过度拟合。横坐标代表随机分组的Y与原始分组的Y的相关性,纵坐标代表R2和Q2的得分 R2 intercept and Q2 intercept represent the intercept of the R2 and Q2 regression lines and the Y-axis, Q2 intercept < 0 indicate that the OPLS-DA model is not over-fitting. The abscissa represent the correlation between the random grouping Y and the original grouping Y, and the ordinate represent the scores of R2 and Q2 图 4 正(A)、负(B)离子模式下OPLS-DA置换检验 Fig. 4 OPLS-DA replacement test under positive(A), negative(B) ion modes |
本试验将VIP>1和单变量统计分析P < 0.05的代谢物作为具有显著性差异的代谢物。在正、负离子模式下共筛选出25种显著性差异代谢物,正离子模式下有12个,负离子模式下有13个,筛选的显著性差异代谢物见表 2、表 3。使用MetaboAnalyst分析平台对筛选出的25种差异代谢物进行聚类分析,由图 5可知,异常组和正常组数据基本能够很好的聚集在一起,说明试验样本组内无明显差异,根据左面树杈的分类情况可知,25种代谢物总体分为两大类,第一类代谢物有6种,分别是鞘氨醇、环己胺、四氧嘧啶、5′-脱氧腺苷、N6, N6, N6-三甲基-L-赖氨酸、戊酸,说明这6种代谢物在2组样本中表达模式相似,根据FC值可知这6种代谢物的表达模式均为下调,剩余19种代谢物聚为一类,它们的表达模式均为上调。
|
|
表 2 正离子模式下差异代谢物VIP及Kruskal-Wallis检验结果 Table 2 VIP and Kruskal-Wallis test results of differentiated metabolites under the positive ion mode |
|
|
表 3 负离子模式下差异代谢物VIP及Kruskal-Wallis检验结果 Table 3 VIP and Kruskal-Wallis test results of differentiated metabolites under the negative ion mode |
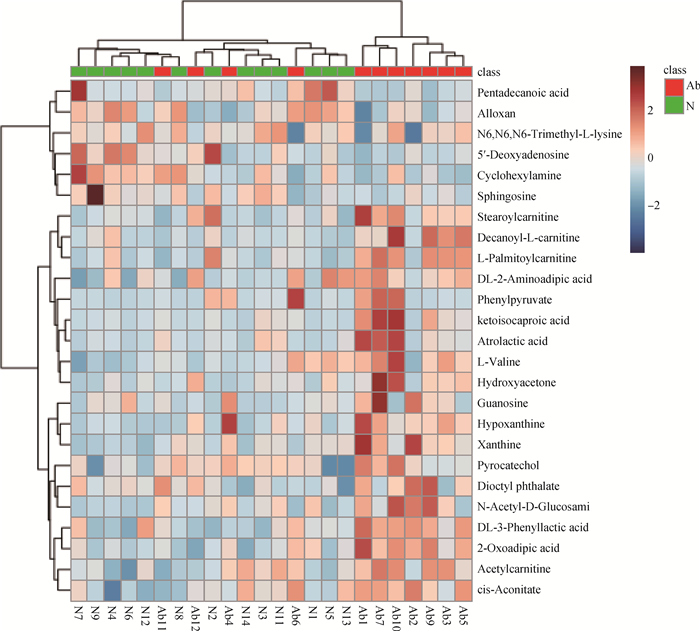
|
异常组(红色组)与正常组(绿色组)精浆中25种代谢物分级聚类的热图,红色方块表示强度增强,蓝色方块表示强度减弱 Heat map of hierarchical clustering of 25 selected metabolites in seminal plasma between abnormal group(red class) and normal group (green class), red blocks indicate increased intensities, blue blocks indicate decreased intensities 图 5 总显著性差异代谢物层次聚类结果 Fig. 5 Total significant differential metabolites hierarchical clustering results |
本试验所筛选出的25种差异代谢物表征了与精液品质相关的生物信息变化,为更好筛选出具有标志性作用的关键代谢物,进一步采用ROC曲线和LC-Q/TOF-MS峰强箱式图对已筛选出的25种差异代谢物进行二次筛选(图 6、图 7),筛选出ROC曲线下面积(AUC)>0.5的差异代谢物,本试验结果显示,鞘氨醇、环己胺、四氧嘧啶、5′-脱氨腺苷、N6, N6, N6-三甲基-L-赖氨酸、戊酸的AUC>0.5,说明这6种代谢物对2组精浆样品具有较好的识别能力。在这6个差异代谢物中,鞘氨醇的AUC面积在0.80以上,P < 0.05,说明鞘氨醇是识别2组精浆样品的主要指标。
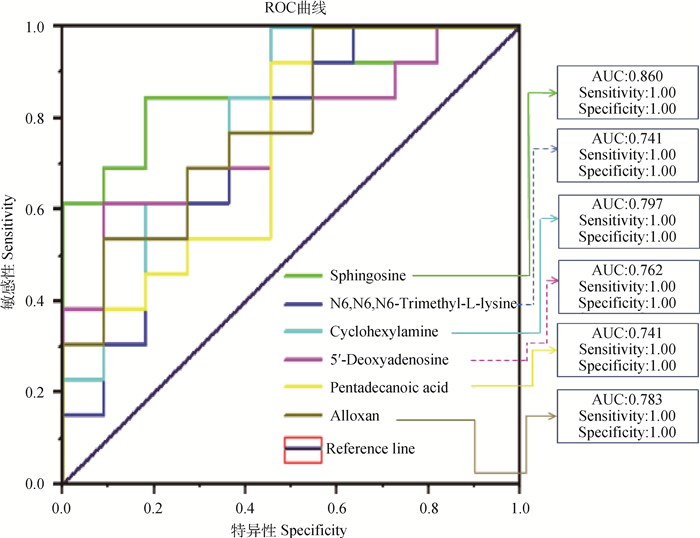
|
图 6 6个差异代谢物的ROC曲线 Fig. 6 ROC curves of 6 differential metabolites |
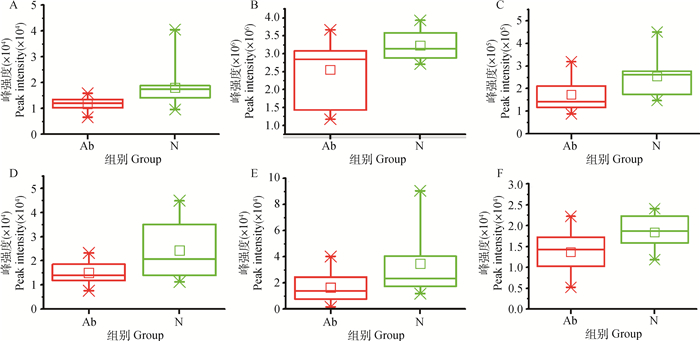
|
A.鞘氨醇; B. N6, N6, N6-三甲基-L-赖氨酸; C.环己胺; D. 5′-脱氧腺苷; E.戊酸; F.四氧嘧啶 A.Sphingosine; B.N6, N6, N6-Trimethyl-L-lysine; C.Cyclohexylamine; D.5′-Deoxyadenosine; E. Pentadecanoic acid; F. Alloxan 图 7 异常组和正常组中6个差异代谢物LC-Q/TOF-MS峰强度箱式图 Fig. 7 LC-Q/TOF-MS peak intensity box plots of 6 differential metabolites in abnormal and normal groups |
本研究发现,在肉用种公牛的精液中,精子活力正常组的鞘氨醇浓度高于异常组。而刘丹薇等[13]在1-磷酸鞘氨醇对雄性小鼠环磷酰胺染毒的生殖毒性损害的拮抗作用的研究中发现,与环磷酰胺染毒组相比,各1-磷酸鞘氨醇剂量组精子计数升高,畸形率降低,乳酸脱氢酶活力升高,DNA损伤降低(P<0.05)。说明1-磷酸鞘氨醇对雄性小鼠生殖细胞毒性损害具有一定的拮抗作用,它能提高精液质量与能量代谢酶乳酸脱氢酶的活性,一定程度上抵御细胞DNA损伤。
赖氨酸是肉碱合成的关键物质[14],在本研究中,正常组的N6, N6, N6-三甲基-L-赖氨酸水平显著高于异常组,可能是由于异常组中赖氨酸的缺乏导致脂肪酸不能被充分利用。另一个可能的原因是DNA甲基化和组蛋白翻译后修饰变化引起基因表达的可遗传变化[15]。N6, N6, N6-三甲基-L-赖氨酸作为蛋白质甲基化修饰的重要结合位点,精子的蛋白修饰发生变化将导致赖氨酸出现异常。有研究表明,组蛋白3和4 (H3K9ac, 12-H4K12ac)中赖氨酸残基的乙酰化/去乙酰化会影响男性的生殖能力[16]。
动物附睾组织中含有非常丰富的肉碱,其单位体积的含量明显高于其它器官组织[17-18]。附睾中的精子主要通过脂肪酸氧化供能[19]。在脂肪酸氧化过程中,中链和短链脂肪酸可直接进入线粒体氧化,不需要肉碱参与[20];而长链脂肪酸不能直接透过线粒体膜,通过存在于线粒体外膜的肉碱棕榈酰转移酶I催化成脂酰肉碱,才能透过线粒体内膜,从胞质进入到线粒体基质进行β-氧化产生能量,用于精子的运动和成熟[21-23]。另外,精子膜是由磷脂、糖脂和固醇组成的异质混合物[24]。有研究报道,精子膜中总饱和脂肪酸的含量与活精子细胞膜的完整性呈负相关[25]。精子膜中的主要饱和脂肪酸是棕榈酸[26-27]和硬脂酸[28]。本试验中,活力异常组中L-氯化棕榈酰肉碱、L-棕榈酰肉碱和硬脂酰肉碱含量均高于正常组,说明活力异常的精液中棕榈酸和硬脂酸浓度很高,且异常组中的长链酰基肉碱不能被及时利用,导致长链酰基肉碱在精清中大量蓄积,致使精子品质低下。虽然这些指标的AUC值比较低,但也说明它们在精液活力方面具有一定的意义。
由于异常组的总饱和脂肪酸(棕榈酸和硬脂酸)肉碱的含量高,使得精子细胞膜的完整性差[25, 29],从而导致细胞核内的遗传物质进入精浆,这是精浆中测得的次黄嘌呤、黄嘌呤和鸟嘌呤核苷含量显著高于正常组的一个可能的原因。脱氧腺苷主要用于DNA合成和修复[30]。低含量的脱氧腺苷可能会导致DNA合成和修复受阻,从而表现为精子活力异常。
4 结论本试验采用UPLC-Q-TOF MS代谢组学技术对西门塔尔种公牛精浆代谢物和精子活力的变化趋势进行了研究,结合Kruskal-Wallis检验和ROC曲线筛选了6个生物标志物。这些代谢物为鞘氨醇、环己胺、四氧嘧啶、5′-脱氧腺苷、N6, N6, N6-三甲基-L-赖氨酸、戊酸。并且这6种代谢物均在精子活力正常组中浓度高,这些物质有望成为判定精液活力的重要指标。
| [1] |
苏春霞, 王凌, 王若竹, 等. 不育男性精液白细胞增高对精子质量影响临床研究[J]. 中国实验诊断学, 2015, 19(4): 665–666.
SU C X, WANG L, WANG R Z, et al. Clinical study on the effect of leukocyte increase on sperm quality in sterile male semen[J]. Chinese Journal of Laboratory Diagnosis, 2015, 19(4): 665–666. (in Chinese) |
| [2] | ROTHSCHILD L, BARNES H. Constituents of bull seminal plasma[J]. J Exp Biol, 1954, 31(4): 561–572. |
| [3] |
赵凯.稀释液中添加维生素D和C及褪黑激素对水牛精液冷冻保存效果的影响[D].武汉: 华中农业大学, 2016.
ZHAO K.Cryoprotective effects of vitamins D and C as well as melatonin administrated in diluent of buffalo frozen semen[D].Wuhan: Huazhong Agricultural University, 2016.(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10504-1016156199.htm |
| [4] |
任小霞.应用LCM技术结合冰冻切片捕获奶牛生精细胞及RNA的提取[D].北京: 中国农业科学院, 2016.
REN X X.The capture of dairy cattle spermatogenic cells using LCM-frozen section technology and extraction of total RNA[D].Beijing: Chinese Academy of Agricultural Sciences, 2016.(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-82101-1016171391.htm |
| [5] |
任向楠, 梁琼麟. 基于质谱分析的代谢组学研究进展[J]. 分析测试学报, 2017, 36(2): 161–169.
REN X N, LIANG Q L. Advance in metabolomics based on mass spectrometry[J]. Journal of Instrumental Analysis, 2017, 36(2): 161–169. DOI: 10.3969/j.issn.1004-4957.2017.02.002 (in Chinese) |
| [6] | KLEPACKI J, KLAWITTER J, KLAWITTER J, et al. Amino acids in a targeted versus a non-targeted metabolomics LC-MS/MS assay.Are the results consistent?[J]. Clin Biochem, 2016, 49(13-14): 955–961. DOI: 10.1016/j.clinbiochem.2016.06.002 |
| [7] |
许国旺, 路鑫, 杨胜利. 代谢组学研究进展[J]. 中国医学科学院学报, 2007, 29(6): 701–711.
XU G W, LU X, YANG S L. Recent advances in metabonomics[J]. Acta Academiae Medicinae Sinicae, 2007, 29(6): 701–711. DOI: 10.3321/j.issn:1000-503x.2007.06.001 (in Chinese) |
| [8] |
郭延生, 陶金忠. 基于LC-Q/TOF-MS代谢组学方法筛选奶牛妊娠识别阶段乳样生物标志物的研究[J]. 畜牧兽医学报, 2018, 49(8): 1633–1641.
GUO Y S, TAO J Z. Selection of milk biomarkers of pregnancy recognition in dairy cows based on LC-Q/TOF-MS metabolomics[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(8): 1633–1641. (in Chinese) |
| [9] |
郭延生, 贾启鹏, 陶金忠. 基于GC-MS策略的奶牛热应激血液代谢组学研究[J]. 畜牧兽医学报, 2015, 46(8): 1356–1362.
GUO Y S, JIA Q P, TAO J Z. Blood metabolomic studies of heat stress cow with GC-MS[J]. Acta Veterinaria et Zootechnica Sinica, 2015, 46(8): 1356–1362. (in Chinese) |
| [10] |
陶金忠, 郭延生. 奶牛产后血浆1H-NMR代谢组学分析[J]. 畜牧兽医学报, 2016, 47(1): 198–206.
TAO J Z, GUO Y S. Study on the plasma metabolism using 1H-NMR in postpartum cows[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(1): 198–206. (in Chinese) |
| [11] | GUPTA A, MAHDI A A, AHMAD M K, et al. 1H NMR spectroscopic studies on human seminal plasma:a probative discriminant function analysis classification model[J]. J Pharm Biomed Anal, 2011, 54(1): 106–113. DOI: 10.1016/j.jpba.2010.07.021 |
| [12] | HAMAMAH S, SEGUIN F, BUJAN L, et al. Quantification by magnetic resonance spectroscopy of metabolites in seminal plasma able to differentiate different forms of azoospermia[J]. Hum Reprod, 1998, 13(1): 132–135. DOI: 10.1093/humrep/13.1.132 |
| [13] |
刘丹薇, 潘卫, 徐国宾, 等. 1-磷酸鞘氨醇对雄性小鼠生殖毒性损害的拮抗作用[J]. 贵阳医学院学报, 2016, 41(5): 515–519.
LIU D W, PAN W, XU G B, et al. Study on antagonistic effect of S1 P on toxicity damage to male mice' reproductive cells by cyclophosphamide[J]. Journal of Guiyang Medical College, 2016, 41(5): 515–519. (in Chinese) |
| [14] | VAZ F M, WANDERS R J A. Carnitine biosynthesis in mammals[J]. Biochem J, 2002, 361(3): 417–429. |
| [15] | SÁNCHEZ V, WISTUBA J, MALLIDIS C. Semen analysis:update on clinical value, current needs and future perspectives[J]. Reproduction, 2013, 146(6): R249–R258. DOI: 10.1530/REP-13-0109 |
| [16] | PARADOWSKA A S, MILLER D, SPIESS A N, et al. Genome wide identification of promoter binding sites for H4K12ac in human sperm and its relevance for early embryonic development[J]. Epigenetics, 2012, 7(9): 1057–1070. DOI: 10.4161/epi.21556 |
| [17] | BIEBER L L. Carnitine[J]. Annu Rev Biochem, 1988, 57(1): 261. |
| [18] | MONGIOI L, CALOGERO A E, VICARI E, et al. The role of carnitine in male infertility[J]. Andrology, 2016, 4(5): 800–807. DOI: 10.1111/andr.12191 |
| [19] | NG C M, BLACKMAN M R, WANG C, et al. The role of carnitine in the male reproductive system[J]. Ann N Y Acad Sci, 2004, 1033(1): 177–188. DOI: 10.1196/annals.1320.017 |
| [20] |
刘丽, 张学红, 陆彪, 等. 线粒体脂肪酸β-氧化障碍的研究新进展[J]. 中国优生与遗传杂志, 2014, 22(5): 4–7.
LIU L, ZHANG X H, LU B, et al. Novel progress in mitochondrial fatty acid β-oxidation disorders[J]. Chinese Journal of Birth Health & Heredity, 2014, 22(5): 4–7. (in Chinese) |
| [21] |
商学军, 王修来, 黄宇烽. 肉碱与男性生殖[J]. 中华男科学杂志, 2006, 12(8): 726–729.
SHANG X J, WANG X L, HUANG Y F. Carnitines and male reproduction[J]. National Journal of Andrology, 2006, 12(8): 726–729. (in Chinese) |
| [22] | ABD-ELRAZEK A M, AHMED-FARID O A H. Protective effect of L-carnitine and L-arginine against busulfan-induced oligospermia in adult rat[J]. Andrologia, 2018, 50(4): e12806. |
| [23] | LONGOBARDI V, SALZANO A, CAMPANILE G, et al. Carnitine supplementation decreases capacitation-like changes of frozen-thawed buffalo spermatozoa[J]. Theriogenology, 2017, 88: 236–243. DOI: 10.1016/j.theriogenology.2016.09.031 |
| [24] | SEBASTIAN S M, SELVARAJ S, ARULDHAS M M, et al. Pattern of neutral and phospholipids in the semen of normospermic, oligospermic and azoospermic men[J]. J Reprod Fertil, 1987, 79(2): 373–378. DOI: 10.1530/jrf.0.0790373 |
| [25] | GARCÍA B M, FERNÁNDEZ L G, FERRUSOLA C O, et al. Membrane lipids of the stallion spermatozoon in relation to sperm quality and susceptibility to lipid peroxidation[J]. Reprod Domest Anim, 2011, 46(1): 141–148. DOI: 10.1111/j.1439-0531.2010.01609.x |
| [26] | LADHA S. Lipid heterogeneity and membrane fluidity in a highly polarized cell, the mammalian spermatozoon[J]. J Membr Biol, 1998, 165(1): 1–10. |
| [27] | TANG B, SHANG X, QI H, et al. Metabonomic analysis of fatty acids in seminal plasma between healthy and asthenozoospermic men based on gas chromatography mass spectrometry[J]. Andrologia, 2017, 49(9): e12744. DOI: 10.1111/and.12744 |
| [28] | KHOSROWBEYGI A, ZARGHAMI N. Fatty acid composition of human spermatozoa and seminal plasma levels of oxidative stress biomarkers in subfertile males[J]. Prostaglandins Leukot Essent Fatty Acids, 2007, 77(2): 117–121. DOI: 10.1016/j.plefa.2007.08.003 |
| [29] | FLORENT S, MALAPLATE-ARMAND C, YOUSSEF I, et al. Docosahexaenoic acid prevents neuronal apoptosis induced by soluble amyloid-β oligomers[J]. J Neurochem, 2006, 96(2): 385–395. DOI: 10.1111/j.1471-4159.2005.03541.x |
| [30] | LEE S H, JUNG B H, KIM S Y, et al. A rapid and sensitive method for quantitation of nucleosides in human urine using liquid chromatography/mass spectrometry with direct urine injection[J]. Rapid Commun Mass Spectrom, 2004, 18(9): 973–977. DOI: 10.1002/rcm.1400 |



