猪圆环病毒2型(PCV2)是一种二十面体对称、小而无囊膜、单股环状的DNA病毒,病毒粒子的直径约为17 nm,属于圆环病毒科、圆环病毒属[1]。PCV2基因组共含有11个开放阅读框(ORF),其中,ORF1编码与复制相关酶的蛋白(Rep和Rep′);ORF2编码衣壳蛋白(Cap)[2];而ORF5编码的蛋白在猪肺泡巨噬细胞中诱导内质网应激和未折叠蛋白应答[3];Rep蛋白是病毒DNA开始复制的主要因子[4]。PCV2病毒最先靶向猪的免疫系统并导致淋巴耗竭,引发免疫抑制和多系统疾病,包括出现以消瘦和黄疸为典型特征的猪断奶后多系统衰竭综合征(PMWS)[5-6],猪呼吸系统疾病综合症(PRDC)、猪皮炎和肾病综合征(PDNS)以及猪增生性和坏死性肺炎(PNP)。这些疾病统称为猪圆环病毒相关疾病(PCVAD)或猪圆环病毒疾病(PCVD)[7-8]。近年来,PCV2在全球范围内的传染率和PCV2感染猪的阳性率不断增加[9],给养猪业带来了巨大的经济损失[10]。
丝氨酸蛋白酶抑制剂(serpin)是控制蛋白酶参与炎症、补体、凝血和纤维蛋白溶解途径的蛋白质超家族[11],是一类规模最大分布最广的蛋白酶抑制剂[12]。该超家族的成员由350~400个氨基酸组成,分子量约为40~50 ku[13]。SERPINC1又称为ATⅢ(抗凝血酶Ⅲ),是丝氨酸蛋白酶抑制剂家族中的重要一员,可以抑制凝血通路中的凝血酶以及其他丝氨酸蛋白酶的活性[14]。SERPINC1还参与了对病毒感染的早期先天性免疫反应[15],具有广谱的抗病毒和抗炎症能力。据报道,在HIV(人类免疫缺陷病毒,即艾滋病病毒)感染的情况下,SERPINC1及其他丝氨酸蛋白酶抑制剂在起始和逆转录阶段都会干扰病毒复制[16-17],具有显著抑制HIV-1的能力[18-19]。近期研究表明,SERPINC1基因敲除可能通过PI3K/Akt/mTOR信号通路促进HNE 3细胞凋亡,抑制细胞增殖, 从而可能起到抵抗PCV2的作用[20]。
猪的遗传背景对PCV2的易感性具有显著的影响。与杜洛克猪和大白猪相比,长白猪更容易发生PCVD[21]。另一项研究发现,与皮特兰猪相比长白猪的病变更为严重[8]。López-Soria等[22]用不同父系(A:100%皮特兰猪、B: 50%大白猪× 50%皮特兰猪、C:25%大白猪× 75%杜洛克猪)与同一母系杂交,发现产生的后代对PMWS的易感性也有差异,其中父系C与母本杂交产生的仔猪更容易发生PMWS。本课题组前期对PCV2攻毒后的莱芜猪(LW)和大长杂交猪(YL)临床症状、血清病毒载量以及主要组织器官的病变进行了比较,发现攻毒的YL猪出现体温升高、体重增长缓慢,血清中病毒载量显著升高的现象,而LW猪的临床症状并不明显[23]。在攻毒后第35天,对试验组和对照组的猪进行解剖,观察各器官病变。发现YL猪最显著的病变出现在肺,攻毒组肺充血、出血严重,在病理组织切片上观察到支气管处出现大量的淋巴细胞浸润;而攻毒组LW猪的病理变化不明显,说明LW猪对PCV2病毒有较强的抗感染能力,而YL猪对该病毒的抗感染能力较弱[23]。
分析肺转录组的数据发现,攻毒组LW猪肺组织中SERPINC1的表达显著高于未攻毒组,而攻毒组YL猪肺组织中该基因的表达水平与未攻毒组相比无显著差异[23]。由于SERPINC1基因的表达变化与猪抗PCV2感染的关系尚不清楚,所以本研究在细胞水平上对SERPINC1影响PCV2复制的效应进行了分析,对猪SERPINC1基因的转录调控机制进行了初步探讨。
1 材料与方法 1.1 细胞与病毒猪肾细胞系(PK15)由哈尔滨兽医研究所馈赠,培养条件:含10%胎牛血清(BioInd, 以色列)的DMEM培养液(Gibco, 美国);猪肺泡巨噬细胞系(PAM)3D4/21由中国农业大学馈赠,培养条件:含10%胎牛血清的RPMI Medium Modified培养液(Gibco, 美国);培养温度为37 ℃,CO2浓度为5%。PCV2-SD毒株由山东农业大学动物分子病原学实验室馈赠,滴度为0.1 TCID50。
1.2 试验动物15头纯种的莱芜猪(LW)和15头大约克夏-长白杂交的商品猪(YL)分别购买于山东省莱芜市黑猪原种保种场和山东省济南市长清区的宏祥猪场,并且由山东省畜牧总站对这些猪进行PCV2、猪繁殖与呼吸综合征病毒、伪狂犬病毒和猪瘟病毒的抗原、抗体检测,检测结果均为阴性的猪个体。每个品种分为2组:接毒组(10头)和对照组(5头)。对接毒组的猪肌肉注射3 mL的6.3×10-3 TCID50的PCV2-SD毒株,对照组的猪肌肉注射3 mL的磷酸盐缓冲液。
在相同的环境和管理条件下饲养所有的试验猪,均在莱芜润达猪场进行饲养,在感染PCV2-SD毒株后第35天,对这些试验猪进行屠宰,取其多个组织放入无RNase的2 mL冻存管中,并立即放于液氮中保存,提取组织总RNA。剪取耳组织放入75%乙醇中,提取基因组DNA。
1.3 猪SERPINC1基因过表达载体的构建和细胞转染依据猪SERPINC1基因的序列(GenBank accession number: NC_010451.4),设计引物F:5′-AGGG-GAAGATTAGCGACCATG-3′; 和R:5′-TTAACAA-GGGTTGGCTACTC-3′扩增SERPINC1基因的编码区, 上游引物加入Kpn Ⅰ酶切位点,下游引物加入EcoR Ⅰ酶切位点。PCR体系:5×PrimeSTAR Buffer 5 μL,上下游引物(10 μmol·L-1)各0.5 μL,模板DNA 1.5 μL,PrimeSTAR DNA Polymerase 0.25 μL,dNTP Mixture 2 μL,加ddH2O至25 μL。反应程序:94 ℃预变性4 min,35个循环(98 ℃ 10 s,59 ℃ 15 s,72 ℃ 90 s), 72 ℃再延伸5 min。将扩增片段连接到pcDNA3.1/V5-His表达载体上构建过表达载体pcDNA3.1/V5-His-SERPINC1。在24孔板中将PK15细胞均匀铺板,待细胞长到70%时(每孔约6×104个细胞)进行转染。将Lipofectamine LTX with Plus试剂(Invitrogen, 美国)分别和空载体pcDNA3.1/V5-His以及过表达载体pcDNA3.1/V5-His-SERPINC1混匀后转染细胞,36 h后,分别用RT-qPCR和猪抗凝血酶Ⅲ(SERPINC1)酶联免疫分析(ELISA)(酶联生物,上海,中国)检测SERPINC1的mRNA和蛋白表达水平。
1.4 猪SERPINC1基因5′调控区的扩增及启动子活性分析依据猪SERPINC1基因的序列(GenBank accession number: NC_010451.4),设计引物QDZ1F:5′-AAATCTTACTCCCACCCCTGTC-3′和QDZR:5′-GGTCGCTAATCTTCCACAGGTCT-3′扩增SERPINC1基因的5′调控区, 上游引物加入Kpn Ⅰ酶切位点,下游引物加入Sma I酶切位点。分别扩增LW与YL猪SERPINC1基因-3 854~+15 bp(转录起始位点定义为+1)的片段,并连接到pGL3-Basic载体上构建启动子活性检测载体pGL3-LW与pGL3-YL。在24孔板中将PK15细胞均匀铺板,待细胞长到70%时(每孔约6×104个细胞),用Lipofectamine LTX with Plus试剂和载体pGL3-Basic、pGL3-LW以及pGL3-YL转染细胞,并接种PCV2。分别在转染后24、36、48 h收集细胞,用Dual-Luciferase Repoter Assay System(Promega, 美国)检测荧光素酶活性。
1.5 猪SERPINC1基因5′调控区删除载体的构建及转录活性检测以pGL3-YL为扩增模板,依据上述扩增得到的序列设计上游引物QDZ2F:5′-AACAGGAAAAGACCAGTGCT-3′; QDZ3F:5′-GGACCAAAAACTTGGAGGACC-3′; QDZ4F:5′-TTCCCCTTCTTTTGCACCCA-3′; QDZ5F:5′-GGAGGCTTTTCCTAACCCCT-3′; QDZ6F:5′-GTGACAAGGAGCCTCTGACC-3′; QDZ7F:5′-GAATTCCCTTCACCTCCCCA-3′和下游引物QDZR:5′-GGTCGCTAATCTTCCACAGGTCT-3′,扩增5′调控区序列不同长度的启动子,上游引物加入Kpn Ⅰ酶切位点,下游引物加入Sma I酶切位点。将得到的不同长度的删除片段分别连接到pGL3-Basic载体上构建不同长度的删除载体pGL3-SERPINC1 (-3246/+15)、pGL3-SERPINC1(-2538/+15)、pGL3-SERPINC1(-1843/+15)、pGL3-SERPINC1(-1325/+15)、pGL3-SERPINC1(-821/+15)和pGL3-SERPINC1(-493/+15)。采用1.4的方法检测荧光素酶活性。
1.6 猪SERPINC1基因启动子突变载体的构建和转录活性的检测以pGL3-YL为扩增模板,依据检测到的多态性位点设计引物QDZ-DDTB1F:5′-GTACTTTT-ACCGCTGCAGCTTGGGTTCAATCCCTGGTCT-G-3′,QDZ-DDTB1R:5′-CAGACCAGGGATT-GAACCCAAGCTGCAGCGGTAAAAGTAC-3′;QDZ-DDTB2F:5′-GTCAAAACTATTTTAATACAAACTATTTAAATAATAATAT-3′,QDZ-DD-TB2R:5′-ATATTATTATTTAAATAGTTTGT-ATTAAAATAGTTTTGAC-3′扩增重组载体,引入突变位点并插入pGL3-Basic载体中构建定点突变载体pGL3-(-3607T>C)、pGL3-(-2616C>T)。采用1.4的方法检测荧光素酶活性。
1.7 PCV2病毒拷贝数的检测用Lipofectamine LTX with Plus试剂将过表达载体及空载体分2组分别转染PK15细胞,6 h后接种PCV2(MOI=0.1),作用1 h后将病毒吸出,30 h后将细胞板放到-80 ℃反复冻融3次,用试剂盒提取PCV2基因组DNA,对PCV2进行绝对定量,计算2组之间拷贝数的差异。拷贝数计算公式:拷贝数=[6.02×1023×(质粒浓度×10-9)]/[质粒bp数× 650]。注:1 mol=6.02×1023;质粒浓度为872.1 ng·μL-1; 质粒bp数为5 723(1 bp的dsDNA=650道尔顿)。
1.8 数据统计分析试验结果采用“平均数±标准误”来表示,应用SPSS软件,通过ANOVA中Linear Models的Duncan’s Multiple Range Text统计分析方法对试验过程中所获得的数据进行统计分析。分析结果P < 0.05为差异显著,P < 0.001为差异极显著。
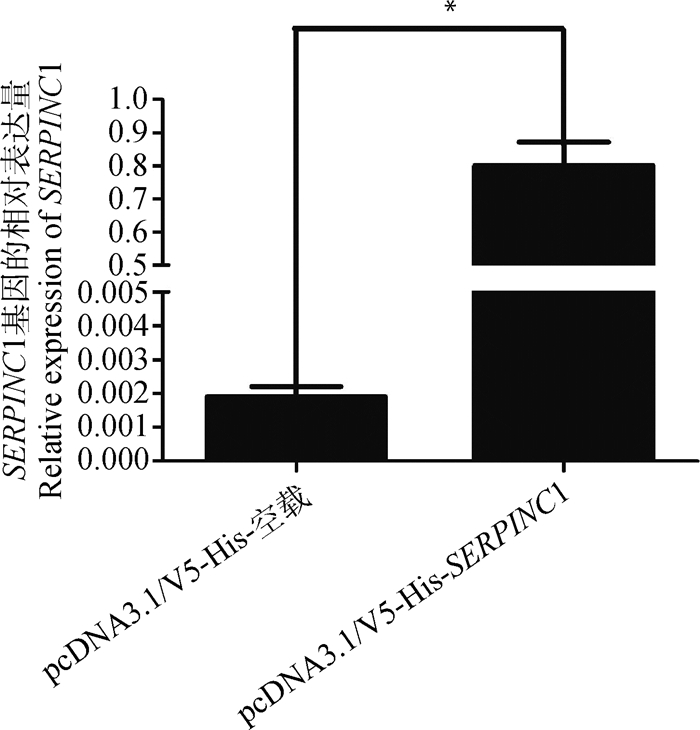
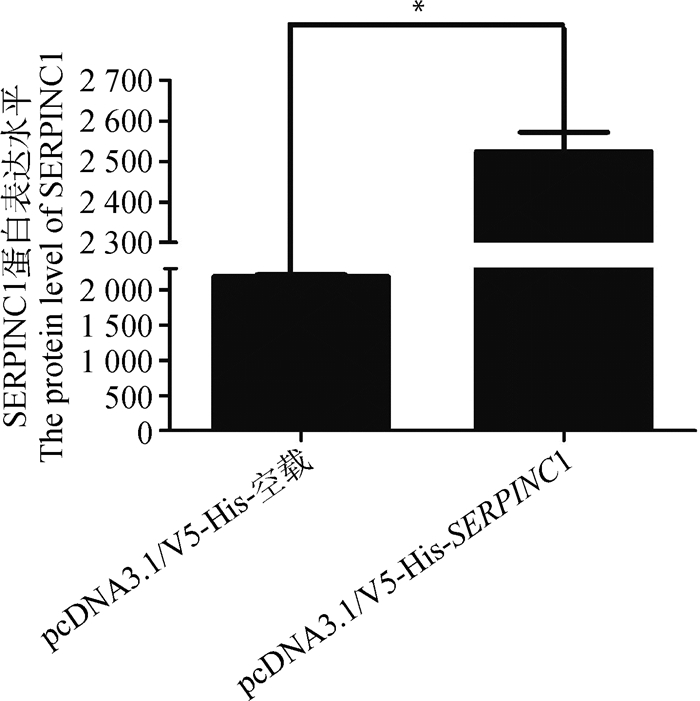
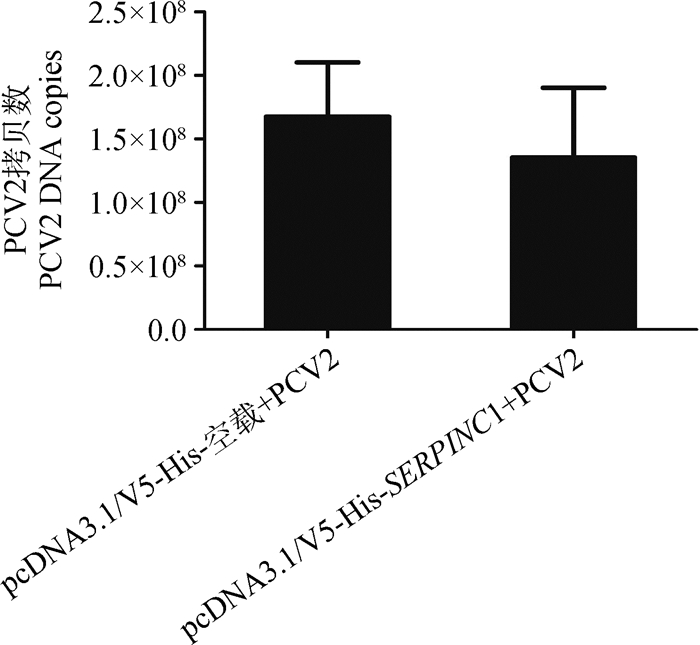
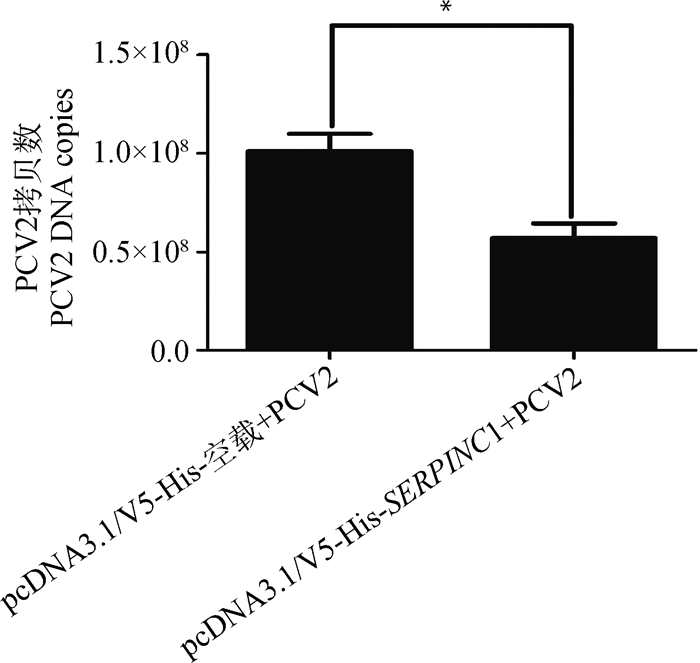
2 结果 2.1 猪SERPINC1基因对PCV2病毒复制的效应本研究将pcDNA3.1/V5-His-空载以及pcDNA3.1/V5-His-SERPINC1过表达载体分别转染PK15细胞,进行猪SERPINC1的表达量分析,发现细胞中SERPINC1的mRNA表达量显著升高(P < 0.05,图 1),细胞上清液中SERPINC1蛋白表达水平也显著升高(P < 0.05,图 2)。对转染pcDNA3.1/V5-His-空载和pcDNA3.1/V5-His-SERPINC1过表达载体的细胞进行PCV2接毒处理(MOI=0.1),30 h后检测细胞中PCV2基因组DNA的拷贝数。结果表明,在转染pcDNA3.1/V5-His-SERPINC1过表达载体的PK15细胞中PCV2的拷贝数没有显著变化(P=0.171,图 3),说明SERPINC1基因在PK15细胞中不能显著抑制PCV2的复制;而在PAM细胞中,PCV2的拷贝数在SERPINC1过表达后显著降低(P < 0.05,图 4),说明在PAM细胞系中过表达SERPINC1基因可以显著抑制PCV2的复制。
|
*表示差异显著(P < 0.05);**表示差异极显著(P < 0.001),下同 * indicates significant difference(P < 0.05);** indicates extremely significant difference (P < 0.001), the same as below 图 1 pcDNA3.1/V5-His-SERPINC1转染PK15细胞后SERPINC1基因mRNA的表达量 Fig. 1 The mRNA expression of porcine SERPINC1 in PK15 cells transfected with pcDNA3.1/V5-His-SERPINC1 |
|
图 2 pcDNA3.1/V5-His-SERPINC1转染PK15细胞后SERPINC1蛋白的表达水平 Fig. 2 The expression level of SERPINC1 protein in PK15 cells transfected with pcDNA3.1/V5-His-SERPINC1 |
|
图 3 PCV2接毒后过表达猪SERPINC1的PK15细胞中PCV2的拷贝数(MOI=0.1) Fig. 3 Viral DNA copies in PCV2-infected PK15 cells transfected with pcDNA3.1/V5-His-SERPINC1 (MOI=0.1) |
|
图 4 PCV2接毒后过表达猪SERPINC1的PAM细胞中PCV2的拷贝数(MOI=0.1) Fig. 4 Viral DNA copies in PCV2-infected PAM cells transfected with pcDNA3.1/V5-His-SERPINC1 (MOI=0.1) |
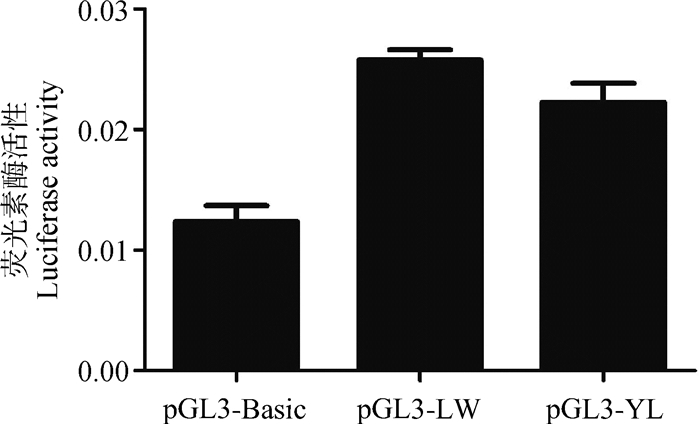
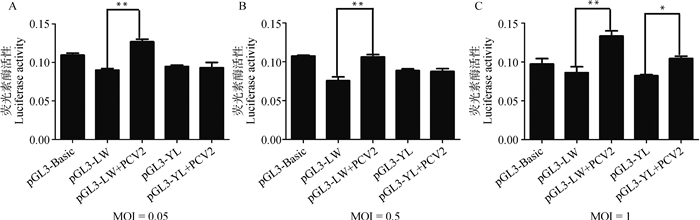
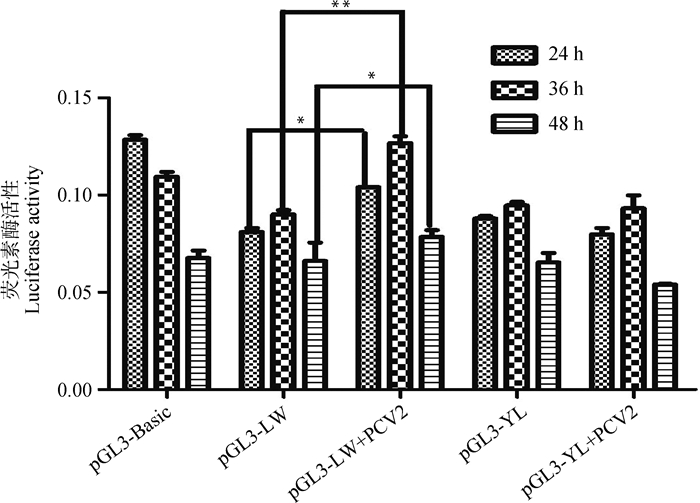
未接毒PCV2时,pGL3-LW、pGL3-YL重组质粒转染PK15细胞30 h后SERPINC1基因的启动子活性没有显著变化(图 5)。pGL3-LW、pGL3-YL重组质粒转染到PK15细胞,6 h后分别按照MOI=0.05、0.5、1三个滴度进行PCV2接毒,接毒24 h后检测荧光素酶活性。结果显示,LW猪SERPINC1基因的启动子活性均在按照3个滴度接毒后极显著升高(图 6A,图 6B,图 6C,P < 0.001),而YL猪SERPINC1基因的启动子活性只有在MOI=1的情况下才显著升高(图 6C,P < 0.05)。PCV2(MOI=0.05)接毒24、36和48 h后LW猪SERPINC1的启动子活性均显著升高(图 7,P < 0.05),而YL猪的启动子活性均没有显著变化(图 7)。
|
图 5 LW与YL猪SERPINC1基因的启动子活性比较 Fig. 5 Comparison of the transcriptional activity of the SERPINC1 promoter in LW and YL pigs |
|
图 6 不同滴度的PCV2接毒前后LW与YL猪SERPINC1基因的启动子活性比较 Fig. 6 Comparison of the transcriptional activity of the SERPINC1 promoter in LW and YL pigs before and after infection with different titers of PCV2 |
|
图 7 PCV2接毒后不同时间点LW与YL猪SERPINC1基因的启动子活性比较(MOI=0.05) Fig. 7 Comparison of the transcriptional activity of the SERPINC1 promoter in LW and YL pigs at different time points after infection with PCV2 (MOI=0.05) |
启动子删除试验结果表明,当猪的SERPINC1基因启动子片段从-3 854 bp删除至-3 246 bp时以及从-821 bp删除至-493 bp时,荧光素酶活性显著下降(P < 0.05,图 8),表明在转录起始位点上游-3 854~-3 246 bp之间以及-821~-493 bp之间的区段中存在能增强SERPINC1转录活性的正调控元件;当片段从-3 246 bp删除至-2 538 bp时以及从-1 325 bp删除至-821 bp时,荧光素酶活性显著上升(P < 0.05,图 8),表明在转录起始位点上游-3 246~-2 538 bp之间以及-1 325~-821 bp之间的区段中存在能减弱SERPINC1基因转录活性的负调控元件。

|
图 8 猪SERPINC1基因不同启动子删除片段的转录活性 Fig. 8 Transcriptional activity of different promoter fragments of porcine SERPINC1 gene |
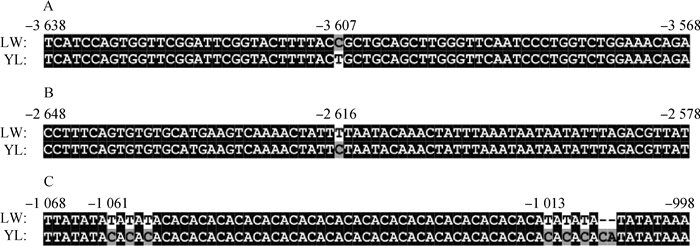
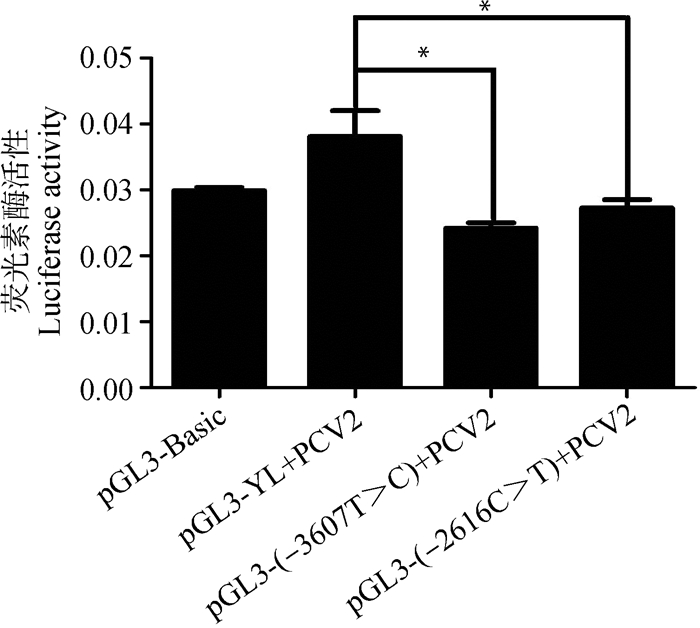
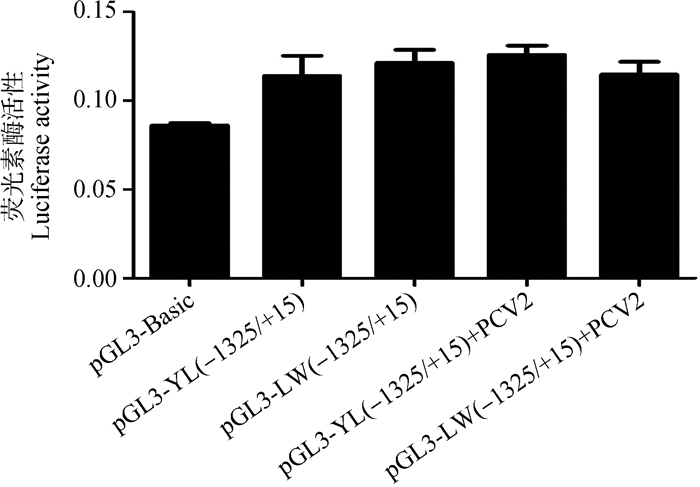
根据上述找到的4个关键调控区(调控区Ⅰ:-3 854~-3 246 bp;调控区Ⅱ:-3 246~-2 538 bp;调控区Ⅲ:-1 325~-821 bp;调控区Ⅳ:-821~-493 bp),比对了LW猪与YL猪SERPINC1基因的启动子序列,发现关键调控区Ⅰ、Ⅱ、Ⅲ中存在着多态位点(图 9),分别为-3607 (YL)T>(LW)C、-2616(YL)C>(LW)T、-1061(YL)CCC>(LW)TTT、-1013(YL)CCCCA>(LW)TTT。进一步针对图 9A和9B出现的SNPs,利用引物QDZ-DDTB1F/1R将YL猪启动子中-3 607 bp T突变为C或利用引物QDZ-DDTB2F/2R将YL猪启动子中-2 616 bp C突变为T,并对2个定点突变的启动子片段进行转录活性检测。结果表明,突变后的启动子转录活性在接毒后(MOI=0.1)显著下降(P < 0.05,图 10)。针对图 9C的突变,对LW猪的SERPINC1基因启动子区用SERPINC1-QDZ5F/R引物进行了相应的删除试验,得到LW猪删除载体pGL3-LW(-1325/+15),将LW猪删除载体pGL3-LW(-1325/+15)与pGL3-YL(-1325/+15)分别转染细胞并检测荧光素酶活性。结果表明,删除后的LW与YL猪SERPINC1基因启动子片段在接毒前后启动子活性无明显变化(图 11)。
|
A. -3607(YL)T>(LW)C; B. -2616(YL)C>(LW)T; C. -1061(YL)CCC>(LW)TTT, -1013(YL)CCCCA>(LW)TTT 图 9 LW与YL猪SERPINC1基因启动子关键调控区中存在的多态位点 Fig. 9 Polymorphic loci in the key regulatory regions of SERPINC1 promoter in LW and YL pigs |
|
图 10 YL猪SERPINC1基因启动子(pGL3-YL)与2个定点突变的启动子((pGL3-YL(-3607T>C)和pGL3-YL(-2616C>T))在PCV2感染后的转录活性(MOI=0.1) Fig. 10 Transcriptional activity of porcine SERPINC1 promoters in YL pigs (pGL3-YL)and 2 site-directed mutated SERPINC1 promoters ((pGL3-YL(-3607T>C) and pGL3-YL(-2616C>T))after PCV2 infection (MOI=0.1) |
|
图 11 LW与YL猪SERPINC1基因-1 325~+15 bp启动子片段PCV2接毒前后的转录活性(MOI=0.1) Fig. 11 Transcriptional activity of porcine SERPINC1 promoter fragments (-1 325 - +15 bp) in LW and YL pigs before and after PCV2 infection (MOI=0.1) |
前人和本课题组先前的研究结果均表明, 猪对PCV2的抗性与猪的遗传背景密切相关[23-24]。针对肺组织进行的转录组测序结果显示,凝血与补体级联通路中的SERPINC1、SERPINA1、SERPINA5和TFPI等4个基因在LW和YL猪中的表达存在显著差异[25]。本研究在细胞水平上进一步对SERPINC1基因过表达对PCV2复制的效应进行了分析,对SERPINC1基因的转录调控机制进行了探讨。
本研究采用绝对定量的方法对SERPINC1基因过表达后PCV2拷贝数的变化进行了分析,发现在PAM细胞中过表达SERPINC1后,PCV2的拷贝数显著降低,而在PK15细胞中过表达SERPINC1,PCV2的拷贝数虽然有降低的趋势,但抑制效果不如在PAM中明显,这可能与细胞中SERPINC1基因的本底表达量及细胞对PCV2的易感性不同有关。进一步对LW与YL猪SERPINC1基因的启动子活性在接种PCV2后的差异进行了分析,证明在接种PCV2后LW猪SERPINC1基因的启动子活性呈现显著的上升,这与在个体水平上进行攻毒试验的结果一致[23],提示SERPINC1基因的表达变化可能与LW猪抗PCV2感染有关。
随后,通过对YL猪SERPINC1基因的启动子区进行删除和启动子活性的对比分析,确定了猪SERPINC1基因的启动子中存在4个关键调控区。将LW和YL猪关键调控区的序列进行比对,分别在-3 607和-2 616 bp发现了SNP位点。将YL猪SERPINC1基因的启动子区进行了单碱基定点突变(将-3 607 bp的T突变为C或将-2 616 bp的C突变为T),在PCV2接毒后检测荧光素酶活性,发现YL猪启动子活性没有出现显著升高反而出现了下降,推测这2个位点可能不是关键的应答位点。进一步利用Genomatix软件对2处SNPs结合的转录因子进行预测,发现在-3 607 bp将T突变成C后,转录因子由DMRT3和NUDR变成LEF1、PRDM15和TH1E47;在-2 616 bp将C突变为T后,转录因子由BRN2、FHXB、OCT2和PHOX2变成ISL2、BRN2和LHX3等,由此推测,将YL猪SERPINC1基因的启动子区-3 607和-2 616 bp 2个位点进行单碱基定点突变后的确会影响转录因子的结合,但具体是哪种转录因子结合的改变导致SERPINC1基因转录活性的改变,需要进一步研究。
对比LW与YL猪SERPINC1基因启动子中关键调控区Ⅲ(-1 325~-821 bp)的序列,发现存在几个连续的SNPs(在LW猪中是6个TA重复,而在YL猪中是7个CA重复)。对于关键调控区Ⅲ中出现的SNPs,不容易进行定点突变,但是通过序列比对发现,这些SNPs存在于删除后的-1 325~+15 bp的序列中,因此对LW猪的启动子区进行了相应的删除试验,结果发现,该区段的差异不能使PCV2接毒后的LW猪启动子活性显著升高,所以猜测该部分可能不是关键转录调控区域,仅仅是作为一处微卫星存在。微卫星(microsatellite),又称为简单序列重复(simple sequence repeat,ssR),短串联重复(short tandem repeat, STR),是以少数几个核苷酸(一般2~4个)为重复单位的串联重复DNA序列。微卫星位点广泛分布于真核生物的基因组中[26]。因此,该位点的多态性也不是影响YL和LW猪对PCV2感染后SERPINC1基因表达差异的主要原因。
本研究所分析的多态性位点,单个位点的效应均不能解释LW猪在PCV2感染后SERPINC1基因转录水平显著升高的现象,推测这些位点间可能存在互作效应,也可能调控SERPINC1基因转录水平的关键多态位点并非位于本研究发现的4个关键调控区中。因此,导致PCV2感染后YL和LW猪SERPINC1基因表达差异的分子机制仍需进一步研究。
4 结论本研究证明了在猪肺泡巨噬细胞中过表达SERPINC1基因能够显著抑制PCV2的复制,LW猪SERPINC1基因的启动子在接种PCV2后的转录活性显著高于YL猪。通过启动子删除试验确定了调控SERPINC1表达的关键区段,并在其中找到了4处多态位点,但这4处多态位点均不影响猪SERPINC1基因的转录水平,该研究结果为找到与猪抗PCV2有关的基因及分子标记奠定了基础。
| [1] | ELLIS J, HASSARD L, CLARK E, et al. Isolation of circovirus from lesions of pigs with postweaning multisystemic wasting syndrome[J]. Can Vet J, 1998, 39(1): 44–51. |
| [2] | AFOLABI K O, IWERIEBOR B C, OKOH A I, et al. Global status of Porcine circovirus type 2 and its associated diseases in sub-saharan Africa[J]. Adv Virol, 2017, 2017: 6807964. |
| [3] | OUYANG Y L, XU L, LV J M, et al. Porcine circovirus type 2 ORF5 protein induces endoplasmic reticulum stress and unfolded protein response in porcine alveolar macrophages[J]. Arch Virol, 2019, 164(5): 1323–1334. DOI: 10.1007/s00705-019-04185-1 |
| [4] | STEINFELDT T, FINSTERBUSCH T, MANKERTZ A. Demonstration of nicking/joining activity at the origin of DNA replication associated with the rep and rep' proteins of porcine circovirus type 1[J]. J Virol, 2006, 80(13): 6225–6234. DOI: 10.1128/JVI.02506-05 |
| [5] | MENG X J. Porcine circovirus type 2(PCV2):pathogenesis and interaction with the immune system[J]. Annu Rev Anim Biosci, 2013, 1: 43–64. DOI: 10.1146/annurev-animal-031412-103720 |
| [6] | HARDING J C. Post-weaning multisystemic wasting syndrome (PMWS):preliminary epidemiology and clinical presentation[J]. Proc Am Assoc Swine Pract, 1997, 28: 503. |
| [7] | OPRIESSNIG T, MENG X J, HALBUR P G. Porcine circovirus type 2-associated disease:update on current terminology, clinical manifestations, pathogenesis, diagnosis, and intervention strategies[J]. J Vet Diagn Invest, 2007, 19(6): 591–615. DOI: 10.1177/104063870701900601 |
| [8] | OPRIESSNIG T, PATTERSON A R, MADSON D M, et al. Difference in severity of porcine circovirus type two-induced pathological lesions between Landrace and Pietrain pigs[J]. J Anim Sci, 2009, 87(5): 1582–1590. DOI: 10.2527/jas.2008-1390 |
| [9] | KOINIG H C, TALKER S C, STADLER M, et al. PCV2 vaccination induces IFN-γ/TNF-α co-producing T cells with a potential role in protection[J]. Vet Res, 2015, 46. |
| [10] | ALLAN G, KRAKOWKA S, ELLIS J, et al. Discovery and evolving history of two genetically related but phenotypically different viruses, porcine circoviruses 1 and 2[J]. Virus Res, 2012, 164(1-2): 4–9. DOI: 10.1016/j.virusres.2011.09.013 |
| [11] | SINGH P, JAIRAJPURI M A. Structure function analysis of serpin super-family:"a computational approach"[J]. Protein Pept Lett, 2014, 21(8): 714–721. |
| [12] | LAW R H, ZHANG Q W, MCGOWAN S, et al. An overview of the serpin superfamily[J]. Genome Biol, 2006, 7(5): 216. |
| [13] | PATSTON P A. Serpins and other serine protease inhibitors[J]. Immunol Today, 2000, 21(7): 354. DOI: 10.1016/S0167-5699(00)01638-8 |
| [14] | WANG F, ZHANG G Y, LU Z Y, et al. Antithrombin Ⅲ/SerpinC1 insufficiency exacerbates renal ischemia/reperfusion injury[J]. Kidney Int, 2015, 88(4): 796–803. |
| [15] | OPAL S M, ESMON C T. Bench-to-bedside review:functional relationships between coagulation and the innate immune response and their respective roles in the pathogenesis of sepsis[J]. Crit Care, 2003, 7(1): 23–38. |
| [16] | CONGOTE L F. Serpin A1 and CD91 as host instruments against HIV-1 infection:are extracellular antiviral peptides acting as intracellular messengers?[J]. Virus Res, 2007, 125(2): 119–134. DOI: 10.1016/j.virusres.2006.12.018 |
| [17] | CONGOTE L F. The C-terminal 26-residue peptide of serpin A1 is an inhibitor of HIV-1[J]. Biochem Biophys Res Commun, 2006, 343(2): 617–622. DOI: 10.1016/j.bbrc.2006.02.190 |
| [18] | ELMALEH D R, BROWN N V, GEIBEN-LYNN R. Anti-viral activity of human antithrombin Ⅲ[J]. Int J Mol Med, 2005, 16(2): 191–200. |
| [19] | GEIBEN-LYNN R, BROWN N, WALKER B D, et al. Purification of a modified form of bovine antithrombin Ⅲ as an HIV-1 CD8+ T-cell antiviral factor[J]. J Biol Chem, 2002, 277(44): 42352–42357. DOI: 10.1074/jbc.M207079200 |
| [20] | XU J, YING Y, XIONG G Y, et al. Knockdown of serpin peptidase inhibitor clade C member 1 inhibits the growth of nasopharyngeal carcinoma cells[J]. Mol Med Rep, 2019, 19(5): 3658–3666. |
| [21] | OPRIESSNIG T, FENAUX M, THOMAS P, et al. Evidence of breed-dependent differences in susceptibility to porcine circovirus type-2-associated disease and lesions[J]. Vet Pathol, 2006, 43(3): 281–293. DOI: 10.1354/vp.43-3-281 |
| [22] | LÓPEZ-SORIA S, NOFRARÍAS M, CALSAMIGLIA M, et al. Post-weaning multisystemic wasting syndrome (PMWS) clinical expression under field conditions is modulated by the pig genetic background[J]. Vet Microbiol, 2011, 149(3-4): 352–357. DOI: 10.1016/j.vetmic.2010.12.009 |
| [23] | LI Y P, LIU H, WANG P F, et al. RNA-seq analysis reveals genes underlying different disease responses to porcine circovirus type 2 in pigs[J]. PLoS One, 2016, 11(5): e0155502. DOI: 10.1371/journal.pone.0155502 |
| [24] | OPRIESSNIG T, THACKER E L, YU S, et al. Experimental reproduction of postweaning multisystemic wasting syndrome in pigs by dual infection with Mycoplasma hyopneumoniae and porcine circovirus type 2[J]. Vet Pathol, 2004, 41(6): 624–640. DOI: 10.1354/vp.41-6-624 |
| [25] |
李艳平.猪抗蓝耳病、圆环病毒病相关基因的鉴定与功能分析[D].泰安: 山东农业大学, 2015.
LI Y P.Identification and characterization of genes related to PRRSV and PCV2 resistance in pigs[D].Tai'an: Shandong Agricultural University, 2015.(in Chinese) |
| [26] |
曾庆国, 陈艺燕. 微卫星位点筛选方法综述[J]. 生态科学, 2005, 24(4): 368–372.
ZENG Q G, CHEN Y Y. The methods of isolating microsatellite loci[J]. Ecologic Science, 2005, 24(4): 368–372. (in Chinese) |



