2. 河北省山区农业工程技术研究中心, 保定 071001;
3. 河北农业大学动物医学院, 保定 071001;
4. 河北农业大学动物科技学院, 保定 071001
2. Hebei Agricultural Engineering Technology Research Center in Mountainous Area, Baoding 071001, China;
3. College of Veterinary Medicine, Hebei Agricultural University, Baoding 071001, China;
4. College of Animal Science and Technology, Hebei Agricultural University, Baoding 071001, China
机体的生长发育和新陈代谢与其对营养物质的消化吸收能力密切相关,机体对小肽和氨基酸的吸收起始于小肠,已知的小肽转运载体主要包括Pep T1、Pep T2、PHT1和PHT2,本试验选择的小肽转运载体Pep T1主要在小肠中表达,对小肽的吸收起关键性作用[1-3]。氨基酸转运载体可分为碱性、中性、酸性氨基酸转运载体,本试验选择的碱性氨基酸转运载体CAT1、中性氨基酸转运载体B0AT、酸性氨基酸转运载体EAAT3和兼性氨基酸转运载体rBAT在各类氨基酸的转运中发挥重要作用,它们能够有代表性地反映各类氨基酸在小肠不同区段的转运吸收情况[4-6]。葡萄糖转运载体主要分为Na+依赖性和Na+非依赖性两类,本试验选择的Na+依赖性葡萄糖共转运载体SGLT1和Na+非依赖性葡萄糖易化转运载体GLUT2,共同完成葡萄糖在小肠黏膜上的吸收;而Na+非依赖性葡萄糖易化转运载体GLUT5是肠道转运果糖的主要载体,这3种葡萄糖转运载体是肠道最重要的葡萄糖转运载体[7-9]。FATP4是哺乳动物肠道中唯一存在的脂肪酸转运载体,对小肠吸收脂肪酸具有举足轻重的作用[10-11]。
小肠是营养物质消化和吸收的主要场所之一,虽然十二指肠、空肠和回肠黏膜的组织学特征相近,但小肠不同区段对营养素分子的消化吸收能力有所不同,小肠的消化吸收能力取决于吸收面积及单个细胞的转运能力[12-13],因此,小肠转运载体的正常表达对于机体消化吸收营养成分具有重要作用。
家兔是一种常见的模式动物,常被用来进行人类健康的各项相关研究。本试验研究家兔小肠不同区段的营养物质转运载体的表达分布规律,探讨小肽、氨基酸、葡萄糖和脂肪酸在家兔小肠吸收的分子机理,有助于更清楚地了解营养物质在家兔肠道的消化吸收过程,为进行人类营养健康的各项相关研究、生理学研究和家兔生产环节的营养调控提供理论依据。
1 材料与方法 1.1 试验动物及样品采集试验兔为白色獭兔,由河北农业大学教学实验兔场提供,饲喂全价颗粒料,日粮组成及营养水平见表 1。选择110日龄体重相近的健康白色獭兔10只进行屠宰,颈动脉放血,剖开腹腔后迅速分离肠道,用4 ℃预冷的生理盐水和PBS缓冲液分别冲洗肠道各部位,用吸水纸吸干,分别取十二指肠、空肠和回肠中部样各2 cm左右,放入1.5 mL离心管中,置液氮速冻,-70 ℃冷冻保存备用。
|
|
表 1 日粮配方及营养水平(风干基础) Table 1 Composition and nutrient levels of diet (air-dry basis) |
取肠段样品100 mg,采用Trizol一步抽提法提取样品总RNA,用蛋白核酸测定仪测定RNA的浓度和纯度,用琼脂糖凝胶电泳检测RNA的质量,所有样品总RNA均稀释至1 μg·μL-1。以5 μL总RNA样品为模板,使用DNA酶去除基因组痕量DNA后,配制20 μL反转录反应体系:10.0 μL 2×RT buffer,1.0 μL 6N随机引物(100 pmol·μL-1),1.0 μL RT-mix,5.0 μL RNA模板,3.0 μL RNase Free dH2O;反应程序:25 ℃ 10 min,42 ℃ 50 min,85 ℃ 5 min。反转录合成的cDNA -20 ℃保存备用。
1.3 引物设计与合成选取β-actin为内参基因,参照GenBank中家兔Pep T1、CAT1、rBAT、B0AT、EAAT3、SGLT1、GLUT2、GLUT5和FATP4基因的mRNA序列,用Primer Premier 5.0设计引物,引物由上海闪晶分子生物科技有限公司合成,引物序列及参数见表 2。
|
|
表 2 Real-time PCR中使用的各转运载体基因和内参基因β-actin的引物信息 Table 2 The information of primers for amplifying β-actin and transporter genes for real-time PCR |
以β-actin基因作为内参,50 μL的real-time PCR反应体系包括:25.0 μL 2×PCR buffer,1.0 μL上游引物(25 pmol·μL-1),1.0 μL下游引物(25 pmol·μL-1),0.5 μL SYBR green Ⅰ,2.0 μL cDNA,20.5 μL RNase Free dH2O。反应程序:94 ℃预变性4 min;94 ℃变性20 s,60 ℃退火30 s,72 ℃延伸30 s,共35个循环;每次循环的最后一步收集SYBR green荧光信号,循环结束时从60 ℃升温至95 ℃进行熔解曲线分析。
1.5 数据处理和统计分析基因相对表达量采用2-ΔCT法计算,数据以“平均值±标准差(x±s)”表示,用SPSS 13.0统计软件对样品各基因的mRNA表达量进行单因素方差分析,以Duncan方法进行多重比较。
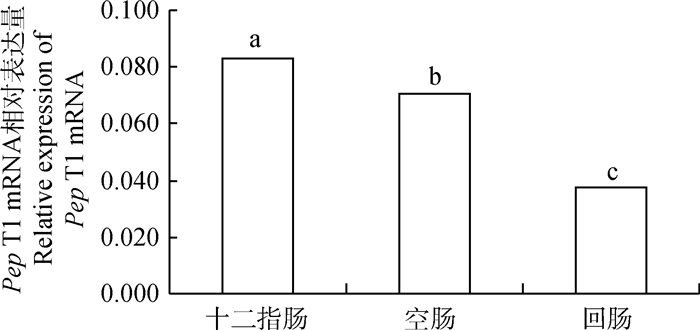
2 结果 2.1 家兔小肠不同区段小肽转运载体相关基因的表达由图 1可知,在家兔小肠不同区段内小肽转运载体Pep T1 mRNA相对表达量差异极显著(P < 0.01),其中Pep T1 mRNA在小肠近端十二指肠的相对表达量最高,在空肠的表达量低于十二指肠,回肠最低。
|
不同小写字母表示差异极显著(P < 0.01),下同 The different lowercase letters indicate significant difference (P < 0.01), the same as below 图 1 Pep T1 mRNA表达的组织特异性 Fig. 1 Tissue specific expression of Pep T1 mRNA |
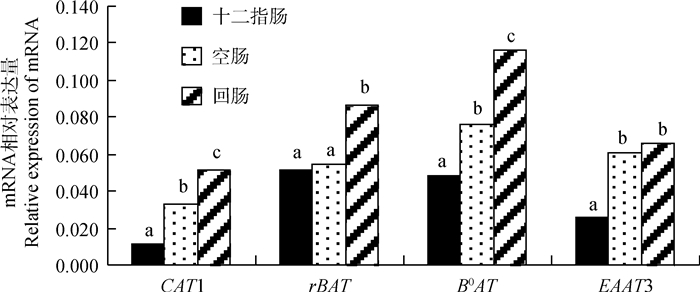
由图 2可知,在家兔小肠不同区段内碱性氨基酸转运载体CAT1和中性氨基酸转运载体B0AT mRNA相对表达量均差异极显著(P < 0.01),且从小肠近端到远端的表达量均依次增加,B0AT mRNA在小肠各区段的表达量均高于CAT1的表达量;兼性氨基酸转运载体rBAT mRNA在家兔小肠远端回肠相对表达量极显著高于十二指肠和空肠(P < 0.01);酸性氨基酸转运载体EAAT3 mRNA在家兔小肠近端十二指肠相对表达量极显著低于空肠和回肠(P < 0.01)。
|
图 2 CAT1、rBAT、B0AT和EAAT3 mRNA表达的组织特异性 Fig. 2 Tissue specific expression of CAT1, rBAT, B0AT and EAAT3 mRNA |
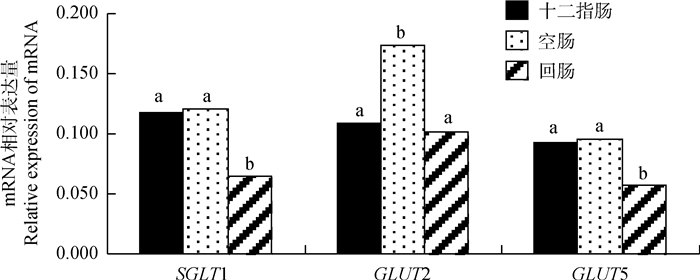
由图 3可知,Na+依赖性葡萄糖共转运载体SGLT1 mRNA在家兔小肠远端回肠相对表达量极显著低于十二指肠和空肠(P < 0.01);Na+非依赖性葡萄糖易化转运载体GLUT2 mRNA在空肠的相对表达量极显著高于其在十二指肠和回肠的表达量(P < 0.01);Na+非依赖性葡萄糖易化转运载体GLUT5 mRNA在回肠的相对表达量极显著低于十二指肠和空肠(P < 0.01)。
|
图 3 SGLT1、GLUT2和GLUT5 mRNA表达的组织特异性 Fig. 3 Tissue specific expression of SGLT1, GLUT2和GLUT5 mRNA |
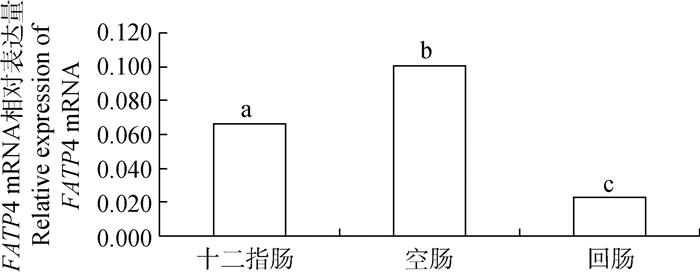
由图 4可知,在家兔小肠不同区段内脂肪酸转运载体FATP4 mRNA相对表达量差异极显著(P < 0.01),其中FATP4 mRNA在空肠的相对表达量最高,在十二指肠的表达量次之,回肠最低。
|
图 4 FATP4 mRNA表达的组织特异性 Fig. 4 Tissue specific expression of FATP4 mRNA |
不同物种肠道的Pep T1分布并不一致,Pep T1 mRNA在猪[14]、鸡[15]、小鼠[16]等单胃动物的十二指肠和空肠表达量较高,而在反刍动物肠道的表达分布以空肠和回肠为主[2, 17]。家兔虽然是单胃动物,但消化道结构与其他单胃动物和反刍动物都有差异,本试验发现,家兔Pep T1 mRNA的表达丰度在十二指肠最高,空肠较低,回肠最低,这与Freeman等[18]在家兔上的的研究结果相一致,也与前人对单胃动物的相关研究结果一致,表明家兔肠道转运吸收小肽的主要部位是小肠前半段。
针对不同物种的研究表明,回肠是CAT1转运载体的主要表达部位[19-21];rBAT是肠上皮细胞中最重要的碱性氨基酸转运载体,Munck等[19]报道,兔小肠不同氨基酸转运载体的活性从空肠到回肠逐渐升高, 其他物种的相关研究也发现,rBAT mRNA的表达丰度在回肠最高,空肠和十二指肠有降低的趋势[12, 21-22],本试验发现,家兔CAT1 mRNA的表达丰度在回肠最高,空肠次之,十二指肠最低,rBAT mRNA的表达丰度在回肠也显著高于空肠和十二指肠,与前人研究结果一致。小鼠[23]、肉鸡[12, 15]等的相关研究表明,肠道中B0AT mRNA的表达丰度在回肠最高,十二指肠最低,本试验发现,家兔B0AT mRNA的表达丰度在回肠最高,空肠次之,十二指肠最低,与其他物种的研究结果相一致。前人研究报道,EAAT3 mRNA的表达量在回肠和空肠较高[12, 15, 17],本试验发现,家兔EAAT3 mRNA的表达丰度在回肠和空肠显著高于十二指肠,与前人研究结果一致。表明家兔肠道转运吸收氨基酸的主要部位是小肠后半段。
在肠道吸收糖类的过程中,SGLT1、GLUT2和GLUT5都起了重要作用,前人研究发现,SGLT1和GLUT5两种转运蛋白的mRNA表达量均为小肠近端高于远端[7, 12],本试验发现,SGLT1和GLUT5 mRNA在家兔小肠远端回肠的表达量显著低于十二指肠和空肠,与前人研究结果一致。据报道,肉鸡肠道的GLUT2 mRNA表达量在十二指肠和空肠均较高[24],家鸽肠道的GLUT2 mRNA表达量则在空肠中最高,十二指肠次之,回肠最低[25],本试验发现,GLUT2 mRNA在家兔空肠的表达量最高,与家鸽的研究结果一致,表明家兔肠道转运吸收葡萄糖的主要部位是小肠前半段。
FATP4是哺乳动物肠道中唯一存在的脂肪酸转运载体,张爱华[12]研究发现,肉鸡肠道的FATP4 mRNA表达丰度在空肠最高,十二指肠次之,回肠最低,本试验的研究结果与张爱华的报道一致,表明家兔肠道转运吸收脂肪酸的主要部位是小肠前半段。
4 结论本研究结果表明,家兔肠道转运吸收小肽、葡萄糖和脂肪酸的主要部位是小肠前半段,转运吸收氨基酸的主要部位是小肠后半段。
| [1] | NOSWORTHY M G, BERTOLO R F, BRUNTON J A. Ontogeny of dipeptide uptake and peptide transporter 1 (PepT1) expression along the gastrointestinal tract in the neonatal Yucatan miniature pig[J]. Br J Nutr, 2013, 110(2): 275–281. DOI: 10.1017/S0007114512005041 |
| [2] |
许庆彪.奶牛瓣胃上皮细胞对小肽的吸收机制及小肽转运载体1的特征研究[D].杭州: 浙江大学, 2015.
XU Q B.The mechanism of small peptide absorption in bovine omasal epithelial cells and characterization of bovine peptide transporter 1[D].Hangzhou: Zhejiang University, 2015.(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10335-1015643532.htm |
| [3] | MISKA K B, FETTERER R H. Expression of amino acid and sugar transporters, aminopeptidase, and the di- and tri-peptide transporter PepT1;differences between modern fast growing broilers and broilers not selected for rapid growth[J]. Poult Sci, 2019, 98(5): 2272–2280. DOI: 10.3382/ps/pey583 |
| [4] | PONCET N, TAYLOR P M. The role of amino acid transporters in nutrition[J]. Curr Opin Clin Nutr Metab Care, 2013, 16(1): 57–65. DOI: 10.1097/MCO.0b013e32835a885c |
| [5] | SCALISE M, GALLUCCIO M, CONSOLE L, et al. The human SLC7A5 (LAT1):the intriguing histidine/large neutral amino acid transporter and its relevance to human health[J]. Front Chem, 2018, 6: 243. DOI: 10.3389/fchem.2018.00243 |
| [6] | BRÖER S. Amino acid transport across mammalian intestinal and renal epithelia[J]. Physiol Rev, 2008, 88(1): 249–286. DOI: 10.1152/physrev.00018.2006 |
| [7] | BYERS M S, HOWARD C, WANG X F. Avian and mammalian facilitative glucose transporters[J]. Microarrays, 2017, 6(2): 7. DOI: 10.3390/microarrays6020007 |
| [8] | HUMMEL C S, LU C, LOO D D F, et al. Glucose transport by human renal Na+/D-glucose cotransporters SGLT1 and SGLT2[J]. Am J Physiol Cell Physiol, 2011, 300(1): C14–C21. DOI: 10.1152/ajpcell.00388.2010 |
| [9] | KISHIDA K, MARTINEZ G, ⅡDA T, et al. D-allulose is a substrate of glucose transporter type 5 (GLUT5) in the small intestine[J]. Food Chem, 2019, 277: 604–608. DOI: 10.1016/j.foodchem.2018.11.003 |
| [10] | LIN M H, MINER J H. Fatty acid transport protein 1 can compensate for fatty acid transport protein 4 in the developing mouse epidermis[J]. J Invest Dermatol, 2015, 135(2): 462–470. DOI: 10.1038/jid.2014.378 |
| [11] | LENZ L S, MARX J, CHAMULITRAT W, et al. Adipocyte-specific inactivation of acyl-CoA synthetase fatty acid transport protein 4 (Fatp4) in mice causes adipose hypertrophy and alterations in metabolism of complex lipids under high fat diet[J]. J Biol Chem, 2011, 286(41): 35578–35587. DOI: 10.1074/jbc.M111.226530 |
| [12] |
张爱华.肉仔鸡肠道主要营养素转运载体mRNA表达发育规律的研究[D].北京: 中国农业科学院, 2014.
ZHANG A H.Ontogenetic regulation of nutrient transporters in the small intestine of broilers[D].Beijing: Chinese Academy of Agricultural Sciences, 2014.(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-82101-1014326610.htm |
| [13] | SPEIER J S, YADGARY L, UNI Z, et al. Gene expression of nutrient transporters and digestive enzymes in the yolk sac membrane and small intestine of the developing embryonic chick[J]. Poult Sci, 2012, 91(8): 1941–1949. DOI: 10.3382/ps.2011-02092 |
| [14] |
邹仕庚, 冯定远, 黄志毅, 等. 猪肠道寡肽转运载体1(PepT1)mRNA表达的肠段特异性和发育性变化[J]. 农业生物技术学报, 2009, 17(2): 229–236.
ZOU S G, FENG D Y, HUANG Z Y, et al. Segmental distribution and ontogenetic regulation of peptide transporter 1 (PepT1) mRNA expression in intestine of pigs[J]. Journal of Agricultural Biotechnology, 2009, 17(2): 229–236. (in Chinese) |
| [15] | GILBERT E R, LI H, EMMERSON D A, et al. Developmental regulation of nutrient transporter and enzyme mRNA abundance in the small intestine of broilers[J]. Poult Sci, 2007, 86(8): 1739–1753. DOI: 10.1093/ps/86.8.1739 |
| [16] |
吴丽娜.α-菠菜甾醇对小鼠小肠P糖蛋白和寡肽转运体PepT1药物转运体的影响研究[D].雅安: 四川农业大学, 2016.
WU L N.The influence of α-spinasterol on the expression of P-glycoprotein and PepT1 on the small intestine of mice[D].Ya'an: Sichuan Agricultural University, 2016.(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10626-1017016814.htm |
| [17] |
孙雅君, 倪志鹤, 陈玉林, 等. 绵羊胃肠道游离氨基酸与小肽分布及其转运载体相关基因表达的研究[J]. 畜牧兽医学报, 2017, 48(3): 462–473.
SUN Y J, NI Z H, CHEN Y L, et al. Study on distribution of free amino acid and small peptide and the expression of related transporter genes in gastrointestinal tract of sheep[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(3): 462–473. (in Chinese) |
| [18] | FREEMAN T C, BENTSEN B S, THWAITES D T, et al. H+/Di-tripeptide transporter (PepT1) expression in the rabbit intestine[J]. Pflügers Arch, 1995, 430(3): 394–400. DOI: 10.1007/BF00373915 |
| [19] | MUNCK L K, MUNCK B G. Variation in amino acid transport along the rabbit small intestine.Mutual jejunal carriers of leucine and lysine[J]. Biochim Biophys Acta, 1992, 1116(2): 83–90. DOI: 10.1016/0304-4165(92)90103-2 |
| [20] |
周响艳, 左建军, 职爱民, 等. 猪肠道碱性氨基酸转运载体(CAT1)mRNA表达的组织特异性和发育性变化[J]. 畜牧兽医学报, 2008, 39(2): 170–175.
ZHOU X Y, ZUO J J, ZHI A M, et al. Segmental distribution and ontogenetic regulation of cationic amino acid transporter mRNA expression in the small intestine of pigs[J]. Acta Veterinaria et Zootechnica Sinica, 2008, 39(2): 170–175. (in Chinese) |
| [21] |
周英昊.陕北白绒山羊碱性氨基酸转运载体基因cDNA克隆及时空表达分析[D].杨凌: 西北农林科技大学, 2015.
ZHOU Y H.cDNA cloning and space-time expression analysis of cationic amino acid transporters gene in Shanbei White Cashmere goat[D].Yangling: Northwest A&F University, 2015.(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10712-1015333824.htm |
| [22] | DAVE M H, SCHULZ N, ZECEVIC M, et al. Expression of heteromeric amino acid transporters along the murine intestine[J]. J Physiol, 2004, 558(2): 597–610. DOI: 10.1113/jphysiol.2004.065037 |
| [23] | ROMEO E, DAVE M H, BACIC D, et al. Luminal kidney and intestine SLC6 amino acid transporters of B0AT-cluster and their tissue distribution in Mus musculus[J]. Am J Physiol Renal, 2006, 290(2): 376–383. DOI: 10.1152/ajprenal.00286.2005 |
| [24] |
王修启, 谭会泽, 束刚, 等. 鸡肠道SGLT1和GLUT2 mRNA表达的组织特异性研究[J]. 畜牧兽医学报, 2006, 37(1): 12–17.
WANG X Q, TAN H Z, SHU G, et al. Study on tissue-specific expression of SGLT1 and GLUT2 mRNA in chicken intestine[J]. Acta Veterinaria et Zootechnica Sinica, 2006, 37(1): 12–17. (in Chinese) |
| [25] |
董信阳.鸽早期小肠发育及碳水化合物对其调控的研究[D].杭州: 浙江大学, 2013.
DONG X Y.Research on early development of the pigeon small intestine and its regulation by carbohydrates[D].Hangzhou: Zhejiang University, 2013.(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10335-1013186916.htm |



