2. 重庆市高校兽医科学工程研究中心中兽药创新研发实验室, 重庆 402460
2. Chinese Veterinary Herbal Drugs Innovation Research Lab, University Veterinary Science Engineering Research Center in Chongqing, Chongqing 402460, China
大肠杆菌所致的仔猪腹泻是猪场中常见疾病之一,严重影响着我国养猪业的发展。现代兽医学普遍认为动物腹泻的主要靶器官在肠道,腹泻动物的肠黏膜均有不同程度的损伤[1]。产肠毒素大肠杆菌(enterotoxigenic Escherichia coli,ETEC)能产生并释放肠毒素(enterotoxin)和脂多糖(lipopolysaccharide,LPS),并造成肠黏膜细胞结构的破坏[2]。炎症在肠黏膜损伤中起着维持内环境稳定的作用,但过度的炎症又会加剧肠黏膜损伤的严重程度。LPS不仅能诱导炎症发生,还可能造成过度炎症而加重肠黏膜的损伤[3]。肠三叶因子(trefoil factor family,TFF3)是由肠上皮杯状细胞分泌的一种小分子多肽,一定范围内表达的TFF3能对损伤的黏膜起到立即修复的作用[4-5];但过量表达的TFF3却能引起损伤部位的淋巴结转移和肿瘤新生血管的形成[6]。TNF-α和IL-8分别作为促炎因子和炎症趋化因子在炎症形成过程中发挥重要作用[7],有学者认为特异性地阻断TNF-α和IL-8可为炎症性疾病的治疗提供思路[8-9]。
目前,防治仔猪腹泻通常采用抗生素和化学抗病毒药物,但易产生耐药性,因此采用中药复方防治仔猪腹泻具有一定的实践意义[10]。术芩提取液(Zhu Qin extractive fluid,ZQEF)是由复方术芩中的白术、黄芩和黄芪等中药按照一定比例水醇提取而得的;复方术芩为自拟处方,用于仔猪腹泻的治疗。前期研究表明,复方术芩提取液具有抑菌、抗病毒和抗炎以及增强机体免疫功能的作用[11-13],术芩颗粒能提高仔猪的生长性能[14],但复方术芩对仔猪腹泻的治疗机制还有待进一步探究。为此,本试验采用LPS和具有典型肠上皮细胞特性的IPEC-J2细胞建立细胞损伤模型[15],研究ZQEF对损伤的IPEC-J2细胞的增殖与修复作用以及对TFF3、TNF-α和IL-8转录的影响,以期为ZQEF修复肠黏膜损伤提供理论依据。
1 材料与方法 1.1 试验材料白术、黄芩、黄芪等中药(批号:160201),购自四川千金方中药饮片有限公司;对照药材白术(批号:120925-201310)、黄芩(批号:120955-201309)、黄芪(批号:120974-201311),标准物质白术内酯Ⅰ(批号:111975-201501,纯度:99.9%)、黄芩苷(批号:110715-201318,纯度:93.3%)、黄芪甲苷(批号:110781-201314,纯度:95.8%)等均购自中国食品药品检定研究院;胎牛血清(FBS,批号:1347575),高糖培养基DMEM(批号:8115352),0.25% Trysin-EDTA(批号:1780400)等均购自美国Gibco公司;LPS(Lipopolysacchrides from Escherichia coli 055:B5,SIGMA,044M4004V);SYBR® Premix Ex-TaqTM Ⅱ荧光定量试剂盒(货号:RR820A),DL2000 DNA Marker(TaKaRa)均购自北京宝日医生物有限公司;UNIQ-10柱式总RNA抽提试剂盒(货号:B511361),引物均购自生工生物工程(上海)股份有限公司;甲醇(批号:021260702,液相色谱纯)、正丁醇(批号:2015031001,分析纯)、氯仿(批号:20170901,分析纯)等常用试剂,均购自重庆川东化工(集团)有限公司。
1.2 主要仪器GOODLOOK-1000薄层色谱成像系统(上海科哲生化科技有限公司);LC-20A高效液相色谱仪(岛津公司);3111型隔水式CO2细胞培养箱、Thermo Fisher高速冷冻离心机(Thermo Electron Laboratories,USA);Mode680酶标仪、CFX96荧光定量PCR仪器[伯乐生命医学产品(上海)有限公司Bio-Rad Laboratories]等。
1.3 细胞系及培养方法IPEC-J2细胞系购西北农林科技大学。IPEC-J2细胞系培养方法:以10% FBS、1%青-链霉素和89% DMEM维持液为培养基,于37 ℃,5% CO2培养箱中培养。当细胞汇合度达到80%时,用0.25% Trysin-EDTA消化传代,传5代后用于试验。
1.4 ZQEF制备方法与鉴定ZQEF是将复方术芩中白术(4份)、黄芩(3份)、黄芪(4.5份)等味中药[13],按水醇提取法提取得到含生药1 g·mL-1的提取液(提取液中乙醇浓度为70%)。将ZQEF用直径0.22 μm的无菌滤膜滤过,并用DMEM维持液稀释成浓度分别为10-1、10-2、10-3、10-4、10-5g·mL-1的ZQEF用于细胞试验。参照《中华人民共和国兽药典》二部(2015年版)中白术、黄芩和黄芪的薄层色谱鉴定方法和条件,分别配制ZQEF供试品溶液,白术、黄芩、黄芪对照药材溶液,白术内酯Ⅰ、黄芩苷、黄芪甲苷标准品溶液以及处方中分别不含白术、黄芩、黄芪的阴性对照品溶液,进行薄层色谱鉴定。高效液相色谱法测定ZQEF中黄芩苷含量,色谱条件参照《中华人民共和国兽药典》二部(2015年版),样品平行测定5次,记录峰面积并计算黄芩苷含量及RSD。
1.5 IPEC-J2细胞分组处理与IPEC-J2细胞增殖率测定将对数生长期的IPEC-J2细胞按每孔104个细胞接种于6孔细胞培养板中,随机分成7个组,分别为空白组、LPS模型组和药物Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ组,5孔·组-1。LPS模型组和各药物组均添加100 μL浓度为100 μg·mL-1的LPS刺激30 min,将造模成功后的药物Ⅰ~Ⅴ组再分别加入100 μL的ZQEF(浓度分别为10-1、10-2、10-3、10-4、10-5g·mL-1),LPS模型组与空白组添加等量DMEM维持液。各组IPEC-J2细胞培养24 h;加入20 μL的MTT,培养4 h,弃液;再加入150 μL的DMSO溶液作用10 min,轻微振动;在490 nm波长下测定OD值。以空白组细胞增殖率为100%并计算各试验组的细胞增殖率,计算公式:细胞增殖率=[1-(空白组OD-试验组OD)/空白组OD]×100%。
1.6 药物对IPEC-J2细胞中TFF3、TNF-α、IL-8转录的影响IPEC-J2细胞随机分为空白组,LPS模型组和药物组(ZQEF浓度为10-2g·mL-1),各组处理方法同“1.5”,经24 h培养后收集细胞。
1.6.1 IPEC-J2细胞总RNA的提取和反转录(RT)按照UNIQ-10柱式总RNA抽提试剂盒说明书提取IPEC-J2细胞的总RNA。按照promega反转录试剂盒GoScriptTM Reverse Transcription System说明书操作步骤将提取的总RNA反转录成cDNA,保存于-20 ℃冰箱备用。
1.6.2 PCR引物的设计参考基因库(GenBank)中已发表的猪TFF3、TNF-α、IL-8和β-actin的RNA序列,利用Primer 5.0软件设计引物,由生工生物工程(上海)股份有限公司合成。TFF3(2 bp):引物1,5′-GTDTTAGCCTCTCCCAGCAG-3′;引物2,5′-TCTCAAGGGTCACGGAAAGT-3′。TNF-α(20 bp)引物1,5′-ACCAGCCAGGAGAGA-GACAA-3′;引物2,5′-AGCGTGTGAGAGGGAGAGAG-3′。IL-8引物1(21 bp),5′-TGAGAA-GCAACAACAACAGCA-3′;引物2(20 bp),5′-CAGCACAGGAATGAGGCATA-3′。β-actin,引物1(19 bp),5′-CTCTTCCAGCCCTCCTTCC-3′;引物2(17 bp),5′-GGTCCTTGCGGATGTCG-3′。
1.6.3 qRT-PCR的测定[16]反应体系:反应体积为20 μL,其中含有2×qPCR SYBR® Premix Ex-Taq 10 μL,QF(10 μmol·L-1)与QR(10 μmol·L-1)各0.5 μL,Template cDNA 2 μL,RNase Free dH2O 7 μL。荧光定量PCR的扩增条件:90 ℃ 30 s,95 ℃ 5 s,61 ℃ 30 s,循环40次。熔解条件:95 ℃ 1 min,55 ℃ 30 s,95 ℃ 30 s,循环1次。TFF3、TNF-α、IL-8和β-actin的mRNA检测结果由计算机工作站给出。以β-actin为内参基因,各待测基因转录强度以基因绝对拷贝数/β-actin绝对拷贝数表示,通过熔解曲线判断是否有非特异性扩增产物或引物二聚体出现,采用2-△△Ct法进行相对定量[17]。
1.7 数据分析采用SPSS 20.0统计软件对所得数据进行单因素方差分析和Duncan多重比较,P < 0.05为差异显著,P < 0.01为差异极显著;IPEC-J2细胞增殖率和mRNA相对转录量均以Prism5.0作图。
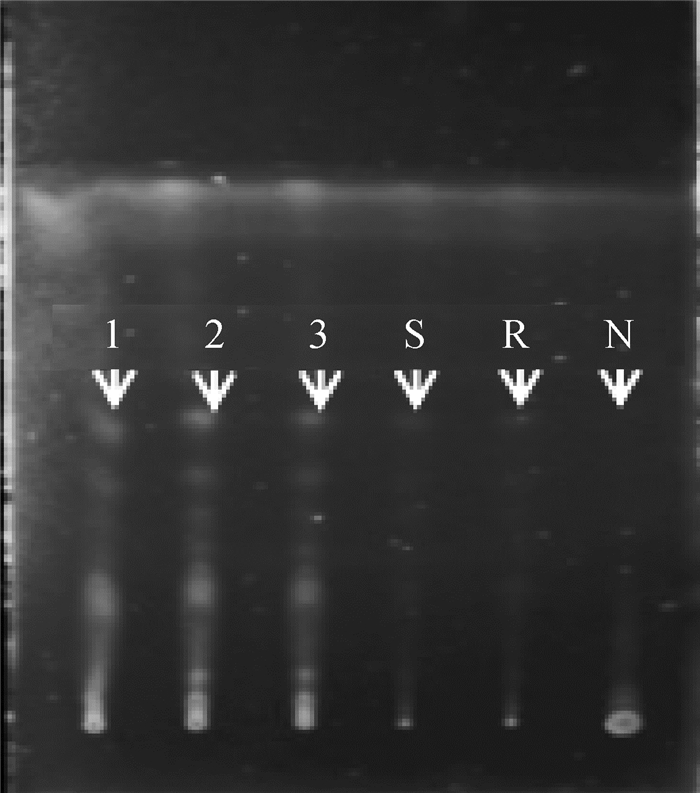
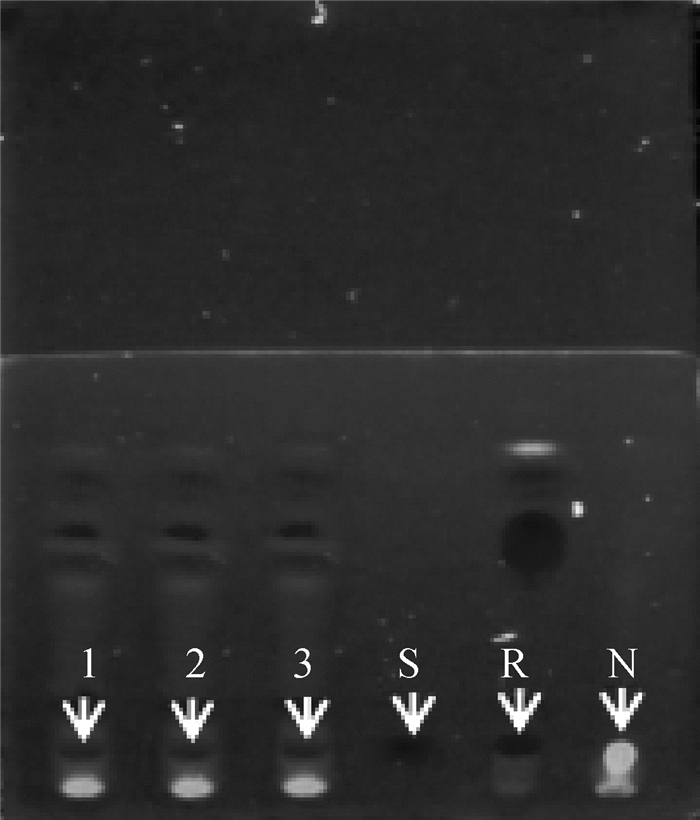
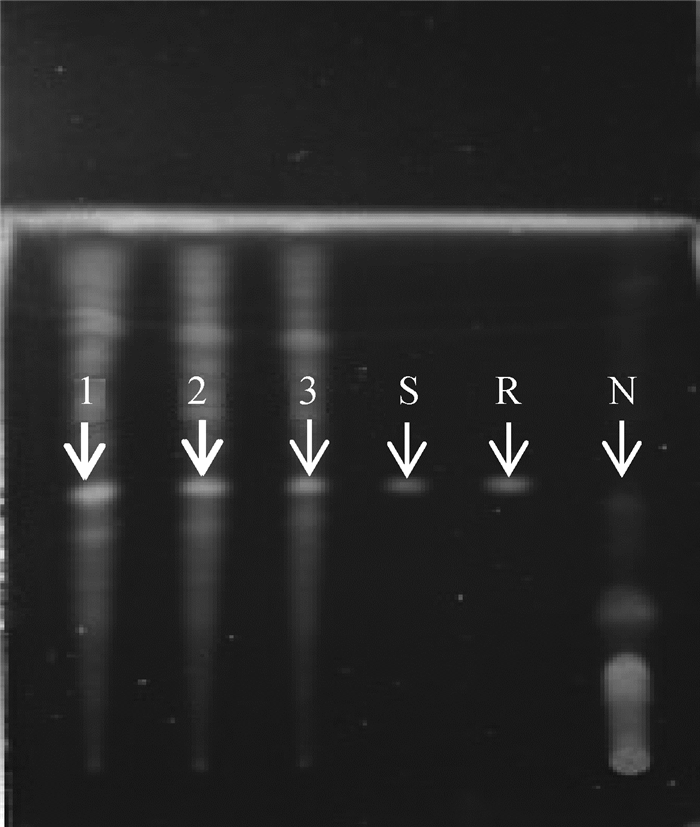
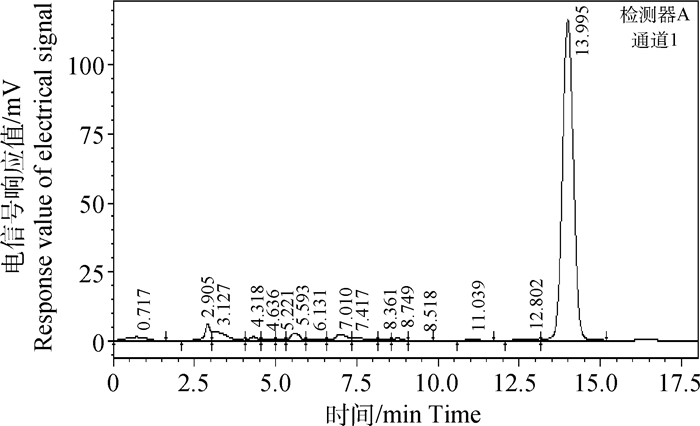
2 结果 2.1 ZQEF有效活性成分的薄层色谱鉴定及黄芩苷含量高效液相测定白术、黄芩和黄芪的薄层色谱鉴定结果显示,ZQEF供试品均在白术、黄芩和黄芪对照药材及标准品处呈现相同颜色的斑点,而阴性对照品则不出现,说明ZQEF中含白术、黄芩和黄芪以及白术内酯Ⅰ、黄芩苷和黄芪甲苷等主要活性成分,分别见图 1~3。高效液相色谱法测定结果显示,ZQEF中黄芩苷的平均含量为1.469 8%,RSD=1.576 7%,见图 4、5。
|
1~3. ZQEF供试品;S.白术内酯Ⅰ标准品;R.白术对照药材;N.阴性对照品 1-3. ZQEF samples; S. Standard atractylenolide-Ⅰ; R. Rhizoma atractylodis macrocephalae reference substance; N. Negative reference substance 图 1 ZQEF中白术薄层色谱鉴别 Fig. 1 Identify the atractylodes of ZQEF by TLC |
|
1~3. ZQEF供试品;S.黄芩苷标准品;R.黄芩对照药材;N.阴性对照品 1-3. ZQEF samples; S. Standard baicalin; R. Scutellaria baicalensis reference substance; N. Negative reference substance 图 2 ZQEF中黄芩苷薄层色谱鉴别 Fig. 2 Identify the baicalin of ZQEF by TLC |
|
1~3. ZQEF供试品;S.黄芪甲苷标准品;R.黄芪对照药材;N.阴性对照品 1-3. ZQEF samples; S. Standard astragaloside; R. Astragalus membranaceus reference substance; N. Negative reference substance 图 3 ZQEF中黄芪甲苷薄层色谱鉴别 Fig. 3 Identify the astragaloside of ZQEF by TLC |
|
图 4 HPLC色谱图(黄芩苷标准品) Fig. 4 HPLC chromatogram (Standard baicalin) |
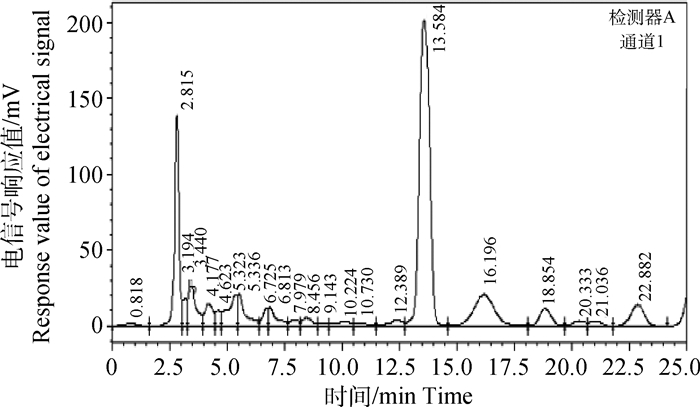
|
图 5 HPLC色谱图(ZQEF供试品) Fig. 5 HPLC chromatogram (ZQEF samples) |
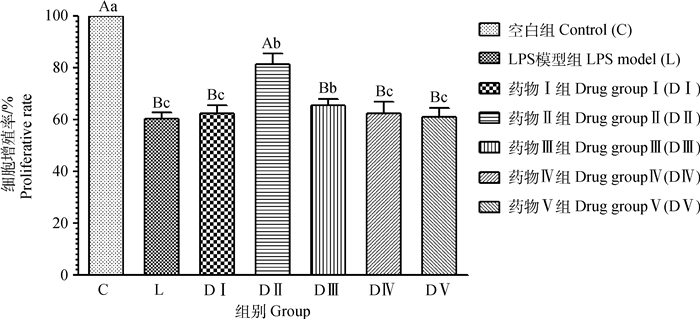
结果显示,LPS模型组IPEC-J2细胞增殖率降低,与空白组相比,差异极显著(P < 0.01)。与LPS模型组相比,药物Ⅰ~Ⅴ组IPEC-J2细胞增殖率均增高,其中药物Ⅱ组(10-2g·mL-1)差异极显著(P < 0.01),药物Ⅲ组(10-3 g·mL-1)差异显著(P < 0.05),详见图 6。说明不同浓度ZQEF均能促进LPS损伤的IPEC-J2细胞的修复,其中10-2和10-3 g·mL-1ZQEF效果显著,10-2 g·mL-1 ZQEF效果最佳。
|
不同大写字母表示组间差异极显著(P < 0.01),不同小写字母表示组间差异显著(P < 0.05)。下图同 Different capital letters mean highly significant difference among groups (P < 0.01), different lowercase letters mean significant difference among groups (P < 0.05). The same as below 图 6 不同浓度ZQEF对LPS损伤IPEC-J2细胞增殖率的影响 Fig. 6 Effects of different concentrations of ZQEF on proliferative rate of LPS-injured IPEC-J2 cells |
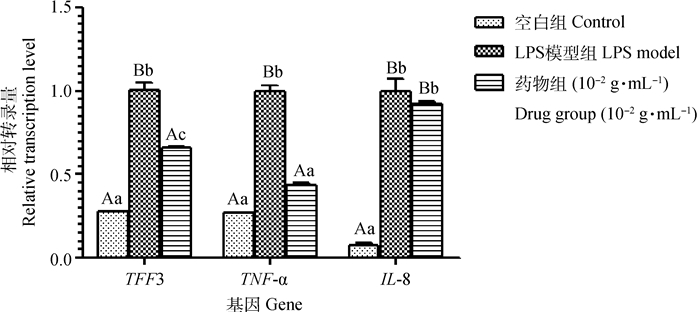
空白组IPEC-J2细胞中TFF3 mRNA的相对量为0.28,LPS模型组IPEC-J2细胞中TFF3 mRNA的相对量为1.01,与空白组相比,差异极显著(P < 0.01);药物组(10-2 g·mL-1)IPEC-J2细胞中TFF3 mRNA的相对量为0.66,与LPS模型组相比,差异极显著(P < 0.01),说明10-2g·mL-1ZQEF能够明显降低TFF3的转录,如图 7所示。
|
图 7 药物(10-2 g·mL-1)对IPEC-J2细胞中TFF3、TNF-α、IL-8相对转录量的影响 Fig. 7 Effects of drugs (10-2 g·mL-1) on mRNA transcription of TFF3, TNF-α and IL-8 in IPEC-J2 cells |
空白组IPEC-J2细胞中TNF-α mRNA的相对量为0.27;LPS模型组IPEC-J2细胞中TNF-α mRNA的相对量为1.00,与空白组相比,差异极显著(P < 0.01);药物组(10-2g·mL-1)IPEC-J2细胞中TNF-α mRNA的相对量为0.44,与LPS模型组相比,差异极显著(P < 0.01),说明10-2g·mL-1 ZQEF能够明显抑制炎性因子TNF-α的转录,如图 7所示。
2.5 ZQEF对IPEC-J2细胞中IL-8转录的影响空白组IPEC-J2细胞中IL-8 mRNA的相对量为0.08,LPS模型组IPEC-J2细胞中IL-8 mRNA的相对量为1.00,与空白组相比,差异极显著(P < 0.01);药物组(10-2g·mL-1)IPEC-J2细胞中IL-8 mRNA的相对量为0.92,与LPS模型组相比差异不显著(P>0.05),说明10-2 g·mL-1ZQEF能够抑制炎性因子IL-8的转录,如图 7所示。
3 讨论随着仔猪腹泻病的频发以及抗生素的滥用,农业农村部提出了“减抗”的要求。而中药对于仔猪腹泻的治疗作用除抑菌外,还包括抗肠毒素、抑制小肠推动和抑制炎性渗出等作用[18]。查阅文献发现,含白头翁、黄芩和苦参等中药的复方可以加速肠组织修复、减轻炎症和调节免疫,对猪流行性腹泻的疗效优于抗生素疗法[19-20]。本研究所用的复方术芩主要是从补脾健胃、益气健脾、清热燥湿等方面组方,其术芩总多糖能增强机体免疫力[21]。本试验结果显示,ZQEF中主要活性成分有白术内酯Ⅰ、黄芩苷和黄芪甲苷,并测得黄芩苷平均含量为1.469 8%。其主要成分白术内酯Ⅰ具有较强的抗炎活性[22],黄芩苷具有广谱抗菌活性[23],黄芪甲苷能起到抗病毒和调节免疫的作用[24]。提示ZQEF可能具有抗菌、抗病毒、抗炎和调节免疫的作用。
动物腹泻的原因主要是肠黏膜受损,局部血管通透性增加,继而引起肠道渗出液分泌增加[25]。本试验结果显示,LPS能明显降低IPEC-J2细胞增殖率,与文献[26]结果一致,说明LPS能损伤肠黏膜细胞。当肠上皮细胞处于损伤或炎症等病理状态时,TFF3除了表达部位的特异性消失,还具有促血管形成作用,因此TFF3被认为是一种能促进肿瘤生长和转移的小分子多肽[27]。本试验结果显示,LPS能明显增加IPEC-J2细胞中TFF3 mRNA的量,与文献报道一致[28-29],ZQEF提高IPEC-J2细胞增殖率并降低LPS损伤的IPEC-J2细胞中的TFF3 mRNA量。提示ZQEF通过促进肠上皮细胞增殖和调节TFF3表达,参与了损伤的肠上皮细胞的修复过程。
在LPS的作用下,细胞因子及炎症介质会过度释放,引起机体组织损伤,严重时甚至导致器官衰竭、死亡。研究认为LPS可通过促进IκB的磷酸化,激活NF-κB炎性通路而发挥致炎作用[30],也有研究认为TNF-α和IL-8是NF-κB炎性通路的下游因子[31]。童明宏等[32]认为当TNF-α和IL-8的分泌量增加后,能在局部使得粒细胞发生聚集进而引起炎症反应,进一步地造成病理损伤。因此,LPS所诱导产生的TNF-α和IL-8都是重要的促炎因子。TNF-α主要在巨噬细胞、中性粒细胞和淋巴细胞的细胞质中表达,能激活淋巴细胞,也可正向调控靶细胞以合成IL-8[33]。IL-8的作用则表现在诱导嗜中性粒细胞、嗜碱性粒细胞和T淋巴细胞浸润到炎性部位并释放炎性介质,引起炎性反应。
目前,笔者未查阅到复方术芩对LPS诱导的相关疾病的研究,但查阅了该复方中白术、黄芩及黄芪等味药及主要活性物质对LPS诱导的炎症的研究。颜亮等[34]发现黄芩中的主要活性成分黄芩苷能抑制LPS致敏的小鼠巨噬细胞中NLRP3炎症小体的活化;钟秀会等[35]研究表明黄芩和白术的组方能降低LPS诱导产生的TNF-α水平;杨天任等[36]发现黄芪多糖能显著降低经伤寒沙门菌攻毒后小鼠血清中的TNF-α含量。本试验结果显示,LPS能明显增加IPEC-J2细胞中TNF-α和IL-8 mRNA的量,而ZQEF降低了TNF-α和IL-8 mRNA量,但对IL-8转录的影响并不显著,提示ZQEF通过拮抗TNF-α和IL-8等炎性因子的表达而降低肠上皮细胞的炎性损伤。对于IL-8 mRNA量降低不显著的原因,笔者认为可能是IL-8的合成存在多个途径,ZQEF可能仅通过拮抗TNF-α表达以负调控IL-8合成,而并没有拮抗其主要合成的途径。因此,ZQEF对IL-8的调控机制还有待进一步研究。
4 结论术芩提取液中含白术内酯Ⅰ、黄芩苷和黄芪甲苷等成分,其中黄芩苷含量为1.469 8%,对LPS所损伤的IPEC-J2细胞具有修复作用。其机理可能是通过促进LPS损伤的IPEC-J2细胞增殖,拮抗LPS损伤的IPEC-J2细胞中TNF-α、IL-8等炎性因子的表达,达到修复肠黏膜的作用。
| [1] |
唐志高, 刘冲, 赵小刚, 等. 乳仔猪腹泻发生的原因及规律[J]. 中国畜牧兽医, 2009, 36(8): 121–124.
TANG Z G, LIU C, ZHAO X G, et al. The cause and pathogenesis of diarrhea in weaning piglets[J]. China Animal Husbandry & Veterinary Medicine, 2009, 36(8): 121–124. (in Chinese) |
| [2] |
孙丽, 夏日炜, 殷学梅, 等. LPS诱导条件下猪小肠上皮细胞TLR4及其信号通路基因表达变化分析[J]. 畜牧兽医学报, 2015, 46(7): 1095–1101.
SUN L, XIA R W, YIN X M, et al. Analysis of differential expression of TLR4 and TLR4 signaling pathway genes under lipopolysaccharide-induced pig intestinal epithelial cells[J]. Acta Veterinaria et Zootechnica Sinica, 2015, 46(7): 1095–1101. (in Chinese) |
| [3] |
徐子伟. 仔猪肠道损伤修复营养调控及其机制和应用[J]. 动物营养学报, 2014, 26(10): 3033–3045.
XU Z W. Mechanism and application for nutritional regulations of intestine damage repair in piglets[J]. Chinese Journal of Animal Nutrition, 2014, 26(10): 3033–3045. DOI: 10.3969/j.issn.1006-267x.2014.10.015 (in Chinese) |
| [4] | CHEN Y H, LU Y, DE PLAEN I G, et al. Transcription factor NF-κB signals antianoikic function of trefoil factor 3 on intestinal epithelial cells[J]. Biochem Biophys Res Commun, 2000, 274(3): 576–582. DOI: 10.1006/bbrc.2000.3176 |
| [5] |
张博, 窦逾常, 王垂杰. 四君子汤对脾虚大鼠肠黏膜TFF3蛋白表达及TFF3 mRNA表达的影响[J]. 中国实验诊断学, 2014, 18(5): 715–717.
ZHANG B, DOU Y C, WANG C J. Effects of Sijunzi decoction on the expression of TFF3 mRNA and TFF3 protein in intestinal mucosa of spleen deficiency rats[J]. Chinese Journal of Laboratory Diagnosis, 2014, 18(5): 715–717. (in Chinese) |
| [6] |
张秋宁, 马力. 三叶因子3在胃癌组织中的表达及与血管形成的关系[J]. 现代肿瘤医学, 2005, 13(1): 42–44.
ZHANG Q N, MA L. Correlation between expression of trefoil factor 3 and angiogenesis in gastric cancer[J]. Journal of Modern Oncology, 2005, 13(1): 42–44. DOI: 10.3969/j.issn.1672-4992.2005.01.016 (in Chinese) |
| [7] |
贾长河, 许泼实, 康谊. 溃疡性结肠炎患者血清IL-8、IL-10、TNF-α的水平及临床意义[J]. 中华实用诊断与治疗杂志, 2008, 22(8): 574–575, 578.
JIA C H, XU P S, KANG Y. Serum contents of IL-8, IL-10 and TNF-α in the patients with ulcerative colitis and the clinical significance[J]. Journal of Chinese Practical Diagnosis and Therapy, 2008, 22(8): 574–575, 578. (in Chinese) |
| [8] |
李瑶, 吕德官, 陈临溪. IL-8及其受体药物与疾病的研究进展[J]. 中国药理学通报, 2014, 30(3): 310–314.
LI Y, LV D G, CHEN L X. Research progress of IL-8 and its receptor drugs in diseases[J]. Chinese Pharmacological Bulletin, 2014, 30(3): 310–314. DOI: 10.3969/j.issn.1001-1978.2014.03.004 (in Chinese) |
| [9] | BERNSTEIN C N, FRIED M, KRABSHUIS J H, et al. World gastroenterology organization practice guidelines for the diagnosis and management of IBD in 2010[J]. Inflamm Bowel Dis, 2010, 16(1): 112–124. DOI: 10.1002/ibd.21048 |
| [10] |
杨洪早, 王东升, 董书伟, 等. 仔猪腹泻的病因及中药防治研究进展[J]. 动物医学进展, 2016, 37(10): 89–93.
YANG H Z, WANG D S, DONG S W, et al. Progress on causes of diarrhea in piglets and the comprehensive prevention and treatment the use of TCM[J]. Progress in Veterinary Medicine, 2016, 37(10): 89–93. DOI: 10.3969/j.issn.1007-5038.2016.10.019 (in Chinese) |
| [11] |
刘付国树, 朱兆荣, 刘娟, 等. 复方术芩提取液抗菌抗炎作用初步研究[J]. 中兽医医药杂志, 2016, 35(1): 8–12.
LIUFU G S, ZHU Z R, LIU J, et al. Antibacterial and antiphlogistic effects of compound Zhuqin extract[J]. Journal of Traditional Chinese Veterinary Medicine, 2016, 35(1): 8–12. (in Chinese) |
| [12] |
朱买勋, 余春成, 朱兆荣, 等. 复方术芩提取液体外抗PEDV感染PK-15细胞的作用效果[J]. 中国兽医学报, 2014, 34(3): 485–488, 491.
ZHU M X, YU C C, ZHU Z R, et al. The effect of compound Zhuqin extract resisting porcine epidemic diarrhea virus infecting PK-15 cells in vitro[J]. Chinese Journal of Veterinary Science, 2014, 34(3): 485–488, 491. (in Chinese) |
| [13] | JUAN L, HONG Q, RONG Z Z, et al. Influence of Zhuqin formula extract on the cellular and humoral immune response in cyclophosphamide-immunocompromised mice[J]. J Anim Plant Sci, 2015, 25(5): 1335–1343. |
| [14] |
刘付国树, 袁丽花, 朱兆荣, 等. 术芩颗粒对仔猪生长性能和血液生理生化指标的影响[J]. 中国兽医杂志, 2016, 52(10): 52–55.
LIUFU G S, YUAN L H, ZHU Z R, et al. The influence of growth performance and blood physiological and biochemical of Zhuqin granules on piglets[J]. Chinese Journal of Veterinary Medicine, 2016, 52(10): 52–55. DOI: 10.3969/j.issn.0529-6005.2016.10.021 (in Chinese) |
| [15] | SCHIERACK P, NORDHOFF M, POLLMANN M, et al. Characterization of a porcine intestinal epithelial cell line for in vitro studies of microbial pathogenesis in swine[J]. Histochem Cell Biol, 2006, 125(3): 293–305. DOI: 10.1007/s00418-005-0067-z |
| [16] |
张驰宇, 徐顺高, 黄新祥. 一种新颖简便的荧光实时RT-PCR相对定量方法的建立[J]. 生物化学与生物物理进展, 2005, 32(9): 883–888.
ZHANG C Y, XU S G, HUANG X X. A novel and convenient relative quantitative method of fluorescence real time RT-PCR assay based on slope of standard curve[J]. Progress in Biochemistry and Biophysics, 2005, 32(9): 883–888. DOI: 10.3321/j.issn:1000-3282.2005.09.013 (in Chinese) |
| [17] |
刘俊玮, 刘娟, 杜林林, 等. 复方参芩对犬细小病毒致心肌组织Bcl-2和Bax mRNA的影响[J]. 畜牧兽医学报, 2013, 44(1): 122–128.
LIU J W, LIU J, DU L L, et al. Effect of Shenqin compound on mRNA expression of Bcl-2 and Bax genes in canine myocardium infected by canine parvovirus[J]. Acta Veterinaria et Zootechnica Sinica, 2013, 44(1): 122–128. (in Chinese) |
| [18] |
刘玉芹, 张秀英, 马得莹, 等. 中草药抗仔猪大肠杆菌性腹泻作用机理的研究[J]. 畜牧兽医学报, 2005, 36(6): 620–624.
LIU Y Q, ZHANG X Y, MA D Y, et al. Study on mechanism of action of Chinese herbal medicine on Escherichia coli-induced diarrhea of piglet[J]. Acta Veterinaria et Zootechnica Sinica, 2005, 36(6): 620–624. DOI: 10.3321/j.issn:0366-6964.2005.06.021 (in Chinese) |
| [19] |
杨云乔, 郑建高, 姜军华, 等. 复方中药对猪流行性腹泻的治疗效果[J]. 中国兽医学报, 2017, 37(7): 1353–1358.
YANG Y Q, ZHENG J G, JIANG J H, et al. Therapeutic effect of compound Chinese herbal medicine on porcine epidemic diarrhea[J]. Chinese Journal of Veterinary Science, 2017, 37(7): 1353–1358. (in Chinese) |
| [20] |
董世山, 蔡辉益, 刘作华, 等. 几种中药复方提取物对仔猪腹泻的防治作用及相关机理[J]. 中国农业大学学报, 2005, 10(3): 60–64.
DONG S S, CAI H Y, LIU Z H, et al. Antidiarrheal effects and mechanisms of several Chinese medicinal herb extractions[J]. Journal of China Agricultural University, 2005, 10(3): 60–64. DOI: 10.3321/j.issn:1007-4333.2005.03.013 (in Chinese) |
| [21] |
庞敏, 朱兆荣, 乔芊芊, 等. 术芩总多糖对免疫低下小鼠脾淋巴细胞增殖与自噬的影响[J]. 畜牧兽医学报, 2018, 49(12): 2762–2770.
PANG M, ZHU Z R, QIAO Q Q, et al. Effect of polysaccharides from ZhuQin formula on the proliferation and autophagy of spleen lymphocyte in immunocompromised mice[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(12): 2762–2770. (in Chinese) |
| [22] | LI C Q, HE L C, DONG H Y, et al. Screening for the anti-inflammatory activity of fractions and compounds from Atractylodes macrocephala koidz[J]. J Ethnopharmacol, 2007, 114(2): 212–217. DOI: 10.1016/j.jep.2007.08.002 |
| [23] |
刘昊, 赵自冰, 王新. 黄芩苷抗菌作用研究进展[J]. 畜牧与饲料科学, 2017, 38(7): 61–63.
LIU H, ZHAO Z B, WANG X. Research progress on antibacterial activity of baicalin[J]. Animal Husbandry and Feed Science, 2017, 38(7): 61–63. DOI: 10.3969/j.issn.1672-5190.2017.07.022 (in Chinese) |
| [24] |
曹玉冰. 黄芪甲苷的药理作用及其机制的研究进展[J]. 现代药物与临床, 2017, 32(5): 954–960.
CAO Y B. Research progress on pharmacological activities and mechanism of astragaloside Ⅳ[J]. Drugs & Clinic, 2017, 32(5): 954–960. (in Chinese) |
| [25] |
孙宏伟, 王泽岩, 任少敏, 等. 猪主要腹泻病的发病机制综述[J]. 中国动物检疫, 2016, 33(3): 63–66, 70.
SUN H W, WANG Z Y, REN S M, et al. Summary on the pathogenesis of porcine primary diarrhea diseases[J]. China Animal Health Inspection, 2016, 33(3): 63–66, 70. DOI: 10.3969/j.issn.1005-944X.2016.03.022 (in Chinese) |
| [26] |
李若楠, 洪盼, 郎伍营, 等. β-胡萝卜素对脂多糖刺激的IPEC-J2细胞紧密连接蛋白表达的影响[J]. 中国免疫学杂志, 2017, 33(11): 1611–1615.
LI R N, HONG P, LANG W Y, et al. Effects of β-carotene on expression of cell tight junction protein of IPEC-J2 with LPS-stimulated[J]. Chinese Journal of Immunology, 2017, 33(11): 1611–1615. DOI: 10.3969/j.issn.1000-484X.2017.11.003 (in Chinese) |
| [27] | JOO Y E, REW J S, SEO Y H, et al. Cyclooxygenase-2 overexpression correlates with vascular endothelial growth factor expression and tumor angiogenesis in gastric cancer[J]. J Clin Gastroenterol, 2003, 37(1): 28–33. DOI: 10.1097/00004836-200307000-00009 |
| [28] |
张宏伟, 石莎, 卢克美. 替普瑞酮及雷贝拉唑对急性胃黏膜损伤大鼠TFF3表达的研究[J]. 安徽医药, 2015, 19(12): 2280–2283.
ZHANG H W, SHI S, LU K M. Expression of TFF3 in rats with acute gastric mucosal lesion treated by Teprenone and Rabeprazole[J]. Anhui Medical and Pharmaceutical Journal, 2015, 19(12): 2280–2283. DOI: 10.3969/j.issn.1009-6469.2015.12.009 (in Chinese) |
| [29] |
张蓉, 闫再宏, 张俊英. 幽门螺杆菌相关性胃溃疡与胃癌中NF-κB、TFF3的表达及意义[J]. 胃肠病学和肝病学杂志, 2013, 22(2): 130–132.
ZHANG R, YAN Z H, ZHANG J Y. Expressions of TFF3, NF-κB and their implications in Helicobacter pylori associated-gastric ulcer and gastric cancer[J]. Chinese Journal of Gastroenterology and Hepatology, 2013, 22(2): 130–132. (in Chinese) |
| [30] | KIM Y S, KIM J S, JUNG H C, et al. The effects of thalidomide on the stimulation of NF-κB activity and TNF-α production by lipopolysaccharide in a human colonic epithelial cell line[J]. Mol Cells, 2004, 17(2): 210–216. |
| [31] | LEE S H, KIM Y J, KWON S H, et al. Inhibitory effects of flavonoids on TNF-α-induced IL-8 gene expression in HEK 293 cells[J]. BMB Rep, 2009, 42(5): 265–270. DOI: 10.5483/BMBRep.2009.42.5.265 |
| [32] |
童明宏, 孙晨光, 贺士平. 幽门螺杆菌感染患者血清IL-8和TNFα的水平变化及临床意义探讨[J]. 检验医学, 2004, 19(2): 106–108.
TONG M H, SUN C G, HE S P. Study on the levels of IL-8 and TNFα in serum of patients with Helicobacter pylori infection and its clinical significance[J]. Laboratory Medicine, 2004, 19(2): 106–108. (in Chinese) |
| [33] |
苗雪, 官杰. IL-8的研究进展[J]. 齐齐哈尔医学院学报, 2011, 32(22): 3693–3695.
MIAO X, GUAN J. Advance of research in IL-8[J]. Journal of Qiqihar University of Medicine, 2011, 32(22): 3693–3695. DOI: 10.3969/j.issn.1002-1256.2011.22.056 (in Chinese) |
| [34] |
颜亮, 李陈广, 徐丽慧, 等. 黄芩苷对NLRP3炎症小体活化和细胞焦亡的抑制作用及其机制研究[J]. 免疫学杂志, 2018, 34(2): 93–100, 114.
YAN L, LI C G, XU L H, et al. Inhibitory effects of baicalin on NLRP3 inflammasome activation and pyroptosis and the underlying mechanism[J]. Immunological Journal, 2018, 34(2): 93–100, 114. (in Chinese) |
| [35] |
钟秀会, 周占祥, 孙秉贵, 等. 黄芩白术对LPS诱导流产小鼠的保胎作用及子宫内TNF-α含量的影响[J]. 畜牧兽医学报, 2000, 31(5): 430–435.
ZHONG X H, ZHOU Z X, SUN B G, et al. Effects of the anti-abortifacient Chinese herbal medicine Radix scutellariae and Rhizoma atractylodis on LPS induced abortion and uterine contents of TNF-α in mice[J]. Acta Veterinaria et Zootechnica Sinica, 2000, 31(5): 430–435. DOI: 10.3321/j.issn:0366-6964.2000.05.009 (in Chinese) |
| [36] |
杨天任, 王帅, 黄烁, 等. 抗菌肽Sublancin与黄芪多糖对小鼠免疫调节作用的比较研究[J]. 动物营养学报, 2018, 30(6): 2337–2345.
YANG T R, WANG S, HUANG S, et al. Comparative study on immunomodulatory effect of antimicrobial peptide Sublancin and Astragalus polysaccharide of mice[J]. Chinese Journal of Animal Nutrition, 2018, 30(6): 2337–2345. DOI: 10.3969/j.issn.1006-267x.2018.06.038 (in Chinese) |



