半月板是位于股骨髁和胫骨平台间的半月形纤维软骨组织,具有吸收振荡、传导膝关节负荷、润滑关节等重要作用[1-2]。半月板损伤会严重限制膝关节的功能,增加膝关节骨关节炎的风险,而半月板损伤病例在临床上常见。由于缺乏血管和细胞,半月板损伤后很难再生[3]。目前,半月损伤的常用修复方式为半月板部分或全部切除术和异体半月板移植术[4]。但前者会诱发关节软骨退行性病变和骨关节炎,后者则存在免疫排斥反应、解剖学不匹配等问题[1]。
近年来,组织工程为半月板损伤修复治疗提供了一种新的方向。组织工程的主要步骤是首先制备支架,然后将细胞接种于支架上,并通过细胞因子、力学刺激等方法调控细胞-支架复合物,使之产生细胞外基质(extracellular matrix, ECM),形成有功能的组织后移植至动物或人体内[5]。3D打印技术作为一种新兴的支架制造技术,在精确性、孔隙调节、空间结构复杂性、个体化定制等方面有很高的可控性[6]。由于半月板解剖学结构的特殊性,相比其他组织工程支架的制备技术,3D打印技术在制备组织工程半月板支架上有很大优势。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)较软骨细胞和半月板纤维软骨细胞更容易获取,且具有很强的自我增殖能力及向软骨细胞和纤维软骨细胞分化能力,是理想的半月板组织工程种子细胞的来源[7]。诱导培养BMSCs-支架复合物使其软骨向分化,在合成一定量的ECM后再移植入动物体内能更快地发挥其功能,响应膝关节压力[8],但不同诱导时间对体外构建组织工程半月板生长分化的影响目前缺乏深入研究。明确BMSCs-支架复合物在体外诱导培养过程中细胞生长和ECM合成随时间的变化,可更加合理地决定细胞-支架复合物的体内移植时机。本试验通过3D打印技术制备聚己内酯(polycaprolactone,PCL)半月板支架,观察支架形态结构和理化性能以及细胞相容性,并接种以犬BMSCs,在体外分别进行成软骨诱导7、14、21、28 d,分析和比较不同体外诱导时间对细胞-支架复合物ECM合成的影响,为其体内移植研究提供参考。
1 材料与方法 1.1 试验材料与仪器设备由西北农林科技大学实验动物中心提供的膝关节状态良好的淘汰实验犬1只,年龄5岁,体重9.8 kg,符合后续犬3D打印半月板体内移植试验犬的年龄体型范围。Handy SCAN 700TM三维扫描仪(西安厚德机电科技有限公司),3D生物打印机(南京松泓智能科技有限公司),HY-0230万能生物力学测试机(上海衡翼精密仪器有限公司),Nova Nano SEM-450场发射扫描电子显微镜(FEI公司,美国),Spark多功能酶标仪(Tecan公司,瑞士),化学发光成像系统(Bio-Rad公司,美国),CO2培养箱。
转化生长因子-β3(Pepro Tech公司,美国),重组骨形态发生蛋白2(Pepro Tech公司,美国),双链DNA荧光定量试剂盒(上海翊圣生物科技有限公司),Blyscan糖胺聚糖检测试剂盒(Biocolor生物公司,英国),小鼠抗Ⅱ型胶原抗体(Abcam公司,英国),山羊抗小鼠IgG抗体(Abcam公司,英国)。
1.2 3D打印半月板支架的制备及观察实验犬安乐死,取出犬尸体的后肢内侧半月板,通过三维扫描仪采集其3D图像信息,用Vxelements软件处理扫描数据,构建半月板三维立体模型,将数据以STL格式导入3D打印控制软件中,参考Szojka等[9]的方法调整3D生物打印机打印参数,模仿天然半月板中胶原纤维束的排列结构控制模型的打印结构,通过沉积熔融43~50 ku相对分子质量的PCL线材进行支架的3D打印。同时使用相同打印参数打印直径5 mm、高度3 mm标准大小的圆柱体PCL支架,以进行后续的诱导分化试验。
取打印好的支架,大体观察其形态,冷冻干燥、喷金后,扫描电镜观察支架微观结构。
1.3 支架力学性能和降解率的评估支架的生物力学特性通过万能生物力学测试机检测。使用直径5 mm的环形钻将3D打印的PCL半月板型支架在不同位置环切出直径5 mm,厚约3 mm的圆柱体(n=5),PBS缓冲液浸润后进行压缩力学测试,在持续垂直压力作用下以1 mm·min-1的速率挤压支架,根据所获得的应力-形变关系曲线计算压缩模量。
支架的降解率通过12周体外降解的质量变化来测定。将干燥的PCL支架称重后记为m1,置于37 ℃,pH 7.4的PBS缓冲液中,每2周取出支架在45 ℃的烘箱中干燥24 h,称重记为m2,并更换PBS缓冲液,共在体外降解12周。其体外降解率根据以下公式计算:降解率(%)=(m1-m2)/ m1×100%。
1.4 支架与细胞相容性的评估使用CCK-8细胞毒性试验评价支架与细胞的相容性。复苏实验室冻存的第3代犬BMSCs,将100 μL密度为3×106个·mL-1的细胞悬液接种在清洗消毒过的标准圆柱体PCL支架上,置于细胞培养箱中分别培养1、3、5、7 d后,加入10 μL CCK-8溶液并在37 ℃培养箱孵育4 h,之后使用酶标仪测量450 nm处的光密度(OD)值。以单层培养的BMSCs作为对照组评估,每组3个重复。
1.5 BMSCs-支架复合物的制备将打印的PCL支架置于超净工作台内,使用紫外射线照射4 h,之后浸泡于75%的酒精备用;接种细胞前,将消毒灭菌过的支架转入无菌PBS溶液中清洗浸泡,将Ⅰ型胶原用6 mmol·L-1的乙酸溶液稀释终浓度至20 μg·mL-1,将支架浸入Ⅰ型胶原溶液中,放入细胞培养箱中静置12 h,取出后放入超净工作台内过夜干燥,用无菌PBS溶液清洗3遍,用完全培养基浸泡过夜备用。
将第三代犬BMSCs用胰蛋白酶消化后重悬,将细胞按5×104个·cm-2的密度,采用离心接种法接种于支架上,将支架静置于细胞培养箱中5 h,使细胞充分黏附于支架,然后转移至24孔板中,加入BMSCs培养基。
1.6 不同体外诱导时间培养时BMSCs-支架复合物分化生长程度的检测将接种了犬BMSCs的标准大小的圆柱体支架,加入软骨诱导培养基(含有5% FBS、1%双抗、40 ng·mL-1地塞米松、50 μg·mL-1L-脯氨酸、1 mmol·L-1丙酮酸钠和胰岛素转铁蛋白硒、10 ng·mL-1转化生长因子-β3、10 ng·mL-1骨形态发生蛋白-2、α-MEM培养基)培养7、14、21、28 d,在不同培养时间点使用倒置显微镜观察BMSCs-支架复合物的生长情况、糖胺聚糖(glycosaminoglycan,GAG)水平和DNA含量、软骨基质Ⅱ胶原蛋白的表达情况,用BMSCs培养基(含有5% FBS、1%双抗、α-MEM培养基)培养的细胞-支架复合物作为对照组,判断其在体外诱导培养不同时间时的分化程度。
1.6.1 BMSCs-支架复合物形态学观察倒置相差显微镜下连续观察细胞在支架微孔中的生长情况以及细胞外基质的分泌状况。
1.6.2 GAG及DNA含量测定将不同诱导培养时间的BMSCs-支架复合物在预先准备好的含10 mmol·L-1 EDTA、10 mmol·L-1盐酸半胱氨酸、100 mmol·L-1磷酸钠的125 μg·mL-1木瓜蛋白酶中以60 ℃消化过夜。
使用1, 9-二甲基亚甲基蓝(DMMB)染料结合试验测定GAG含量。使用分光光度计在656 nm波长测定二甲基亚甲蓝与样品中GAG结合的吸光度,利用硫酸软骨素标准品绘制标准对照曲线,得出不同细胞-支架复合物中GAG含量。
使用PicoGreen双链DNA荧光定量测定法测定样品中的DNA含量。配制PicoGreen检测工作液dsDNA标准品,取180~199 μL检测工作液至样本PCR管中,分别加入1~20 μL待检样品,使PCR管中每个样品终体积为200 μL,轻轻涡旋振荡2~3 s,充分混匀,避光于室温下孵育2 min。将孵育好的溶液加入96孔板中,在荧光酶标仪中检测各样品和dsDNA标准品的荧光值,Ex/Em=480 nm/520 nm。以标准品溶液的浓度和荧光值作标准曲线,将样品荧光值代入标准曲线,求出样品的DNA含量(ng·mL-1)。
每组分别选取5个样品检测,结果以x±s表示。计算每个细胞-支架复合物的GAG/DNA比值。
1.6.3 Western blot检测Ⅱ型胶原蛋白的表达情况细胞-支架复合物分别在体外诱导培养7、14、21、28 d后,弃去培养液,PBS洗涤2次,加入2.5 μL PMSF、250 μL RIPA裂解液后在4 ℃下裂解20 min,之后在4 ℃以12 000 r·min-1离心4 min,收集上清液。配制12%的分离胶及6%的浓缩胶,吸取蛋白样品30 μL后开始电泳。电泳结束后去除浓缩胶,低温下恒定电流200 mA转膜4 h,转膜结束后将PVDF膜与5%脱脂奶粉封闭液反应1 h,之后用小鼠抗Ⅱ型胶原抗体(1:1 000)孵育过夜,洗涤后与过氧化物酶偶联的山羊抗小鼠IgG抗体(1:5 000)孵育1 h,使用显影剂开始显影后使用凝胶成像仪进行曝光,并将曝光图片作灰度分析。以PCNA为内参,以普通培养基培养的BMSCs-支架复合物作为对照,分析Ⅱ型胶原蛋白的表达情况。
1.7 统计学方法采用SPSS17.0统计软件进行分析。数据以x±s表示,组间比较用t检验,检验水准α=0.05。
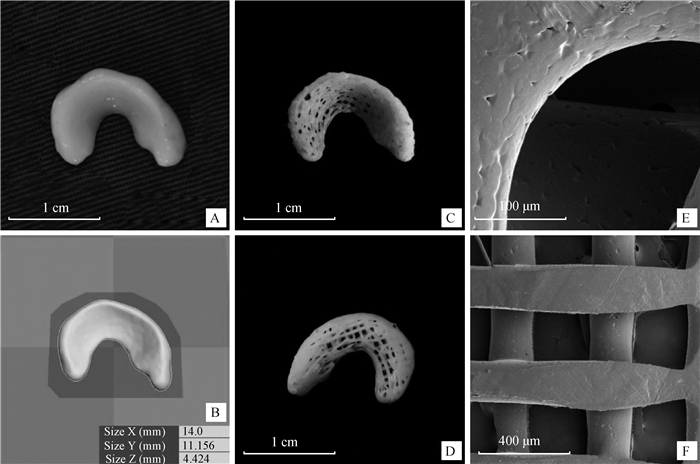
2 结果 2.1 3D打印支架形态及微观结构观测3D打印PCL半月板支架的参数见表 1。大体观察下,打印的半月板支架形状对天然半月板及其扫描模型还原度较高,上表面为环向与径向交叉的结构,内部为十字交叉的结构,扫描电镜观察可见支架孔径分布均匀,孔道连通性良好(图 1)。
|
|
表 1 半月板支架3D打印参数 Table 1 3D printing parameters of meniscus scaffold |
|
A.犬天然半月板;B.天然半月板扫描重建模型;C、E. 3D打印半月板支架上表面大体观察及扫描电镜图;D、F. 3D打印半月板支架底面大体观察及扫描电镜图 A. Canine natural meniscus; B. Natural meniscus scan reconstruction model; C, E.3D printed meniscus stent upper surface observation and SEM images; D, F. 3D printed meniscus scaffold bottom observation and SEM images 图 1 3D打印半月板支架的制备及观察 Fig. 1 Preparation and observation of 3D printed meniscus scaffold |
经生物力学试验机测定所得3D打印PCL支架的压缩模量为(12.21±0.78)MPa,有一定的生物力学性能。PCL支架在37 ℃下持续浸泡12周,在第4、8、12周的体外降解率分别为0.78%±0.11%、1.13%±0.05%、1.48%±0.13%,可见PCL支架降解较为缓慢。
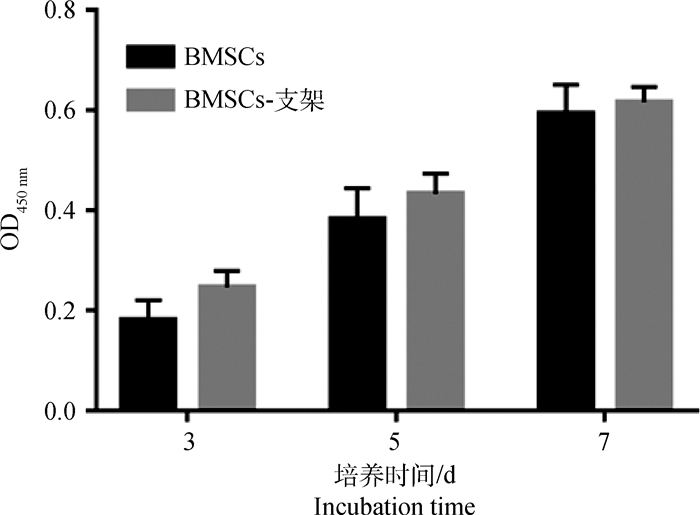
2.3 支架与细胞的相容性CCK-8检测显示(图 2),培养3、5、7 d的细胞,其增殖的OD值分别为0.251±0.021、0.445±0.048、0.616±0.032。说明随时间延长,接种于PCL支架上的细胞数量呈递增趋势,提示支架无细胞毒性,与细胞有较好的相容性。
|
图 2 CCK-8检测PCL半月板支架细胞相容性 Fig. 2 The cell compatibility of the PCL meniscus scaffolds by CCK-8 |
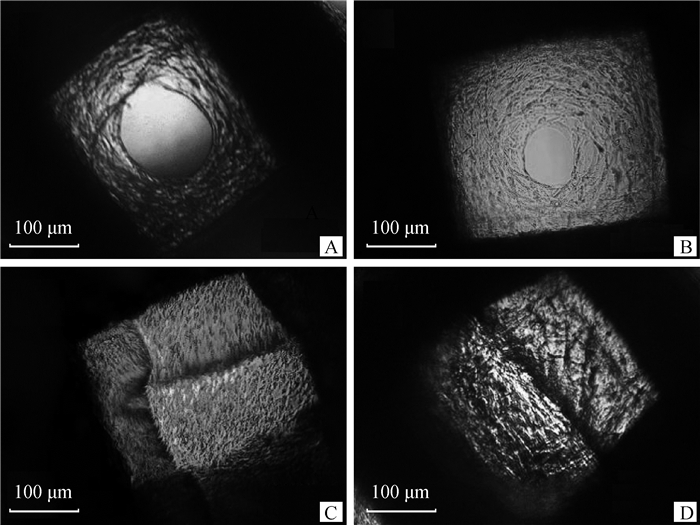
通过倒置相差显微镜可以观察到(图 3),在细胞接种支架后的7~28 d内,BMSCs在支架上生长良好,快速增殖,支架孔隙间细胞和合成的ECM逐渐增多,在21 d时几乎充满支架孔隙。
|
A、B、C、D.诱导培养7、14、21、28 d A, B, C, D. Induced culture for 7, 14, 21, 28 d 图 3 BMSCs-支架复合物的倒置相差显微镜下观察 Fig. 3 Observation of BMSCs-scaffold construction under inverted phase contrast microscope |
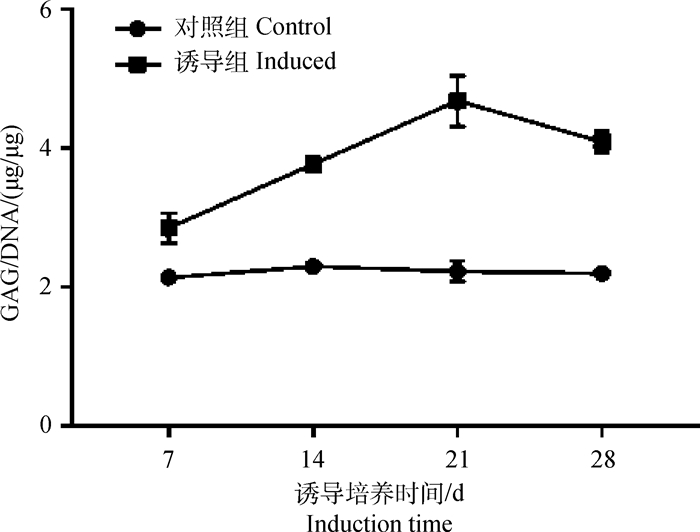
通过DMMB染料结合试验测定糖胺聚糖(GAG)含量,利用PicoGreen双链DNA定量测定法得到DNA含量,相比于未诱导的细胞-支架复合物,软骨向诱导的复合物的GAG含量在诱导培养期间显示出明显增加的趋势(图 4)。21 d时,GAG/DNA值达到最高值,大约达到诱导培养7 d时的2倍,在28 d时则有所下降。
|
图 4 不同诱导时间BMSCs-支架复合物的GAG/DNA比值 Fig. 4 GAG/DNA ratio of BMSCs-scaffold construction at different induction time |
Western blot结果显示(图 5),与对照组比较,诱导组中的Ⅱ型胶原表达量随时间不断增加,同GAG/DNA结果类似,在诱导培养21 d时Ⅱ型胶原蛋白的表达量最高,灰度分析得出其与其他诱导时间组表达量差异显著(P < 0.05),28 d时表达量下降。
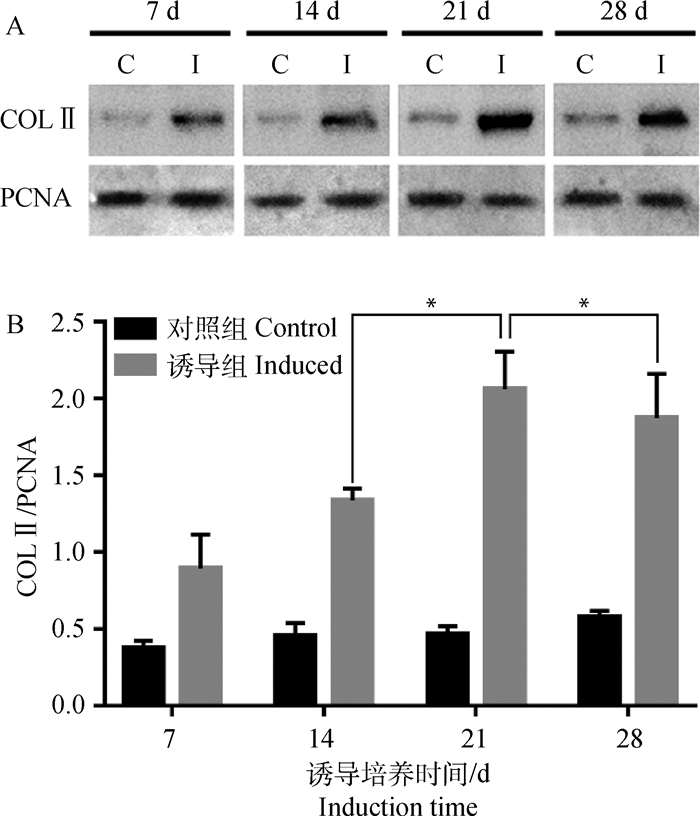
|
*.P < 0.05 图 5 不同诱导时间BMSCs-支架复合物Ⅱ型胶原蛋白的Western blot结果(A)和蛋白水平相对表达量(B) Fig. 5 Western blot results (A) and relative protein expression levels (B) of BMSCs-scaffold construction collagen Ⅱ at different induction time |
半月板通过分散膝关节负荷来保护关节软骨免受过度的压力。其内部的无血管区域造成损伤后不易愈合,使其失去缓冲功能,并增加膝关节骨性关节炎的风险[1, 10]。半月板组织工程旨在通过在生物工程支架上接种细胞形成再生组织来恢复正常的半月板功能[5]。
在半月板组织工程中,与其他天然材料或高分子聚合物相比,PCL因其优越的机械特性、生物相容性、加工性和较缓慢的降解性而成为一种很有前景的材料[11-12]。由于半月板的解剖学结构较为特殊[3],与传统的支架加工方法(如冷冻干燥、微粒浸出、静电纺丝等[13])相比,3D打印技术对打印实体的几何参数(如形状、孔径大小、孔隙率和孔隙分布等[14])控制度更高,能更好地还原出半月板的形状结构。本研究使用激光扫描仪扫描犬的完整半月板,通过计算机辅助设计3D打印制备出PCL支架,通过大体和扫描电镜观察,发现其对天然半月板解剖形状的还原度较高,孔隙均匀,孔间连通性好,通过对其力学性能、降解率和细胞的检测,证明其有一定的力学抗压性能,降解率小,可较好地支撑体内细胞和组织的生长[15],且其细胞相容性良好,适合用于组织工程半月板的构建。
骨髓间充质干细胞(BMSCs)易分离和扩增、免疫原性低、具有多向分化潜能,故被广泛用作组织工程的种子细胞[16-17]。大量研究证明骨髓间充质干细胞在转化生长因子-β3的存在下可以向软骨细胞分化[16]。GAG和Ⅱ型胶原是半月板软骨细胞外基质(ECM)的主要组成成分[18],故两者含量常用作MSC在分化培养中产生软骨基质的标准[19]。细胞-支架复合物在体外诱导培养分泌、沉积ECM可使其与健康组织在结构上和功能上更加相似,从而能够在移植后更快地承受正常的关节负荷,发挥其功能[20],因此,了解细胞-支架复合物在体外诱导培养过程中细胞生长和ECM合成沉积随时间的变化,可为组织工程半月板的动物体内移植试验提供基础。本试验中,在体外诱导培养周期内,细胞在支架孔隙中不断增殖,且与对照组比较,诱导培养的细胞-支架复合物的GAG/DNA比率随着时间的延长而逐渐上升,显示出不断增高的细胞增殖和软骨基质分泌的趋势,在培养21 d时达到最高,28 d时则稍有下降,Western blot检测结果显示Ⅱ型胶原蛋白的表达量也呈相同的趋势,此时软骨基质分泌量达到最高,而28 d时ECM合成量有所下降,有可能与BMSCs在体外长时间的软骨化诱导时发生肥大化有关[21]。这些结果说明,体外成软骨诱导21 d更有利于BMSCs-支架复合物软骨基质的合成和沉积,为组织工程半月板提供了参考,但仍需后续动物的体内移植试验来进一步探究其是否能更有效地修复半月板损伤,从而应用于人和动物临床。
4 结论通过3D打印技术制备出在结构、力学性能、细胞相容性上适用于构建组织工程半月板的支架,且其与犬BMSCs的复合物在体外诱导21 d更有利于合成软骨基质,可为组织工程半月板在动物体内的移植实验提供参考。
| [1] | MAKRIS E A, PASHA H, ATHANASIOU K A. The knee meniscus: structure-function, pathophysiology, current repair techniques, and prospects for regeneration[J]. Biomaterials, 2011, 32(30): 7411–7431. DOI: 10.1016/j.biomaterials.2011.06.037 |
| [2] | PROFFEN B L, MCELFRESH M, FLEMING B C, et al. A comparative anatomical study of the human knee and six animal species[J]. Knee, 2012, 19(4): 493–499. DOI: 10.1016/j.knee.2011.07.005 |
| [3] | FOX A J, WANIVENHAUS F, BURGE A J, et al. The human meniscus: a review of anatomy, function, injury, and advances in treatment[J]. Clin Anat, 2015, 28(2): 269–287. DOI: 10.1002/ca.22456 |
| [4] | BRUCKER P U, VON CAMPE A, MEYER D C, et al. Clinical and radiological results 21 years following successful, isolated, open meniscal repair in stable knee joints[J]. Knee, 2011, 18(6): 396–401. DOI: 10.1016/j.knee.2010.11.007 |
| [5] | ZHANG Z Z, JIANG D, WANG S J, et al. Scaffolds drive meniscus tissue engineering[J]. RSC Adv, 2015, 5(123): 102096. DOI: 10.1039/C5RA90106E |
| [6] | CHOI Y J, YI H G, KIM S W, et al. 3D cell printed tissue analogues: a new platform for theranostics[J]. Theranostics, 2017, 7(12): 3118–3137. DOI: 10.7150/thno.19396 |
| [7] | DING Z, HUANG H. Mesenchymal stem cells in rabbit meniscus and bone marrow exhibit a similar feature but a heterogeneous multi-differentiation potential: superiority of meniscus as a cell source for meniscus repair[J]. BMC Musculoskelet Disord, 2015, 16: 65. DOI: 10.1186/s12891-015-0511-8 |
| [8] | MAKRIS E A, GOMOLL A H, MALIZOS K N, et al. Repair and tissue engineering techniques for articular cartilage[J]. Nat Rev Rheumatol, 2015, 11(1): 21–34. DOI: 10.1038/nrrheum.2014.157 |
| [9] | SZOJKA A, LALH K, ANDREWS S H J, et al. Biomimetic 3D printed scaffolds for meniscus tissue engineering[J]. Bioprinting, 2017, 8: 1–7. DOI: 10.1016/j.bprint.2017.08.001 |
| [10] | ENGLUND M, HAUGEN I K, GUERMAZI A, et al. Evidence that meniscus damage may be a component of osteoarthritis: the Framingham study[J]. Osteoarthr Cartilage, 2016, 24(2): 270–273. |
| [11] | LU L, ZHANG Q W, WOOTTON D M, et al. Mechanical study of polycaprolactone-hydroxyapatite porous scaffolds created by porogen-based solid freeform fabrication method[J]. J Appl Biomater Funct Mater, 2014, 12(3): 145–154. |
| [12] | RONGEN J J, VAN TIENEN T G, VAN BOCHOVE B, et al. Biomaterials in search of a meniscus substitute[J]. Biomaterials, 2014, 35(11): 3527–3540. DOI: 10.1016/j.biomaterials.2014.01.017 |
| [13] | GROGAN S P, CHUNG P H, SOMAN P, et al. Digital micromirror device projection printing system for meniscus tissue engineering[J]. Acta Biomater, 2013, 9(7): 7218–7226. DOI: 10.1016/j.actbio.2013.03.020 |
| [14] | JUNG J P, BHUIYAN D B, OGLE B M. Solid organ fabrication: comparison of decellularization to 3D bioprinting[J]. Biomater Res, 2016, 20: 27. DOI: 10.1186/s40824-016-0074-2 |
| [15] | LI P, FENG X L, JIA X L, et al. Influences of tensile load on in vitro degradation of an electrospun poly(L-lactide-co-glycolide) scaffold[J]. Acta Biomater, 2010, 6(8): 2991–2996. DOI: 10.1016/j.actbio.2010.02.023 |
| [16] | BHARDWAJ N, KUNDU S C. Chondrogenic differentiation of rat MSCs on porous scaffolds of silk fibroin/chitosan blends[J]. Biomaterials, 2012, 33(10): 2848–2857. DOI: 10.1016/j.biomaterials.2011.12.028 |
| [17] | HARRIS G M, PIROLI M E, JABBARZADEH E. Deconstructing the effects of matrix elasticity and geometry in mesenchymal stem cell lineage commitment[J]. Adv Funct Mater, 2014, 24(16): 2396–2403. DOI: 10.1002/adfm.v24.16 |
| [18] | CENGIZ I F, PEREIRA H, PÊGO J M, et al. Segmental and regional quantification of 3D cellular density of human meniscus from osteoarthritic knee[J]. J Tissue Eng Regen Med, 2017, 11(6): 1844–1852. DOI: 10.1002/term.v11.6 |
| [19] | HORÁK M, HANDL M, PODŠKUBKA A, et al. Comparison of the cellular composition of two different chondrocyte-seeded biomaterials and the results of their transplantation in humans[J]. Folia Biol (Praha), 2014, 60(1): 1–9. |
| [20] | ZEIFANG F, OBERLE D, NIERHOFF C, et al. Autologous chondrocyte implantation using the original periosteum-cover technique versus matrix-associated autologous chondrocyte implantation: a randomized clinical trial[J]. Am J Sports Med, 2010, 38(5): 924–933. DOI: 10.1177/0363546509351499 |
| [21] | FISCHER J, DICKHUT A, RICKERT M, et al. Human articular chondrocytes secrete parathyroid hormone-related protein and inhibit hypertrophy of mesenchymal stem cells in coculture during chondrogenesis[J]. Arthritis Rheum, 2014, 62(9): 2696–2706. |



