2. 安徽科技学院动物科学学院, 滁州 233100
2. College of Animal Science, Anhui Science and Technology University, Chuzhou 233100, China
胰岛素抵抗(insulin resistance, IR)是组织或器官对胰岛素信号响应降低的生理状态。肝、骨骼肌和脂肪等组织的IR是2型糖尿病(type 2 diabetes, T2DM)病程的早期阶段和中心环节[1];除此之外,IR也与肥胖、慢性炎症、甲状腺疾病、多囊卵巢综合征等多种疾病的发生密切相关[1-4]。脂肪组织具有脂质储存、产热调节和内分泌等功能,是重要的胰岛素敏感组织。
葡萄糖转运蛋白4(glucose transporter 4, GluT4)是脂肪细胞表面的葡萄糖协助扩散运载体,其典型特征是可以响应胰岛素信号而发挥葡萄糖转运功能。胰岛素信号促使位于细胞质内的GluT4储存囊泡迅速转移至细胞膜,大量GluT4插入细胞膜表面,将葡萄糖转运至脂肪细胞内。脂肪组织特异性敲除GluT4会导致小鼠脂肪组织葡萄糖摄取障碍,并表现出全身的IR[5],而脂肪组织特异性过表达GluT4则降低小鼠空腹血糖、提高葡萄糖耐受[6];2型糖尿病患者脂肪组织GluT4表达减少,囊泡转运受阻[7];说明GluT4对葡萄糖的转运是脂肪响应胰岛素信号的关键环节。
由多潜能性3T3-L1成纤维细胞分化而来的脂肪样细胞是脂肪细胞生物学研究中最常用的体外模型之一[8]。脂质合成和脂滴累积是3T3-L1成纤维细胞分化为脂肪细胞的必要过程,这一过程涉及一系列转录因子、细胞周期蛋白和脂肪合成相关基因的表达调控以及酶活性的改变[9]。生长抑制后的3T3-L1细胞在胰岛素、合成糖皮质激素地塞米松(dexamethasone,Dex)、磷酸二酯酶抑制剂1-甲基-3-异丁基黄嘌呤(1-methyl-3-isobutyl xanthine,IBMX)和过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor-γ, PPARγ)激动剂罗格列酮(rosiglitazone,Rosi)联合处理下可分化为成熟的白色脂肪细胞。目前常见的胰岛素抵抗3T3-L1细胞模型构建方法包括Dex诱导、胰岛素诱导、高糖诱导、脂肪酸诱导等[10-13],但缺少自发胰岛素抵抗的细胞模型。
本研究拟利用CRISPR/Cas9技术对3T3-L1细胞的GluT4基因进行编辑,获得GluT4功能障碍细胞株,分析GluT4功能障碍对前脂肪细胞增殖、分化、脂质合成和胰岛素敏感性的影响,以期建立一种稳定的自发IR的3T3-L1细胞模型,为脂肪营养代谢和IR相关研究提供一种新材料。
1 材料与方法 1.1 材料 1.1.1 细胞株、质粒载体及菌种试验所用3T3-L1细胞株购自上海子实生物科技有限公司;CRISPR/Cas9质粒载体委托苏州金唯智生物科技有限公司构建;DH5α感受态细胞购自北京博迈德基因技术有限公司。
1.1.2 试剂与仪器Amaxa Nucleofector Kit V(Lonza)、DMDM/F12培养基(Lonza);增强型CCK-8试剂盒(碧云天);重组胰岛素(CC101-5MG)、地塞米松(Sigma D1756)、罗格列酮(Sigma R2408)、IBMX(Sigma I5879)、兔抗GluT4多克隆抗体(Abcam ab654)、兔抗GluT1单克隆抗体(Abcam ab115730)、兔抗SCD-1单克隆抗体(CST#2794)、兔抗PPARγ单克隆抗体(CST#2443)、兔抗Tubulin单克隆抗体(CST #15115)、HRP标记山羊抗兔IgG抗体(CST #7074)、HRP标记山羊抗鼠IgG抗体(阳光英锐SBA0002);BCA试剂盒(Thermo #23227)、High-sig ECL发光液(Tanon 180-500)等。Lonza 2B核转仪,7500 Real-Time PCR系统,Tanon5200显影系统等。
1.2 方法 1.2.1 gRNA设计及切割效率验证利用NCBI数据库查询小鼠slc2a4(solute linked carrier family 2, subfamily A4)基因组序列,通过在线网站(http://crispr.mit.edu)设计gRNA,委托苏州金唯智科技有限公司构建相应的CRISPR/Cas9基因编辑载体。将3T3-L1细胞接种至6 cm培养皿,待其融合度为80%时,用0.1%胰酶消化并进行细胞计数,取106个细胞分别电转染3种质粒,操作步骤按照Lonza电转染试剂盒V说明书进行。转染后24 h在培养基中添加终浓度为2 μg·mL-1的嘌呤霉素进行药筛,共维持4 d。收集细胞,裂解后取2 μL做PCR扩增,上游引物:5′-AGCCTCTGATCATCGCAGTG-3′,下游引物:5′-ACCGTAGACTACAGCACCCA-3′。反应条件:95 ℃ 5 min; 95 ℃ 10 s, 58 ℃ 30 s, 72 ℃ 30 s, 34个循环; 72 ℃ 10 min; 12 ℃ 5 min。所得PCR产物用T7EI酶切,根据琼脂糖凝胶电泳结果选择打靶效率最高的sgRNA-质粒载体。
1.2.2 稳定突变细胞株的筛选用效率最高的质粒载体电转染3T3-L1细胞,转染后24 h更换一次含10%FBS、1%双抗的DMEM/F12培养基(完全培养基)。转染后48 h用0.1%胰酶消化,流式细胞术分选含有GFP荧光的单克隆细胞至96孔板。待单克隆群落长至80%融合度,取部分细胞用于基因型检测,余下的细胞继续培养。PCR扩增产物委托天一辉远生物科技有限公司测序,DNAMAN软件分析测序结果。选择经有效切割修复的细胞株再次克隆测序验证序列,确定序列正确后继续传代培养,及时冻存保种。
1.2.3 Western blot及细胞增殖活力检测提取细胞总蛋白,用BCA试剂盒检测蛋白浓度。将蛋白通过SDS-PAGE电泳并转移至PVDF膜,5%脱脂牛奶室温封闭2 h,分别用GluT1、GluT4、SCD-1、PPARγ和Tubulin抗体4 ℃孵育过夜;一抗孵育结束后,用TBST洗膜3次,加入对应的二抗室温孵育45 min,TBST洗膜3次,滴加发光液,用显影系统进行显影。为了确保突变的GluT4蛋白能被抗体检测到,所选抗体识别区域在抗原蛋白的N端。
使用CCK-8法检测细胞活力。将细胞以每孔5 000个(100 μL培养基)接种到96孔板,在接种后的第6、24、72和120小时,每孔加入10 μL增强型CCK-8溶液,37 ℃孵育2 h,用酶标仪检测450 nm吸光度。每种细胞做24孔重复。
1.2.4 成脂诱导分化细胞的诱导分化采用鸡尾酒法。细胞正常传代,待其融合度达到100%后加入诱导分化1液(在完全培养基中添加终浓度5 μg·mL-1 Insulin、1 μmol·L-1 Dex、0.5 mmol·L-1 IBMX和1 μmol·L-1 Rosi),4 d后换为诱导分化2液(在完全培养基中添加终浓度5 μg·mL-1 Insulin),期间每2 d更换一次新鲜培养基,第8天即可完成成脂分化。油红O染色观察脂滴形态。
1.2.5 葡萄糖摄取及三酰甘油释放量检测将细胞接种至6 cm培养皿,在分化第0和8天,更换为5 mL完全培养基(Basal)或5 mL含5 μg·mL-1 insulin的完全培养基(Insulin),以不接种细胞的培养皿作为空白对照组;24 h后取培养基,立即用自动生化仪检测培养基的葡萄糖和三酰甘油浓度,并计算细胞的实际葡萄糖消耗量和三酰甘油释放量,每个处理采用4×3个生物学重复。
1.2.6 GluT4及糖脂代谢相关基因的转录检测按照Bioteke总RNA提取试剂盒的操作说明提取细胞分化第0和8天的RNA。qPCR使用相对定量法,使用18S作为内参基因,用2-△△Ct法计算各目的基因的mRNA相对转录情况,相关引物序列见表 1。为了确保突变的GluT4 mRNA可以被检测到,引物设计在CDS区前端,每个处理采用4×3个生物学重复。
|
|
表 1 qPCR引物序列 Table 1 The sequences of qPCR primers |
试验数据经过t-test统计学分析,P < 0.05时认为具有统计学意义;绘图使用GraphPad Prism 6软件。
2 结果 2.1 gRNA的选择选择gRNA在线设计网站评分最高的3条gRNA序列,分别命名为sgRNA1、sgRNA2和sgRNA3(图 1A)。基因编辑载体质粒结构如图 1B。经测序,载体及插入的sgRNA序列完全正确。用3种重组质粒分别转染3T3-L1细胞,转染sgRNA2-重组质粒的细胞PCR产物经T7E1酶切后,产生符合预期大小的3条带(图 1C),说明细胞基因组靶位点已被有效切割,故选择sgRNA2-重组质粒用于后续试验。
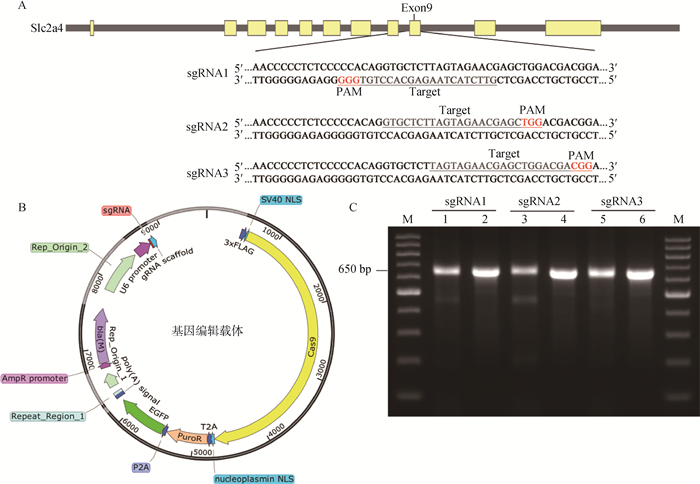
|
A. sgRNA识别序列;B.基因编辑载体结构;C. sgRNA效率验证,泳道1、3、5为转染3种sgRNA质粒载体的细胞基因组PCR扩增产物经T7E1酶切后的鉴定结果;泳道2、4、6为转染3种sgRNA质粒载体的细胞基因组PCR扩增产物未经酶切的鉴定结果;泳道M为相对分子质量标准 A. Target sequences of sgRNA; B. Structure of gene-editing plasmid; C. sgRNA efficiency verification, T7E1 digested PCR product of transfected cell genome (Line 1, 3, 5); Undigested PCR product of transfected cell genome (Line 2, 4, 6); 100 bp-Ⅱ DNA ladder (Line M) 图 1 sgRNA的设计与筛选 Fig. 1 Design and selection of sgRNA |
sgRNA2-重组质粒电转染3T3-L1细胞,流式细胞术分选的单克隆细胞,经PCR扩增测序,获得161个阳性克隆,其中143个克隆发生单条染色体上的移码突变,18个克隆两条染色体的目的基因均发生突变。选取测序峰图无双峰的126#克隆突变纯合子进行TA克隆测序,其在sgRNA2靶位点附近发生13 bp碱基的缺失(图 2A)。该突变会导致GluT4在第361位氨基酸处提前终止翻译。利用Swiss-Model预测突变蛋白结构并与正常GluT4进行比较,结果显示突变的蛋白缺少4个底物结合所必需的α螺旋结构,同时失去了与囊泡运输相关的蛋白C端(图 2B)。

|
A.单克隆细胞株126#与野生型3T3-L1细胞测序峰图,黑色部分为126#缺失的13 bp;B. GluT4蛋白结构预测图,左侧为野生型,右侧为突变型 A. Gene sequences comparison of 126# clone (up) with wild-type 3T3-L1 cell line (down), the missing 13 bp was marked in black; B. GluT4 protein structure prediction of wild-type (left) and 126# clone (right) 图 2 单克隆细胞株126#的GluT4基因测序结果及蛋白结构预测 Fig. 2 GluT4 gene sequencing results and protein structure prediction of monoclonal cell line 126# |
CCK-8法细胞活力检测的统计分析结果显示,126#与对照组细胞在铺板后第6、24、72和120小时的450 nm吸光度值均无显著差异(P>0.05)(图 3A),说明GluT4功能丧失不会影响前脂肪细胞的增殖活力。Western blot结果显示,126#细胞分化前(第0天)的葡萄糖转运、脂分化和合成的蛋白表达情况与对照组无显著差异;分化后(第8天),与对照组相比较,126#细胞的GluT4表达显著降低,GluT1蛋白表达略低,成脂分化关键基因PPARγ表达显著降低,硬脂酰-CoA去饱和酶-1(stearoyl-CoA desaturase 1, SCD-1)不表达(图 3B)。
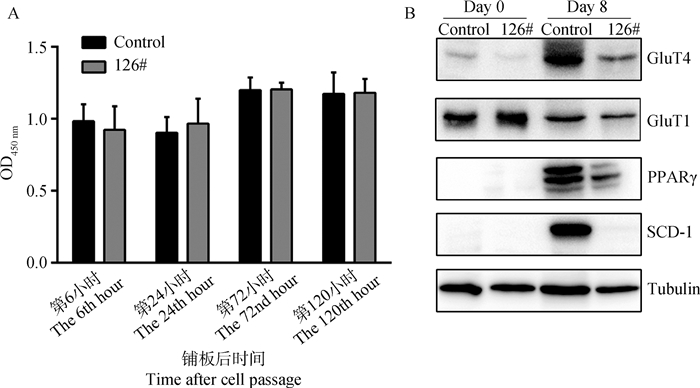
|
A.细胞增殖活力检测结果;B. 126#与对照组细胞Western blot检测结果。Control.野生型3T3-L1细胞(对照组);126#. 126号细胞株;Day 0.成脂诱导第0天;Day 8.成脂诱导第8天。数值为x±sx(n=24) A. Detection of cell proliferation activity by CCK-8; B. Western blot analysis of control cell and 126# clone. Control. Wild-type 3T3-L1 cell; 126#. 126# clone; Day 0. Day 0 during differentiation; Day 8. The 8th day during differentiation. Values are expressed as x±sx (n=24) 图 3 细胞增殖活力及关键蛋白表达 Fig. 3 Activity of cell proliferation and expression of crucial proteins |
分别对126#和对照组细胞进行成脂诱导,在分化第8天检测分化程度。油红O染色结果显示,126#在成脂诱导的第8天,已分化细胞的比例低于对照组,且细胞内脂滴数量和体积小于对照组(图 4A),表明126#的成脂分化能力和脂滴形成能力减弱。

|
A.分化第0和8天油红O染色结果,上方为对照组;下方为126#;B.分化第0和8天的细胞在对照处理(basal)或5 μg·mL-1胰岛素处理下(insulin)24 h的葡萄糖消耗量;C.分化第8天细胞24 h三酰甘油释放量。Control.野生型3T3-L1细胞(对照组);126#. 126#细胞株;Day 0.成脂诱导第0天;Day 8.成脂诱导第8天。数值为x±sx(n=6),*.P < 0.05, **.P < 0.01 A. Oil red O staining of control cell (up) and 126# clone (down) at day 0 or day 8 during differentiation; B. Glucose consumption in 24 hours at day 0 or day 8 during differentiation, cell were control treated (basal) or treated with 5 μg·mL-1 insulin (insulin); C. TG release in 24 hours at day 8 during differentiation. Control. Wild-type 3T3-L1 cell; 126#. 126# clone; Day 0. Day 0 during differentiation; Day 8. The 8th day during differentiation. Values are given as x±sx (n=6), *.P < 0.05, **.P < 0.01 图 4 细胞成脂能力、葡萄糖消耗及三酰甘油释放量 Fig. 4 Adipogenic activity, glucose consumption and TG release |
成脂分化前(第0天),胰岛素处理的对照组和126#细胞24 h葡萄糖消耗量极显著或显著升高(P < 0.01或P < 0.05),两种细胞间差异不显著(P>0.05)。成脂分化后(第8天),未经胰岛素处理的对照组细胞24 h葡萄糖消耗量达到分化前的8倍以上,胰岛素处理使细胞24 h葡萄糖消耗量提高81%;而126#细胞,分化后细胞的葡萄糖消耗量稍低于分化前(P>0.05),胰岛素处理未增加葡萄糖消耗量(P>0.05)(图 4B)。126#和对照组细胞分化到第8天,126#细胞24 h培养基中的三酰甘油释放极显著低于对照组(P < 0.01)(图 4C)。
2.6 GluT4及糖脂代谢相关基因的转录检测为了揭示GluT4失活影响细胞成脂分化的机制,通过qPCR检测了126#、对照组细胞中与糖脂代谢相关基因在mRNA水平的表达情况,结果如图 5所示。与葡萄糖摄取相关的GluT1和GluT4检测结果显示,分化前(第0天)GluT1高转录,GluT4几乎不转录,对照组和126#细胞间同一基因转录差异不显著;分化后(第8天)GluT1转录较分化前显著降低,但126#细胞与对照组相比表现出代偿性上调转录,GluT4转录显著增高,但126#细胞增加量极显著低于对照组细胞,该结果与Western blot检测的蛋白表达量变化趋势一致。与GluT4囊泡运输密切相关的AS160(Akt substrate of 160 kDa)在对照组细胞分化后转录上调5倍,而126#细胞中分化后的转录水平依然很低。
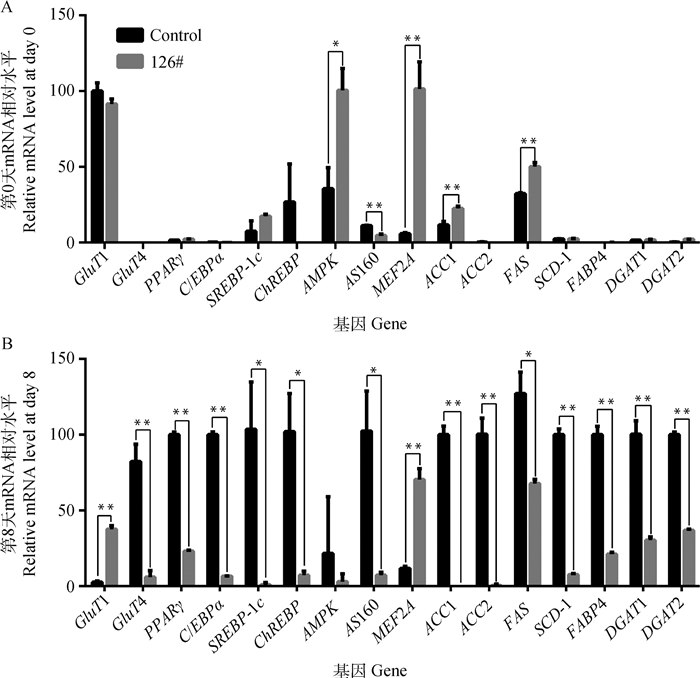
|
A.基因在成脂诱导第0天时的相对mRNA量;B.基因在成脂诱导第8天时的相对mRNA量。Control.野生型3T3-L1细胞(对照组);126#. 126#细胞株。数值为x±sx(n=6),*.P < 0.05, **.P < 0.01 A. Gene transcription at day 0 during differentiation; B. Gene transcription at day 8 during differentiation. Control. Wild-type 3T3-L1 cell; 126#: 126# clone. Values are given as x±sx (n=6), *.P < 0.05, **.P < 0.01 图 5 糖脂代谢关键基因的转录情况 Fig. 5 Expression of crucial genes in glucose metabolism and lipid metabolism |
5′-腺苷-磷酸激活蛋白激酶(5′-adenosine monophosphate-activated protein kinase, AMPK)和肌细胞增强因子2A(myocyte enhancer factor 2A, MEF2A)在能量对GluT4的转录调控过程中起着重要作用。分化前126#细胞的AMPK转录量显著高于对照组(P < 0.05);分化后对照组AMPK表达略有升高,但126#细胞的AMPK转录下调且显著低于对照组(P < 0.05)。对照组细胞分化前后的MEF2A呈低转录,而126#细胞的MEF2A在分化前后mRNA转录量均极显著高于对照组(P < 0.01)。
PPARγ、C/EBPα(CCAAT/enhancer binding protein α)和SREBP-1c(sterol regulatory element binding protein 1c)是脂肪分化过程中的关键因子,同时也是脂肪细胞中负责调控GluT4转录的主要转录因子。PPARγ、C/EBPα和SREBP-1c在对照组细胞分化前低转录,分化后高转录,符合3T3-L1细胞成脂分化过程中的基因转录规律。126#细胞分化前PPARγ、C/EBPα和SREBP-1c呈低转录,与对照组无显著差异(P>0.05);分化后,PPARγ、C/EBPα和SREBP-1c的转录量只有对照组的1/4、1/15和1/20。同样的,作为胰岛素信号下游重要转录因子,参与糖代谢和脂质合成调控的ChREBP(carbohydrate-responsive element-binding protein)在对照组细胞分化后大量转录,而126#细胞分化后的ChREBP转录量仅为对照组的1/14。
与脂肪酸和三酰甘油合成相关的基因乙酰-CoA羧化酶(acetyl-CoA carboxylase, ACC)、脂肪酸合成酶(fatty acid synthase, FAS)、SCD-1、脂肪酸结合蛋白4(fatty acid-binding protein 4, FABP4 /aP2)、二酰甘油酰基转移酶(diaclyceride acyltransferase, DGAT)在对照组细胞中都呈现分化前低表达,分化后高表达的趋势;而这些基因在分化后的126#细胞中仍呈低表达甚至不表达的状态,组间差异显著或极显著(P < 0.05或P < 0.01)。
3 讨论葡萄糖转运蛋白(GluTs)是一类具有12次跨膜螺旋结构域的协助扩散型膜转运蛋白,由Slc2a基因编码,依据其蛋白结构被分为3组,同组GluTs之间具有较高的同源性。早先的研究表明,GluT2对底物的选择取决于第7—8跨膜区的结构,而对底物的亲和力取决于第9—12跨膜区[14]。随后的一系列研究又发现GluT4蛋白的C端结构是囊泡转运所必需的,C端氨基酸的缺失会导致胰岛素刺激下细胞膜表面的GluT4分布大幅减少[15]。2014年,颜宁研究团队[16]解析了人源的葡萄糖转运蛋白GluT1的晶体结构,为GluTs家族其他成员的结构和功能研究提供了重要参考。结合颜宁等科学家对GluTs蛋白结构的研究结果,我们选择在Slc2a4编码区的第9外显子区域(编码GluT4蛋白的第8—10个跨膜区)设计gRNA,利用CRISPR/Cas9技术对3T3-L1细胞系的Slc2a4基因进行编辑,以期获得一种GluT4功能障碍、自发IR的细胞株。
GluT1在胚胎发育早期的卵母细胞和胚胎细胞中都有表达,随着胚胎发育,GluT1的分布出现组织特异性。成体动物GluT1在全身各组织器官都有表达,但大脑和红细胞中的表达量最高[17]。GluT4主要在骨骼肌、脂肪和心肌中表达,其对葡萄糖的转运需要胰岛素信号参与[18]。啮齿类胚胎期,骨骼肌、棕色脂肪和心肌中的主要葡萄糖转运蛋白是GluT1;出生后20~21 d,GluT4逐步取代GluT1,成为这些组织的主要葡萄糖转运体[19]。本研究中,未分化的3T3-L1细胞GluT1高表达,GluT4几乎不表达,此时细胞的葡萄糖摄取依靠GluT1。126#细胞虽然丧失了GluT4的功能,但GluT1不受影响。因此,在未分化的3T3-L1细胞中,GluT4功能的丧失不影响细胞的增殖活力、24 h葡萄糖消耗量和胰岛素响应。3T3-L1细胞经历接触抑制后,在胰岛素等外源激素的联合作用下,负责脂肪形成调控的关键基因PPARγ和C/EBPα逐渐上调表达,激活糖代谢和脂合成相关基因的表达,细胞进入成脂分化的终末阶段[8]。PPARγ、C/EBPα和SREBP-1c都可以与GluT4的基本启动子区结合,激活脂肪中GluT4的转录[20]。本研究中,PPARγ、C/EBPα和SREBP-1c在分化后期的表达量始终低于对照组,是造成GluT4表达量下调的主要原因之一。另外,GluT4失活和低表达引起了分化后细胞的GluT1代偿性表达,但其葡萄糖摄入量极显著低于对照组。这说明GluT1无法代替GluT4发挥作用,GluT4的表达和功能障碍会引起3T3-L1细胞出现严重的IR现象。
ChREBP是一个可以被碳水化合物摄入激活的转录因子。ChREBP可以调控糖酵解和磷酸戊糖途径,同时也是脂肪酸从头合成过程中的关键调控因子[21]。脂肪组织特异性过表达GluT4的小鼠(AG4OX)具有更高的糖耐量和胰岛素敏感性,ChREBP表达上调;当AG4OX小鼠的ChREBP被敲除后,脂肪的脂肪酸从头合成被减弱,小鼠糖耐量下降,说明ChREBP活性的降低与脂肪组织的IR相关[22]。本研究中,GluT4的功能障碍同样引起了ChREBP表达的下调,细胞出现自发IR;ChREBP和SREBP-1c转录的下调导致脂质合成相关酶的表达下调,继而抑制了细胞的脂肪酸和三酰甘油合成(图 6)。

|
图 6 3T3-L1细胞成脂分化过程中的关键通路 Fig. 6 Critical pathways in 3T3-L1 differentiation |
AMPK是细胞能量代谢调控中的关键激酶,被升高的AMP/ATP激活并发挥磷酸化作用。AMPK可以激活生成ATP的生物过程,如脂肪酸氧化、糖酵解和葡萄糖摄取;同时抑制消耗ATP的过程,如脂肪酸从头合成。有报道称,脂联素通过AMPK途径激活肌细胞的葡萄糖摄取和脂肪酸氧化,从而提高骨骼肌的胰岛素敏感性[23]。AMPK可以通过MEF2A激活肌细胞的GluT4转录(图 6)。有趣的是,在自发IR细胞分化前,虽然细胞可以通过GluT1摄取葡萄糖,但细胞的AMPK mRNA水平表达高于对照组;相应的,该细胞的MEF2A表达量也高于对照组,但是GluT4表达量并没有因此升高。骨骼肌和脂肪组织的GluT4转录调控方式存在差异[20],由此我们推测,脂肪细胞中GluT4的转录更多地受PPARγ、C/EBPα和SREBP-1c的调控,当这些转录因子表达不足时,MEF2A的高表达无法引起GluT4表达量的升高。AMPK也可以通过AS160促进GluT4的囊泡转运。AS160是GluT4囊泡转运过程中的关键调控因子。胰岛素信号通路通过PI3K-AKT途径将AS160磷酸化,解除其对下游Rab-GTPase的抑制,从而促进GluT4插入细胞膜中发挥葡萄糖转运功能[24]。AS160敲除鼠脂肪和骨骼肌的GluT4表达、囊泡转位、葡萄糖摄取和糖代谢出现不同程度的异常,说明AS160在能量代谢的过程中发挥不可或缺的作用[25]。自发IR细胞的AS160出现表达下调,也是导致糖代谢异常的因素之一。
综上,基因编辑改变了GluT4的蛋白结构,使其功能丧失;GluT4功能丧失的3T3-L1细胞在成脂诱导分化前,由于GluT1正常发挥葡萄糖转运功能,其增殖分化能力和葡萄糖摄取能力与对照组细胞无显著差异。在成脂诱导分化的过程中,GluT1无法完全代替GluT4发挥作用,细胞出现严重的IR,进而通过AMPK和ChREBP调控成脂分化相关基因的表达,引起细胞脂质合成障碍。
4 结论3T3-L1是研究脂肪发育的经典模式细胞系,本研究利用CRISPR/Cas9技术对3T3-L1细胞的GluT4进行基因编辑,获得了一株稳定的自发IR的3T3-L1细胞模型。其优点在于:首先,相对于药物诱导的IR模型,自发IR脂肪细胞模型的表型稳定,在经过多次传代培养后,细胞的IR表型具有很高的可重复性。其次,自发IR的脂肪细胞模型的培养条件与对照组细胞完全一致,这更利于IR相关药物研发、机制探索等研究工作的开展。
| [1] | PARK S E, PARK C Y, SWEENEY G. Biomarkers of insulin sensitivity and insulin resistance: past, present and future[J]. Crit Rev Clin Lab Sci, 2015, 52(4): 180–190. DOI: 10.3109/10408363.2015.1023429 |
| [2] | MATULEWICZ N, KARCZEWSKA-KUPCZEWSKA M. Insulin resistance and chronic inflammation[J]. Postepy Hig Med Dosw, 2016, 70: 1245–1258. |
| [3] | DIAMANTI-KANDARAKIS E, SPRITZER P M, SIR-PETERMANN T, et al. Insulin resistance and polycystic ovary syndrome through life[J]. Curr Pharm Des, 2012, 18(34): 5569–5576. DOI: 10.2174/138161212803307590 |
| [4] | GIERACH M, GIERACH J, JUNIK R. Insulin resistance and thyroid disorders[J]. Endokrynol Pol, 2014, 65(1): 70–76. DOI: 10.5603/EP.2014.0010 |
| [5] | ABEL E D, PERONI O D, KIM J K, et al. Adipose-selective targeting of the GLUT4 gene impairs insulin action in muscle and liver[J]. Nature, 2001, 409(6821): 729–733. DOI: 10.1038/35055575 |
| [6] | CARVALHO E, KOTANI K, PERONI O D, et al. Adipose-specific overexpression of GluT4 reverses insulin resistance and diabetes in mice lacking GluT4 selectively in muscle[J]. Am J Physiol Endocrinol Metab, 2005, 289(4): E551–E561. DOI: 10.1152/ajpendo.00116.2005 |
| [7] | GUSTAFSON B, HEDJAZIFAR S, GOGG S, et al. Insulin resistance and impaired adipogenesis[J]. Trends Endocrinol Metab, 2015, 26(4): 193–200. DOI: 10.1016/j.tem.2015.01.006 |
| [8] | MORRISON S, MCGEE S L. 3T3-L1 adipocytes display phenotypic characteristics of multiple adipocyte lineages[J]. Adipocyte, 2015, 4(4): 295–302. DOI: 10.1080/21623945.2015.1040612 |
| [9] | TUNG Y C, HSIEH P H, PAN M H, et al. Cellular models for the evaluation of the antiobesity effect of selected phytochemicals from food and herbs[J]. J Food Drug Anal, 2017, 25(1): 100–110. DOI: 10.1016/j.jfda.2016.10.018 |
| [10] | SAKODA H, OGIHARA T, ANAI M, et al. Dexamethasone-induced insulin resistance in 3T3-L1 adipocytes is due to inhibition of glucose transport rather than insulin signal transduction[J]. Diabetes, 2000, 49(10): 1700–1708. DOI: 10.2337/diabetes.49.10.1700 |
| [11] |
雷婷, 涂珺. 3T3-L1脂肪细胞胰岛素抵抗模型研究现状[J]. 江西中医药大学学报, 2018, 30(3): 106–109.
LEI T, TU J. Research status on the insulin resistance model of 3T3-L1 adipocytes[J]. Journal of Jiangxi University of TCM, 2018, 30(3): 106–109. (in Chinese) |
| [12] |
刘晓华, 江湖, 李海星, 等. 胰岛素诱导3T3-L1脂肪细胞胰岛素抵抗模型的建立[J]. 食品科学, 2012, 33(19): 249–253.
LIU X H, JIANG H, LI H X, et al. Establishment of insulin-resistant 3T3-L1 adipocyte cell model induced by insulin[J]. Food Science, 2012, 33(19): 249–253. (in Chinese) |
| [13] | YI P, LU F E, XU L J, et al. Berberine reverses free-fatty-acid-induced insulin resistance in 3T3-L1 adipocytes through targeting IKKβ[J]. World J Gastroenterol, 2008, 14(6): 876–883. DOI: 10.3748/wjg.14.876 |
| [14] | WU L, FRITZ J D, POWERS A C. Different functional domains of GluT2 glucose transporter are required for glucose affinity and substrate specificity[J]. Endocrinology, 1998, 139(10): 4205–4212. DOI: 10.1210/endo.139.10.6245 |
| [15] | AL-HASANI H, KUNAMNENI R K, DAWSON K, et al. Roles of the N- and C-termini of GluT4 in endocytosis[J]. J Cell Sci, 2002, 115(1): 131–140. |
| [16] | DENG D, XU C, SUN P C, et al. Crystal structure of the human glucose transporter GluT1[J]. Nature, 2014, 510(7503): 121–125. DOI: 10.1038/nature13306 |
| [17] | LONG W T, CHEESEMAN C I. Structure of, and functional insight into the GluT family of membrane transporters[J]. Cell Health Cytoskeleton, 2015, 7: 167–183. |
| [18] | HUANG S H, CZECH M P. The GluT4 glucose transporter[J]. Cell Metab, 2007, 5(4): 237–252. DOI: 10.1016/j.cmet.2007.03.006 |
| [19] | SANTALUCÍA T, CAMPS M, CASTELLÓ A, et al. Developmental regulation of GluT-1 (erythroid/Hep G2) and GluT-4 (muscle/fat) glucose transporter expression in rat heart, skeletal muscle, and brown adipose tissue[J]. Endocrinology, 1992, 130(2): 837–846. |
| [20] |
张楠, 赵颖. 葡萄糖转运蛋白GluT4表达的调节机制[J]. 中国生物化学与分子生物学报, 2016, 32(3): 237–244.
ZHANG N, ZHAO Y. Mechanisms of glucose transporter GluT4 expression regulation[J]. Chinese Journal of Biochemistry and Molecular Biology, 2016, 32(3): 237–244. (in Chinese) |
| [21] | VIJAYAKUMAR A, ARYAL P, WEN J, et al. Absence of carbohydrate response element binding protein in adipocytes causes systemic insulin resistance and impairs glucose transport[J]. Cell Rep, 2017, 21(4): 1021–1035. DOI: 10.1016/j.celrep.2017.09.091 |
| [22] | HERMAN M A, PERONI O D, VILLORIA J, et al. A novel ChREBP isoform in adipose tissue regulates systemic glucose metabolism[J]. Nature, 2012, 484(7394): 333–338. DOI: 10.1038/nature10986 |
| [23] | YAMAUCHI T, KAMON J, MINOKOSHI Y, et al. Adiponectin stimulates glucose utilization and fatty-acid oxidation by activating AMP-activated protein kinase[J]. Nat Med, 2002, 8(11): 1288–1295. DOI: 10.1038/nm788 |
| [24] | JALDIN-FINCATI J R, PAVAROTTI M, FRENDO-CUMBO S, et al. Update on GluT4 vesicle traffic:a cornerstone of insulin action[J]. Trends Endocrinol Metab, 2017, 28(8): 597–611. DOI: 10.1016/j.tem.2017.05.002 |
| [25] | HARGETT S R, WALKER N N, KELLER S R. Rab GAPs AS160 and Tbc1d1 play nonredundant roles in the regulation of glucose and energy homeostasis in mice[J]. Am J Physiol Endocrinol Metab, 2016, 310(4): E276–E288. DOI: 10.1152/ajpendo.00342.2015 |



