肾素-血管紧张素系统(renin-angiotensin system, RAS)是具有内分泌特性的肽能系统,由两条代谢通路组成,分别为经典的ACE-Ang Ⅱ-AT1R和新的ACE 2-Ang 1-7-MasR。两条通路相互拮抗共同维持着RAS的平衡[1]。血管紧张素Ⅱ (Ang Ⅱ)是经典通路中的关键酶血管紧张素转化酶(ACE)的催化产物,作为途径核心,生理剂量的Ang Ⅱ可通过与其靶细胞膜上的受体结合发挥多种效应。过量的Ang Ⅱ可导致血压升高,血管和组织纤维化、氧化应激以及组织损伤等[2-3]。2000年,随着血管紧张素转化酶2(angiotensin-converting enzyme 2,ACE 2)的发现,形成了RAS中ACE 2-Ang 1-7-MasR新的通路。新通路中ACE 2可以降解Ang Ⅱ产生血管紧张素1~7(Ang 1-7),后者通过结合Mas受体(MasR)拮抗Ang Ⅱ,发挥抗炎抗损伤的作用[3-4]。
既往的研究已经证实,除了循环系统存在RAS外,局部组织也存在着RAS。并且局部RAS介导或参与了局部组织的促炎和抗炎的调节作用[5]。研究发现在多种组织炎性损伤时,局部RAS处于激活或过度激活状态,而作为RAS最重要的活性成分,高水平Ang Ⅱ可激活炎症因子促进炎症反应, 是促进炎症反应的主要介质[6]。ACE 2可以通过降解Ang Ⅱ,抑制其对炎症反应的上调效应,并且生成Ang 1~7,激活MasR起到拮抗Ang Ⅱ的作用,从而实现对炎症反应下调效应[7-8]。王鲲等[9]用脂多糖(LPS)诱导小鼠乳腺及乳腺上皮细胞炎症损伤,发现小鼠血液和细胞上清中Ang Ⅱ的浓度均有升高,推测Ang Ⅱ与在其他组织中一样,也是乳腺炎症损伤中起促炎作用的主要介质。提示:在牛乳腺组织发生炎症损伤时,过量产生Ang Ⅱ及ACE 2表达下调可能仍然是关键的调控因子,但二者之间有怎样的作用还不清楚。
肿瘤坏死因子-α(TNF-α)[10]、白细胞介素(interleukin,IL) -6[11]、IL-8[12]、IL-10[13]均已被证实是参与细胞炎性损伤的细胞因子。因此,本研究拟以牛乳腺上皮细胞为研究对象,以Ang Ⅱ诱导细胞发生炎性损伤,通过检测不同浓度Ang Ⅱ刺激对MAC-T炎性因子释放的影响,并通过比较细胞中降解和产生Ang Ⅱ的主要酶ACE 2和ACE的表达变化,分析ACE 2与各因子之间的相关性。探讨ACE 2与Ang Ⅱ致细胞损伤的相互关系,为进一步研究奠定基础。
1 材料与方法 1.1 细胞来源牛乳腺上皮细胞系(MAC-T):美国伊利诺伊大学Loor教授馈赠,本实验室冻存。
1.2 主要试剂血管紧张素Ⅱ(Ang Ⅱ)购于南京建成生物科技有限公司;牛IL-6、IL-8、IL-10、TNF-α ELISA试剂盒购于南京奥青生物技术有限公司;BCA蛋白定量试剂盒购于上海碧云天生物技术公司;ACE 2、ACE抗体均购自英国Abcam公司;磷酸甘油醛脱氢酶(GAPDH)抗体购于南京生兴生物有限公司;山羊抗兔IgG购于上海生工生物工程有限公司;聚偏二氟乙烯(PVDF)膜购于Millipore公司;超敏ECL化学发光液购于Tanon公司等。
1.3 Ang Ⅱ体外诱导MAC-T细胞炎症损伤 1.3.1 细胞处理与收集首先进行预试验,用终浓度分别为0、10-8、10-7、10-6、10-5 mol·L-1的Ang Ⅱ处理牛MAC-T细胞24 h后,通过检测细胞上清中应激损伤的相关指标,包括羟基自由基(·OH)、一氧化氮合酶(NOS)、超氧化物歧化酶(SOD);结果显示终浓度为10-7mol·L-1时,各指标产生显著或极显著变化;而在10-6、10-5 mol·L-1时各指标均产生了极显著的变化。因此,本试验筛选出10-8 (低浓度)和10-6 mol·L-1 (高浓度)两个浓度用于后续的试验。
将细胞按照合适密度接种于6孔板中,待细胞融合至80%时,弃培养液,加入不完全培养液(不含胎牛血清)饥饿处理12 h;加入Ang Ⅱ终浓度分别为0、10-8、10-6 mol·L-1的不完全培养液,在37 ℃、5% CO2条件下培养6 h,收集上清和细胞。收集的细胞在冰浴环境下破碎,4 ℃离心,取细胞上清作为待测样品。用BCA法测定样品的蛋白浓度。每个处理设3个平行孔,收集细胞上清和细胞待测样品进行相关指标检测。
1.3.2 细胞上清中促炎因子TNF-α、IL-6、IL-8和抗炎因子IL-10含量的检测ELISA方法测定,操作步骤按试剂盒说明书进行,以空白孔调零,450 nm波长依序测量各孔的吸光度(OD值)。结果以标准物的浓度为横坐标,OD值为纵坐标,绘出标准曲线,根据样品的OD值由标准曲线查出相应的浓度;或用标准物的浓度与OD值计算出标准曲线的直线回归方程式,将样品的OD值代入方程式,计算出样品浓度,即为样品的实际浓度(单位:ng·L-1)。
1.3.3 Ang Ⅱ处理牛MAC-T细胞中ACE 2/ACE蛋白表达变化Western blot检测各处理细胞中ACE 2、ACE的表达变化,参照王鲲等[9]的方法进行操作。利用Image J软件分析蛋白条带的灰度,均以GAPDH作为内参,目的条带与内参相比得到相对表达量。
1.4 添加ACE 2活性蛋白对Ang Ⅱ诱导损伤的保护作用 1.4.1 牛乳腺上皮细胞培养及分组将细胞按照合适密度接种于6孔板中,待细胞融合至80%时,弃去培养液,PBS洗涤细胞两遍,加入不完全培养液饥饿处理12 h后,将细胞分为:1)空白对照组:加入同体积的不完全培养液;2)Ang Ⅱ高浓度组:终浓度为10-6 mol·L-1Ang Ⅱ;3)Ang Ⅱ低浓度组:终浓度为10-8 mol·L-1 Ang Ⅱ;4)处理组Ⅰ:终浓度为100 ng·mL-1的ACE 2;5)处理组Ⅱ:终浓度为100 ng·mL-1 ACE 2以及终浓度为10-8 mol·L-1 Ang Ⅱ共同处理;6)处理组Ⅲ:终浓度为100 ng·mL-1 ACE 2以及终浓度为10-6 mol·L-1 Ang Ⅱ共同处理。在处理组Ⅱ和处理组Ⅲ中,均为2 h后加入Ang Ⅱ。
每组处理设置3个平行孔,37 ℃、5% CO2培养箱中处理6 h后,收集各孔细胞和细胞上清用于后续ELISA检测TNF-α、IL-6、IL-8、IL-10等的含量。提取细胞总蛋白,BCA蛋白浓度测定试剂盒测定并计算出蛋白浓度。
1.4.2 细胞上清中TNF-α、IL-6、IL-8和IL-10的含量测定用ELISA方法测定,方法同“1.3.2”。
1.5 数据统计分析获得的数据通过SPSS 16.0统计软件进行统计分析,采用单因子方差分析(One way ANOVA,LSD)进行差异显著性检验。所有数值以平均值±标准误(x±sx)来表示。
2 结果 2.1 Ang Ⅱ体外诱导对牛MAC-T细胞抗炎和促炎作用的影响选用终浓度分别为0、10-8、10-6 mol·L-1的Ang Ⅱ作用于牛MAC-T细胞6 h后,检测其细胞上清中炎性细胞因子的含量。结果见表 1。
|
|
表 1 不同浓度Ang Ⅱ处理牛MAC-T细胞各炎性因子含量(x±sx,n=3) Table 1 Determination of inflammatory factors in bovine MAC-T cells treated with different concentrations of Ang Ⅱ (x±sx, n=3) |
由表 1看出,Ang Ⅱ刺激6 h后可以导致牛MAC-T细胞上清中TNF-α含量升高,高浓度(Ang Ⅱ高浓度组,10-6mol·L-1)时,TNF-α含量极显著升高(P < 0.01),低浓度(Ang Ⅱ低浓度组,10-8 mol·L-1)时,升高但差异不显著;同时细胞上清中IL-8含量升高,与对照组相比,低浓度处理组IL-8含量显著升高(P < 0.05),高浓度处理组差异极显著(P < 0.01);此外细胞上清中IL-6含量升高,在高浓度刺激下,IL-6含量极显著升高(P < 0.01),而低浓度处理组升高但差异不显著;而细胞上清中抗炎因子IL-10的含量下降,与对照组相比,低浓度处理组差异不显著,高浓度处理组差异显著(P < 0.05)。
2.2 不同浓度Ang Ⅱ诱导细胞中ACE 2、ACE的表达变化Western blot结果(图 1)显示,在10-8 mol·L-1 Ang Ⅱ处理组,ACE 2蛋白表达略低于未处理组(0.91±0.06 vs 1.07±0.21,P>0.05);在10-6 mol·L-1 Ang Ⅱ处理组,ACE 2蛋白表达显著下调(0.74±0.06 vs 1.07±0.21,P < 0.05)。而在10-8 mol·L-1 Ang Ⅱ处理组,ACE蛋白表达出现显著升高(0.61±0.06 vs 0.42±0.03,P < 0.05);在10-6 mol·L-1 Ang Ⅱ处理组,ACE蛋白表达极显著上升(0.80±0.03 vs 0.42±0.03,P < 0.01)。此外ACE 2与ACE的比值显示,Ang Ⅱ作用于MAC-T细胞可以引起ACE 2/ACE比值极显著下调。

|
与对照组(0 mol·L-1)比较,*. P < 0.05; **. P < 0.01 Compared with control group (0 mol·L-1), *. P < 0.05; **. P < 0.01 图 1 MAC-T细胞中ACE 2、ACE蛋白表达变化 Fig. 1 The ACE 2 protein expression changes in the MAC-T cells |
对不同浓度的Ang Ⅱ与ACE 2蛋白表达之间进行相关性分析,结果如图 2,由图看出:ACE 2的蛋白表达水平与Ang Ⅱ浓度之间呈负相关性,相关性系数为-0.878 8。
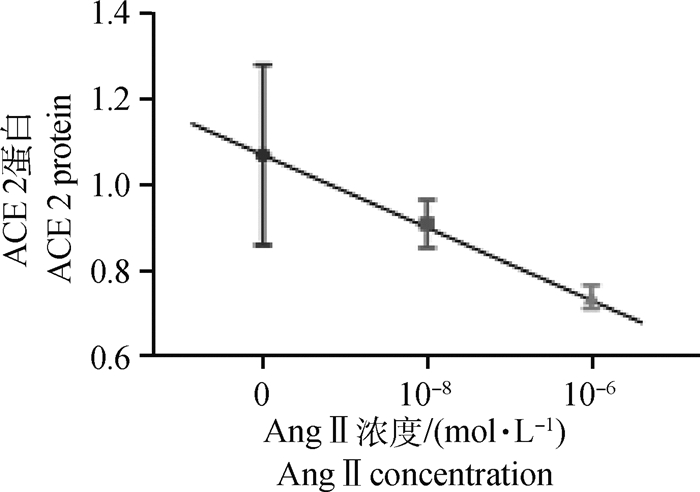
|
图 2 MAC-T中Ang Ⅱ浓度与ACE 2蛋白表达的线性关系 Fig. 2 Linear relationship between Ang Ⅱ concentration and ACE 2 protein expression in MAC-T |
各处理组炎症损伤指标TNF-α、IL-8、IL-6和IL-10测定结果如图 3所示。
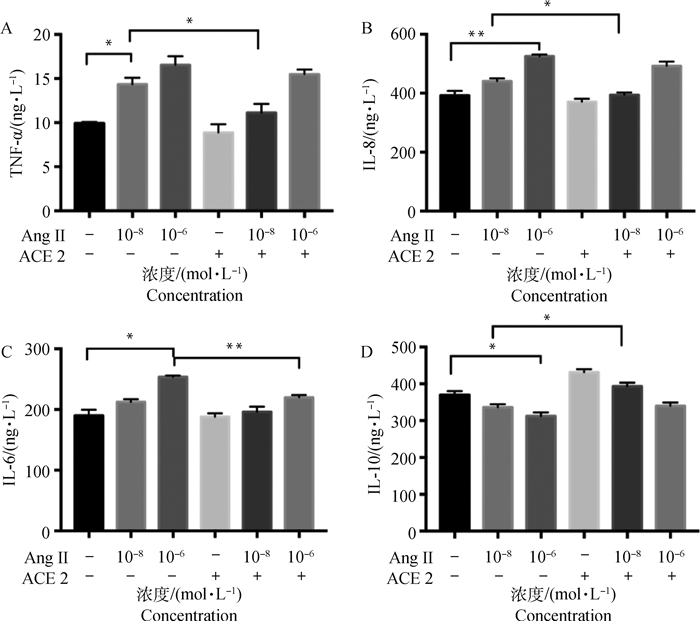
|
*. P < 0.05; **. P < 0.01. n=3 图 3 细胞上清中TNF-α、IL-8、IL-6和IL-10含量 Fig. 3 The content of TNF-α, IL-8, IL-6 and IL-10 in cell supernatant |
如图 3A所示,终浓度为10-8 mol·L-1 Ang Ⅱ处理组与无Ang Ⅱ处理组相比,TNF-α浓度显著升高(P < 0.05);ACE 2活性蛋白与Ang Ⅱ共处理,可以显著降低Ang Ⅱ诱导的TNF-α的升高(P < 0.05)。
2.3.2 IL-8的测定如图 3B所示,结果与TNF-α一致,ACE 2外源活性蛋白的添加可以显著降低10-8 mol·L-1 Ang Ⅱ诱导的IL-8的增加(P < 0.05)。
2.3.3 IL-6的测定如图 3C所示,在Ang Ⅱ终浓度为10-6 mol·L-1时可以诱导IL-6出现显著增高。外源性活性蛋白ACE 2的添加可以极显著降低MAC-T细胞IL-6的分泌(P < 0.01)。
2.3.4 IL-10的测定如图 3D所示,Ang Ⅱ在终浓度为10-6 mol·L-1时,可以显著刺激IL-10分泌的降低(P < 0.05);添加ACE 2活性蛋白后,细胞上清中IL-10的含量出现上升,其中10-8 mol·L-1 Ang Ⅱ处理组与10-8mol·L-1 Ang Ⅱ+ACE 2共处理组相比差异显著(P < 0.05)。
2.3.5 结果分析根据以上结果,在Ang Ⅱ刺激MAC-T细胞6 h后,检测到细胞上清中的促炎因子TNF-α、IL-6和IL-8均出现了显著升高,且与Ang Ⅱ浓度呈正相关;而抗炎因子IL-10浓度显著下降,与Ang Ⅱ浓度呈负相关。Ang Ⅱ可引起促炎因子释放,抑制抗炎因子的释放或分泌。不同浓度Ang Ⅱ处理细胞后,ACE 2蛋白表达均有降低,10-6 mol·L-1 Ang Ⅱ处理后显著降低(P < 0.05),而ACE蛋白表达则相反;ACE 2与Ang Ⅱ浓度之间存在显著负相关。添加外源性ACE 2活性蛋白后,结果显示细胞上清中的TNF-α、IL-6和IL-8浓度均有一定程度的下降,IL-10浓度升高,即ACE 2可以抑制Ang Ⅱ诱导的促炎因子的释放,诱导IL-10的分泌,即抑制炎性反应。
3 讨论本实验室前期研究发现,当奶牛乳腺发生炎症时,乳腺Ang Ⅱ水平升高[14],提示Ang Ⅱ的过量产生可能与乳腺炎的发生有着一定的联系,但详细机制尚不清楚。IL-6是在损伤后协调机体防御反应的一种重要的细胞因子,是炎症反应的重要介质。IL-6和IL-8多在细胞受到TNF-α的刺激后产生[15-16]。Boudjellab等[17]使用MAC-T细胞的体外研究表明,当用不同浓度梯度的LPS刺激时,MAC-T表达IL-8 mRNA并分泌IL-8蛋白,且这种反应呈时间和剂量依赖性,当LPS刺激1 h时,可以检测到IL-8 mRNA水平表达;当使用20 μg·mL-1的LPS刺激48 h时,IL-8表达量达到最高,提示MAC-T在乳腺炎症早期可以是IL-8的来源,IL-8在抵抗细菌感染中起到重要作用。Lee和Zhao[18]通过共同培养MAC-T和牛主动脉内皮细胞,发现rHIL-8(recombinant interleukin-8)可通过由诱导嗜中性粒细胞的迁移,且rHIL-8以剂量依赖性方式刺激牛嗜中性粒细胞的迁移。
本试验中笔者检测了细胞上清中TNF-α和IL-6以及IL-8和IL-10水平,结果Ang Ⅱ刺激MAC-T细胞6 h后,细胞上清中TNF-α和IL-6以及IL-8的升高,IL-10的下降,证实Ang Ⅱ在浓度为10-8(低浓度)和10-6(高浓度)mol·L-1时作用MAC-T细胞6 h可以导致细胞炎性因子的释放或细胞炎性反应。这个结果也与王鲲等[9]在大鼠乳腺上皮细胞上的研究结果一致。
已经证实,Ang Ⅱ是RAS经典通路中的重要活性物质,生理水平的Ang Ⅱ在调节血压和维持机体水电解质平衡等方面发挥着重要作用,但过量的Ang Ⅱ可导致血压升高,血管和心脏纤维化,氧化应激,进而促进组织损伤的发生发展[19-20]。已证实ACE 2是RAS系统的负向调控因子[21]。其在体内、外均能够有效水解Ang Ⅱ产生Ang 1~7,后者与MasR受体结合,抑制Ang Ⅱ的作用,从而实现对组织的保护作用。还通过诱导内皮细胞释放NO,减轻氧化应激,实现对组织的保护作用[22]。
近些年ACE 2-Ang 1-7-Mas途径在抗炎症的作用得到了广泛的关注,由于外界作用导致机体积累形成高水平的Ang Ⅱ成为激发炎症反应的主要因素之一。Imai等[23]指出SARS冠状病毒感染可以导致ACE 2表达的下调。ACE 2下调引发RAS失衡,使Ang Ⅱ累积,最终造成肺水肿和肺损伤。并提出肺局部RAS参与机体的炎症反应,Ang Ⅱ可激发炎症反应,诱导肺组织损伤。炎症反应早期,即有Ang Ⅱ表达的升高,Ang Ⅱ受体表达上调,Ang Ⅱ可诱导单核细胞活化,促进血管平滑肌细胞和巨噬细胞分泌IL-1、IL-6、IL-8、TNF-α及单核细胞趋化蛋白(MCP-1)等细胞因子的释放[24-25]。本研究中直接用Ang Ⅱ诱导细胞损伤,观察了ACE 2和ACE蛋白表达的变化,发现在所选浓度Ang Ⅱ的诱导下,ACE 2和ACE的蛋白表达发生了相反的变化,ACE 2蛋白表达下降,ACE蛋白表达升高,且ACE 2蛋白表达与Ang Ⅱ浓度呈负相关。因此提示:ACE 2/ACE轴的失衡是Ang Ⅱ诱导损伤的主要原因。
ACE 2在心[26]、肾[27]、肺[28]、肠[29]、胰腺[30]等组织器官中的抗损伤作用主要是通过降解Ang Ⅱ,介导Ang 1-7/MasR通路实现的。Ang Ⅱ与细胞炎症反应和氧化应激等存在明显的正相关性,它本身能够引起细胞炎症反应,也能被炎症反应上调。高水平的Ang Ⅱ对Ang 1-7是ACE 2的产物也是ACE 2-Ang 1-7-MasR轴的重要环节,能够直接参与调节细胞炎症损伤。本研究中发现外源ACE 2活性蛋白加入,对Ang Ⅱ诱导的牛乳腺上皮细胞炎性损伤有一定的抵抗作用,与He等[31]在间充质干细胞上的研究一致。
4 结论本研究表明Ang Ⅱ诱导细胞炎性损伤的主要原因是使ACE 2/ACE轴失衡。高水平Ang Ⅱ可激活炎症因子促进炎症反应,是促进炎症反应的主要介质,而外源ACE 2活性蛋白的加入,可以抑制其对炎症反应的上调效应,对细胞炎性损伤有一定的缓解作用。
| [1] | RIBEIRO-OLIVEIRA A Jr, NOGUEIRA A I, PEREIRA R M, et al. The renin-angiotensin system and diabetes:An update[J]. Vasc Health Risk Manag, 2008, 4(4): 787–803. |
| [2] | RODRIGUES P T R, ROCHA N P, MIRANDA A S, et al. The anti-inflammatory potential of ACE2/angiotensin-(1-7)/mas receptor axis:evidence from basic and clinical research[J]. Curr Drug Targets, 2017, 18(11): 1301–1313. |
| [3] | HAN J B, ZOU C P, MEI L Q, et al. MD2 mediates angiotensin Ⅱ-induced cardiac inflammation and remodeling via directly binding to Ang Ⅱ and activating TLR4/NF-κB signaling pathway[J]. Basic Res Cardiol, 2017, 112(1): 9. DOI: 10.1007/s00395-016-0599-5 |
| [4] |
丁文飞, 李雪, 吴蔚桦, 等. 阿利吉仑抑制糖尿病肾病大鼠血管紧张素Ⅱ/血管紧张素1-7(Ang Ⅱ/Ang1-7)信号途径[J]. 细胞与分子免疫学杂志, 2018, 34(10): 891–895.
DING W F, LI X, WU W H, et al. Aliskiren inhibits angiotensin Ⅱ/angiotensin 1-7(Ang Ⅱ/Ang1-7) signal pathway in rats with diabetic nephropathy[J]. Chinese Journal of Cellular and Molecular Immunology, 2018, 34(10): 891–895. (in Chinese) |
| [5] | ASGHAR W, AGHAZADEH-HABASHI A, JAMALI F. Cardiovascular effect of inflammation and nonsteroidal anti-inflammatory drugs on renin-angiotensin system in experimental arthritis[J]. Inflammopharmacology, 2017, 25(5): 543–553. DOI: 10.1007/s10787-017-0344-1 |
| [6] | STANKE-LABESQUE F, DEVILLIER P, BEDOUCH P, et al. Angiotensin Ⅱ-induced contractions in human internal mammary artery:effects of cyclooxygenase and lipoxygenase inhibition[J]. Cardiovasc Res, 2000, 47(2): 376–383. DOI: 10.1016/S0008-6363(00)00112-7 |
| [7] |
黄丽, 应涛, 何文明. 不同肾素血管紧张素系统阻滞剂对ACE2-Ang-(1-7)及炎症因子的影响[J]. 心电与循环, 2017, 36(2): 77–80.
HUANG L, YING T, HE W M. The effects of different renin-angiotensin system inhibitors on ACE2-Angiotensin(1-7) and inflammatory factors[J]. Journal of Electrocardiology and Circulation, 2017, 36(2): 77–80. (in Chinese) |
| [8] | ZHANG M L, GAO Y H, ZHAO W G, et al. ACE-2/ANG1-7 ameliorates ER stress-induced apoptosis in seawater aspiration-induced acute lung injury[J]. Am J Physiol-Lung Cell Mol Physiol, 2018, 315(6): L1015–L1027. DOI: 10.1152/ajplung.00163.2018 |
| [9] | WANG K, LIU X Q, HANG X, et al. The correlation between inflammatory injury induced by LPS and RAS in EpH4-Ev cells[J]. Int Immunopharmacol, 2017, 46: 23–30. DOI: 10.1016/j.intimp.2017.02.016 |
| [10] | MEHAFFEY E, MAJID D S A. Tumor necrosis factor-α, kidney function, and hypertension[J]. Am J Physiol Renal Physiol, 2017, 313(4): F1005–F1008. DOI: 10.1152/ajprenal.00535.2016 |
| [11] | PETERSEN A M, PEDERSEN B K. The role of IL-6 in mediating the anti-inflammatory effects of exercise[J]. J Physiol Pharmacol, 2006, 57(Suppl 10): 43–51. |
| [12] | REDONDO E, GÁZQUEZ A, VADILLO S, et al. Induction of interleukin-8 and interleukin-12 in neonatal ovine lung following experimental inoculation of bovine respiratory syncytial virus[J]. J Comp Pathol, 2014, 150(4): 434–448. DOI: 10.1016/j.jcpa.2013.08.002 |
| [13] | QIN S Y, JIANG H X, LU D H, et al. Association of interleukin-10 polymorphisms with risk of irritable bowel syndrome:a meta-analysis[J]. World J Gastroenterol, 2013, 19(48): 9472–9480. DOI: 10.3748/wjg.v19.i48.9472 |
| [14] |
刘小倩, 刘颖, 荣超, 等. ACE 2在奶牛乳腺中的表达定位及其抗炎性损伤作用的研究[J]. 畜牧兽医学报, 2017, 48(3): 552–560.
LIU X Q, LIU Y, RONG C, et al. Expression localization of angiotensin converting enzyme 2(ACE 2) in dairy cow mammary gland and its anti-inflammation effect[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(3): 552–560. (in Chinese) |
| [15] | AOUN E, CHEN J, REIGHARD D, et al. Diagnostic accuracy of interleukin-6 and interleukin-8 in predicting severe acute pancreatitis:a meta-analysis[J]. Pancreatology, 2009, 9(6): 777–785. DOI: 10.1159/000214191 |
| [16] | SAHIBZADA H A, KHURSHID Z, KHAN R S, et al. Salivary IL-8, IL-6 and TNF-α as potential diagnostic biomarkers for oral cancer[J]. Diagnostics (Basel), 2017, 7(2): E21. DOI: 10.3390/diagnostics7020021 |
| [17] | BOUDJELLAB N, CHAN-TANG H S, LI X, et al. Interleukin 8 response by bovine mammary epithelial cells to lipopolysaccharide stimulation[J]. Am J Vet Res, 1998, 59(12): 1563–1567. |
| [18] | LEE J, ZHAO X. Recombinant human interleukin-8, but not human interleukin-1β, induces bovine neutrophil migration in an in vitro co-culture system[J]. Cell Biol Int, 2000, 24(12): 889–895. DOI: 10.1006/cbir.2000.0562 |
| [19] | GONZÁLEZ G E, RHALEB N E, D'AMBROSIO M A, et al. Cardiac-deleterious role of galectin-3 in chronic angiotensin Ⅱ-induced hypertension[J]. Am J Physiol Heart Circ Physiol, 2016, 311(5): H1287–H1296. DOI: 10.1152/ajpheart.00096.2016 |
| [20] |
郑书国, 任尤楠, 赵梦秋, 等. 芝麻素含药血清对血管紧张素Ⅱ诱导大鼠心肌细胞凋亡的影响[J]. 中药材, 2015, 38(5): 1013–1017.
ZHENG S G, REN Y N, ZHAO M Q, et al. Effect of serum containing sesamin on angiotensin Ⅱ-induced apoptosis in rat cardiomyocytes[J]. Journal of Chinese Medicinal Materials, 2015, 38(5): 1013–1017. (in Chinese) |
| [21] | PATEL V B, BASU R, OUDIT G Y. ACE2/Ang 1-7 axis:A critical regulator of epicardial adipose tissue inflammation and cardiac dysfunction in obesity[J]. Adipocyte, 2016, 5(3): 306–311. DOI: 10.1080/21623945.2015.1131881 |
| [22] | NIAZI Z R, SILVA G C, RIBEIRO T P, et al. EPA:DHA 6:1 prevents angiotensin Ⅱ-induced hypertension and endothelial dysfunction in rats:role of NADPH oxidase- and COX-derived oxidative stress[J]. Hypertens Res, 2017, 40(12): 966–975. DOI: 10.1038/hr.2017.72 |
| [23] | IMAI Y, KUBA K, PENNINGER J M. The discovery of angiotensin-converting enzyme 2 and its role in acute lung injury in mice[J]. Exp Physiol, 2008, 93(5): 543–548. DOI: 10.1113/expphysiol.2007.040048 |
| [24] | HAN J B, YE S J, ZOU C P, et al. Angiotensin Ⅱ causes biphasic STAT3 activation through TLR4 to initiate cardiac remodeling[J]. Hypertension, 2018, 72(6): 1301–1311. DOI: 10.1161/HYPERTENSIONAHA.118.11860 |
| [25] | YU X Y, XIA Y F, ZENG L Y, et al. A blockade of PI3Kγ signaling effectively mitigates angiotensin Ⅱ-induced renal injury and fibrosis in a mouse model[J]. Sci Rep, 2018, 8: 10988. DOI: 10.1038/s41598-018-29417-3 |
| [26] | SODHI C P, WOHLFORD-LENANE C, YAMAGUCHI Y, et al. Attenuation of pulmonary ACE2 activity impairs inactivation of des-Arg9 bradykinin/BKB1R axis and facilitates LPS-induced neutrophil infiltration[J]. Am J Physiol-Lung Cell Mol Physiol, 2018, 314(1): L17–L31. DOI: 10.1152/ajplung.00498.2016 |
| [27] | SIMŌES ESILVA A C, TEIXEIRA M M. ACE inhibition, ACE2 and angiotensin-(1-7) axis in kidney and cardiac inflammation and fibrosis[J]. Pharmacol Res, 2016, 107: 154–162. DOI: 10.1016/j.phrs.2016.03.018 |
| [28] | HAO Y W, LIU Y. Osthole alleviates bleomycin-induced pulmonary fibrosis via modulating angiotensin-converting enzyme 2/angiotensin-(1-7) axis and decreasing inflammation responses in rats[J]. Biol Pharm Bull, 2016, 39(4): 457–465. DOI: 10.1248/bpb.b15-00358 |
| [29] | LIU C X, XIAO L P, LI F D, et al. Generation of outbred Ace2 knockout mice by RNA transfection of TALENs displaying colitis reminiscent pathophysiology and inflammation[J]. Transgenic Res, 2015, 24(3): 433–446. DOI: 10.1007/s11248-014-9855-3 |
| [30] | WANG J, LIU R X, QI H Y, et al. The ACE2-angiotensin-(1-7)-Mas axis protects against pancreatic cell damage in cell culture[J]. Pancreas, 2015, 44(2): 266–272. DOI: 10.1097/MPA.0000000000000247 |
| [31] | HE H L, LIU L, CHEN Q H, et al. MSCs modified with ACE2 restore endothelial function following LPS challenge by inhibiting the activation of RAS[J]. J Cell Physiol, 2015, 230(3): 691–701. DOI: 10.1002/jcp.24794 |



