2. 四川农业大学生命科学院, 雅安 625014;
3. 中国大熊猫保护研究中心, 雅安 625000
2. College of Life Science, Sichuan Agricultural University, Ya'an 625014, China;
3. China Conservation and Research Center for the Giant Panda, Ya'an 625000, China
石膏样小孢子菌是一种分布广泛且具有嗜土性的皮肤癣菌,易感染人和动物,感染途径与环境密切相关[1-2]。被石膏样小孢子菌感染后主要临床症状是脱毛(发)、红斑、鳞屑和结痂、脓癣等[3]。尽管石膏样小孢子菌感染动物后主要定植在角质层,但仍可诱导适应性免疫应答。研究表明在启动抗真菌免疫应答中与抗真菌免疫应答密切相关的模式识别受体(pattern recognition receptor,PRR)主要有TLR-2、TLR-4、Dectin-1和Dectin-2[4-6],PRR识别真菌表面的模式识别分子(pathogen-associated molecular patterns,PAMPs)后激活一系列免疫应答途径并促进细胞因子、趋化因子和抗菌肽的释放从而清除病原真菌[7]。研究表明被红色毛癣菌[8]、须癣毛癣菌[9]、念珠菌[10]、烟曲霉[11]感染后Th17途径在抗真菌感染中发挥主要作用,而Th17细胞分化成熟后分泌IL-17、IL-21、IL-22、GM-CSF等细胞因子,通过激活相应的免疫细胞和非免疫细胞吞噬清除病原真菌,并释放抗菌肽、趋化因子等物质从而清除病原真菌[7]。小鼠是最常用作皮肤癣菌感染的动物模型[9, 12],常用于体外药敏试验和药物筛选,但很少有研究报道关于小鼠被石膏样小孢子菌感染后抗皮肤癣菌免疫应答的研究。为了了解石膏样小孢子菌感染小鼠后的免疫应答机制,本试验通过皮下接种石膏样小孢子菌感染小鼠,研究模式识别受体Dectin-1、TLR-2和TLR-4及细胞因子动态变化规律。
1 材料与方法 1.1 试验材料 1.1.1 实验菌株石膏样小孢子菌(Microsporum gypseum),分离自中国大熊猫保护研究中心雅安碧峰峡基地大熊猫体表,由四川农业大学动物医学院临床兽医学外科实验室鉴定[13]并保存。
1.1.2 实验动物6周龄SPF健康雌性C57BL/6小鼠,购自成都达硕试验动物有限责任公司,采用无毒塑料鼠笼无菌环境中饲养,每笼5只,自由饮食和饮水。每周两次更换消毒鼠笼和垫料。
1.1.3 仪器与试剂仪器:霉菌培养箱(MJ-400B),上海跃进医疗器械有限公司;显微镜(BX51),日本Olympus公司;Real-Time PCR(CFX9),美国Bio-Rad公司。试剂:SYBR Premix Ex TaqTM(TaKaRa,中国大连);PrimeScriptTM RT reagent Kit with gDNA Eraser(TaKaRa,中国大连);TRIzol(Invitrogen,成都欣亿维);福尔马林(40%甲醛水溶液)、异丙醇、氯仿、95%酒精均购于万科生物科技有限公司。
1.2 方法 1.2.1 菌悬液制备将石膏样小孢子菌接种于沙氏葡萄糖蛋白胨培养基(Sabouraud Dextrose Agar,SDA)上,25 ℃培养8 d,取4 mL无菌PBS在培养基表面反复冲洗数次,吹打培养基上的孢子,将菌悬液吸入无菌试管中,振荡混匀,通过血球计数法将菌悬液浓度调整至约1×106 CFU·鼠-1(或1×107 CFU·mL-1)。
1.2.2 实验动物处理试验组64只雌鼠,皮下接种1×106 CFU·鼠-1石膏样小孢子菌,即0.1 mL,对照组8只雌鼠注射0.1 mL PBS溶液;分别于注射后第0、3、6、12小时,以及第1、3、7和14天(n=8)断颈法处死小鼠,采病变皮肤组织。
1.2.3 病理学检查将病变皮肤组织放入10%中性福尔马林(4%甲醛水溶液)固定,脱水,透明和石蜡包埋,切片(4 μm),常规苏木精、伊红(hematoxylin and eosin,HE)染色和碘酸雪夫(Periodic Acid-Schiff stain, PAS)染色。BX51显微镜下观察。
1.2.4 总RNA的提取及反转录 1.2.4.1 提取总RNA取100 mg皮肤组织研磨,研成粉末后加入1 mL TRIzol,室温中静置裂解5 min。12 000 g,4 ℃离心15 min。取上清液,并加入200 μL氯仿,混匀,室温中静置5 min。12 000 g,4 ℃离心15 min。取上清液,并加入500 μL异丙醇,室温中静置10 min。12 000 g,4 ℃离心10 min。弃上清液,加入1 mL 75%的乙醇12 000 g 4 ℃离心5 min。弃上清液,在室温中干燥5 min。加入适量的RNase-free水溶解RNA。
1.2.4.2 去除基因组DNA3 μL RNase Free dH2O,2 μL 5×gDNA Eraser Buffer和1 μL gDNA Eraser,最后加入4 μL Total RNA,42 ℃维持2 min。
1.2.4.3 反转录在上述反应体系中依次加入4 μL RNase Free dH2O,4 μL 5×PrimeScript Buffer 2 (for Real Time),1 μL PrimeScript RT Enzyme Mix I和1 μL RT Primer Mix,混匀,37 ℃维持15 min,85 ℃维持5 s,最后4 ℃保存。
1.2.5 设计及合成引物根据NCBI数据库中的小鼠TLR-2、TLR-4和Dectin-1的序列,通过序列比对分析,采用Primer Premier 5.0软件设计基因引物,12S rRNA、IL-6、IL-1β、TNF-α、IL-22、IL-10的引物参照文献[9],TGF-β的引物参考文献[14],IL-23和IL-17F的引物参考文献[15],IL-17A的引物参考文献[16]。所有引物由上海生工合成,引物信息见表 1。
|
|
表 1 引物序列 Table 1 The primer sequences |
反应体系:SYBR Premix 5 μL,上、下游引物各0.5 μL,RNase Free dH2O 3 μL,cDNA 1 μL。混匀反应体系后,瞬时离心。PCR程序:95 ℃预变性2 min,95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s共40个循环。扩增完成后进行熔解曲线分析:95 ℃维持10 s,65 ℃处理1 s,此后从65 ℃开始,每一个循环温度增加0.5 ℃,时间为1 s。每个样品重复3次。
1.2.7 统计分析荧光定量PCR分别检测细胞因子IL-22、IL-17A、IL-17F、IL-10、IL-12、IL-1β、IL-6、IL-23、IL-1β、TNF-α、TGF-β等基因,模式识别受体基因Dectin-1、TLR-2、TLR4等以及参照基因12S rRNA的Ct值,以0 h(d)为对照,采用2-ΔΔCt的方法计算相对转录量。数据以“x±s”表示,然后用SPSS 22.0进行统计分析,同一基因同一组织的不同处理和不同时间的表达水平用Duncan法多重性比较,P < 0.05达到显著水平。
2 结果 2.1 组织病理学观察1×106 CFU·鼠-1剂量的石膏样小孢子菌经皮下注射感染小鼠,通过HE染色和PAS染色动态观察小鼠皮肤感染石膏样小孢子菌后皮肤病理变化和石膏样小孢子菌定植部位。皮肤组织切片PAS染色显示皮下组织有孢子(图 1),在第3天的组织中发现有菌丝生成(图 1A)。HE染色显示试验组小鼠皮肤组织中在石膏样小孢子菌周围有大量的炎性细胞浸润,并伴有大量坏死细胞,网状层淤血,并有少量的炎性细胞浸润,角质层明显增厚(图 2)。
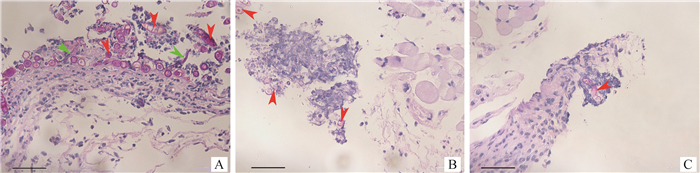
|
A、B、C分别表示石膏样小孢子菌经皮肤感染后第3、7、14天小鼠皮肤组织切片PAS染色,红色箭头所指为孢子,绿色箭头所指为菌丝 A, B and C indicate PAS staining of skin tissue sections of mice with M. gypseum on the 3rd, 7th, 14th day after skin infection, respectively; red arrow refers to spores, green arrow refers to hyphae, multiple 图 1 石膏样小孢子菌感染小鼠后皮肤的组织病理变化(400×,PAS染色) Fig. 1 Histopathological changes of skin after infection with M. gypseum(400×, PAS staining) |
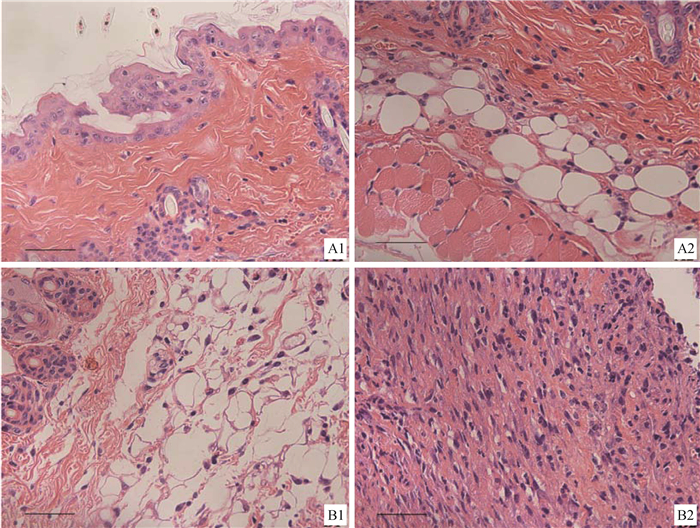
|
A1、A2表示石膏样小孢子菌经皮肤感染后第3天小鼠皮肤组织切片;B1、B2表示石膏样小孢子菌经皮肤感染后第7天小鼠皮肤组织切片 A1 and A2 represent tissue sections of mice with M. gypseum on the 3rd day after infection; B1 and B2 respectively indicate skin tissue sections of mice with M. gypseum on the 7th day after infection 图 2 石膏样小孢子菌感染小鼠后皮肤的组织病理变化(400×,HE染色) Fig. 2 Histopathological changes of skin after infection with M. gypseum(400×, HE staining) |
当石膏样小孢子菌刺激皮肤组织后不同时间段内模式识别受体Dectin-1、TLR-2和TLR-4转录表达量如图 3所示,Dectin-1、TLR-2和TLR-4转录表达量在第3、6小时极显著高于空白组(第0小时)(P < 0.01或P < 0.001),第3小时Dectin-1和TLR-4转录表达量最大,第6小时受体TLR-2转录表达量最大。第12小时TLR-2转录表达量极显著高于空白组(P < 0.01)。
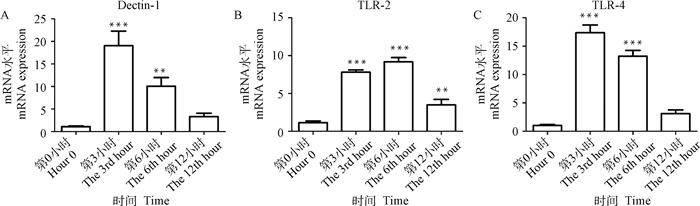
|
与第0小时相比,*.P < 0.05; **.P < 0.01; ***.P < 0.001 Compared with hour 0, *.P < 0.05; **.P < 0.01; ***.P < 0.001 图 3 损伤皮肤中受体相关基因Dectin-1、TLR-2和TLR-4的转录量 Fig. 3 Transcription levels of receptors related genes such as Dectin-1, TLR-2 and TLR-4 in damaged skin |
石膏样小孢子菌经皮肤感染小鼠第1天,IL-6、IL-1β和TNF-α的转录表达量与对照组(第0天)相比均极显著增加(P < 0.001)(图 4A、B、C),抗炎因子IL-10的转录表达量与对照组相比极显著增加(P < 0.001)(图 4F),而TGF-β、IL-17A、IL-17F、IL-22和IL-23的转录表达量与对照组相比差异不显著(P>0.05)(图 4D、K、I、H、E)。
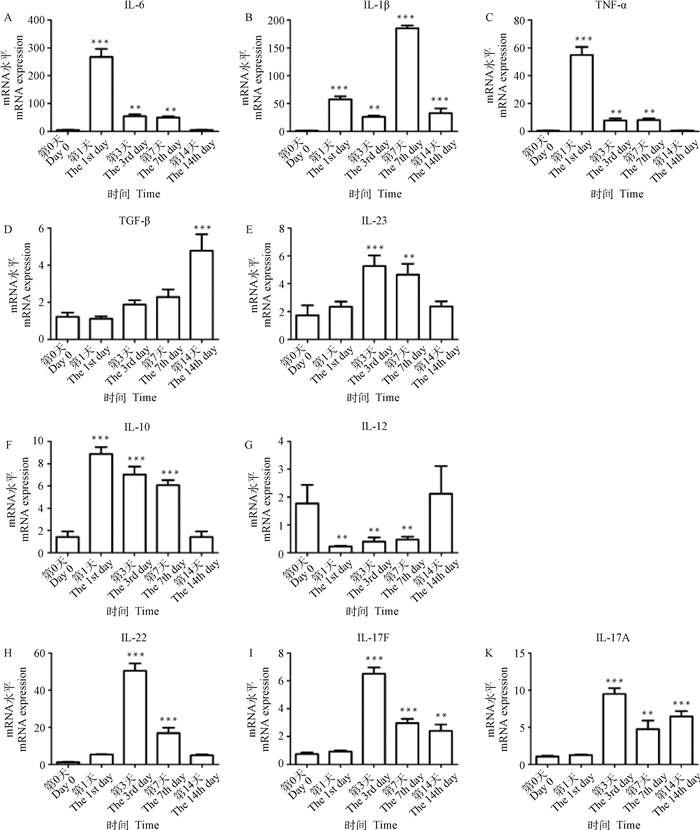
|
与第0天相比,*.P < 0.05; **.P < 0.01; ***.P < 0.001 Compared with day 0, *.P < 0.05; **.P < 0.01; ***.P < 0.001 图 4 损伤皮肤中细胞因子相关基因IL-6、IL-1β、TNF-α、IL-10、IL-23、TGF-β、IL-12、IL-17A、IL-17F和IL-22的转录量 Fig. 4 Transcription levels of cytokines related genes such as IL-6, IL-1β, TNF-α, IL-10, IL-23, TGF-β, IL-12, IL-17A, IL-17F and IL-22 in damaged skin |
石膏样小孢子菌经皮肤感染小鼠第3天,IL-6、IL-1β和TNF-α的转录表达量与对照组相比均极显著增加(P < 0.01),但转录表达量与第1天相比极显著下降(P < 0.001)(图 4A、B、C),IL-23的转录表达量与对照组和第1天相比极显著增加(P < 0.001)(图 4E)。抗炎因子IL-10的转录表达量与对照组相比极显著增加(P < 0.001),但转录表达量与第1天相比显著下降(P < 0.05)(图 4F),IL-17A、IL-17F和IL-22的转录表达量与对照组和第1天相比均极显著增加(P < 0.001)(图 4K、I、H)。
石膏样小孢子菌经皮肤感染小鼠第7天,IL-6、IL-1β、TNF-α和IL-23的转录表达量与对照组相比均极显著增加(P < 0.01或P < 0.001),其中IL-6、TNF-α和IL-23转录表达量与第1天相比均显著下降(P < 0.05),而IL-1β的转录表达量与第1、3天相比极显著增加(P < 0.001)(图 4A、B、C、E)。抗炎因子IL-10的转录表达量极显著增加(P < 0.001),但与第1天相比显著下降(P < 0.05)(图 4F),IL-17A、IL-17F和IL-22的转录表达量与对照组和第1天相比均极显著增加(P < 0.001)(图 4K、I、H),但与第3天相比极显著下降(P < 0.001)。
石膏样小孢子菌经皮肤感染小鼠第14天,IL-1β、TGF-β的转录表达量与对照组相比均极显著增加(P < 0.001) (图 4B、D)。IL-17A和IL-17F第14天的转录表达量与对照组和第1天相比均极显著增加(P < 0.01或P < 0.001)(图 4I、K),但与第7天相比差异不显著(P>0.05)。
石膏样小孢子菌经皮肤感染小鼠后,IL-12在第1、3和7天的转录表达量与对照组相比均极显著降低(P < 0.01),第14天的转录表达量与对照组相比差异不显著(P>0.05)。
3 讨论皮肤癣菌是引起人和动物感染浅部真菌病主要病原菌,其中主要病原菌为:表皮癣菌属、毛癣菌属和小孢子菌属[17]。浅部真菌主要感染人和动物的皮肤和毛发,其主要临床症状为甲癣、股癣、体癣、脚癣、头癣等[18]。De Matos Baltazar等[19]将小鼠背部剃毛,并将皮肤组织2 cm×2 cm划开接种红色毛癣菌感染小鼠,建立模型。Baldo等[20]研究表明,小分生孢子也可附着于角质形成细胞,并且这种黏附是由碳水化合物特异性黏附所介导的。此外,已经证明皮肤癣菌小分生孢子能够在皮肤中发芽并导致组织损伤[21]。由于在空气中也存在大量的真菌,划破的皮肤也易受到其他真菌的侵入,所以笔者通过皮下接种石膏样小孢子菌感染小鼠建立小鼠模型。
皮肤组织切片PAS染色显示第3、7和14天可以看到小鼠皮肤组织中存在石膏样小孢子,但随着感染时间延长在皮肤中定植的石膏样小孢子菌数量减少,说明机体通过调节固有免疫应答和适应性免疫应答清除病原菌,并且与De Matos Baltazar等[19]的研究相符,随着感染时间延长定植在皮肤中的红色毛癣菌减少。皮肤组织切片HE染色显示感染后的小鼠皮肤角质层明显增厚,也与De Matos Baltazar等的研究相符,Cambier等[9]通过皮肤涂擦万博节皮菌感染小鼠的研究也显示感染后的小鼠皮肤角质层明显增厚。尽管皮肤癣菌主要通过分泌角蛋白酶侵入皮肤组织,但对于健康的动物来说,角质增厚也是机体保护自身的现象。
研究表明树突状细胞、嗜中性粒细胞和嗜酸性粒细胞表面有多种受体表达,在启动抗真菌免疫应答中发挥重要的作用,其中与抗真菌免疫应答密切相关的PRR主要有TLR-2、TLR-4、Dectin-1和Dectin-2[4-6]。其中PRR不仅存在于免疫细胞表面, 也存在于非免疫细胞表面[7]。目前研究认为角质形成细胞(keratinocytes cell, KC)表面表达多种固有免疫PRR,在启动抗真菌免疫中发挥重要作用,其中与抗真菌免疫密切相关的PRR主要是TLR-2、TLR-4和Dectin-1[22]。研究发现红色毛癣菌与机体免疫应答密切的PRR主要有Dectin-1和Dectin-2[8],研究发现犬小孢子菌与机体免疫应答密切的PRR主要有TLR-2和TLR-4[23]。本研究结果表明当石膏样小孢子菌感染机体后,模式识别受体TLR-2、TLR-4和Dectin-1的转录表达量也显著增加。
Th17细胞分化成熟需要由IL-6、IL-1β、IL-23和TGF-β等细胞因子激活,分化成熟的Th17细胞通过分泌IL-17、IL-21、IL-22、GM-CSF等细胞因子进一步激活相应的免疫细胞和非免疫细胞,从而清除病原真菌[7]。本研究结果表明当石膏样小孢子菌感染机体后,IL-6、IL-1β、IL-23和TGF-β的转录表达量显著增加,Cambier等[9]用本海姆节皮菌和万博节皮菌感染健康小鼠后IL-1β、IL-6和TGF-β在皮肤组织转录表达量也显著增加[9],说明Th17途径在抗皮肤癣菌的免疫途径中是不可缺少的。本试验结果中IL-12的转录量减少,研究表明由Th17细胞诱导免疫保护反应,Dectin-1和Dectin-2活化诱导关键细胞因子IL-1β、IL-6和IL-23分泌并同时抑制IL-12产生[24],与本试验结果一致。然而De Matos Baltazar等[19]运用IL-12和IFN-γ基因缺失的小鼠被红色毛癣菌感染后发现,小鼠抵抗皮肤癣菌的能力下降,从而间接证明Th1途径能抗红色毛癣菌的感染,并且在基因缺陷的小鼠中IL-1β和TNF-α转录表达量也显著减少。但是Conti等[10]用IL-12和IL-17RA基因缺失的小鼠,结果表明IL-17RA基因缺失的小鼠比IL-12基因缺失的小鼠更易被口腔念珠菌感染,病程更久。表明Th17途径和Th1途径在抗真菌感染都发挥重要的作用,但Th17途径为抗真菌感染的主导作用;这也可能与真菌是条件性致病菌有关,基因缺失的小鼠本身抗病能力减弱。
本试验结果中IL-10的转录表达量显著增加,IL-10的增加主要通过激活Treg途径来减少炎症反应[25],促炎因子TNF-α、IL-6、IL-1β在本试验结果中转录表达量也显著增加,而促炎因子过量的表达会损伤机体,IL-10的分泌抑制促炎因子的过量表达,从而保护机体。本试验结果中IL-22、IL-17A和IL-17F的转录表达量也显著增加,表明Th17途径是抗石膏样小孢子菌的主要途径。IL-22是由Th17辅助细胞产生分泌的,IL-22在皮肤和黏膜免疫的建立中具有重要作用,IL-22R只表达于皮肤表皮细胞、消化系统表皮细胞和呼吸系统表皮细胞,IL-22作用于角质形成细胞从而上调β-Defensin 2和β-Defensin 3的表达,从而清除病原真菌[26]。IL-17A和IL-17F是由Th17辅助细胞产生分泌的,IL-17不仅诱导免疫细胞释放细胞因子、趋化因子、抗菌肽等物质抵抗真菌,还可以诱导非免疫细胞释放细胞因子、趋化因子等抵抗真菌[7, 27-28]。本研究结果表明Th17途径是抗石膏样小孢子菌的主要途径。
研究表明,IL-17过量的表达会导致类风湿、系统性红斑狼疮、银屑病等疾病[28]。本研究结果表明每一种细胞因子的表达量均未长期持续在一个较高的水平。随着感染石膏样小孢子菌时间的延长,均呈现出先升高后降低,这种调节使IL-17A、IL-17F和IL-22的转录表达量不会过量表达而损伤机体。
4 结论通过皮下接种石膏样小孢子菌,小鼠皮肤处易形成脓肿,在脓肿处皮肤的角质层增厚,炎性细胞大量浸润,病灶处模式识别受体Dectin-1、TLR-2和TLR-4的转录显著增加,提示模式识别受体识别石膏样小孢子菌表面模式识别分子从而激活Th17途径,分化成熟的Th17细胞分泌细胞因子IL-22、IL-17A和IL-17F,从而发挥抗石膏样小孢子菌的作用。
| [1] | HAVLICKOVA B, CZAIKA V A, FRIEDRICH M. Epidemiological trends in skin mycoses worldwide[J]. Mycoses, 2008, 51(Suppl 4): 2–15. |
| [2] | DEGREEF H. Clinical forms of dermatophytosis (ringworm infection)[J]. Mycopathologia, 2008, 166(5-6): 257–265. DOI: 10.1007/s11046-008-9101-8 |
| [3] | NARDONI S, MUGNAINI L, PAPINI R, et al. Canine and feline dermatophytosis due to Microsporum gypseum:a retrospective study of clinical data and therapy outcome with griseofulvin[J]. J Mycol Med, 2013, 23(3): 164–167. DOI: 10.1016/j.mycmed.2013.05.005 |
| [4] | BONFIM C V, MAMONI R L, BLOTTA M H S L. TLR-2, TLR-4 and dectin-1 expression in human monocytes and neutrophils stimulated by Paracoccidioides brasiliensis[J]. Med Mycol, 2009, 47(7): 722–733. DOI: 10.3109/13693780802641425 |
| [5] | SAIJO S, IKEDA S, YAMABE K, et al. Dectin-2 recognition of α-mannans and induction of Th17 cell differentiation is essential for host defense against Candida albicans[J]. Immunity, 2010, 32(5): 681–691. DOI: 10.1016/j.immuni.2010.05.001 |
| [6] | PATIN E C, THOMPSON A, ORR S J. Pattern recognition receptors in fungal immunity[J]. Semin Cell Dev Biol, 2019, 89: 24–33. DOI: 10.1016/j.semcdb.2018.03.003 |
| [7] | HEINEN M P, CAMBIER L, FIEVEZ L, et al. Are Th17 cells playing a role in immunity to dermatophytosis?[J]. Mycopathologia, 2017, 182(1-2): 251–261. DOI: 10.1007/s11046-016-0093-5 |
| [8] | YOSHIKAWA F S, YABE R, IWAKURA Y, et al. Dectin-1 and Dectin-2 promote control of the fungal pathogen Trichophyton rubrum independently of IL-17 and adaptive immunity in experimental deep dermatophytosis[J]. Innate Immun, 2016, 22(5): 316–324. DOI: 10.1177/1753425916645392 |
| [9] | CAMBIER L, WEATHERSPOON A, DEFAWEUX V, et al. Assessment of the cutaneous immune response during Arthroderma benhamiae and A. vanbreuseghemii infection using an experimental mouse model[J]. Br J Dermatol, 2014, 170(3): 625–633. DOI: 10.1111/bjd.12673 |
| [10] | CONTI H R, SHEN F, NAYYAR N, et al. Th17 cells and IL-17 receptor signaling are essential for mucosal host defense against oral candidiasis[J]. J Exp Med, 2009, 206(2): 299–311. DOI: 10.1084/jem.20081463 |
| [11] | ZELANTE T, DE LUCA A, BONIFAZI P, et al. IL-23 and the Th17 pathway promote inflammation and impair antifungal immune resistance[J]. Eur J Immunol, 2007, 37(10): 2695–2706. DOI: 10.1002/(ISSN)1521-4141 |
| [12] | LEE S J, HAN J I, LEE G S, et al. Antifungal effect of eugenol and nerolidol against Microsporum gypseum in a guinea pig model[J]. Biol Pharm Bull, 2007, 30(1): 184–188. DOI: 10.1248/bpb.30.184 |
| [13] |
张悦天, 马晓平, 古玉, 等. 大熊猫源石膏样小孢子菌的分离鉴定与致病性研究[J]. 中国兽医科学, 2015, 45(6): 551–559.
ZHANG Y T, MA X P, GU Y, et al. Identification and pathogenicity of Microsporum gypseum isolated from Ailuropoda melanoleuca[J]. Chinese Veterinary Science, 2015, 45(6): 551–559. (in Chinese) |
| [14] | KNIGHT V, LOURENSZ D, TCHONGUE J, et al. Cytoplasmic domain of tissue factor promotes liver fibrosis in mice[J]. World J Gastroenterol, 2017, 23(31): 5692–5699. DOI: 10.3748/wjg.v23.i31.5692 |
| [15] | WU Q, MARTIN R J, RINO J G, et al. IL-23-dependent IL-17 production is essential in neutrophil recruitment and activity in mouse lung defense against respiratory Mycoplasma pneumoniae infection[J]. Microbes Infect, 2007, 9(1): 78–86. DOI: 10.1016/j.micinf.2006.10.012 |
| [16] | ZHU J F, WANG Y Y, YANG F L, et al. IL-33 alleviates DSS-induced chronic colitis in C57BL/6 mice colon lamina propria by suppressing Th17 cell response as well as Th1 cell response[J]. Int Immunopharmacol, 2015, 29(2): 846–853. DOI: 10.1016/j.intimp.2015.08.032 |
| [17] | CHERMETTE R, FERREIRO L, GUILLOT J. Dermatophytoses in animals[J]. Mycopathologia, 2008, 166(5-6): 385–405. DOI: 10.1007/s11046-008-9102-7 |
| [18] | GUARNER J, BRANDT M E. Histopathologic diagnosis of fungal infections in the 21st century[J]. Clin Microbiol Rev, 2011, 24(2): 247–280. DOI: 10.1128/CMR.00053-10 |
| [19] | DE MATOS BALTAZAR L, SANTOS P C, DE PAULA T P, et al. IFN-γ impairs Trichophyton rubrum proliferation in a murine model of dermatophytosis through the production of IL-1β and reactive oxygen species[J]. Med Mycol, 2014, 52(3): 293–302. DOI: 10.1093/mmy/myt011 |
| [20] | BALDO A, MONOD M, MATHY A, et al. Mechanisms of skin adherence and invasion by dermatophytes[J]. Mycoses, 2012, 55(3): 218–223. DOI: 10.1111/myc.2012.55.issue-3 |
| [21] | SMIJS T G M, BOUWSTRA J A, SCHUITMAKER H J, et al. A novel ex vivo skin model to study the susceptibility of the dermatophyte Trichophyton rubrum to photodynamic treatment in different growth phases[J]. J Antimicrob Chemother, 2007, 59(3): 433–440. DOI: 10.1093/jac/dkl490 |
| [22] | VAN DE VEERDONK F L, KULLBERG B J, VAN DER MEER J W, et al. Host-microbe interactions:innate pattern recognition of fungal pathogens[J]. Curr Opin Microbiol, 2008, 11(4): 305–312. DOI: 10.1016/j.mib.2008.06.002 |
| [23] | CAMBIER L C, HEINEN M P A L, BAGUT E T, et al. Overexpression of TLR-2 and TLR-4 mRNA in feline polymorphonuclear neutrophils exposed to Microsporum canis[J]. Vet Dermatol, 2016, 27(2): 78–81e. DOI: 10.1111/vde.2016.27.issue-2 |
| [24] | VAUTIER S, DA GLÓRIA SOUSA M, BROWN G D. C-type lectins, fungi and Th17 responses[J]. Cytokine Growth Factor Rev, 2010, 21(6): 405–412. DOI: 10.1016/j.cytogfr.2010.10.001 |
| [25] | SABAT R, GRüTZ G, WARSZAWSKA K, et al. Biology of interleukin-10[J]. Cytokine Growth Factor Rev, 2010, 21(5): 331–344. DOI: 10.1016/j.cytogfr.2010.09.002 |
| [26] | WOLK K, KUNZ S, WITTE E, et al. IL-22 increases the innate immunity of tissues[J]. Immunity, 2004, 21(2): 241–254. DOI: 10.1016/j.immuni.2004.07.007 |
| [27] | CONTI H R, GAFFEN S L. IL-17-mediated immunity to the opportunistic fungal pathogen candida albicans[J]. J Immunol, 2015, 195(3): 780–788. DOI: 10.4049/jimmunol.1500909 |
| [28] | GAFFEN S L. An overview of IL-17 function and signaling[J]. Cytokine, 2008, 43(3): 402–407. DOI: 10.1016/j.cyto.2008.07.017 |



