2. 福建农林大学动物科学学院, 福州 350002
2. College of Animal Sciences, Fujian Agriculture and Forestry University, Fuzhou 350002, China
解旋酶(helicases)是一类对所有生物都至关重要的酶,在哺乳动物、细菌、噬菌体和病毒中均存在,主要功能是基因解旋。解旋酶是一种马达蛋白,能够沿着核酸的磷酸二酯酶骨架移动,利用ATP将退火的核酸双链(DNA、RNA、RNA:DNA)分开。大约1%的真核基因编码解旋酶,说明其对真核生物至关重要[1]。人类基因组编码64种RNA解旋酶和31种DNA解旋酶。许多细胞过程(如DNA复制、转录、翻译、重组、DNA修复和核糖体生物合成)均依赖解旋酶[2]。解旋酶可分为七个超家族(super family,SF),分别命名为超家族1~7。DEAD/H box解旋酶属于SF2家族的成员,是最大的参与各种细胞活动的解旋酶家族[3]。DEAD/H box RNA解旋酶在解旋RNA过程中发挥重要作用,包含DEAD(DDX)和DEAH(DHX)家族,已被鉴定出的DDX有36个成员,DHX有14个成员[4]。
DNA和RNA病毒是两种最重要的细胞外源的核酸刺激物。迄今为止,已有许多DDX/DHX被证实在病毒复制各个阶段发挥调控作用。其中DDX58又被称之为维甲酸诱导基因-Ⅰ(retinoic acid inducible gene 1, RIG-Ⅰ),是最重要的识别RNA病毒的细胞质受体[5]。DHX58又被称之为人遗传学和生理学实验室蛋白2(laboratory of genetics and physiology 2,LGP2)[6],与RIG-Ⅰ有相同的抑制结构域,能够抑制RIG-Ⅰ介导的先天性免疫[7]。除此之外,DDX3、DDX5、DDX21等也被证明参与病毒复制的各个阶段[8-10]。
DDX21是1993年被发现的一种重要的解旋RNA的DDX,能够解旋细胞内的双链RNA和DNA:RNA[11]。近年来的报道证实DDX21在抗病毒先天性免疫中发挥重要的作用。DDX21被证实通过与DDX1、DHX36结合参与识别双链RNA,与Toll样受体3下游接头分子TRIF结合诱导先天性免疫[12]。DDX21能够抑制流感病毒复制,并且能被流感病毒的非结构蛋白1(NS1)拮抗[13]。在登革热病毒感染细胞后,细胞中的DDX21由细胞核转位至细胞质,发挥调控先天性免疫和病毒复制的作用[10]。
新城疫病毒(Newcastle disease virus,NDV)对养禽业危害重大,同时能够特异性感染多种肿瘤细胞[14-15]。NDV能够通过多种途径调控宿主先天性免疫,使其能够在禽细胞和肿瘤细胞中高效复制。NDV在复制过程中能产生双链RNA,其双链RNA的解旋对于形成子代病毒至关重要。近年来成簇的规律间隔的短回文重复序列(clustered regularly interspaced short palindromic repeats, CRISPR)被证明能够作为一种新型高效的基因编辑工具,对内源基因组DNA序列进行靶向删除、插入或修饰[16]。为了研究DDX21是否能够参与NDV病毒复制,本研究应用CRISPR/Cas9系统对NDV易感的HeLa细胞株进行DDX21敲除,验证其在NDV感染细胞中的作用,为探索NDV如何调控先天性免疫,以促进自身复制以及制备高效疫苗及溶瘤病毒奠定可靠的试验基础。
1 材料与方法 1.1 质粒、菌株、病毒和细胞CRISPR/Cas9质粒pGK1.1为南京吉锐生物有限公司产品。Top10感受态细胞为天根生化科技有限公司产品。Herts/33标准强毒株购自中国兽医药品监察所,由笔者所在实验室保存。HeLa、DF-1细胞购自美国ATCC生物标准品资源中心,用含10%胎牛血清(FBS)的DMEM培养基(Thermo Fisher Scientific),于5% CO2、37 ℃培养。
1.2 抗体与试剂Anti-DDX21抗体为美国Abcam公司产品,anti-β-actin抗体为美国Sigma公司产品。新城疫病毒抗核蛋白(NP)单克隆抗体由本课题组制备。山羊抗兔/山羊抗小鼠IgG(H+L)HRP为Jackson公司的产品。DMEM培养基、Opti-MEM培养基、胎牛血清FBS、Lipofectamin 2000为美国Thermo公司产品。嘌呤霉素为美国Merck Millipore公司产品。T4 DNA连接酶为美国Promega公司产品。Genloci TNA抽提试剂盒为南京吉锐生物有限公司产品。Western及IP细胞裂解液为碧云天生物公司产品。ECL化学发光试剂为Thermo公司产品。
1.3 sgRNA oligo序列设计及合成参考GenBank中人DDX21基因序列(Gene ID:9188),通过麻省理工学院的CRISPR设计工具(http://crispr.mit.edu/)在DDX21基因区域中前后共设计6对20 bp左右的oligo DNA。
第一轮靶位点设计:选取DDX21基因转录本的CDS区,找出CDS区所处的第三个外显子进行靶位点设计(第一个外显子靶位点评分太低,第二个外显子太短),设计3条靶点序列,分别命名为1~3号sgRNA(single guide RNA)。
第二轮靶位点设计:选取DDX21基因转录本的CDS区,找出CDS区所处的第五个外显子进行靶位点设计,再设计3条靶点序列,分别命名为4~6号sgRNA。
靶点设计完后,正向引物添加CACC(G)(若靶序列第一个碱基不是G,则在靶序列前加一个G),反向引物添加AAAC。靶序列引物设计见表 1,序列均由上海生工生物有限公司合成。
|
|
表 1 DDX21 sgRNA oligo序列 Table 1 The sequences of DDX21 sgRNA oligo |
将合成后的2条单链oligo DNA(10 μmol·L-1)退火形成dsDNA,再利用T4连接酶与线性化后的pGK1.1载体连接,转化Top10感受态细胞。使用上游引物VSP primer(CATATGCTTACCGTAACTTGAAAG)与下游负链oligo引物进行菌落PCR筛选,阳性克隆PCR产物大小应为100 bp,对筛选到的阳性克隆抽提质粒进一步测序验证。
1.5 电转染靶细胞及单克隆的制备和生长取状态良好的对数生长期HeLa细胞悬液台盼蓝计数,确定细胞数及细胞活力(细胞活力>95%)。取5×106细胞于15 mL离心管中,1 000 r·min-1离心4 min,弃上清。将细胞沉淀悬浮于210 μL DPBS中,转移至1.5 mL EP管中,加入所需量构建好的敲除质粒5~8 μg(质粒浓度要求1 μg·μL-1以上),轻轻混匀后电转,电转条件为550 V,脉冲数1。电转24 h后,加入嘌呤霉素(1 μg·mL-1)筛选24 h,得到的pool(混合克隆)细胞进行初步测序验证,对靶点位置及之后序列中出现套峰的细胞进行亚克隆。梯度稀释法稀释细胞至96孔板中,培养一周后观察单克隆生长情况,约两周后将生长良好的单克隆转移至48孔中扩大培养;当细胞长满48孔1/2时,即可取出一部分(102~104),提取细胞基因组。
1.6 单克隆细胞系genotyping PCR测序鉴定在敲除靶位点附近设计高特异性的引物进行genotyping PCR鉴定,鉴定引物序列见表 2。
|
|
表 2 DDX21 genotyping RCR引物序列 Table 2 The sequences of DDX21 genotyping PCR primer |
收集野生型HeLa细胞和测序正确的单克隆细胞,裂解细胞后进行SDS-PAGE电泳,转印至硝酸纤维素膜,5%脱脂乳封闭,一抗4 ℃孵育过夜,TBST洗涤后加入二抗37 ℃孵育1 h,ECL化学发光试剂盒显影。
1.8 RNA干扰和病毒感染为了敲减内源性DDX21,将150 pmol DDX21干扰RNA转染至HeLa细胞,干扰RNA序列如下:(5′-AGGCCAGAAGCGGAGUUUCAGUAAA-3′),48 h后以1个多重感染复数(MOI) NDV感染,病毒吸附1 h后用无血清培养基洗3遍,换1% FBS维持液,24 h后收细胞样品和上清,Western blot检测细胞样品中病毒NP蛋白表达,在DF-1细胞上测定上清液中病毒TCID50。
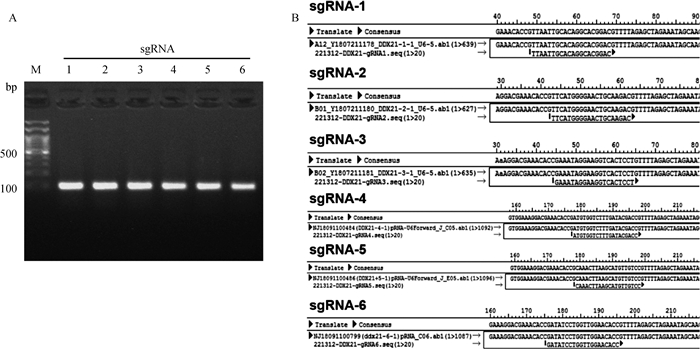
2 结果 2.1 用于DDX21基因敲除打靶载体的构建为了筛选获得对DDX21打靶效率高的sgRNA,将合成的6个sgRNA寡核苷酸序列退火后与线性质粒pGK1.1载体连接,转化后挑取单菌落,利用上游VSP primer和下游负链Oligo引物进行菌落PCR筛选,阳性克隆PCR正确产物大小为100 bp(图 1A),与预期大小一致,筛选到的阳性克隆抽提质粒进一步测序验证(图 1B),证明DDX21基因敲除载体构建成功。
|
A. DDX21基因打靶载体PCR鉴定(M. 100 bp DNA ladder H3 RTU);B. DDX21基因打靶载体测序结果 A. The PCR identification of DDX21 gene targeting vector (M. 100 bp DNA ladder H3 RTU); B. The sequencing results of DDX21 gene targeting vector 图 1 DDX21基因敲除打靶载体鉴定 Fig. 1 Identification of DDX21 gene targeting vector |
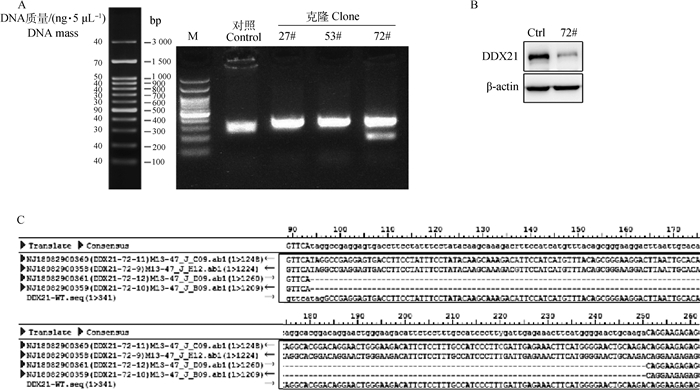
将以上鉴定阳性的sgRNA电转HeLa细胞24 h后,嘌呤霉素筛选,得到的pool细胞进行初步测序验证,对靶点位置及之后序列中出现套峰的细胞进行亚克隆,提取细胞基因组进行PCR鉴定。本研究中共进行了3轮电转试验,包括sgRNA-1和sgRNA-2,sgRNA-2和sgRNA-3,sgRNA-4、sgRNA-5和sgRNA-6载体混合电转。根据扩增引物(DDX21-genotyping-1F/R)及理论敲除位点位置,扩增产物约341 bp,扩增产物条带偏小的克隆为疑似阳性克隆,图中72#克隆初步定为疑似阳性克隆(图 2A)。Western blot结果显示,疑似阳性克隆中DDX21表达量显著下降(图 2B)。对72#克隆提取细胞基因组进行genotyping PCR测序鉴定,结果显示:72#克隆的一个亲本缺失157 bp,另一个亲本为野生型(图 2C)。以上结果说明获得一株DDX21杂合子敲除细胞。尽管未完全敲除,但杂合子中DDX21蛋白表达量显著下降,能够进行后续试验。
|
A. DDX21敲除细胞克隆株PCR鉴定(M. 100 bp DNA ladder H3 RTU);B. DDX21敲除细胞克隆株Western blot鉴定; C. DDX21敲除细胞克隆株测序鉴定 A. PCR identification of DDX21 knockout cell clones (M. 100 bp DNA ladder H3 RTU); B. Western blot identification of DDX21 knockout cell clones; C. The sequencing results of DDX21 knockout cell clones 图 2 DDX21敲除细胞克隆株鉴定 Fig. 2 Identification of DDX21 knockout cell clones |
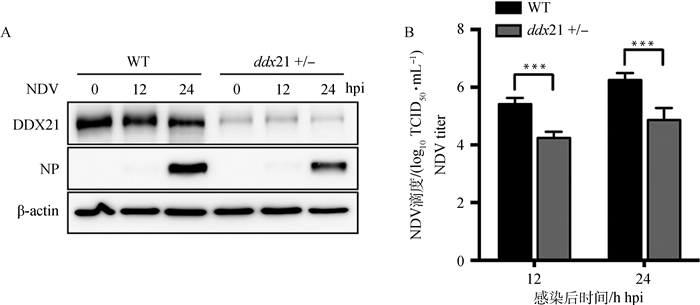
将野生型(WT)HeLa细胞与ddx21+/-细胞计数,以相同MOI数感染NDV,分别在12和24 h后收集细胞样品和上清,Western blot结果显示,感染后24 h,ddx21+/-细胞样品中病毒NP蛋白明显低于WT HeLa细胞(图 3A),病毒TCID50滴定结果显示:DDX21敲除明显抑制NDV复制(图 3B)。
|
A. Western blot检测DDX21敲除对NDV NP表达的影响;B. DDX21敲除对上清中NDV滴度的影响, ***.P < 0.05 A. The effect of DDX21 knockout on NDV NP expression by Western blot analysis; B. The effect of DDX21 knockout on NDV titer in supernatant, ***.P < 0.05 图 3 DDX21基因敲除对NDV复制的影响 Fig. 3 The effect of DDX21 knockout on NDV replication |
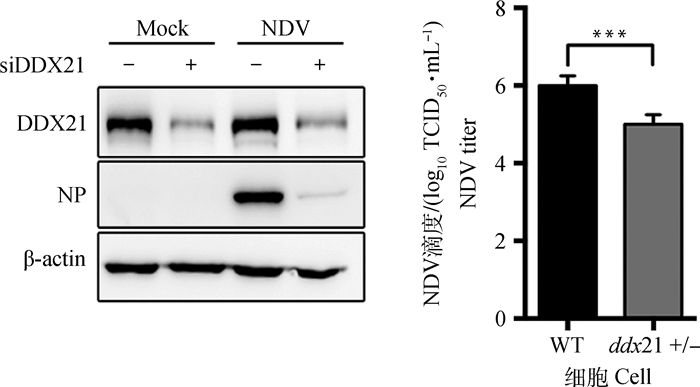
为了进一步验证DDX21在NDV复制中的作用,HeLa细胞分别转染对照无序RNA(scramble RNA)和siDDX21,48 h后感染病毒,24 h后收集细胞样品和上清,结果显示:与DDX21敲除结果类似,DDX21干扰明显抑制病毒NP蛋白的表达(图 4A),上清液中病毒滴度降低(图 4B)。
|
A. Western blot检测DDX21干扰对NDV NP表达的影响;B. DDX21干扰对上清中NDV滴度的影响, ***.P < 0.05 A. The effect of DDX21 knockdown on NDV NP expression by Western blot analysis; B. The effect of DDX21 knockdown on NDV titer in supernatant, ***.P < 0.05 图 4 DDX21基因干扰对NDV复制的影响 Fig. 4 The effect of DDX21 knockdown on NDV replication |
CRISPR/Cas9目前已经成为一种最高效的基因编辑手段,比经典的锌指核酸内切酶(zinc finger endonuclease,ZFN)和类转录激活因子效应物核酸酶(transcription activator-like effector nuclease,TALEN)介导的基因编辑技术更简单、高效[17]。本研究用到的pGK1.1包含Cas9核酸酶表达框和gRNA克隆框,并有嘌呤霉素筛选标记,单个载体电转完成基因组DNA精准、低脱靶的基因编辑。
DDX和DHX解旋酶在解旋DNA和RNA过程中发挥重要作用,因此许多DDX在维持细胞基因组稳定过程中发挥重要作用。例如DDX19能够解旋DNA:RNA(R环),在DNA损伤条件下,能够抑制基因组的不稳定性[18]。SIRT7和DDX21能够协作解旋基因组R环,从而保证基因组的稳定性[19]。另外,DDX21能够作为RNA聚合酶Ⅰ和Ⅱ的转录传感器,促进核糖体RNA的加工和转录[20]。这些结果表明,作为一种重要的RNA解旋酶,DDX21在维持基因组稳定过程中发挥重要作用。本研究中,经过3轮亚克隆,均未获得阳性纯合子,尤其在第三轮筛选中,在测序340 bp目的带时发现测序结果出现明显的套峰现象,说明sgRNA-2和sgRNA-3的敲除效率较高。但后续筛选并未得到一个纯合子克隆,推测原因可能是DDX21与细胞生长和分裂密切相关,敲除的DDX21纯合子在扩培到足够数量前已死亡。迄今为止的DDX21研究中还未有DDX21敲除细胞或小鼠的报道,针对其他DDX的相关研究也证明某些DDX对细胞或小鼠的生长至关重要,无法获得敲除纯合子。DDX24是一种干扰素诱导解旋酶,研究者能够获得正常ddx24+/-杂合子小鼠,但是所有ddx24-/-纯合子小鼠均在胚胎期死亡[21]。另有研究结果表明:ddx5-/-小鼠在胚胎期11.5 d前死亡,ddx17-/-小鼠能够正常出生,但仅能存活2 d[22]。尽管如此,本研究中获得的DDX21敲除杂合子中DDX21的表达量较野生型细胞相比有显著下降,能够作为研究DDX21功能的工具。
DDX21被认为是发挥正调控先天性免疫和抗病毒的分子[10, 12-13],但是,流感病毒的NS1能够拮抗DDX21的抗病毒作用[13]。本研究中,DDX21的敲除和干扰均显著抑制NDV的复制,说明DDX21发挥促进NDV复制的作用。NDV能够通过多种手段抑制宿主抗病毒先天性免疫和应激反应,本实验室前期研究结果表明:NDV的V蛋白能够降解磷酸化的STAT1,抑制干扰素信号通路[23]。另外,NDV还能够通过调控宿主细胞的应激颗粒,细胞自噬等促进病毒复制[24-25]。因此,为了保证NDV在细胞中的高效复制,其能通过多种策略拮抗甚至是利用宿主的抗病毒反应,为自身复制服务。本研究中,作为一种先天性免疫伴侣分子,DDX21促进NDV复制,说明NDV能够利用DDX21促进病毒复制。由于NDV感染过程中能够产生双链RNA,而DDX21是一种RNA解旋酶,因此推测DDX21可能在NDV双链RNA解旋形成病毒基因组RNA过程中发挥关键作用,具体机制还有待进一步阐明,本研究丰富了NDV拮抗宿主先天性免疫策略,为研究其在细胞中高效复制的机制研究奠定了基础。
4 结论利用CRISPR/Cas9技术构建了DDX21敲除细胞杂合子,鉴定得到的杂合子中DDX21表达量显著降低,并通过基因敲除结合基因干扰试验证实DDX21能够促进NDV复制。
| [1] | WU Y. Unwinding and rewinding:double faces of helicase?[J]. J Nucleic Acids, 2012, 2012: 140601. |
| [2] | UMATE P, TUTEJA N, TUTEJA R. Genome-wide comprehensive analysis of human helicases[J]. Commun Integr Biol, 2011, 4(1): 118–137. DOI: 10.4161/cib.13844 |
| [3] | TANNER N K, LINDER P. DExD/H box RNA helicases:from generic motors to specific dissociation functions[J]. Mol Cell, 2001, 8(2): 251–262. DOI: 10.1016/S1097-2765(01)00329-X |
| [4] | ABDELHALEEM M, MALTAIS L, WAIN H. The human DDX and DHX gene families of putative RNA helicases[J]. Genomics, 2003, 81(6): 618–622. DOI: 10.1016/S0888-7543(03)00049-1 |
| [5] | YONEYAMA M, KIKUCHI M, NATSUKAWA T, et al. The RNA helicase RIG-I has an essential function in double-stranded RNA-induced innate antiviral responses[J]. Nat Immunol, 2004, 5(7): 730–737. DOI: 10.1038/ni1087 |
| [6] | SAITO T, HIRAI R, LOO Y M, et al. Regulation of innate antiviral defenses through a shared repressor domain in RIG-I and LGP2[J]. Proc Natl Acad Sci U S A, 2007, 104(2): 582–587. DOI: 10.1073/pnas.0606699104 |
| [7] | YONEYAMA M, KIKUCHI M, MATSUMOTO K, et al. Shared and unique functions of the DExD/H-box helicases RIG-I, MDA5, and LGP2 in antiviral innate immunity[J]. J Immunol, 2005, 175(5): 2851–2858. DOI: 10.4049/jimmunol.175.5.2851 |
| [8] | VALIENTE-ECHEVERRÍA F, HERMOSO M A, SOTO-RIFO R. RNA helicase DDX3:at the crossroad of viral replication and antiviral immunity[J]. Rev Med Virol, 2015, 25(5): 286–299. DOI: 10.1002/rmv.v25.5 |
| [9] | ZHAO S C, GE X N, WANG X L, et al. The DEAD-box RNA helicase 5 positively regulates the replication of porcine reproductive and respiratory syndrome virus by interacting with viral Nsp9 in vitro[J]. Virus Res, 2015, 195: 217–224. DOI: 10.1016/j.virusres.2014.10.021 |
| [10] | DONG Y C, YE W, YANG J, et al. DDX21 translocates from nucleus to cytoplasm and stimulates the innate immune response due to dengue virus infection[J]. Biochem Biophys Res Commun, 2016, 473(2): 648–653. DOI: 10.1016/j.bbrc.2016.03.120 |
| [11] | FLORES-ROZAS H, HURWITZ J. Characterization of a new RNA helicase from nuclear extracts of HeLa cells which translocates in the 5' to 3' direction[J]. J Biol Chem, 1993, 268(28): 21372–21383. |
| [12] | ZHANG Z Q, KIM T, BAO M S, et al. DDX1, DDX21, and DHX36 helicases form a complex with the adaptor molecule TRIF to sense dsRNA in dendritic cells[J]. Immunity, 2011, 34(6): 866–878. DOI: 10.1016/j.immuni.2011.03.027 |
| [13] | CHEN G F, LIU C H, ZHOU L G, et al. Cellular DDX21 RNA helicase inhibits influenza A virus replication but is counteracted by the viral NS1 protein[J]. Cell Host Microbe, 2014, 15(4): 484–493. DOI: 10.1016/j.chom.2014.03.002 |
| [14] | ALEXANDER D J. Newcastle disease and other avian paramyxoviruses[J]. Rev Sci Tech, 2000, 19(2): 443–462. DOI: 10.20506/rst.issue.19.2.14 |
| [15] | FIOLA C, PEETERS B, FOURNIER P, et al. Tumor selective replication of Newcastle disease virus:association with defects of tumor cells in antiviral defence[J]. Int J Cancer, 2006, 119(2): 328–338. DOI: 10.1002/(ISSN)1097-0215 |
| [16] | HSU P D, LANDER E S, ZHANG F. Development and applications of CRISPR-Cas9 for genome engineering[J]. Cell, 2014, 157(6): 1262–1278. DOI: 10.1016/j.cell.2014.05.010 |
| [17] | YU Z S, REN M D, WANG Z X, et al. Highly efficient genome modifications mediated by CRISPR/Cas9 in Drosophila[J]. Genetics, 2013, 195(1): 289–291. DOI: 10.1534/genetics.113.153825 |
| [18] | HODROJ D, SERHAL K, MAIORANO D. Ddx19 links mRNA nuclear export with progression of transcription and replication and suppresses genomic instability upon DNA damage in proliferating cells[J]. Nucleus, 2017, 8(5): 489–495. DOI: 10.1080/19491034.2017.1348448 |
| [19] | SONG C L, HOTZ-WAGENBLATT A, VOIT R, et al. SIRT7 and the DEAD-box helicase DDX21 cooperate to resolve genomic R loops and safeguard genome stability[J]. Genes Dev, 2017, 31(13): 1370–1381. DOI: 10.1101/gad.300624.117 |
| [20] | CALO E, FLYNN R A, MARTIN L, et al. RNA helicase DDX21 coordinates transcription and ribosomal RNA processing[J]. Nature, 2015, 518(7538): 249–253. DOI: 10.1038/nature13923 |
| [21] | MA Z, MOORE R, XU X X, et al. DDX24 negatively regulates cytosolic RNA-mediated innate immune signaling[J]. PLoS Pathog, 2013, 9(10): e1003721. DOI: 10.1371/journal.ppat.1003721 |
| [22] | JANKNECHT R. Multi-talented DEAD-box proteins and potential tumor promoters:p68 RNA helicase (DDX5) and its paralog, p72 RNA helicase (DDX17)[J]. Am J Transl Res, 2010, 2(3): 223–234. |
| [23] | QIU X S, FU Q, MENG C C, et al. Newcastle disease virus V protein targets phosphorylated STAT1 to block IFN-I signaling[J]. PLoS One, 2016, 11(2): e0148560. DOI: 10.1371/journal.pone.0148560 |
| [24] | SUN Y J, DONG L N, YU S Q, et al. Newcastle disease virus induces stable formation of bona fide stress granules to facilitate viral replication through manipulating host protein translation[J]. FASEB J, 2017, 31(4): 1337–1353. DOI: 10.1096/fj.201600980R |
| [25] | SUN Y J, YU S Q, DING N, et al. Autophagy benefits the replication of Newcastle disease virus in chicken cells and tissues[J]. J Virol, 2014, 88(1): 525–537. DOI: 10.1128/JVI.01849-13 |



