脂肪组织在动物机体中发挥着重要作用,参与调控很多生理功能,主要负责机体能量的储存和代谢,还影响动物的肉品质和口感。硬脂酰辅酶A去饱和酶(stearoyl-CoA desaturase, SCD)在脂肪组织中高度表达[1],具有生脂作用[2],是调节脂肪代谢的潜在靶点[3]。动物体内脂肪沉积所需要的脂肪酸主要来自脂肪酸的从头合成途径。SCD可将脂肪酸从头合成过程中产生的棕榈酸和硬脂酸去饱和分别生成棕榈油酸和油酸,通过调节不饱和脂肪酸和饱和脂肪酸的比例影响细胞膜的流动和信号转导,进而参与脂肪代谢[4]。SCD还可以通过其他方式参与脂肪代谢。研究显示,SCD是重要的瘦素调节基因,对瘦素具有下调作用[5]。
miRNA是一类长约22 nt的内源性非编码RNA,主要通过调控基因表达参与生命代谢过程。像miR-200家族主要在癌症和脂肪代谢中起作用。miR-200可通过调节CXCL12β (chemokine (C-X-C motif) ligand 12)在卵巢癌中的表达来影响成纤维细胞异质性和免疫抑制[6]。miR-8/miR-200靶向USH/FOG基因增强PI3K活性,促进果蝇脂肪细胞自主生长[7]。对miRNA调节SCD1的研究已有报道。例如,miR-192b-5p靶向SCD1基因抑制人非酒精性脂肪肝疾病中脂质的积累[8]。miR-29a靶向SCD抑制罗非鱼肝中脂质积累[9]。miR-212-5p通过靶向SCD1抑制小鼠肝脂肪生成[10]。miR-125b靶向SCD1抑制皮下脂肪生成[11]。已有的研究发现,SCD1在不同物种脂肪组织中的表达均受miRNAs的调控。而且,SCD1可同时受多个miRNAs调控。但是,这些研究主要集中在人、鼠、鱼和猪等物种,关于miRNAs调节绵羊皮下脂肪细胞中SCD1表达的研究尚未见报道。
本研究利用生物信息学方法预测出与SCD1具有潜在靶标关系的miRNAs,然后利用试验手段解析miRNAs对体外培养的绵羊皮下脂肪细胞中SCD1基因表达的影响,为阐明绵羊皮下脂肪细胞生成的网络调控机制提供新视角。
1 材料与方法 1.1 材料 1.1.1 试验材料试验动物为1月龄小尾寒羊。将其屠宰后迅速采集其背部皮下脂肪组织,用75%的酒精消毒后置于无菌PBS缓冲液(含1%双抗)中带回。一部分样品剪成约1 cm3,用锡纸包裹装入冻存管中,-80 ℃保存,用于总RNA的提取;另一部分剪碎,用Ⅱ型胶原酶消化,液氮中保存,用于细胞培养。
1.1.2 主要试剂氯仿和异丙醇购自天津市北辰方正试剂厂;75%的酒精购自河北瑞康医药科技有限公司;Trans5α感受态细胞、T4连接酶、限制性内切酶Xho Ⅰ和Sal Ⅰ、RNAiso Plus、SYBR Premix Ex TaqTM Ⅱ试剂盒和PrimeScript® RT reagent kit反转录试剂盒均购自TaKaRa公司;Endo-free Plasmid Mini Kit Ⅱ(50)和Plasmid Mini Kit Ⅰ(100)均购自OMEGA公司;磷酸缓冲盐溶液(PBS)粉末、Tween-20、Ⅱ型胶原酶购自索莱宝生物科技有限公司;Dual-Luciferase Reporter Assay System试剂盒购自Promega公司;DMEM/F-12 (HAM)、DMEM/low Glucose和DMEM/High Glucose等3种培养基及胎牛血清(fetal bovine serum, FBS)购自Biological Industries;Lipofectamine 2000购自Invitrogen公司;双抗和胰蛋白酶购自Gibco公司;蛋白裂解液购自上海碧云天公司;蛋白酶抑制剂和PMSF购自博士德公司;SCD1抗体购自Abcam公司。
1.2 方法 1.2.1 与SCD1基因有靶标关系的miRNAs的预测利用生物信息学软件TargetScan[12]、mirDB[13]、StarBase[14]和miRanda[15]预测与SCD1具有靶标关系的miRNAs。使用在线软件Venny2.1对预测结果做韦恩图取交集。经初步分析,选用miR-200c和miR-429作为研究对象。
1.2.2 引物设计与合成根据NCBI核酸数据库(https://www.ncbi.nlm.nih.gov/genbank/)中公布的绵羊SCD1基因的mRNA序列(登录号:NM_001009254.1),利用NCBI中Primer BLAST设计绵羊SCD1-CDS荧光定量PCR引物和SCD1-3′UTR引物。miRNA引物采用茎环法设计。以U6为miRNA的内参基因,18S rRNA为基因表达内参基因。引物由北京六合华大基因科技股份有限公司(基因)和上海生物工程股份有限公司(miRNA)合成。引物序列见表 1。
|
|
表 1 实时荧光定量PCR和载体构建所用引物序列及内参引物序列 Table 1 Primer sequences for qPCR, plasmid construction and reference genes |
按照RNAiso Plus说明书,提取绵羊脂肪组织的总RNA,测定总RNA质量和浓度。用1%琼脂糖凝胶电泳检测RNA的完整性。将所得RNA反转录成cDNA,以cDNA为模板,对SCD1-3′UTR序列进行扩增。用1%琼脂糖凝胶电泳检测并获得目的片段,割胶回收,然后进行纯化。利用Xho Ⅰ、Sal Ⅰ内切酶对SCD1-3′UTR的PCR产物和pmir-GLO载体分别进行双酶切,然后进行胶回收和纯化。
将纯化后的SCD1-3′UTR的PCR产物和pmir-GLO产物进行连接。体系为:6 μL酶切后目的片段,2 μL酶切后pmir-GLO,1 μL的T4连接酶,4 μL的Rnase free H2O,4 ℃过夜。连接产物转至感受态细胞中,涂布在加有Ampicillin Na的LB固体培养基上,37 ℃恒温培养箱过夜。挑取单个菌落于LB液体培养基中摇菌,菌液送公司测序。测序鉴定成功的重组质粒命名为pmir-SCD1。
1.2.4 双荧光报告系统检测将HEK293T细胞培养于24孔板中。待细胞密度达到80%左右时,按照Lipofectamine 2000说明书对细胞进行转染。试验分为2组,每组设置3个重复。分别共转染pmir-SCD1与miR-200c mimic和miR-429 mimic为过表达组;分别共转染pmir-SCD1与miR-200c NC和miR-429 NC为阴性对照组。转染48 h后,利用Dual-Luciferase Reporter Assay System试剂盒进行检测。
1.2.5 绵羊皮下脂肪细胞培养与转染绵羊皮下脂肪细胞的培养:将采集的绵羊皮下脂肪组织带回细胞房,用剪刀剪至碎末,放入用基础培养基配置好的Ⅱ型胶原酶中,混匀振荡仪中300 r·min-1振荡消化。当脂肪组织成匀浆状时,加入等体积的完全培养基终止消化,700×g,25 ℃离心10 min。挑走上层脂肪油,弃掉上清液,重悬底部沉淀。悬浮液用200和400目网筛过滤,收集滤液。加入适量的完全培养基(普通培养基DMEM/low Glucose中加入1%双抗和10%胎牛血清(FBS)),在37 ℃,5% CO2培养箱中培养。细胞铺满皿底后接种于6孔板中。
绵羊皮下脂肪细胞的转染:将绵羊皮下脂肪细胞接种于6孔板中,待细胞密度达到80%左右时,按照Lipofectamine 2000说明书对细胞进行转染。试验分为两部分,第一部分为单转染,分为3组,转染miR-200c(或miR-429)mimic为过表达组,转染miR-200c(或miR-429)NC为阴性对照组,转染miR-200c(或miR-429)inhibitor为抑制表达组。每组设置3个重复。转染后24 h收集细胞,提取总RNA;转染后48 h收集细胞,提取总蛋白。显微镜下观察细胞状态。然后,用RT-PCR检测转染后miR-200c、miR-429和SCD1 mRNA的表达量,用Western-blotting检测转染后SCD1蛋白表达量。
第二部分为共转染,分为5组。即共转染miR-200c和miR-429 mimics、miR-200c和miR-429 inhibitor、miR-200c mimic和miR-429 inhibitor、miR-200c inhibitor和miR-429 mimic、miR-200c和miR-429 NC。每组设置3个重复。转染后24 h收集细胞,提取总RNA,用RT-PCR检测转染后SCD1 mRNA的表达量。
1.2.6 绵羊皮下脂肪细胞中miR-200c、miR-429和SCD1 mRNA的表达量检测miRNA表达量检测:对所提取RNA进行miRNA反转录。反应体系为:Special primer (10 μmol·L-1) miRNA 0.5 μL,U6R 0.5 μL,5×PrimeScript Buffer (for Real Time) 2 μL,RNA≤500 ng,PrimeScript RT Enzyme Mix Ⅰ 0.5 μL,Rnase free DH2O加至10 μL。反应程序为:37 ℃ 15 min, 85 ℃ 5 s, 4 ℃保存。将反转录后的cDNA稀释到50 ng·μL-1,用SYBR® Premix Ex TaqTM Ⅱ试剂盒进行实时荧光定量PCR,反应体系为:cDNA模板1 μL,miRNAs Specific primer (10 μmol·L-1) 0.4 μL,统一反向引物(10 μmol·L-1)0.4 μL,SYBR® Premix Ex TaqTM (2×) 5 μL,ROX Reference Dye Ⅱ (<) 0.2 μL,ddH2O 3 μL,总体积为10 μL。将以上反应体系放入7500荧光定量PCR仪(ABI公司)中,反应程序为:(1)预变性:95 ℃ 30 s;(2)PCR反应阶段:95 ℃ 15 s,60 ℃ 34 s(此步骤共进行45个循环);(3)熔解曲线分析阶段:95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s。
SCD1 mRNA表达量检测:用SYBR®Premix Ex TaqTM Ⅱ试剂盒进行实时荧光定量PCR。反应体系为:SYBR® Premix Ex TaqTM (2×) 10 μL,ROX Reference Dye Ⅱ (50×) 0.4 μL,SCD1正向引物(10 μmol·L-1)0.8 μL,反向引物(10 μmol·L-1)0.8 μL,cDNA产物2 μL,ddH2O 6 μL,总体积20 μL。反应程序为:(1)预变性:95 ℃ 30 s;(2)PCR反应阶段:95 ℃ 5 s,60 ℃ 34 s,共45个循环;(3)熔解曲线分析阶段:95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s。
1.2.7 绵羊皮下脂肪细胞中总蛋白的提取与SCD1蛋白表达量检测将上述所提蛋白与变性试剂以4:1比例配制,100 ℃变性10 min。然后,以每孔40 μg上样量进行点样,80 ℃ 30 min,120 ℃ 90 min进行电泳。待溴酚蓝跑至底部时,利用湿转仪将所需蛋白从凝胶转移至NC膜上,用5%的脱脂奶粉(用PBS溶解)封闭1 h。随后进行抗体孵育,一抗4 ℃过夜孵育(SCD抗体或GAPDH抗体以1:1 000比例稀释),PBST缓冲液洗4次,每次洗5 min。二抗孵育1 h(羊抗兔IgG-HRP以1:20 000比例稀释),PBST缓冲液冲洗4次,每次洗5 min。扫描后观察结果。
1.2.8 数据处理与分析用2-ΔΔCt法计算miR-200c、miR-429和SCD1的相对表达量。对于双荧光报告系统检测结果和miR-200c、miR-429的表达量,使用独立样本t检验分析。对于SCD1基因的表达量,单转染miR-200c和miR-429时采用独立样本t检验。共转染miR-200c和miR-429时采用以组为因子的单因素方差分析(SPSS 17.0(SPSS Inc, Chicago, Ill, USA))。所有图形用GraphPad Prism 7.0(GraphPad Software Inc, San Diego, CA, USA)绘制。
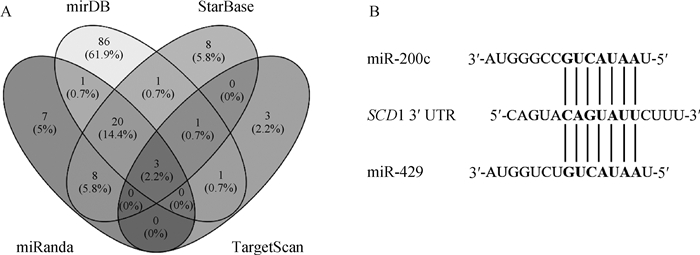
2 结果 2.1 与绵羊SCD1基因具有靶标关系的miRNAs预测用TargetScan、mirDB、StarBase和miRanda分别预测出11、112、33和39个miRNAs。韦恩图显示,与SCD1具有靶标关系的3个miRNAs分别为miR-200c、miR-429和miR-216a(图 1A)。miR-200c和miR-429的种子区序列(2~8)碱基均与SCD1第1 395~1 401个碱基完全互补,即具有同一个结合位点。已有的研究表明,miR-200家族在脂肪组织中表达量较高,而且本试验旨在研究拥有共同结合位点的2个miRNAs对SCD1表达量的影响。因此,本试验以miR-200c和miR-429为研究对象。
|
A.预测出的与SCD1基因具有靶标关系的miRNAs;B. SCD1与2个miRNAs的结合位点 A. Predicted miRNAs potentially targeting SCD1 gene; B. Binding sites between SCD1 gene and 2 miRNAs 图 1 预测出的与SCD1基因具有靶标关系的miRNAs及其结合位点 Fig. 1 Predicted miRNAs potentially targeting SCD1 gene and its binding sites |
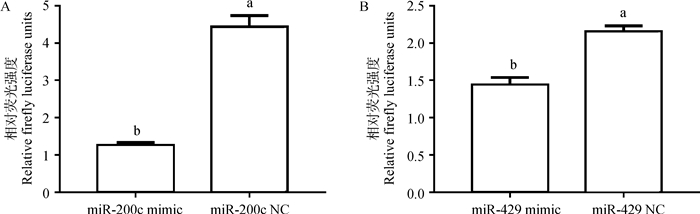
过表达miR-200c和miR-429后的荧光活性见图 2。可见,过表达miR-200c后的荧光活性(1.26±0.07)极显著地低于阴性对照组(4.44±0.30)(P < 0.01,图 2A)。同样,过表达miR-429后的荧光活性(1.44±0.18)也极显著地低于阴性对照组(2.15±0.08)(P < 0.01,图 2B)。说明miR-200c和miR-429均与SCD1 -3′ UTR靶位点结合抑制了荧光信号的产生。比较图 2A和图 2B发现,miR-200c对荧光信号的抑制作用强于miR-429。
|
不同字母表示差异极显著(P < 0.01),图 6同 The different letters indicate highly significant difference(P < 0.01), the same as figure 6 图 2 过表达miR-200c(A)和miR-429(B)后pmir-SCD1 3′UTR的相对荧光强度 Fig. 2 The relative fluorescence intensity of pmir-SCD1 3′UTR after over-expressing miR-200c(A)and miR-429(B) |
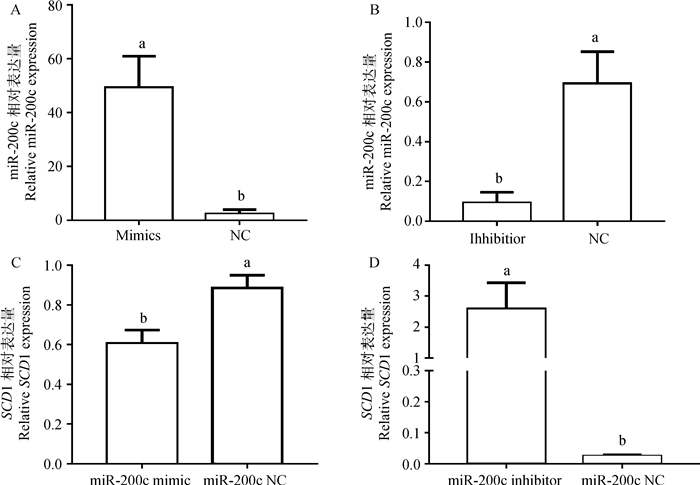
对于miR-200c的表达量,过表达组(49.34±11.60)显著高于阴性对照组(2.37±1.64)(P < 0.05,图 3A),抑制组(0.09±0.05)显著低于阴性对照组(0.69±0.16)(P < 0.05,图 3B)。表明,miR-200c mimic和miR-200c inhibitor均成功转入了绵羊皮下脂肪细胞中。对于SCD1 mRNA的表达量,过表达组(0.61±0.07)显著低于阴性对照组(0.89±0.06)(P < 0.05,图 3C),抑制组(2.59±0.84)显著高于阴性对照组(0.02±0.004)(P < 0.05,图 3D)。说明miR-200c负调控SCD1 mRNA的表达。
|
A.转染miR-200c mimic后miR-200c的表达量;B.转染miR-200c inhibitor后miR-200c的表达量;C.转染miR-200c mimic后SCD1的表达量;D.转染miR-200c inhibitor后SCD1的表达量。不同字母表示差异显著(P < 0.05),图 4同 A. miR-200c expression transfected with miR-200c mimic; B. miR-200c expression transfected with miR-200c inhibitor; C.SCD1 mRNA expression transfected with miR-200c mimic; D. SCD1 mRNA expression transfected with miR-200c inhibitor. The different letters indicate significant difference (P < 0.05), the same as figure 4 图 3 miR-200c过表达和抑制表达后miR-200c和SCD1在绵羊皮下脂肪细胞中的表达量 Fig. 3 The expression of miR-200c and SCD1 in ovine subcutaneous adipocytes after over- and inhibited-expressing miR-200c |
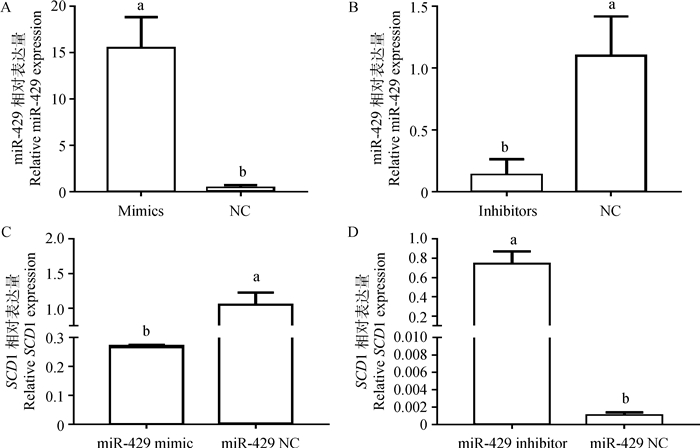
对于miR-429的表达量,过表达组(15.49±3.33)显著高于阴性对照组(0.04±0.28)(P < 0.05,图 4A),抑制组的(0.14±1.13)显著低于阴性对照组(1.10±0.32)(P < 0.05,图 4B)。表明miR-429 mimic和miR-429 inhibitor均成功转入了绵羊皮下脂肪细胞中。对于SCD1的表达量,过表达组(0.27±0.0036)显著低于阴性对照组(1.05±0.17)(P < 0.05,图 4C),抑制组(0.74±0.13)显著高于阴性对照组(0.001 1±0.000 3)(P < 0.05,图 4D)。表明miR-429也负调控SCD1 mRNA的表达。
|
A.转染miR-429 mimic后miR-429的表达量;B.转染miR-429 inhibitor后miR-429的表达量;C.转染miR-429 mimic后SCD1的表达量;D.转染miR-429 inhibitor后SCD1的表达量 A. miR-429 expression transfected with miR-429 mimic; B. miR-429 expression transfected with miR-429 inhibitor; C. SCD1 mRNA expression transfected with miR-429 mimic; D. SCD1 mRNA expression transfected with miR-429 inhibitor 图 4 miR-429过表达和抑制表达后miR-429和SCD1在绵羊皮下脂肪细胞中的表达量 Fig. 4 The expression of miR-429 and SCD1 in ovine subcutaneous adipocytes after over- and inhibited-expressing miR-429 |
图 5显示的是共转染miR-200c和miR-429后SCD1 mRNA的表达变化。可见,共转染2个miRNAs inhibitors组(1.26±0.23)的SCD1 mRNA表达量极显著(P < 0.001)高于NC组(0.72±0.03),后者极显著(P < 0.001)高于共同转染两个miRNAs mimics组(0.034±0.016)的表达量。说明,miR-200c和miR-429共同作用时会抑制SCD1的表达。
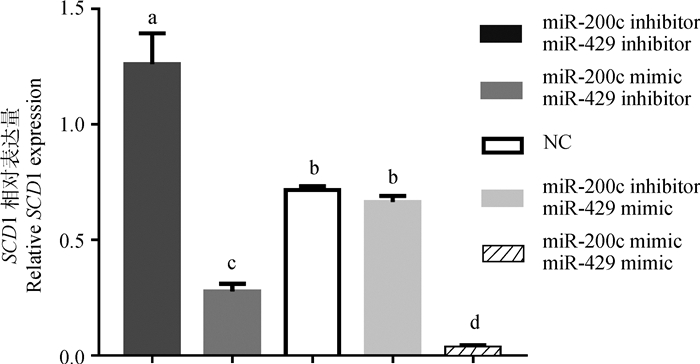
|
a或d表示差异极显著(P < 0.001),b表示差异不显著(P>0.05),c表示差异极显著(P < 0.01) a or d indicate highly significant difference(P < 0.001), b indicate no significant difference(P>0.05), c indicate highly significant difference(P < 0.01) 图 5 共转染miR-200c和miR-429后SCD1 mRNA的表达量 Fig. 5 SCD1 mRNA expression after co-transfection for miR-200c and miR-429 |
共转染miR-200c mimic和miR-429 inhibitor组SCD1 mRNA的表达量(0.28±0.05)极显著(P < 0.01)低于NC组(0.72±0.03),而共同转染miR-200c inhibitor和miR-429 mimic组(0.66±0.047)的SCD1 mRNA表达量与NC组(0.72±0.03)无显著性差异(P>0.05)。说明,在2个miRNAs中,miR-200c对SCD1 mRNA表达调控的作用更强。
2.6 转染miR-200c和miR-429后绵羊皮下脂肪细胞中SCD1蛋白的表达图 6显示的是分别转染miR-200c和miR-429后SCD1的表达水平。其中,A1和B1为Western-blotting条带图,A2和B2为蛋白表达量。可见,分别过表达2个miRNAs后SCD1的表达量极显著低于相应的阴性对照组(P < 0.01);同样对照组也极显著低于抑制表达后SCD1的表达量(P < 0.01)。说明,miR-200c和miR-429负调控SCD1蛋白的表达。
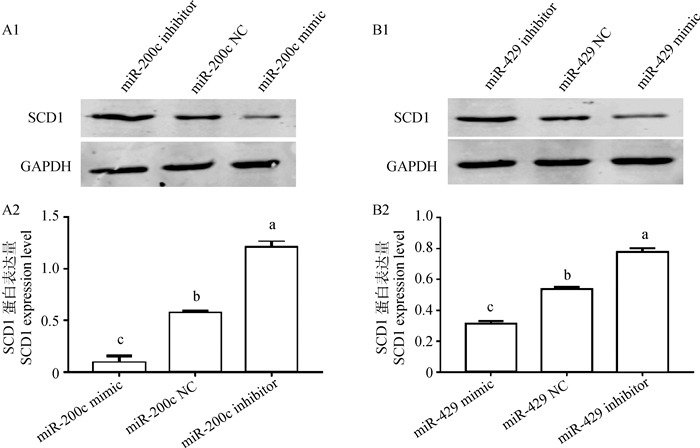
|
A1、A2.分别为转染miR-200c后蛋白条带图和蛋白表达量;B1、B2.分别为转染miR-429后蛋白条带图和蛋白表达量 A1, A2. Western-blotting diagram (A1) and protein expression level (A2) after transfected for miR-200c; B1, B2. Western-blotting diagram (B1) and protein expression level (B2) after transfected for miR-429 图 6 分别转染miR-200c和miR-429后绵羊皮下脂肪细胞中SCD1的表达量 Fig. 6 The expression of SCD1 in ovine subcutaneous adipocytes after transfection for miR-200c and miR-429, respectively |
在细胞培养的第8天显微镜观察,发现分别过表达miR-200c和miR-429 2个组的脂滴数少于NC组,更少于相应的抑制表达组(图 7)。表明,miR-200c和miR-429均可抑制绵羊皮下脂滴生成。
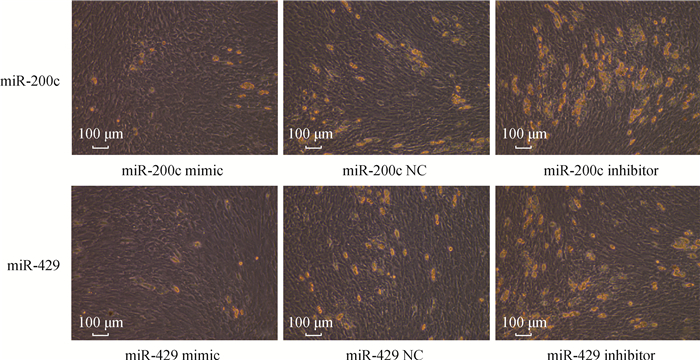
|
黄色部分是脂滴 The yellow parts are lipid droplets 图 7 转染miR-200c和miR-429后第8天绵羊皮下脂肪组织中脂滴积累情况(100×) Fig. 7 Lipid droplets observed in ovine subcutaneous fat tissue at 8th day after transfection of miR-200c and miR-429 (100×) |
本研究中,利用在线软件预测的与SCD1具有靶标关系的miRNAs分别是miR-429、miR-200c和miR-216a。miR-200家族成员包括miR-200a、miR-200b、miR-200c、miR-429和miR-141。其中,miR-200b和miR-429与miR-200c位于不同染色体上但拥有相同的种子区(AAUACUG)[16]。miR-216家族成员包括miR-216a和miR-216b两个成员,其种子区序列分别是AAUCUCU和AAUCACA。基于miRNAs的高度保守性和同家族成员之间拥有相同种子区的功能相似性[17],miR-200b与miR-429和miR-200c、miR-216b与miR-216a是否有相似功能,本研究进行了讨论。已有的研究表明,在高脂小鼠与正常小鼠脂肪组织(腹股沟脂肪组织、棕色脂肪组织、肝脂肪组织和附睾脂肪组织)中的miR-200表达量有明显差异[18-19]。miR-216a主要在胰腺腺泡细胞中表达[20],是胰腺外分泌损伤的标志物[21]。miR-216a对脂肪代谢的调节研究未见报道。本试验选取miR-429和miR-200c。关于miR-216a是否调节SCD1的表达有待后续研究。
已有的研究表明,多个miRNAs可同时靶向同一个基因,大部分miRNAs是抑制基因表达。例如,miR-124-3p靶向并抑制BCKDHA基因(branched chain keto acid dehydrogenase α, 支链酮酸脱氢α)在绵羊脂肪细胞中的表达[22]。miR-142和miR-144通过靶向并抑制FoxO1 (forkhead box protein O1,叉头状蛋白O1)的表达,进而抑制转录因子PPARγ表达,从而促进绵羊前体脂肪细胞的分化[23]。miR-200通过靶向ZEB1 3′UTR (zinc finger E-box binding homeobox,E盒结合锌指蛋白),使其表达量下调,进而上调炎症基因环氧合酶-2(COX-2)和单核细胞趋化蛋白-1(MCP-1)表达,使得炎症诱导糖尿病[24]。通常来说,种子序列高度同源的miRNAs更容易具有相似的功能[17]。miR-30家族通过靶向Smad1和Runx2负调控BMP-2(bone morphogenetic protein,骨形态发生蛋白)诱导的成骨细胞分化[25]。本研究中,miR-429和miR-200c具有相同的种子区,均靶向抑制同一个基因的表达,这与前人研究相符。而且,这2个miRNAs与SCD1具有相同的结合位点。
有研究发现,除了miRNAs,SCD1还受转录因子的调控。山羊乳腺组织中过表达PPARγ1可以增强SCD1的转录活性而上调其表达[26]。在针对2型糖尿病患者的治疗中发现,PPARγ激动剂可以上调SCD1的表达,并降低其心血管疾病发生率[27]。肝X受体(liver X receptor, LXR)可以直接调节小鼠肝中SCD1的表达[28]。也有研究证明,miRNAs可以直接靶向转录因子。SREBP1是miR-18a-5p的靶点,降低mir-18a-5p的表达,同时过表达SREBP1可以促进乳腺癌的进展和转移[29]。miR-130通过靶向PPARγ加重急性心肌梗死所致的心肌损伤[30]。miR-122靶向SREBP1并正调控其表达,而miR-370可通过上调miR-122促进SREBP1表达[31]。因此,miRNAs可以通过靶向转录因子调节SCD1表达。
那么,miR-200c和miR-429可以靶向转录因子进而调节SCD1的表达吗?有研究发现,miR-200b和miR-200c可以靶向结合转录因子JUN 3′UTR抑制SREBP1的表达(JUN可以结合SREBP1的启动子区域促进其转录激活)进而抑制小鼠肝脂质积累[32]。本研究中,miR-200c和miR-429直接靶向并抑制绵羊皮下脂肪细胞中SCD1的表达。鉴于miRNAs家族成员间的功能相似性,理论上认为,miR-200c和miR-429也可以靶向转录因子JUN抑制SREBP1的表达,进而抑制SCD1的表达。在人宫颈腺癌细胞[33]的研究中发现,miR-216b与JUN具有靶标关系。理论上miR-216a也可以调控JUN。由此得出,miRNAs与SCD1之间通路图,如图 8所示。
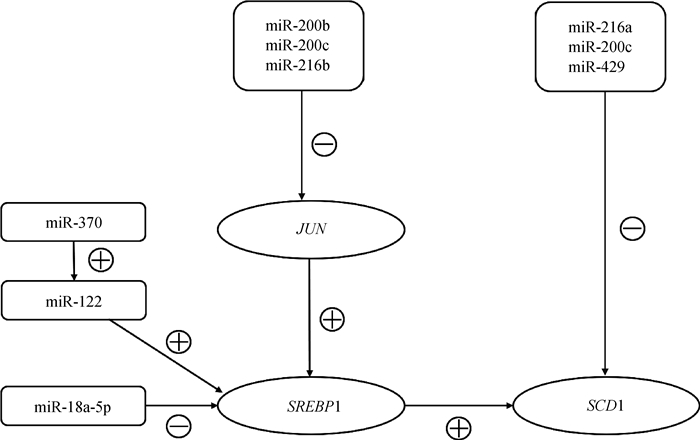
|
方框表示miRNAs;椭圆表示基因。⊕表示正调控;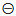 表示负调控
Box means miRNAs; Ellipse means genes.⊕ means positive regulation; 表示负调控
Box means miRNAs; Ellipse means genes.⊕ means positive regulation; 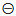 means negative regulation
图 8 miRNAs直接或间接调节SCD的通路图
Fig. 8
Pathways of miRNAs regulating SCD directly or indirectly means negative regulation
图 8 miRNAs直接或间接调节SCD的通路图
Fig. 8
Pathways of miRNAs regulating SCD directly or indirectly
|
本研究通过生物信息学软件预测发现,SCD1基因与miR-200c和miR-429具有相同的结合位点,存在潜在靶标关系。双荧光素酶报告系统试验验证了miR-200c和miR-429与SCD1基因的靶标关系。miRNAs转染结果表明,miR-200c和miR-429均可抑制SCD1 mRNA和蛋白表达,但miR-200c的作用更强。
| [1] | HEINEMANN F S, OZOLS J. Stearoyl-CoA desaturase, a short-lived protein of endoplasmic reticulum with multiple control mechanisms[J]. Prostaglandins Leukot Essent Fatty Acids, 2003, 68(2): 123–133. DOI: 10.1016/S0952-3278(02)00262-4 |
| [2] | DOBRZYN A, NTAMBI J M. The role of stearoyl-CoA desaturase in the control of metabolism[J]. Prostaglandins Leukot Essent Fatty Acids, 2005, 73(1): 35–41. DOI: 10.1016/j.plefa.2005.04.011 |
| [3] | ALJOHANI A M, SYED D N, NTAMBI J M. Insights into stearoyl-CoA desaturase-1 regulation of systemic metabolism[J]. Trends Endocrinol Metab, 2017, 28(12): 831–842. DOI: 10.1016/j.tem.2017.10.003 |
| [4] | MAULUCCI G, COHEN O, DANIEL B, et al. Fatty acid-related modulations of membrane fluidity in cells:detection and implications[J]. Free Radic Res, 2016, 50(S1): S40–S50. |
| [5] | KAKUMA T, LEE Y, UNGER R H. Effects of leptin, troglitazone, and dietary fat on stearoyl CoA desaturase[J]. Biochem Biophys Res Commun, 2002, 297(5): 1259–1263. DOI: 10.1016/S0006-291X(02)02375-6 |
| [6] | GIVEL A M, KIEFFER Y, SCHOLER-DAHIREL A, et al. miR200-regulated CXCL12β promotes fibroblast heterogeneity and immunosuppression in ovarian cancers[J]. Nat Commun, 2018, 9(1): 1056. DOI: 10.1038/s41467-018-03348-z |
| [7] | HYUN S, LEE J H, JIN H, et al. Conserved microRNA miR-8/miR-200 and its target USH/FOG2 control growth by regulating PI3K[J]. Cell, 2009, 139(6): 1096–1108. DOI: 10.1016/j.cell.2009.11.020 |
| [8] | LIU X L, GAO H X, WANG B C, et al. miR-192-5p regulates lipid synthesis in non-alcoholic fatty liver disease through SCD-1[J]. World J Gastroenterol, 2017, 23(46): 8140–8151. DOI: 10.3748/wjg.v23.i46.8140 |
| [9] | QIANG J, TAO Y F, HE J, et al. miR-29a modulates SCD expression and is regulated in response to a saturated fatty acid diet in juvenile genetically improved farmed tilapia (Oreochromis niloticus)[J]. J Exp Biol, 2017, 220(8): 1481–1489. DOI: 10.1242/jeb.151506 |
| [10] | GUO Y, YU J, WANG C, et al. miR-212-5p suppress lipid accumulation by targeting FAS and SCD1[J]. J Mol Endocrinol, 2017, 59(3): 205–217. DOI: 10.1530/JME-16-0179 |
| [11] | CHENG X, XI Q Y, WEI S, et al. Critical role of miR-125b in lipogensis by targeting stearoyl-CoA desaturase-1 (SCD1)[J]. J Anim Sci, 2016, 94(1): 65–76. DOI: 10.2527/jas.2015-9456 |
| [12] | LEWIS B P, BURGE C B, BARTEL D P. Conserved seed pairing, often flanked by adenosines, indicates that thousands of human genes are microRNA targets[J]. Cell, 2005, 120(1): 15–20. DOI: 10.1016/j.cell.2004.12.035 |
| [13] | WONG N, WANG X W. miRDB:an online resource for microRNA target prediction and functional annotations[J]. Nucleic Acids Res, 2015, 43(D1): D146–D152. DOI: 10.1093/nar/gku1104 |
| [14] | LI J H, LIU S, ZHOU H, et al. starBase v2.0:decoding miRNA-ceRNA, miRNA-ncRNA and protein-RNA interaction networks from large-scale CLIP-Seq data[J]. Nucleic Acids Res, 2014, 42(D1): D92–D97. DOI: 10.1093/nar/gkt1248 |
| [15] | JOHN B, ENRIGHT A J, ARAVIN A, et al. Human microRNA targets[J]. PLoS Biol, 2004, 2(11): e363. DOI: 10.1371/journal.pbio.0020363 |
| [16] | FENG X L, WANG Z M, FILLMORE R, et al. miR-200, a new star miRNA in human cancer[J]. Cancer Lett, 2014, 344(2): 166–173. DOI: 10.1016/j.canlet.2013.11.004 |
| [17] | UHLMANN S, ZHANG J D, SCHWÄGER A, et al. miR-200bc/429 cluster targets PLCγ1 and differentially regulates proliferation and EGF-driven invasion than miR-200a/141 in breast cancer[J]. Oncogene, 2010, 29(30): 4297–4306. DOI: 10.1038/onc.2010.201 |
| [18] | TAO C, REN H Y, XU P, et al. Adipocyte miR-200b/a/429 ablation in mice leads to high-fat-diet-induced obesity[J]. Oncotarget, 2016, 7(42): 67796–67807. |
| [19] | CHARTOUMPEKIS D V, ZARAVINOS A, ZIROS P G, et al. Differential expression of microRNAs in adipose tissue after long-term high-fat diet-induced obesity in mice[J]. PLoS One, 2012, 7(4): e34872. DOI: 10.1371/journal.pone.0034872 |
| [20] | ENDO K, WENG H C, KITO N, et al. miR-216a and miR-216b as markers for acute phased pancreatic injury[J]. Biomed Res, 2013, 34(4): 179–188. DOI: 10.2220/biomedres.34.179 |
| [21] | GOODWIN D, ROSENZWEIG B, ZHANG J, et al. Evaluation of miR-216a and miR-217 as potential biomarkers of acute pancreatic injury in rats and mice[J]. Biomarkers, 2014, 19(6): 517–529. DOI: 10.3109/1354750X.2014.944217 |
| [22] | PAN Y Y, JING J J, QIAO L Y, et al. miR-124-3p affects the formation of intramuscular fat through alterations in branched chain amino acid consumption in sheep[J]. Biochem Biophys Res Commun, 2018, 495(2): 1769–1774. DOI: 10.1016/j.bbrc.2017.12.046 |
| [23] |
赵艳艳, 乔利英, 景炅婕, 等. miR-142和miR-144靶向FoxO1基因调节绵羊前体脂肪细胞分化的研究[J]. 畜牧兽医学报, 2018, 49(4): 675–684.
ZHAO Y Y, QIAO L Y, JING J J, et al. Study on the differentiation regulation of miR-142 and miR-144 on ovine preadipocytes by targeting FoxO1 gene[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(4): 675–684. (in Chinese) |
| [24] | ZHANG H N, LIU J, QU D, et al. Inhibition of miR-200c restores endothelial function in diabetic mice through suppression of COX-2[J]. Diabetes, 2016, 65(5): 1196–1207. DOI: 10.2337/db15-1067 |
| [25] | WU T T, ZHOU H B, HONG Y F, et al. miR-30 family members negatively regulate osteoblast differentiation[J]. J Biol Chem, 2012, 287(10): 7503–7511. DOI: 10.1074/jbc.M111.292722 |
| [26] | YAO D, LUO J, HE Q, et al. SCD1 alters long-chain fatty acid (LCFA) composition and its expression is directly regulated by SREBP-1 and PPARγ1 in dairy goat mammary cells[J]. J Cell Physiol, 2017, 232(3): 635–649. DOI: 10.1002/jcp.25469 |
| [27] | IKEDA J, ICHIKI T, TAKAHARA Y, et al. PPARγ agonists attenuate palmitate-induced ER stress through up-regulation of SCD1 in macrophages[J]. PLoS One, 2015, 10(6): e0128546. DOI: 10.1371/journal.pone.0128546 |
| [28] | CHU K K, MIYAZAKI M, MAN W C, et al. Stearoyl-coenzyme A desaturase 1 deficiency protects against hypertriglyceridemia and increases plasma high-density lipoprotein cholesterol induced by liver X receptor activation[J]. Mol Cell Biol, 2006, 26(18): 6786–6798. DOI: 10.1128/MCB.00077-06 |
| [29] | ZHU D X, ZHU W, FANG C, et al. miR-181a/b significantly enhances drug sensitivity in chronic lymphocytic leukemia cells via targeting multiple anti-apoptosis genes[J]. Carcinogenesis, 2012, 33(7): 1294–1301. |
| [30] | CHU X L, WANG Y Q, PANG L W, et al. miR-130 aggravates acute myocardial infarction-induced myocardial injury by targeting PPAR-γ[J]. J Cell Biochem, 2018, 119(9): 7235–7244. DOI: 10.1002/jcb.v119.9 |
| [31] | ILIOPOULOS D, DROSATOS K, HIYAMA Y, et al. microRNA-370 controls the expression of microRNA-122 and Cpt1α and affects lipid metabolism[J]. J Lipid Res, 2010, 51(6): 1513–1523. DOI: 10.1194/jlr.M004812 |
| [32] | GUO J, FANG W W, SUN L B, et al. Reduced miR-200b and miR-200c expression contributes to abnormal hepatic lipid accumulation by stimulating JUN expression and activating the transcription of srebp1[J]. Oncotarget, 2016, 7(24): 36207–36219. |
| [33] | XU Z H, BU Y W, CHITNIS N, et al. miR-216b regulation of c-Jun mediates GADD153/CHOP-dependent apoptosis[J]. Nat Commun, 2016, 7: 11422. DOI: 10.1038/ncomms11422 |



