2. 农业部兽用药物与诊断技术北京科学观测实验站, 北京 100193
2. Scientific Observation and Experiment Station of Veterinary Drugs and Diagnostic Technology of Beijing, Ministry of Agriculture, Beijing 100193, China
猫泛白细胞减少症病毒(feline panleukopenia virus, FPLV)在1928年首次发现,1935年正式命名为猫泛白细胞减少症病毒[1]。20世纪50年代初期,我国开始广泛研究FPLV,1985年李刚等[2]首次从病料中分离到该病毒。FPLV引起患病动物呕吐、腹泻、严重的出血性肠炎和白细胞减少等症状[3],被认为是肉食兽病毒中感染范围最宽、致病性最强的一种[4]。
FPLV属于细小病毒科、细小病毒属成员,病毒粒子呈正二十面体结构,粒子直径为25 nm左右[5]。FPLV是单股DNA病毒,主要编码NS1、NS2非结构蛋白和VP1、VP2结构蛋白。其中,NS1蛋白参与病毒DNA复制,VP2蛋白决定病毒的血凝活性,可诱导机体产生中和抗体[6],且具有自我装配形成病毒样颗粒(VLPs)的能力[7]。FPLV VP2蛋白决定FPLV复制的稳定性及宿主范围,还影响病毒粒子表面结构[6]。笔者从北京某动物医院采集疑似FPLV感染的病猫粪便,利用CRFK细胞进行病毒分离与鉴定,并分析该毒株基因组特性,拟为进一步研究FPLV的遗传进化及有效预防控制该病毒奠定基础。
1 材料与方法 1.1 病料及处理病料采集于北京某动物医院经FPLV试纸条检测结果为阳性的发病猫粪便。将粪便与细胞培养液混匀离心,再使用0.22 μm滤器过滤上清,于-80 ℃保存。
1.2 细胞、菌株与实验动物试验所用的CRFK细胞、Trans 5α感受态细胞由中国农业科学院北京畜牧兽医研究所宠物疫病防控创新团队保存。中华田园猫购自北京某猫养殖场。
1.3 主要试剂DMEM等细胞培养用液购自美国Gibco公司。病毒DNA提取试剂盒(DN40)购自北京艾德莱生物公司。TaKaRa LA Taq等扩增用试剂购自宝生物(大连)有限公司。限制性内切酶等酶切用试剂购自Neb公司。质粒提取试剂盒购自北京全式金生物技术有限公司。FPLV单抗购自安提生物。FITC标记的山羊抗小鼠IgG购自北京中杉金桥公司。
1.4 病毒分离培养将处理过的上清同步接种到CRFK细胞,并设空白对照,每日观察细胞状态。盲传至5代,接毒细胞在第3天出现约80%的细胞病变,反复冻融后,-80 ℃保存。
1.5 形态学鉴定参照文献[8]方法对培养的病毒进行处理,并使用电子显微镜观察病毒粒子的形态。
1.6 PCR鉴定按照刘维全等[9]建立的肉食兽细小病毒通用PCR诊断方法对分离的病毒进行PCR鉴定。
1.7 间接免疫荧光试验参考柏丽华[10]的研究方法进行间接免疫荧光试验。
1.8 血凝(HA)试验在96孔V型微量反应板上,按照二倍稀释法使用1%新鲜猪红细胞测定第5代和第6代分离毒的血凝效价,同时设置空白对照。
1.9 病毒基因组扩增及序列分析 1.9.1 引物设计与合成根据GenBank上登录的FPLV基因组序列(KX434462),使用Primer Premier 5.0软件设计扩增FPLV基因组序列的引物,见表 1。其中,扩增2片段所用引物参考田丽红和华育平[11]设计的引物,扩增6和7片段所用引物参考程楠等[12]设计的两对引物。引物由北京六合华大公司合成。
|
|
表 1 FPLV基因组扩增引物序列 Table 1 The primers used to amplify genomic sequences of FPLV |
取第五代FPLV BJ04株细胞毒,根据北京艾德莱生物公司的病毒基因组DNA提取试剂盒说明书提取病毒DNA。
1.9.3 病毒基因组扩增和测序以FPLV DNA为模板,进行PCR扩增,反应体系50 μL:LA Taq酶0.5 μL,10× LA Buffer 5 μL,dNTPs 8 μL,DNA模板2 μL,上、下游引物各1 μL,无RNase水补足至50 μL。反应程序:95 ℃ 5 min,95 ℃ 1 min,55 ℃ 45 s,72 ℃ 30~120 s,72 ℃ 10 min,35个循环,4 ℃。将PCR产物进行1%琼脂糖凝胶电泳。病毒5′端发卡结构的扩增按照程楠等[12]反应条件进行。PCR扩增产物通过1%琼脂糖凝胶电泳鉴定后,使用上海生工胶回收试剂盒对目的片段进行回收,连接到pMD18-T载体上。经转化挑菌、酶切鉴定后,送往华大公司测序。
1.9.4 FPLV BJ04毒株序列分析使用DNAstar软件对分离株各基因片段进行拼接,并将VP2和NS1基因与GenBank登录的FPLV毒株的VP2和NS1基因进行比对,构建系统进化树,使用MegAlign软件分析基因的同源性。
1.10 动物回归试验用分离毒株第5代细胞培养物人工感染2只2月龄健康中华田园猫,每只口服5 mL,阴性对照组的2只猫口服5 mL细胞培养物,隔离饲养,每天观察猫的精神、食欲和粪便等情况,并收集粪便进行排毒情况检测。
2 结果 2.1 病毒分离无菌处理的粪便上清同步接种CRFK细胞盲传5代后,接毒细胞出现肿胀、变圆并拉网聚堆、脱落等明显细胞病变,对照组细胞边界整齐,形态均一(图略),将其命名为FPLV BJ04株。
2.2 电镜观察在电子显微镜下观察到圆形、无囊膜包裹、直径约25 nm的病毒粒子(图略),与其他FPLV毒株形态基本相似。
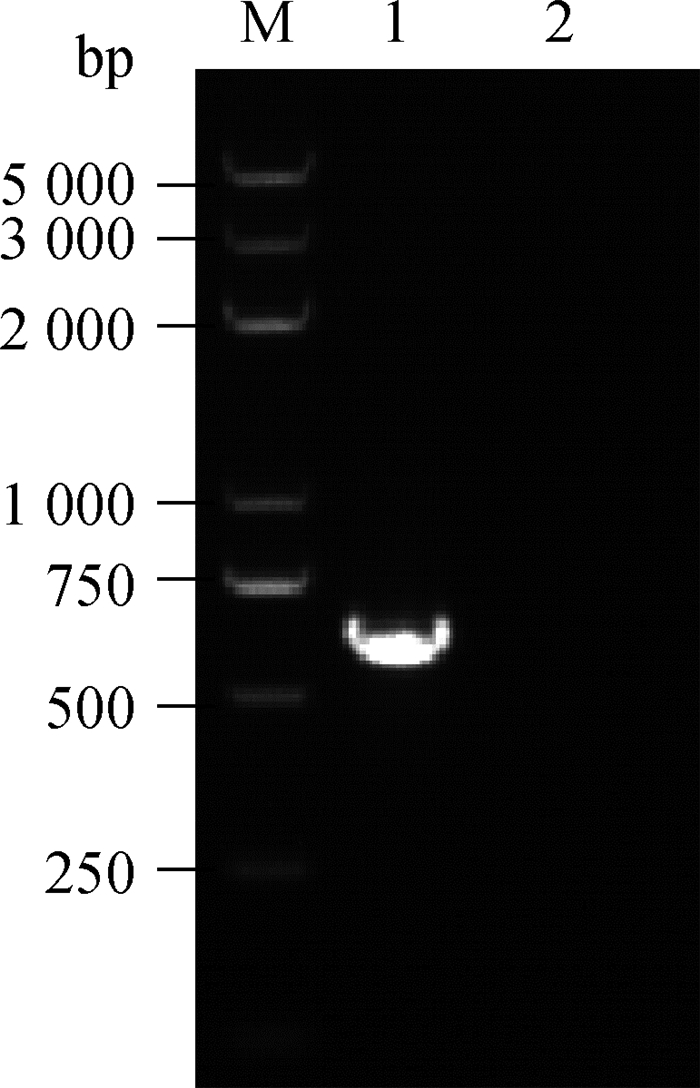
2.3 PCR鉴定PCR扩增产物经1%琼脂糖凝胶电泳检测,结果可见670 bp左右条带,阴性对照没有条带,与预期结果相符,见图 1。
|
M. Trans 2K Plus DNA相对分子质量标准;1. FPLV BJ04毒株;2.阴性对照 M. Trans 2K Plus DNA marker; 1. FPLV BJ04; 2. Negative control 图 1 FPLV BJ04毒株的PCR鉴定 Fig. 1 PCR identification of FPLV BJ04 strain |
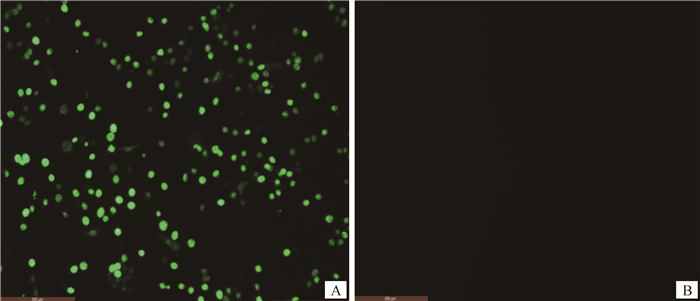
将分离的病毒按4%的比例同步接种到CRFK细胞36 h后进行间接免疫荧光试验,通过荧光倒置显微镜可以观察到接毒细胞组呈现绿色特异性荧光,而未接毒的阴性对照细胞没有荧光,结果见图 2。
|
A. FPLV BJ04接种CRFK细胞;B.阴性对照 A. FPLV BJ04 strain inoculated with CRFK cells; B. Negative control 图 2 FPLV BJ04株接种CRFK细胞的IFA试验(200×) Fig. 2 The IFA result of FPLV BJ04 inoculation with CRFK cells (200×) |
使用1%新鲜猪红细胞悬液测定分离株第5代和第6代细胞培养物的血凝性,其血凝效价均为1:256,说明该分离株能够凝集猪红细胞,与细小病毒的特性相符。
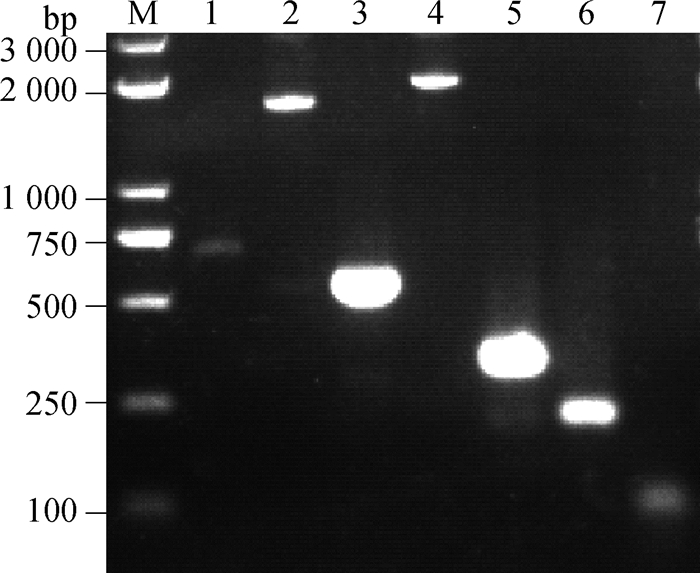
2.6 基因组扩增及测序使用表 1中的7对引物对FPLV BJ04株基因组进行分段扩增,扩增7个片段的大小分别为690、1 806、560、2 007、382、237和96 bp,扩增结果见图 3,其中第2片段包含FPLV的VP2基因,第4片段为FPLV的NS1基因。使用DNAstar软件对测序结果进行拼接,拼接结果显示FPLV BJ04株的基因组长度是5 118 bp。
|
M. Trans 2K Plus DNA相对分子质量标准;1~7. 表 1中7对引物分段扩增的FPLV的PCR产物 M. Trans 2K Plus DNA marker; 1-7. PCR products of FPLV amplified by 7 pairs of primers in table 1 图 3 FPLV BJ04株基因组PCR扩增 Fig. 3 PCR amplification of FPLV BJ04 strain |
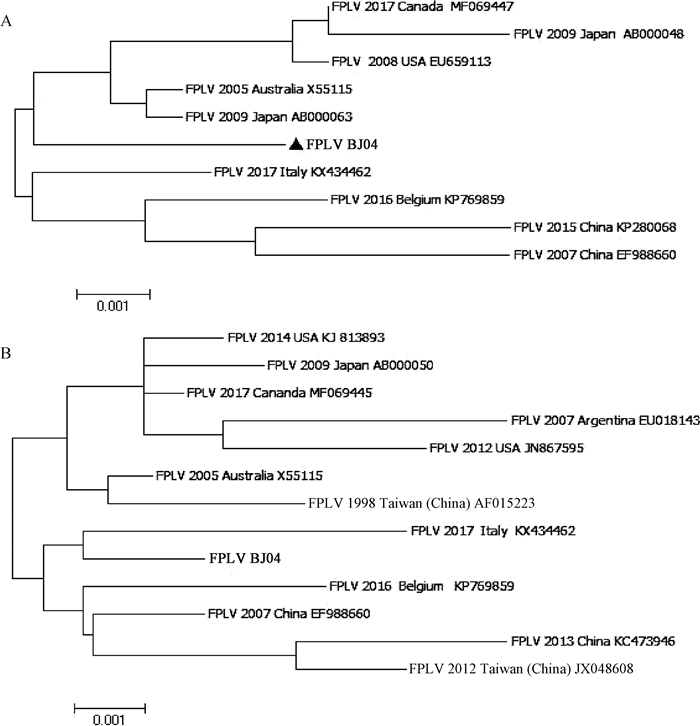
使用MEGA6.0软件将FPLV BJ04株的NS1和VP2基因分别与GenBank登录的FPLV毒株NS1和VP2基因序列构建系统进化树,结果显示FPLV BJ04株的NS1和VP2基因均与其余FPLV处于同一大分支,并且VP2系统进化树结果表明该分离株与KX434462株亲缘关系较近,结果见图 4A和B。使用DNAstar软件对FPLV BJ04株与GenBank登录的FPLV的NS1氨基酸序列进行比对,结果显示有8个氨基酸发生非同义突变;FPLV BJ04株与GenBank登录的FPLV VP2氨基酸序列比对结果为在FPLV决定宿主范围的第80、93、103、323、564、568位氨基酸位点上,FPLV BJ04株与其余FPLV株完全相同,表明本次分离的病毒为FPLV。
|
A. NS1基因系统进化分析树;B. VP2基因系统进化分析树 A. Phylogenetic analysis of NS1 gene of FPLV; B. Phylogenetic analysis of VP2 gene of FPLV 图 4 FPLV BJ04株及参考株基于NS1和VP2基因的系统进化分析 Fig. 4 Phylogenetic analysis of NS1 and VP2 gene of FPLV BJ04 strains |
使用Lasergene软件对FPLV BJ04株和其他FPLV株的NS1基因进行同源性分析,结果显示FPLV BJ04株与AB000063株、KX434462株和X55115株的NS1基因相似性为99.5%,与EF988660株和KP280068株的NS1基因相似性为99.0%。FPLV BJ04株与其他12株FPLV毒株VP2基因进行同源性比较,结果为该毒株的VP2基因与MF069445株、EF988660株和X55115株的基因相似性高达99.5%,与EU018143株和KC473946株的VP2基因同源性为99.1%。
2.8 动物回归试验攻毒猫在第4天开始出现精神不振,食欲下降,伴有呕吐症状,排稀便,脱水,且体温呈双相热变化,第15天死亡。病理剖检发现尸体消瘦,肝淤血,有出血点,对感染组猫粪便进行检测时,结果均为阳性。而对照组猫在整个试验过程中未见任何异常。
3 讨论FPLV具有发病急、死亡率高、幼猫极易感和传播速度快等特点,且对猫科及野生肉食动物的健康造成一定的威胁[8]。因此,加强FPLV的流行监测,了解FPLV的基因变异情况,对预防、控制该病毒及研发有效疫苗具有重要意义。
已有研究显示FPLV VP2蛋白的第80、93、103、323、564和568位氨基酸位点相对保守,能够影响FPLV的宿主嗜性及抗原性[13-14],同时水貂肠炎病毒、犬细小病毒的研究显示VP2上的第87、101、300和305位位点发生突变时,会影响病毒与宿主细胞的转铁蛋白受体(transferrin receptor,TfR)结合,从而影响病毒对宿主的选择[15-16]。2010年,Yang(杨松涛)等[17]发现FPLV VP2蛋白的第323和564位氨基酸分别突变为天冬酰胺和丝氨酸后,该病毒能够感染灵长类动物。FPLV NS1和VP2随时间变化而发生变异[18]。本研究结果显示,决定分离株抗原性和宿主性的VP2蛋白的6个关键氨基酸位点未发生突变,符合FPLV的序列特征。但该分离株的VP2基因与GenBank其他FPLV毒株的VP2基因相比,有且仅有一处发生非同义突变,即第411位氨基酸由谷氨酸突变成丙氨酸,这一突变是否对FPLV BJ04 VP2蛋白的功能和生物学特性造成改变,还有待于进一步研究。从分离株NS1氨基酸序列比对结果来看,NS1的第(M)10(T)、(R)43(H)、(D)93(N)、(H)247(Y)、(D)350(N)、(M)370(I)、(I)574(V)和(R)664(Q)位氨基酸发生非同义突变,其中分离株与KX434462株NS1蛋白的第664位氨基酸发生相同的突变,均是由精氨酸(R)突变为谷氨酰胺(Q),这些突变是否会增强病毒在宿主体内的稳定性和致病性还有待进一步研究。从FPLV BJ04株VP2和NS1发生非同义突变数量来看,VP2蛋白发生的突变较少,具有一定的稳定性,这表明在蛋白功能上VP2蛋白较NS1蛋白稳定,这一结果与已有的研究结果一致[19]。由于在GenBank中FPLV基因组全长序列较少,故没有进行FPLV全基因组序列的同源性分析及构建系统进化树。本研究对分离的FPLV BJ04株基因组序列进行分析,为FPLV毒株的遗传变异、分子流行病学、疫苗研发等奠定基础。
4 结论分离出一株FPLV北京流行株,命名为FPLV BJ04,基因组测序结果表明该分离株与2017年意大利分离株KX434462株相似性较高,决定病毒抗原性和宿主嗜性的VP2蛋白的氨基酸序列有且仅有一处发生非同义突变,而NS1蛋白有8个氨基酸发生非同义突变。
| [1] | STEINEL A, MUNSON L, VAN VUUREN M, et al. Genetic characterization of feline parvovirus sequences from various carnivores[J]. J Gen Virol, 2000, 81(2): 345–350. |
| [2] |
李刚, 蔡宝祥, 张振兴. 猫泛白细胞减少症病毒的分离与鉴定[J]. 病毒学报, 1985, 1(4): 349–353.
LI G, CAI B X, ZHANG Z X. Isolation and identification of feline panleukopenia virus[J]. Chinese Journal of Virology, 1985, 1(4): 349–353. (in Chinese) |
| [3] | JUNGE R E, BAUMAN K, KING M, et al. A serologic assessment of exposure to viral pathogens and Leptospira in an urban raccoon (Procyon lotor) population inhabiting a large zoological park[J]. J Zoo Wild Med, 2007, 38(1): 18–26. |
| [4] |
黄翠琴, 范克伟, 余佳, 等. 华南虎疑似感染猫细小病毒的PCR鉴定与病理组织学检查[J]. 中国动物传染病学报, 2017, 25(6): 43–47.
HUANG C Q, FAN K W, YU J, et al. A case of feline parvovirus virus infection of a south Chinatiger[J]. Chinese Journal of Animal Infectious Diseases, 2017, 25(6): 43–47. (in Chinese) |
| [5] |
饶家辉, 王玉平, 雷连成. 猫细小病毒、犬细小病毒、貂细小病毒的特征比较[J]. 中国畜牧兽医, 2009, 36(7): 166–168.
RAO J H, WANG Y P, LEI L C. Characteristic comparison of feline panleukopenia virus, canine parvovirus and mink enteritis virus[J]. China Animal Husbandry & Veterinary Medicine, 2009, 36(7): 166–168. (in Chinese) |
| [6] | GOVINDASAMY L, HUEFFER K, PARRISH C R, et al. Structures of host range-controlling regions of the capsids of canine and feline parvoviruses and mutants[J]. J Virol, 2003, 77(22): 12211–12221. |
| [7] | LÓPEZ DE TURISO J A, CORTÉS E, MARTÍNEZ C, et al. Recombinant vaccine for canine parvovirus in dogs[J]. J Virol, 1992, 66(5): 2748–2753. |
| [8] |
殷震, 刘景华.
动物病毒学[M]. 2版.北京: 科学出版社, 1997: 1145-1173.
YIN Z, LIU J H. Animalvirology[M]. 2nd ed. Beijing: Science Press, 1997: 1145-1173. (in Chinese) |
| [9] |
刘维全, 范泉水, 江禹, 等. 肉食兽细小病毒通用PCR诊断技术的建立[J]. 中国兽医学报, 2001, 21(3): 249–251.
LIU W Q, FAN Q S, JIANG Y, et al. Establishment of a commonly used PCR technique for detection of Carnivore parvoviruses[J]. Chinese Journal of Veterinary Science, 2001, 21(3): 249–251. DOI: 10.3969/j.issn.1005-4545.2001.03.011 (in Chinese) |
| [10] |
柏丽华.北京地区犬细小病毒病的分子流行病学调查研究[D].北京: 中国农业科学院, 2011.
BAI L H. The molecular epidemiology investigation of Canine parvovirus infection in Beijing[D]. Beijing: Chinese Academy of Agricultural Sciences, 2011. (in Chinese) |
| [11] |
田丽红, 华育平. 虎源猫泛白细胞减少症病毒VP2基因的原核表达及其抗原特性[J]. 中国兽医学报, 2010, 30(5): 602–606.
TIAN L H, HUA Y P. Prokaryotic expression of feline panleukopenia virus(VP2) isolated from tiger and its antigenic characteristics[J]. Chinese Journal of Veterinary Science, 2010, 30(5): 602–606. (in Chinese) |
| [12] |
程楠, 赵永坤, 于永乐, 等. 猫细小病毒HH-1/86株理化性质鉴定及全基因组测序[J]. 中国兽医学报, 2017, 37(5): 818–822.
CHENG N, ZHAO Y K, YU Y L, et al. The physical and chemical characterization of FPV strain HH-1/86 and its whole genome sequenceanalysis[J]. Chinese Journal of Veterinary Science, 2017, 37(5): 818–822. (in Chinese) |
| [13] | TRUYEN U, AGBANDJE M, PARRISH C R. Characterization of the feline host range and a specific epitope of feline panleukopenia virus[J]. Virology, 1994, 200(2): 494–503. |
| [14] | DECARO N, DESARIO C, MICCOLUPO A, et al. Genetic analysis of feline panleukopenia viruses from cats with gastroenteritis[J]. Gen Virol, 2008, 89(9): 2290–2298. |
| [15] |
卞赛赛, 梁琳, 高窦, 等. 水貂肠炎病毒VP2基因的原核表达及多克隆抗体的制备[J]. 中国兽医科学, 2017, 47(5): 597–602.
BIAN S S, LIANG L, GAO D, et al. Prokaryotic expression of VP2 gene of mink enteritis virus and preparation of anti-serum[J]. Chinese Veterinary Science, 2017, 47(5): 597–602. (in Chinese) |
| [16] | STUCKER K M, PAGAN I, CIFUENTE J O, et al. The role of evolutionary intermediates in the host adaptation of canine parvovirus[J]. J Virol, 2012, 86(3): 1514–1521. |
| [17] | YANG S T, WANG S J, FENG H, et al. Isolation and characterization of feline panleukopenia virus from a diarrheic monkey[J]. Vet Microbiol, 2010, 143(2-4): 155–159. |
| [18] |
饶家辉, 王玉平, 雷连成, 等. 猫细小病毒JL1-05株的分离与鉴定[J]. 中国兽医学报, 2009, 29(6): 716–720.
RAO J H, WANG Y P, LEI L C, et al. Isolation and identification of feline panleukopenia virus strain JL1-05[J]. Chinese Journal of Veterinary Science, 2009, 29(6): 716–720. (in Chinese) |
| [19] | HOELZER K, SHACKELTON L A, PARRISH C R, et al. Phylogenetic analysis reveals the emergence, evolution and dispersal of carnivore parvoviruses[J]. J Gen Virol, 2008, 89(9): 2280–2289. |



