2. 湖南省畜牧兽医研究所, 长沙 410131
2. Hunan Institute of Animal Husbandry and Veterinary Medicine, Changsha 410131, China
在现代养猪业中,种公猪是整个养猪产业链中重要的基础因素,不仅承担猪群品种改良的任务,还直接影响猪群的繁殖性能和猪场的经济效益[1]。睾丸是雄性动物的主要生殖器官,其主要功能是产生精子和分泌睾酮,对精液的品质至关重要[2]。在正常生理条件下,睾丸特殊的免疫环境维持其生理功能的稳定。然而,在环境恶化的条件下,如饲养管理不当,多种微生物(如病毒、细菌、寄生虫)感染及流行病的传播等均可破坏其免疫平衡,诱发睾丸炎的发生发展,导致精液品质下降,母猪受胎率低,甚至传播疾病,严重可引起死亡[3-4]。睾丸炎是一种以睾丸内白细胞浸润,曲细精管损伤为特征的炎性病变,常见睾丸炎为自身免疫性睾丸炎和感染性睾丸炎[5]。
脂多糖(lipopolysaccharide,LPS)又称为内毒素,是革兰阴性菌细胞壁的主要致病因子,可诱发多种病症,如脓毒症、内毒素血症和全身炎症综合征等。许多研究表明,细菌感染或LPS暴露可导致母畜繁殖机能障碍,包括胎儿发育异常和生长迟缓[6]、卵巢功能障碍[7-9]以及子宫炎等[10]。在LPS诱导的妊娠大鼠慢性炎症中,可见胎儿宫内发育迟缓,新生鼠出生重降低,成年子代雌鼠卵泡的数量也显著减少[6]。新生大鼠免疫激活使卵巢卵泡储备减少,卵巢炎症介质改变,提示新生儿卵巢内增加的促炎信号可能与LPS诱导的原始卵泡池的耗竭有关[11]。相关研究表明感染也是引起雄性不育的重要因素,其中大部分的睾丸炎与泌尿生殖道的细菌性感染有关[12]。妊娠中、后期小鼠暴露于LPS时,可导致胎儿期雄性小鼠出现异常睾丸间质细胞的聚集;成年后子代雄鼠的精子数显著减少,其血清中睾酮水平也显著降低[13]。LPS主要通过与TLRs的受体结合诱导相应的炎症反应,受体被病原体激活后,通过一系列细胞内信号传导系统,刺激体内多种细胞合成和释放内源性活性因子,使之聚集,这些生物活性分子又可通过“神经-内分泌-免疫”网络,诱导动物在短时间内产生细菌感染症状[3, 14-16]。然而,目前关于急性细菌性感染影响雄性生殖功能的分子机制尚不完全清楚。为探讨急性全身性感染对睾丸组织的影响,本研究主要通过腹腔注射,使机体急性暴露于不同剂量的LPS,模拟养殖过程中因细菌感染使睾丸功能及相关炎症因子的表达发生变化,以期为细菌性睾丸炎的防治提供一定的理论基础。
1 材料与方法 1.1 主要试剂与设备脂多糖(lipopolysaccharides from Escherichia coli O111:B4)购自美国Sigma公司;苏木素、伊红、中性树胶和吉姆萨染液购自北京中杉金桥生物科技有限公司;小鼠睾酮(T)ELISA试剂盒购自莱瑞特生物科技公司;TRIzolTM购自Invitrogen公司;HiScriptⓇII Q RT SuperMix for qPCR(+gDNA wiper)试剂盒、ChamQTM SYBRⓇqPCR Master Mix试剂盒购自南京诺唯赞生物科技有限公司;Bouin’s液购自武汉赛维尔生物科技有限公司;自动精子分析仪(南宁松景天伦生物科技有限公司,迈朗ML-800Ⅲ型);光学显微镜(ZEISS公司);酶标仪(美国Thermo ScientificTM MultiskanTM FC型);StepOne荧光定量PCR仪(美国ABI公司)。
1.2 实验动物分组及处理ICR系雄性小鼠(8周龄,SPF级,体重30~35 g)购于湖南斯莱克景达实验动物有限公司,常规小鼠饲养,自由摄食和饮水。适应性饲养一周后,随机分为4组:即对照组和3个LPS处理组(1.25、2.5和5.0 mg·kg-1 LPS组),每组5只,对照组腹腔注射200 μL生理盐水,试验组分别注射等体积含不同浓度LPS的生理盐水。注射处理12 h后称重、采血,收集睾丸和附睾组织并称重,其中一侧睾丸用Bouin’s液固定,用于制作石蜡切片,另一侧用于提取RNA;血液静置后离心收集血清。
1.3 小鼠体重、睾丸和附睾指数及精子品质检测记录处理前后小鼠体重的变化,收集睾丸和附睾并称重,按与体重的比值计算获得相应的脏器指数。通过检测精子的密度、精子活力、精子活率和精子畸形率来评价精子的品质。具体操作如下:将收集的一侧附睾置于0.5 mL预热的PBS中,眼科剪充分剪碎后用移液枪轻轻吹打,置于37 ℃培养箱中孵育10 min,使精子游出,精子悬液按1:4的比例稀释,取10 μL精子悬液于精子计数板中,用自动精子分析仪进行检测,获得精子的密度、精子活力、精子活率及精子畸形率等参数。同时,取20 μL精子悬液于载玻片上制备抹片,自然晾干后用吉姆萨染液染色5 min,流水冲洗2 min,室温晾干,在光学显微镜下观察精子形态,每个抹片观察5个视野,每个视野确保精子总数超过100个计算,根据畸形精子的数量计算精子的畸形率。
1.4 切片制备及HE染色将固定好的睾丸组织经常规梯度酒精脱水、二甲苯透明、石蜡包埋后切片,厚度5 μm。石蜡切片经苏木素-伊红染色,在光学显微镜下观察睾丸组织的形态学变化。
1.5 ELISA检测血清中睾酮的变化采用竞争ELISA法检测血清中睾酮的含量,按试剂盒说明书进行。将50 μL预先稀释的睾酮标准品和待测血清样品加入酶标板孔内后,立即加入生物素标记的抗睾酮的抗体,37 ℃温育1 h,甩去孔内液体,每孔加入350 μL洗涤液,浸泡10 s,甩去洗涤液,用吸水纸拍干,洗涤3次;每孔加入50 μL的亲和链酶素-HRP,轻轻振荡混匀,37 ℃温育30 min,洗涤缓冲液洗涤3次;每孔加入底物A和B各50 μL,轻轻振荡混匀,37 ℃温育15 min,避免光照;取出酶标板,加入50 μL终止液,在450 nm波长处测定各孔的吸光度(OD)值。
1.6 实时荧光定量PCR将收集的睾丸组织用Trizol法提取总RNA,总RNA产物经HiScriptⓇII Q RT SuperMix for qPCR(+gDNA wiper)试剂盒反转录后,得到cDNA作为模板用于荧光定量PCR检测。采用ChamQTM SYBRⓇqPCR Master Mix试剂盒,在ABI StepOne Real-Time PCR系统中进行qPCR反应,反应程序:95 ℃预变性30 s,40个循环(95 ℃变性10 s,60 ℃退火延伸30 s),熔解曲线(95 ℃变性15 s,60 ℃退火延伸1 min,0.5 ℃·min-1升温至95 ℃ 15 s)。目的基因的表达以β-actin作为内参进行矫正,按相对表达量2-△△Ct法分析试验数据,对照组的基因表达水平设定为1。所用引物参照GenBank中公布的序列,用Primer 5.0软件进行设计,由华大基因股份有限公司合成,序列见表 1。
|
|
表 1 PCR所用引物序列 Table 1 Primer sequences used for PCR |
试验数据以平均值±标准差(x±s)表示,数据处理采用GraphPad Prism 5软件进行统计分析。试验组和对照组采用独立样本t检验,P < 0.05时差异显著,P < 0.01时为差异极显著。
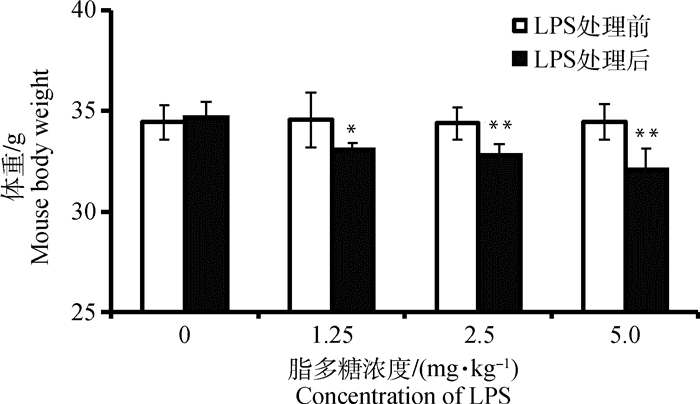
2 结果 2.1 急性暴露LPS对小鼠体重的影响腹腔注射LPS急性暴露后,小鼠精神萎靡、被毛无光泽、活动和饮食量减少,部分小鼠在1 h后出现腹泻,剂量越大、时间越长腹泻现象则越严重,取材前有部分小鼠眼睛出现红肿。小鼠处理前后体重变化如图 1所示,LPS处理12 h后,与对照组相比,各LPS处理组小鼠体重均显著降低(P < 0.05),其中2.5和5.0 mg·kg-1剂量组下降极为显著(P < 0.01)。
|
各组处理后与处理前比较,*. P < 0.05,**. P < 0.01 Comparing before and after treatment, *. P < 0.05, **. P < 0.01 图 1 LPS急性暴露对小鼠体重的影响 Fig. 1 Effect of LPS on body weight of mice |
腹腔注射LPS处理小鼠12 h后,肉眼可见睾丸充血肿胀,如表 2结果所示,三个剂量处理组小鼠的睾丸质量均高于对照组,且呈剂量依赖性增加,其睾丸指数也显著上升;附睾质量及其指数与对照组相比无显著差异(结果未显示);当用不同浓度的LPS处理小鼠12 h后,各处理组小鼠精子品质均受到影响,表现为精子密度、精子活力及精子活率均显著降低(P < 0.05或P < 0.01),同时精子的畸形率均显著升高,以上影响呈剂量依赖。
|
|
表 2 LPS对小鼠睾丸质量和精子品质的影响(x±s) Table 2 Effects of LPS on testicular weight and sperm quality of mice(x±s) |
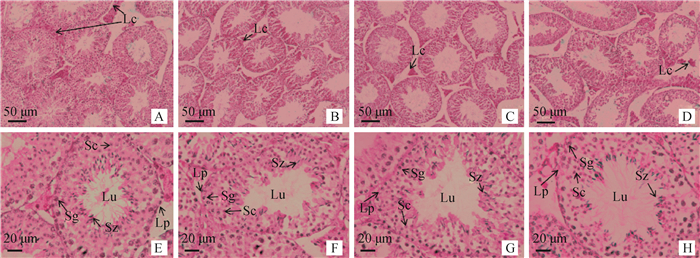
睾丸组织HE染色结果显示,对照组小鼠睾丸内生精小管中生精上皮形态规则,各级生精细胞丰富且排列紧密,界膜清晰,层次较明晰,自曲细精管底部至管腔依次有精原细胞、精母细胞、精子细胞和精子,管腔饱满,腔内可观察到大量的精子,管间含有丰富的间质细胞(图 2A和E)。当用不同剂量的LPS处理后,睾丸组织形态均发生一定的变化,其中1.25和2.5 mg·kg-1剂量处理的小鼠睾丸内,生精细胞间的连接不紧密,部分生精细胞脱落,精子数量减少(图 2B、C、F和C、G);5.0 mg·kg-1剂量处理时形态变化更明显,生精上皮结构松散,细胞间间隙增大,生精细胞数量减少,管腔增大,腔内精子数量减少,有部分精子出现聚集现象(图 2D和H)。
|
A、E.对照组; B、F. 1.25 mg·kg-1 LPS组; C、G. 2.5 mg·kg-1 LPS组;D、H. 5.0 mg·kg-1 LPS组。Lp.基膜; Lc.间质细胞;Sg.精原细胞;Sc.精母细胞;Sz.精子细胞;Lu.曲细精管管腔。A~D.标尺为50 μm;E~H.标尺为20 μm A, E. Control group; B, F. 1.25 mg·kg-1 LPS group; C, G. 2.5 mg·kg-1 LPS group; D, H. 5.0 mg·kg-1 LPS group. Lp. Lamina propria; Lc. Leydig cell; Sg. Spermatogonia; Sc. Spematocyte; Sz. Spermatid; Lu. Lumen. A-D. Scale bar = 50 μm; E-H. Scale bar = 20 μm 图 2 LPS急性暴露对小鼠睾丸组织形态学的影响(HE染色) Fig. 2 Effect of LPS on histopathology of mouse testis (HE staining) |
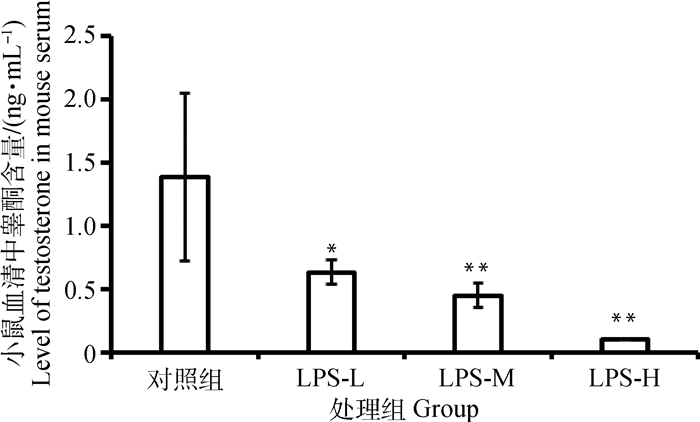
通过ELISA法测定了小鼠血清中睾酮(T)含量的变化,结果如图 3所示,小鼠腹腔注射LPS处理12 h后,与对照组相比,三个剂量LPS处理均能显著降低血清中睾酮的含量,其中5.0 mg·kg-1高剂量处理组下降最为明显,呈剂量依赖效应。
|
对照组. PBS组; LPS-L. 1.25 mg·kg-1 LPS组; LPS-M. 2.5 mg·kg-1 LPS组; LPS-H. 5.0 mg·kg-1 LPS组。与对照组比较,*. P < 0.05,**. P < 0.01。下同 Control. PBS group; LPS-L. 1.25 mg·kg-1 LPS group; LPS-M. 2.5 mg·kg-1 LPS group; LPS-H. 5.0 mg·kg-1 LPS group. Compared with the control group, *. P < 0.05, **. P < 0.01. The same as below 图 3 LPS急性暴露对小鼠血清中睾酮含量的影响 Fig. 3 Effect of LPS on level of testosterone in mouse serum |
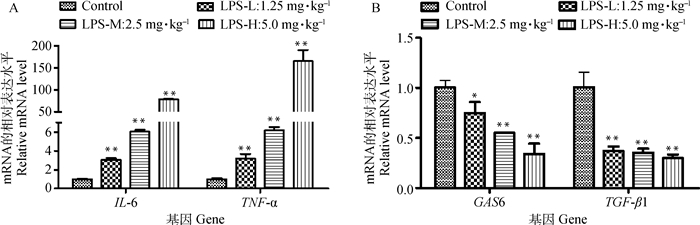
检测了睾丸组织中部分炎症因子mRNA的转录变化,如图 4所示,LPS诱导后,促炎因子IL-6和TNF-α的转录水平极显著升高(P < 0.01),且呈浓度依赖效应;抗炎因子GAS6的转录显著下降(P < 0.05或P < 0.01),也呈浓度依赖效应,TGF-β1的转录也极显著下降(P < 0.01),但不呈现剂量依赖。
|
图 4 LPS急性暴露对小鼠睾丸组织IL-6、TNF-α、GAS6和TGF-β1 mRNA转录的影响 Fig. 4 Effects of LPS on mRNA levels of IL-6, TNF-α, GAS6 and TGF-β1 in mouse testis |
本研究表明,急性LPS暴露对小鼠睾丸造成严重的影响,表现为睾丸组织发生明显的病理学变化,血清中类固醇激素睾酮含量下降,精子品质下降。这些不良影响可能与睾丸微环境失衡有关,在LPS刺激下,睾丸中促炎因子TNF-α和IL-6基因的转录水平升高,而抗炎因子GAS6和TGF-β1基因的转录下降,使正常的促-抗炎平衡受到破坏,导致睾丸免疫稳态失衡,从而严重损害小鼠生殖功能。杨露露等[17]研究发现,LPS处理3和6 h后,对小鼠体重和睾丸质量均无显著影响,而处理12或24 h时,则导致小鼠体重下降、睾丸可见充血肿胀且质量显著增加、睾丸组织中生精细胞数量减少等。本研究中注射LPS后,小鼠产生的炎症反应症状与上述研究结果基本一致。睾酮主要由睾丸间质细胞合成,影响间质细胞的数量和功能均会干扰睾酮的合成,当用1 mg·kg-1的LPS分别处理CD-1小鼠3、6和12 h时可显著减少血清中睾酮的含量,但处理24 h时与对照组无显著差异[17];而在詹绪新等[18]研究中发现,用5 mg·kg-1 LPS处理SD大鼠至12 h时并不影响血清中睾酮的含量,当处理24 h或更长时间时则显著降睾酮的水平;本研究中用5 mg·kg-1以内的LPS处理ICR小鼠12 h时,血清的睾酮含量均显著低于对照小鼠。以上相关研究结果的偏差可能与实验动物品系对LPS耐受、不同菌株来源的LPS及其处理剂量相关。
雄性动物睾丸具有特殊的免疫环境来维持睾丸功能,睾丸分泌的免疫活性因子参与睾丸局部微环境的调节,其中促炎因子和抗炎因子的动态变化决定机体炎症反应的程度。正常情况下,促-抗炎症因子维持在平衡状态下。当多种病原微生物感染时,通过一系列细胞内信号传导可刺激机体细胞大量分泌炎症细胞因子,导致机体促-抗炎症因子失衡,诱发炎症的发生发展,破坏睾丸基本功能[19-20]。
在LPS诱导睾丸炎中,不同炎症因子的变化不同,可能在炎症发生过程中所发挥作用的程度不一。在本研究中,LPS诱导后,睾丸中促炎因子IL-6和TNF-α的表达均极显著升高,而TNF-α的上升水平相对于IL-6表现得更为明显,特别是在高剂量处理时上升水平显著高于IL-6的上升水平,提示在LPS暴露时,TNF-α在致雄性生殖功能障碍过程中可能起主导作用。杨露露等[17]研究发现LPS短时间处理对成年小鼠睾丸间质细胞的数量无影响,提示可能是通过影响间质细胞的功能而影响睾酮的合成。Hong等[21]研究表明,TNF-α对类固醇激素合成具有重要的调控作用,TNF-α可通过激活核转录因子(NF-κB)抑制孤儿核受体的转录激活,从而抑制类固醇生成酶基因的表达,使睾酮类固醇激素合成受到抑制。另外,Wang等[22]研究发现,LPS处理可诱导小鼠全身性的炎症反应,当敲除TNF-α基因后,LPS诱导的小鼠睾丸功能障碍和附睾炎均可消除,而且TNF-α抑制剂帕马利多胺也可阻断LPS对睾丸和附睾的不利影响,其结果提示LPS诱导全身的炎症反应,可能通过TNF-α的产生而导致雄性生殖功能的障碍。本研究中,LPS处理后炎症因子TNF-α的显著上升可能干扰了睾丸间质细胞中类固醇激素的合成过程,从而引起小鼠血清睾酮水平下降,这种干扰作用可能也与其他炎症因子的参与有关;此外,本研究只从基因水平检测部分炎症相关因子的变化,还需从蛋白水平并选择更多的炎症相关因子开展更多更深入的研究,为急性感染损害对雄性生殖功能的具体分子机制及筛选保护药物提供参考依据和新的思路。
4 结论一定剂量范围内的LPS处理能刺激睾丸中促-抗炎性因子表达失衡,破坏睾丸免疫稳态,诱发睾丸的炎症反应。一方面LPS诱导的炎症可导致睾丸组织病理学损伤和精子品质下降,另一方面LPS诱导的炎症可作用于小鼠睾丸间质影响类固醇激素水平,导致血清中T含量降低,干扰正常生殖功能。总的来说,细菌LPS急性暴露可通过破坏机体中炎症因子的平衡,使睾丸组织受到损伤从而导致生精障碍。
| [1] | LOPEZ RODRIGUEZ A, VAN SOOM A, ARSENAKIS I, et al. Boar management and semen handling factors affect the quality of boar extended semen[J]. Porcine Health Manag, 2017, 3: 15. DOI: 10.1186/s40813-017-0062-5 |
| [2] | SAVIĆ R, PETROVIĆ M, RADOJKOVIĆ D, et al. The effect of breed, boar and season on some properties of sperm[J]. Biotechnol Anim Husb, 2013, 29(2): 299–310. DOI: 10.2298/BAH1302299S |
| [3] | CHEN Q Y, DENG T T, HAN D S. Testicular immunoregulation and spermatogenesis[J]. Semin Cell Dev Biol, 2016, 59: 157–165. DOI: 10.1016/j.semcdb.2016.01.019 |
| [4] | NI H J, LU L, DENG J P, et al. Effects of glutamate and aspartate on serum antioxidative enzyme, sex hormones, and genital inflammation in boars challenged with hydrogen peroxide[J]. Mediat Inflamm, 2016, 2016: 4394695. |
| [5] | AZENABOR A, EKUN A O, AKINLOYE O. Impact of inflammation on male reproductive tract[J]. J Reprod Infertil, 2015, 16(3): 123–129. |
| [6] | SHALOM-PAZ E, WEILL S, GINZBERG Y, et al. IUGR induced by maternal chronic inflammation:long-term effect on offspring's ovaries in rat model-a preliminary report[J]. J Endocrinol Invest, 2017, 40(10): 1125–1131. DOI: 10.1007/s40618-017-0681-3 |
| [7] |
果双双, 李辉, 施振旦, 等. 脂多糖对体外培养猪颗粒细胞增殖、凋亡和雌二醇分泌的影响[J]. 畜牧兽医学报, 2016, 47(4): 693–699.
GUO S S, LI H, SHI Z D, et al. Effects of lipopolysaccharide on proliferation, apoptosis and estradiol secretion of in vitro cultured porcine granulosa cells[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(4): 693–699. (in Chinese) |
| [8] | SHIMIZU T, ECHIZENYA R, MIYAMOTO A. Effect of lipopolysaccharide on progesterone production during luteinization of granulosa and theca cells in vitro[J]. J Biochem Mol Toxicol, 2016, 30(4): 206–211. DOI: 10.1002/jbt.2016.30.issue-4 |
| [9] | SHIMIZU T, ISHIZAWA S, MAGATA F, et al. Involvement of lipopolysaccharide in ovarian cystic follicles in dairy cow:expressions of LPS receptors and steroidogenesis-related genes in follicular cells of cystic follicles[J]. Anim Reprod Sci, 2018, 195: 89–95. DOI: 10.1016/j.anireprosci.2018.05.010 |
| [10] | MAGATA F, ISHIDA Y, MIYAMOTO A, et al. Comparison of bacterial endotoxin lipopolysaccharide concentrations in the blood, ovarian follicular fluid and uterine fluid:a clinical case of bovine metritis[J]. J Vet Med Sci, 2015, 77(1): 81–84. DOI: 10.1292/jvms.14-0333 |
| [11] | FULLER E A, SOMINSKY L, SUTHERLAND J M, et al. Neonatal immune activation depletes the ovarian follicle reserve and alters ovarian acute inflammatory mediators in neonatal rats[J]. Biol Reprod, 2017, 97(5): 719–730. |
| [12] | PELLATI D, MYLONAKIS I, BERTOLONI G, et al. Genital tract infections and infertility[J]. Eur J Obstet Gynecol Reprod Biol, 2008, 140(1): 3–11. DOI: 10.1016/j.ejogrb.2008.03.009 |
| [13] | WANG H, YANG L L, HU Y F, et al. Maternal LPS exposure during pregnancy impairs testicular development, steroidogenesis and spermatogenesis in male offspring[J]. PLoS One, 2014, 9(9): e106786. DOI: 10.1371/journal.pone.0106786 |
| [14] | VATANEN T, KOSTIC A D, D'HENNEZEL E, et al. Variation in microbiome LPS immunogenicity contributes to autoimmunity in humans[J]. Cell, 2016, 165(4): 842–853. |
| [15] |
何自标, 兰瑞霞, 陈晨, 等. 脂多糖对母兔下丘脑、卵巢、输卵管中TLR4及其相关细胞因子表达的影响[J]. 畜牧兽医学报, 2014, 45(6): 910–917.
HE Z B, LAN R X, CHEN C, et al. Effect of LPS on the expression of TLR4 and related cytokines in oviduct, ovary and hypothalamus of rabbits[J]. Acta Veterinaria et Zootechnica Sinica, 2014, 45(6): 910–917. (in Chinese) |
| [16] | REDDY M M, MAHIPAL S V K, SUBHASHINI J, et al. Bacterial lipopolysaccharide-induced oxidative stress in the impairment of steroidogenesis and spermatogenesis in rats[J]. Reprod Toxicol, 2006, 22(3): 493–500. |
| [17] |
杨露露, 王华, 姬艳丽, 等. 细菌脂多糖急性暴露对小鼠睾丸组织的损害作用[J]. 中华疾病控制杂志, 2015, 19(2): 166–169.
YANG L L, WANG H, JI Y L, et al. Acute exposure to lipopolysaccharide impairs testicular tissue in male mice[J]. Chinese Journal of Disease Control & Prevention, 2015, 19(2): 166–169. (in Chinese) |
| [18] |
詹绪新, 胡毓安, 卿兴荣, 等. 脂多糖对雄性大鼠睾丸组织病理学和生殖内分泌功能的影响[J]. 中华男科学杂志, 2014, 20(4): 304–308.
ZHAN X X, HU Y A, QING X R, et al. Lipopolysaccharide affects testicular histology and reproductive endocrine function in male rats[J]. National Journal of Andrology, 2014, 20(4): 304–308. (in Chinese) |
| [19] | IWASA T, MATSUZAKI T, TUNGALAGSUVD A, et al. Prenatal undernutrition results in greater lipopolysaccharide-induced changes in hypothalamic TNF-α expression, but does not affect the equivalent changes in the serum levels of luteinizing hormone and testosterone, in adult male rats[J]. Int J Dev Neurosci, 2016, 48: 80–83. DOI: 10.1016/j.ijdevneu.2015.12.001 |
| [20] | TYNAN R J, WEIDENHOFER J, HINWOOD M, et al. A comparative examination of the anti-inflammatory effects of SSRI and SNRI antidepressants on LPS stimulated microglia[J]. Brain Behav Immun, 2012, 26(3): 469–479. DOI: 10.1016/j.bbi.2011.12.011 |
| [21] | HONG C Y, PARK J H, AHN R S, et al. Molecular mechanism of suppression of testicular steroidogenesis by proinflammatory cytokine tumor necrosis factor alpha[J]. Mol Cell Biol, 2004, 24(7): 2593–2604. DOI: 10.1128/MCB.24.7.2593-2604.2004 |
| [22] | WANG F, LIU W H, JIANG Q, et al. Lipopolysaccharide-induced testicular dysfunction and epididymitis in mice: a critical role of tumor necrosis factor alpha[J/OL]. Biol Reprod, 2018: doi: 10.1093/biolre/ioy235[2019-03-05].https://doi.org/10.1093/biolre/ioy235. |



