脱氧雪腐镰刀菌烯醇(DON)是一种由镰刀菌属真菌产生的单端孢霉烯族类毒素,广泛存在于玉米、小麦和大麦等粮谷类农作物中,在世界各地均有很高的污染率[1-2]。DON能够对人和动物DNA、RNA、蛋白质以及各种酶类的合成产生抑制作用,破坏完整的细胞结构,并抑制细胞增殖诱导细胞凋亡,同时还会产生免疫毒性、生殖毒性以及“三致”作用等多种毒性作用[3-4]。DON的污染状况主要受菌株、湿度、通风和温度的影响。产毒菌株主要污染潮湿低温环境下存储的粮谷作物。同时,由于DON产毒菌株在食物链中具有高水平暴露和高污染频率特性而受到极大关注[5-6]。当猪摄入被DON污染的食物或饲料后,会产生一系列的中毒症状,表现为采食量下降,体重增加缓慢以及免疫功能低下,摄入的DON中至少有67%被吸收,表明猪对DON高度敏感[7-8]。因此,DON食源性中毒已经成为制约我国农业发展的重要因素之一。
已有试验证明DON可以引起机体和细胞的脂质过氧化反应,主要表现为丙二醛(MDA)水平升高,以及超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)水平降低[9-10]。Ren等[11]对小鼠进行DON攻毒,发现攻毒组的脑组织MDA含量升高,脑组织SOD、GSH-Px活性降低,表明DON可影响小鼠的正常脑功能。Pestka[12]研究表明,DON能够引起猪血清5-羟色胺(5-HT)浓度升高并引起拒食和呕吐。有研究证明,钙调蛋白(CaM)可以调控突触小泡的产生、传递及再生,改变神经递质的释放,钙调蛋白依赖性激酶Ⅱ(CaMK Ⅱ)是兴奋性突触因子的主要成分,因此被认为是调节神经元功能的重要分子[13-14]。
延髓能够调节维持生命所必要的基本中枢(如呼吸、循环、消化等),延髓一旦受到损伤,常引起迅速死亡,所以延髓有“生命中枢”之称。当前国内外对DON的毒性作用研究主要集中在生长及免疫方面,而DON对延髓的毒性研究少见报道,基于以上国内外研究现状,本试验选择断奶仔猪为试验对象,研究DON饲料对仔猪延髓组织脂质过氧化反应、神经递质分泌和钙稳态变化的影响,探讨DON暴露对仔猪的神经毒性作用,为进一步阐明DON的毒性机制提供试验依据。
1 材料与方法 1.1 试验动物21日龄“杜×长×大”三元杂交断奶仔猪,由安徽省青阳县五星畜牧养殖场提供。
1.2 主要材料与仪器禾谷镰刀菌由南京农业大学动物医学院中毒病实验室惠赠;猪超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)、一氧化氮(NO)、猪5-羟色胺(5-HT)、去甲肾上腺素(NE)、多巴胺(DA)、氨基丁酸(GABA)、乙酰胆碱(ACH)ELISA检测试剂盒,购自上海源叶生物科技有限公司;钙离子(Ca2+)测定试剂盒,购自北京利德曼生化股份有限公司;Trizol RNA提取试剂,购自大连宝生物工程有限公司;β-actin抗体,购自北京锐抗生物科技有限公司;Calmodulin(CaM)、CaMKⅡ、p-CaMKⅡ(phospho Thr305)抗体(动物来源:兔),购自美国ImmunoWay;羊抗兔二抗,购自碧云天生物技术研究所。
高效液相色谱仪,购自美国Waters公司;PierceTM ECL Western blotting Substrate、Multiskan MK3型酶标仪和Arktik多功能PCR仪,购自美国Thermo公司;TGL-18R台式高速离心机,购自珠海黑马医学仪器有限公司;DYY-6C垂直电泳仪、半干转膜仪,购自北京六一仪器厂。
1.3 DON饲料的制备取出保存于4 ℃的禾谷镰刀菌,接种到马铃薯葡萄糖琼脂培养基上,25 ℃培养。将复苏的禾谷镰刀菌接种于察氏液体培养基中,固定于25 ℃恒温振荡培养箱中,140 r·min-1,培养6 d。将玉米放入烘箱中直至将水分烘干,称取150 g烘干的玉米放入500 mL带硅胶塞的锥形瓶中,调节水分含量至45%,冷却后向其中接种禾谷镰刀菌孢子液,置于27 ℃真菌培养箱中培养20 d后,取出,121 ℃高压灭菌30 min,烘干备用。将烘干的霉变玉米粉碎,使用液相色谱法测定其中DON含量,然后与基础日粮进行混合,分别制备含量为1与2 mg·kg-1的DON饲料。
1.4 试验动物的选择、分组与管理将30头21日龄临床检查健康的“杜×长×大”三元杂交断奶仔猪(6.87±0.41 kg),公母各半(公猪已去势),随机分为3组,每组10头。其中对照组饲喂基础日粮,低剂量组和高剂量组饲料中DON含量分别为1、2 mg·kg-1,试验期为60 d。仔猪于同一栋猪舍不同猪栏饲养,保持猪槽中有充足饲粮,仔猪自由采食和饮水,观察记录染毒期间仔猪的临床表现和生长发育情况。严格按照猪的饲养管理标准进行饲养,消毒免疫程序严格按照猪场管理方案进行。
1.5 样品采集与处理试验结束时,每组随机选择5头仔猪,麻醉后进行屠宰,剥离头骨并迅速取出完整的脑组织,于冰上分离出延髓。取部分延髓组织加入一定量生理盐水匀浆,将组织匀浆液以3 000 r·min-1离心10 min,取上清液保存于-80 ℃冰箱内,用于氧化与抗氧化指标、神经递质含量和Ca2+浓度的测定;部分延髓组织放入液氮中保存,用于CaM和CaMK Ⅱ mRNA表达量和CaM、CaMK Ⅱ蛋白表达水平的测定。
1.6 日粮组成混合饲料成分分析保证值:粗蛋白质≥ 18.0%(0~30 d),粗蛋白质≥17.0%(31~60 d),粗纤维≤7.0%,水分≤14.0%,粗灰分≤ 8.0%,钙0.4%~1.2%,总磷0.4%~0.85%,氯化钠0.3%~1.0%,赖氨酸≥ 1.1%。
1.7 氧化与抗氧化指标及神经递质含量的测定取出-80 ℃保存的延髓组织匀浆上清液,梯度升温解冻,直至恢复至常温。根据ELISA检测试剂盒说明书进行操作,用酶标仪检测波长450 nm的吸光度。按照标准曲线方程计算样品的浓度,分别测定氧化与抗氧化指标SOD、GSH-Px活性和MDA、NO浓度,神经递质5-HT、NE、DA、ACH和GABA含量。
1.8 Ca2+浓度的测定取出-80 ℃保存的延髓组织匀浆上清液,梯度升温解冻,直至恢复至常温。组织内Ca2+浓度的测定方法严格按照测定试剂盒说明书进行。
1.9 CaM和CaMKⅡ mRNA相对表达量的检测据GenBank中发布的猪CaM(NM_001244209)、猪CaMKⅡ(NM_214381.1)和猪18S(NR_046261.1)的全基因序列,运用prime 5.0软件设计特异性的上、下游引物,并利用GenBank Blast进行同源性检索,之后由安徽通用生物系统有限公司合成。引物序列及参数见表 1。
|
|
表 1 CaM、CaMK Ⅱ目的基因和18S内参基因引物参数 Table 1 Parameters of primer for CaM, CaMK Ⅱ and 18S genes |
参照StepOneTM Real-time PCR System和BIOMIGA SYBR qPCR Mix配制PCR反应体系,然后按以下程序进行PCR扩增:95 ℃预变性1 min;95 ℃ 15 s,58 ℃ 20 s,72 ℃ 20 s,共40个循环;末段延伸72 ℃,5 min。熔解曲线95 ℃ 1 min,55 ℃ 1 min,每10 s 0.5 ℃的速度由55 ℃升温至98 ℃。试验组的基因CaM、CaMK Ⅱ和内参基因18S均在同一参数下进行3个重复性试验。反应条件为:72 ℃ 5 min。以18S为参照,目的基因相对表达量采用2-ΔΔCt公式进行计算。ΔΔCt=(Ct试验组基因-Ct18S)-(Ct对照组基因-Ct18S)。
1.10 钙调通路中相关蛋白表达的测定称取0.1 g冻存的脑组织,加入1 mL RIPA裂解液,匀浆,4 ℃放置使样品充分裂解;14 000 r·min-1离心10 min收集上清备用。采用BCA法检测组织蛋白浓度。将试剂A和试剂B按照50:1的比例配制成工作液。按照说明书配制BCA标准测定溶液。将2 μL待测组织蛋白样品加入到微孔板,补加PBS 18 μL,每孔加入工作液200 μL,混匀,37 ℃静置30 min。用酶标仪检测波长562 nm的吸光度,绘制标准曲线并计算各组蛋白浓度。将上述蛋白样品加入5×SDS loading buffer,95 ℃水浴处理5~10 min后4 ℃保存备用。以总蛋白50 μg的上样量进行SDS-PAGE电泳,80 V电泳30 min左右,当样品到达分离胶边界后把电压调为120 V,继续电泳60 min左右。随后依照负极-海绵-靠胶滤纸-胶-PVDF膜-靠膜滤纸-海绵-正极的次序放入电泳槽,120 V电压下转膜28 min左右,转膜完成后,将其置于5% BSA溶液中,在摇床上室温封闭4 h。在一抗中冷藏条件下过夜孵育。在二抗中室温摇床孵育45 min。按照ECL发光液说明书,配制发光液,用凝胶成像系统成像,再用Quantity one软件将所取得的图片进行灰度扫描分析。
1.11 数据处理试验数据均以x±s表示,使用SPSS 20.0软件中的ANOVA过程对数据进行分析,多重比较采用LSD法;文中柱形图使用GraphPad Prism 5.0软件制作。
2 结果 2.1 仔猪延髓组织氧化与抗氧化水平检测不同剂量DON对仔猪延髓氧化与抗氧化水平的影响见表 2。由表可知,延髓中SOD活性随DON浓度的增加而降低。与对照组对比,高、低剂量组SOD和GSH-Px活性均极显著降低(P < 0.01),同时高剂量组SOD和GSH-Px活性较低剂量组显著降低(P < 0.05);MDA浓度随DON浓度的增加而增加,各组间MDA浓度无显著差异;与对照组相比,高、低剂量组NO浓度均呈极显著升高(P < 0.01),而高、低剂量组之间NO浓度无显著差异。
|
|
表 2 DON对氧化与抗氧化指标活性的影响(x±s) Table 2 Effects of DON on the activities of oxidation and antioxidant indexes (x±s) |
不同剂量DON对仔猪延髓神经递质的影响见表 3。由表可见,与对照组相比,高、低剂量组5-HT浓度均极显著升高且呈剂量依赖型(P < 0.01),而高剂量组与低剂量组相比无显著差异;NE的浓度随DON剂量的增加而增加,但各组间均无显著差异;与对照组相比,高剂量组DA和GABA浓度显著降低(P < 0.05),低剂量组DA和GABA浓度有所降低但无显著性,高剂量组DA和GABA浓度相比低剂量组有所降低但无显著性;与对照组相比,高、低剂量组的ACH含量均极显著降低(P < 0.01),且与低剂量组相比,高剂量组的ACH含量极显著降低(P < 0.01)。
|
|
表 3 DON对神经递质浓度的影响(x±s) Table 3 Effects of DON on the concentrations of neurotransmitter (x±s) |
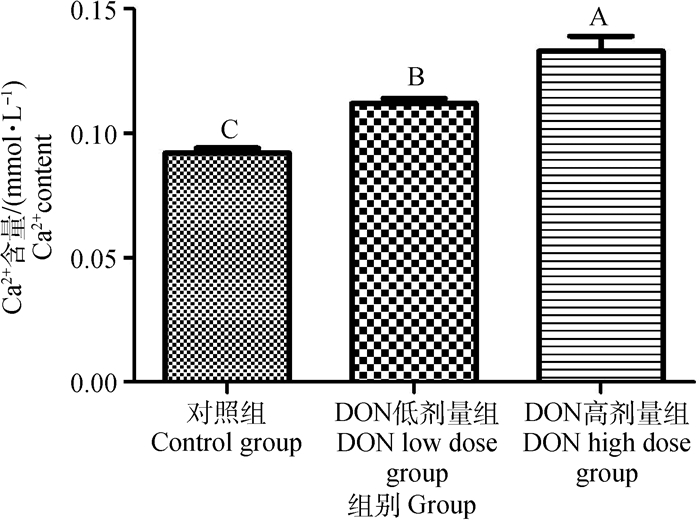
不同剂量DON对仔猪延髓组织中Ca2+浓度的影响如图 1所示。与对照组相比,高、低剂量组的Ca2+浓度均极显著上升(P < 0.01);与低剂量组相比,高剂量组的Ca2+浓度呈极显著升高(P < 0.01)。
|
组间比较,上标小写字母不同表示差异显著(P < 0.05),上标大写字母不同表示差异极显著(P < 0.01),上标有相同字母表示差异不显著(P>0.05)。下同 Comparison among groups, the data with different superscripts of small letters indicate significant difference(P < 0.05), the data with different superscripts of capital letters indicate significant difference(P < 0.01), the data with the same superscript letter or no superscript letter means no significant difference(P>0.05). The same as follows 图 1 DON对钙离子浓度的影响 Fig. 1 Effects of DON on the concentrations of Ca2+ |
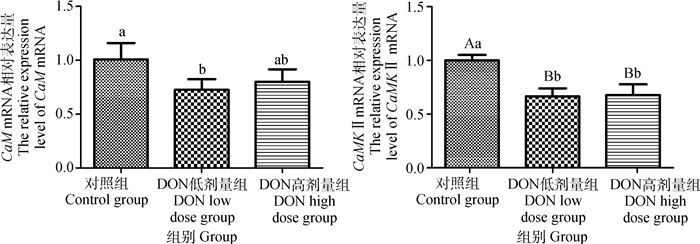
不同剂量DON对仔猪延髓组织中CaM和CaMKⅡ mRNA相对表达量的影响如图 2所示。与对照组相比,高剂量组中CaM mRNA表达量有所降低但效果无显著差异,低剂量组的CaM mRNA相对表达量显著降低(P < 0.05);同时低剂量组和高剂量组CaMKⅡ mRNA基因相对表达量均极显著降低(P < 0.01);高剂量组相比低剂量组的CaMKⅡ mRNA相对表达量有所升高,但结果无显著性差异。
|
图 2 DON对CaM和CaMK Ⅱ mRNA相对表达量的影响 Fig. 2 Effects of DON on the relative expression of CaM and CaMK Ⅱ mRNA |
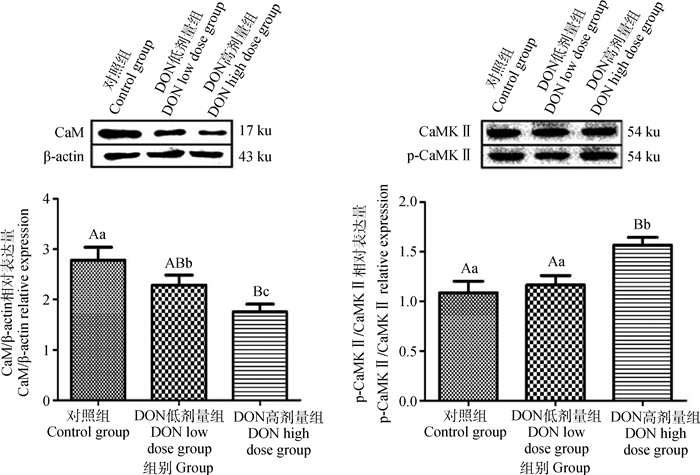
不同剂量DON对仔猪延髓组织中CaM和p-CaMKⅡ蛋白表达水平的影响如图 3所示。与对照组相比,高剂量组CaM蛋白水平呈极显著降低(P < 0.01),低剂量组CaM蛋白水平显著降低(P < 0.05),高剂量组CaM蛋白水平较低剂量组显著降低(P < 0.05);与对照组相比,高剂量组p-CaMKⅡ/CaMKⅡ蛋白水平极显著高于对照组和低剂量组(P < 0.01),而低剂量组与对照组相比无显著差异。
|
图 3 DON对CaM和CaMK Ⅱ蛋白表达水平的影响 Fig. 3 Effects of DON on the expression levels of CaM and CaMK Ⅱ proteins |
镰刀菌属(Fusarium)真菌是世界范围内污染最严重的大型真菌属之一,在世界范围内引起越来越多的食品安全问题[15-16]。DON作为该菌属最重要的毒素之一,在世界范围内被广泛研究。陈晓芳等[17]研究报道,DON可通过引起线粒体功能障碍,激活caspases-3并调节Bcl-2家族基因,从而诱导仔猪海马神经细胞凋亡。目前已有很多关于DON对动物脑、胃肠道、生殖系统以及免疫系统影响的研究,然而有关DON对延髓的影响未见报道,本试验以仔猪延髓组织作为研究对象,探究DON对仔猪延髓组织脂质过氧化反应、神经递质分泌以及钙稳态变化的影响。
SOD和GSH-Px作为机体内最主要的抗氧化损伤酶,有清除机体自由基的功能,MDA是细胞脂质过氧化的终产物,反映了机体脂质过氧化水平,NO的含量与脑损伤程度呈正相关,高浓度的NO具有强烈的神经毒性,能够损害脑组织[18]。Hou等[19]通过研究DON对小鼠的毒性作用,发现实验小鼠血清和组织中MDA水平升高,组织中SOD活性下降,表明DON可以引起小鼠产生氧化应激反应。Wu等[20]通过研究DON对猪生长性能的影响,发现SOD和GSH-Px的活性均随着DON浓度的升高而降低且呈剂量依赖性。本试验结果显示,通过饲喂仔猪含DON的饲料会导致仔猪延髓组织中SOD和GSH-Px活性的降低并且表现出剂量依赖性,同时延髓组织中MDA和NO浓度随DON浓度的增加而升高,说明DON可造成仔猪延髓组织发生氧化应激反应,与上述报道相一致。
神经递质作为机体生命活动信号传输的信使,参与多种生理生化过程[21]。Girish等[22]在给火鸡饲喂以DON为主要毒素的饲料时,发现火鸡脑干中5-HT等神经递质分泌增加,导致鸡拒食,生长缓慢。Swamy等[23-24]试验证明DON可导致猪脑部5-HT浓度升高,进而影响猪的摄食行为,使猪出现拒食和呕吐现象。吴文达[25]研究发现DON诱导水貂机体5-HT水平的变化可能是水貂出现呕吐症状的原因,并发现水貂呕吐程度与血浆中5-HT浓度呈正相关。本试验研究结果显示给仔猪饲喂含DON的饲料,会引起延髓中ACH和GABA水平不同程度的下调,5-HT、NE和DA水平上升,表明DON可影响神经递质的分泌,对仔猪的脑组织生长发育有一定的损伤作用。
钙稳态是指机体正常代谢过程中细胞内游离Ca2+浓度与细胞外Ca2+浓度之间较恒定的梯度差,CaM作为真核细胞内Ca2+的重要受体,具有传导Ca2+信号的作用[26]。神经细胞内异常增加的Ca2+作为第二信使,通过多途径钙信号转导,能够引起涉及蛋白质修饰的短时程反应和改变基因表达的长时程适应性反应[27]。任志华等[28]研究表明,DON暴露能够增加鸡脾淋巴细胞中Ca2+含量和CaM mRNA表达量,且均显著或极显著高于对照组,表明DON能引起鸡淋巴细胞中钙稳态失衡。Tsukane和Yamauchi[29]研究发现,CaMKⅡ能介导P19细胞的凋亡。Wang等[30]研究表明,DON使雏鸡脑组织中CaM含量下调且显著降低CaM mRNA相对表达量,表明DON能够破坏雏鸡神经组织的钙稳态。本试验研究发现饲喂含DON饲料能够抑制仔猪延髓组织中CaMKⅡ mRNA的表达,使CaMKⅡ磷酸化水平升高,导致仔猪出现神经毒性,破坏神经组织的钙稳态,随着DON染毒剂量的增加,神经细胞内Ca2+浓度逐渐升高,CaM游离蛋白水平降低,表明钙调蛋白通路的激活在DON诱导仔猪神经毒性的过程中发挥重要作用。
4 结论通过DON体内暴露试验证实,DON可造成仔猪延髓组织发生氧化应激反应,并影响神经递质的分泌,引起延髓中SOD和GSH-Px活性以及ACH和GABA浓度的降低,同时MDA、NO、5-HT、DA和NE浓度随DON浓度的增加而升高。DON显著升高仔猪延髓组织中钙离子浓度,下调延髓组织中CAM蛋白水平及CaM和CaMKⅡ mRNA的相对表达量,上调CaMKⅡ磷酸化水平,引起钙稳态失衡。DON对仔猪具有神经毒性,引起脂质过氧化作用,在钙调蛋白通路的调控下,使神经递质浓度发生变化,从而产生毒性作用。
| [1] | WANG X C, FAN M X, CHU X Y, et al. Deoxynivalenol induces toxicity and apoptosis in piglet hippocampal nerve cells via the MAPK signaling pathway[J]. Toxicon, 2018, 155: 1–8. |
| [2] | PESTKA J J. Deoxynivalenol:mechanisms of action, human exposure, and toxicological relevance[J]. Arch Toxicol, 2010, 84(9): 663–679. |
| [3] | HAN J, WANG Q C, ZHU C C, et al. Deoxynivalenol exposure induces autophagy/apoptosis and epigenetic modification changes during porcine oocyte maturation[J]. Toxicol Appl Pharmacol, 2016, 300: 70–76. DOI: 10.1016/j.taap.2016.03.006 |
| [4] |
范梦雪, 陈晓芳, 姜云晶, 等. 脱氧雪腐镰刀菌烯醇对仔猪海马神经细胞的毒性作用[J]. 中国兽医科学, 2017, 47(1): 121–127.
FAN M X, CHEN X F, JIANG Y J, et al. Toxic effects of deoxynivalenol on hippocampal nerve cells of piglets[J]. Chinese Veterinary Science, 2017, 47(1): 121–127. (in Chinese) |
| [5] | SAVARD C, NOGUES P, BOYER A, et al. Prevention of deoxynivalenol- and zearalenone-associated oxidative stress does not restore MA-10 Leydig cell functions[J]. Toxicology, 2016, 341-343: 17–27. |
| [6] | TIAN Y, TAN Y L, LIU N, et al. Functional agents to biologically control deoxynivalenol contamination in cereal grains[J]. Front Microbiol, 2016, 7: 395. |
| [7] | PARK S H, KIM J, KIM D, et al. Mycotoxin detoxifiers attenuate deoxynivalenol-induced pro-inflammatory barrier insult in porcine enterocytes as an in vitro evaluation model of feed mycotoxin reduction[J]. Toxicol in Vitro, 2017, 38: 108–116. DOI: 10.1016/j.tiv.2016.10.003 |
| [8] |
许伟, 耿芳芳, 范梦雪, 等. 脱氧雪腐镰刀菌烯醇毒性的研究进展[J]. 生物学杂志, 2016, 33(1): 78–81, 85.
XU W, GENG F F, FAN M X, et al. Research progress of deoxynivalenol toxicity[J]. Journal of Biology, 2016, 33(1): 78–81, 85. DOI: 10.3969/j.issn.2095-1736.2016.01.078 (in Chinese) |
| [9] | NORDKVIST E, HÄGGBLOM P. Fusarium mycotoxin contamination of cereals and bedding straw at Swedish pig farms[J]. Anim Feed Sci Technol, 2014, 198: 231–237. |
| [10] | BRERA C, BERTAZZONI V, DEBEGNACH F, et al. Exposure assessment for Italian population groups to deoxynivalenol deriving from pasta consumption[J]. Toxins, 2013, 5(12): 2293–2309. DOI: 10.3390/toxins5122293 |
| [11] | REN Z H, DENG H D, DENG Y T, et al. Effect of the Fusarium toxins, zearalenone and deoxynivalenol, on the mouse brain[J]. Environ Toxicol Pharmacol, 2016, 46: 62–70. DOI: 10.1016/j.etap.2016.06.028 |
| [12] | PESTKA J J. Deoxynivalenol-induced IgA production and IgA nephropathy-aberrant mucosal immune response with systemic repercussions[J]. Toxicol Lett, 2003, 140-141: 287–295. |
| [13] |
刘冰, 金一和. 中枢神经系统钙稳态紊乱与神经损伤的研究进展[J]. 国外医学(卫生学分册), 2006, 33(4): 193–198.
LIU B, JIN Y H. Advances in research on central nervous system calcium homeostasis and nerve injury[J]. Foreign Medical Sciences (Section Hygiene), 2006, 33(4): 193–198. (in Chinese) |
| [14] | HAN F, SHIRASAKI Y, FUKUNAGA K. Microsphere embolism-induced endothelial nitric oxide synthase expression mediates disruption of the blood-brain barrier in rat brain[J]. J Neurochem, 2006, 99(1): 97–106. DOI: 10.1111/jnc.2006.99.issue-1 |
| [15] | LIU Y P, LU Y, WANG L Y, et al. Occurrence of deoxynivalenol in wheat, Hebei province, China[J]. Food Chem, 2016, 197: 1271–1274. DOI: 10.1016/j.foodchem.2015.11.047 |
| [16] | WU L, LI J J, LI Y H, et al. Aflatoxin B1, zearalenone and deoxynivalenol in feed ingredients and complete feed from different province in China[J]. J Anim Sci Biotechnol, 2017, 7: 63. |
| [17] |
陈晓芳, 张娅菲, 储小燕, 等. 脱氧雪腐镰刀菌烯醇对仔猪海马神经细胞凋亡及线粒体膜电位的影响[J]. 南京农业大学学报, 2018, 41(3): 526–533.
CHEN X F, ZHANG Y F, CHU X Y, et al. Effects of deoxynivalenol on apoptosis and mitochondrial membrane potential in piglet hippocampal nerve cells[J]. Journal of Nanjing Agricultural University, 2018, 41(3): 526–533. (in Chinese) |
| [18] | LIANG Z, REN Z H, GAO S, et al. Individual and combined effects of deoxynivalenol and zearalenone on mouse kidney[J]. Environ Toxicol Pharmacol, 2015, 40(3): 686–691. |
| [19] | HOU Y J, ZHAO Y Y, XIONG B, et al. Mycotoxin-containing diet causes oxidative stress in the mouse[J]. PLoS One, 2013, 8(3): e60374. |
| [20] | WU L, LIAO P, HE L Q, et al. Growth performance, serum biochemical profile, jejunal morphology, and the expression of nutrients transporter genes in deoxynivalenol (DON)- challenged growing pigs[J]. BMC Vet Res, 2015, 11: 144. |
| [21] | ENYEDY E J, MITCHELL J P, NAMBIAR M P, et al. Defective FcγRIIb1 signaling contributes to enhanced calcium response in B cells from patients with systemic lupus erythematosus[J]. Clin Immunol, 2001, 101(2): 130–135. |
| [22] | GIRISH C K, MACDONALD E J, SCHEININ M, et al. Effects of feedborne Fusarium mycotoxins on brain regional neurochemistry of turkeys[J]. Poult Sci, 2008, 87(7): 1295–1302. DOI: 10.3382/ps.2008-00025 |
| [23] | SWAMY H V L N, SMITH T K, MACDONALD E J, et al. Effects of feeding a blend of grains naturally contaminated with Fusarium mycotoxins on swine performance, brain regional neurochemistry, and serum chemistry and the efficacy of a polymeric glucomannan mycotoxin adsorbent[J]. J Anim Sci, 2002, 80(12): 3257–3267. DOI: 10.2527/2002.80123257x |
| [24] | SWAMY H V L N, SMITH T K, MACDONALD E J. Effects of feeding a blend of grains naturally contaminated with Fusarium mycotoxins on brain regional neurochemistry of starter pigs and broiler chickens[J]. J Anim Sci, 2004, 82(7): 2131–2139. DOI: 10.2527/2004.8272131x |
| [25] |
吴文达. B型单端孢霉烯族毒素诱导拒食和呕吐的机理研究[D].南京: 南京农业大学, 2012.
WU W D. Mechanisms of 8-ketotrichothecene-induced anorexia and emesis[D]. Nanjing: Nanjing Agricultural University, 2012. (in Chinese) |
| [26] | PLANK M J, WALL D J N, DAVID T. Atherosclerosis and calcium signalling in endothelial cells[J]. Prog Biophys Mol Biol, 2006, 91(3): 287–313. |
| [27] | GUTHRIE H D, WELCH G R, THEISEN D D, et al. Effects of hypothermic storage on intracellular calcium, reactive oxygen species formation, mitochondrial function, motility, and plasma membrane integrity in striped bass (Morone saxatilis) sperm[J]. Theriogenology, 2011, 75(5): 951–961. DOI: 10.1016/j.theriogenology.2010.10.037 |
| [28] |
任志华, 王亚超, 邓俊良. 脱氧雪腐镰刀菌烯醇与玉米赤霉烯酮联合暴露对体外培养鸡脾脏淋巴细胞内环境稳态的影响[J]. 动物营养学报, 2017, 29(8): 2836–2842.
REN Z H, WANG Y C, DENG J L. Effects of combined exposure to deoxynivalenol and zearalenone on homeostasis of chicken splenic lymphocytes cultured in vitro[J]. Chinese Journal of Animal Nutrition, 2017, 29(8): 2836–2842. DOI: 10.3969/j.issn.1006-267x.2017.08.028 (in Chinese) |
| [29] | TSUKANE M, YAMAUCHI T. Ca2+/calmodulin-dependent protein kinase II mediates apoptosis of P19 cells expressing human tau during neural differentiation with retinoic acid treatment[J]. J Enzy Inhib Med Chem, 2009, 24(2): 365–371. |
| [30] | WANG X C, TANG J S, GENG F F, et al. Effects of deoxynivalenol exposure on cerebral lipid peroxidation, neurotransmitter and calcium homeostasis of chicks in vivo[J]. Toxicon, 2018, 150: 60–65. |



