2. 农业部动物疾病临床诊疗技术重点实验室, 呼和浩特 010018
2. Key Laboratory of Clinical Diagnosis and Treatment Technology in Animal Disease of Ministry of Agriculture, Hohhot 010018, China
β-防御素(β-defensin, BD-1)作为防御素家族的重要成员,广泛分布于多种脊椎动物中[1]。其除了具有直接的抗菌活性外,还具有促进先天性和适应性免疫反应的能力[2-3]。已有研究表明,不同物种的β-防御素在体内和体外可以被酵母菌及其细胞壁成分所诱导[4-8],而酵母菌细胞壁主要由多层碳水化合物组成,包括甘露聚糖、β-葡聚糖和壳多糖[9]。甘露聚糖作为酵母菌细胞壁的主要成分,已被证明具有增加动物体液免疫和细胞免疫能力,并具有调节宿主胃肠道微生态平衡和提高胃肠道免疫反应等多种生物学活性作用[10]。此外,也有报道显示白色念珠菌甘露聚糖能够刺激人角质形成细胞β-防御素-2 mRNA转录水平的增强[11]。本团队前期的研究同样发现来自酿酒酵母(Saccharomyces cerevisiae)的甘露聚糖能够诱导绵羊瘤胃上皮细胞(ovine ruminal epithelial cells,ORECs)β-防御素-1(sheep β-defensin-1, SBD-1)的表达[12],且主要由膜受体Dectin-2介导(未发表资料),但对其下游的信号衔接蛋白脾酪氨酸激酶(spleen tyrosine kinase,Syk)是否参与此诱导过程还未见报道。
Syk是一种细胞质蛋白酪氨酸激酶,是非受体酪氨酸激酶Src的家族成员[13]。其最初仅在造血细胞中发现有表达,但现已显示在非造血细胞中(如肝细胞[14]、结肠癌细胞[15]、乳腺癌细胞[16]和人肠细胞[17])也有表达,并能够介导各种细胞因子的信号传导。此外,Dectin-2激活后可以与Syk形成二聚体结构[18],当Syk被抑制或干扰后,MAPK和NF-κB活化程度均能够被抑制[19],这进一步表明Syk在信号传导中发挥重要作用。然而,并不是所有Dectin-2信号传导都依赖Syk,如在巨噬细胞中由Dectin-2启动的酵母聚糖吞噬作用是Syk非依赖性的[20]。因此,本研究在发现酿酒酵母甘露聚糖(S. cerevisiae mannan,S.c M)通过膜受体Dectin-2介导SBD-1表达的基础上,进一步通过免疫组化、免疫荧光、Western blot、qPCR和ELISA方法对下游的信号衔接蛋白Syk是否参与S.c M诱导SBD-1的表达进行研究,为今后继续研究S.c M诱导SBD-1表达所激活的信号通路奠定了理论基础。
1 材料与方法 1.1 主要试剂及仪器总RNA提取试剂盒(Axygen)、反转录试剂盒(TaKaRa)、qPCR酶(TaKaRa)、SYBR Green Ⅱ荧光染料(TaKaRa)、Syk特异性抑制剂R406(InvivoGen)、兔抗小鼠Syk多克隆抗体(Abcam)、UltraSensitiveTMS-P超敏试剂盒(鼠/兔)(福州迈新)、激光共聚焦显微镜(LSM 800, Zeiss)、化学信号发光检测系统(Chem Studio)。
1.2 ORECs传代培养将本实验室冻存的ORECs在37 ℃水浴锅中迅速融化,并用DMEM/F12将复苏的细胞清洗1次,之后用完全培养基于37 ℃、5% CO2培养箱中静置培养。当ORECs在培养瓶中达到85%~95%后将细胞进行传代培养,传于细胞培养板用于后续的细胞刺激试验。
1.3 引物及siRNA设计本试验中所用的内参基因β-actin,目的基因SBD-1和Syk的引物以及三条靶向Syk的特异性siRNAs(#1、#2和#3)和一条非特异性siRNA(NS siRNA)均由上海生工生物工程股份有限公司设计和合成(表 1、表 2)。
|
|
表 1 RT-PCR引物序列 Table 1 The primer sequences for RT-PCR |
|
|
表 2 小干扰RNA的序列 Table 2 Sequences of short interfering RNAs |
将绵羊瘤胃组织在4%多聚甲醛中室温固定24 h后,常规制备石蜡连续切片。而后按照UltraSensitiveTMS-P超敏试剂盒(鼠/兔)说明书进行操作,一抗为兔抗小鼠Syk多克隆抗体(1:200),经DAB显色、苏木精复染、脱水、透明和中性树胶封片,并用倒置显微镜观察和拍照。对照组用同型对照抗体取代一抗,其他步骤同上。
1.4.2 RT-PCR方法检测将提取的总RNA反转录为cDNA后,根据Premix TaqTM试剂盒说明书进行PCR反应,最后将PCR产物经1%琼脂糖凝胶电泳进行检测。
1.4.3 免疫荧光方法检测ORECs用4%多聚甲醛固定后,经0.5% Triton X-100通透20 min,并在室温下用5%的BSA封闭1 h后加入Syk一抗(1:200),湿盒内4 ℃孵育过夜,然后加相应的二抗室温振荡孵育2 h,最后DAPI复染核后在激光共聚焦显微镜下观察并拍照。
1.5 S.c M刺激ORECs后对Syk表达的影响 1.5.1 qPCR方法检测将培养的ORECs分为2组:不作任何处理的ORECs为空白对照组,S.c M处理的ORECs为刺激组。将以上细胞提取总RNA后进行反转录反应,并以反转录得到的cDNA为模板,按照SYBR Green Ⅱ荧光染料说明书进行qPCR反应。
1.5.2 Western blot方法检测将处理后的细胞根据Western blot及IP细胞裂解液试剂盒说明书提取总蛋白,并使用BCA试剂盒检测蛋白质浓度。依次通过SDS-PAGE、转膜、封闭后,在4 ℃条件下将不同的膜分别与Syk抗体(1:750)、p-Syk抗体(1:750)和β-actin抗体(1:1 000)孵育过夜后,再与相应的二抗进行孵育。最后使用化学信号发光检测系统对膜进行可视化,并用Image-Pro Plus 6.0软件分析每个条带的灰度值。
1.6 Syk siRNA干扰ORECs对Syk表达的影响将Syk特异性siRNAs和NS siRNA根据说明书进行转染,操作步骤如下:在室温下将3条Syk siRNAs和NS siRNA分别与LipofectamineTM 3000转染试剂一起孵育15 min后,将混合物加入到细胞培养板的每个孔中,轻轻摇动混合,将转染的细胞孵育24 h后通过qPCR和Western blot检测Syk的表达情况。同时用MTT法检测Syk特异性siRNAs和NS siRNA转染ORECs 24 h后的细胞活力。将100 μL DMEM/F12培养基和10 μL MTT加入到每个孔中并在37 ℃,5% CO2培养箱中孵育4 h后用DMSO溶解,同时将未处理的细胞作为对照组,最后用酶标仪测定各孔的OD540 nm值。
1.7 Syk在S.c M诱导SBD-1表达过程中的作用为了研究Syk在S.c M诱导SBD-1表达过程中的作用,用特异性Syk siRNA#2干扰ORECs 24 h或用Syk特异性抑制剂R406(1和5 μmol·L-1)预处理ORECs 30 min后再用50 μg·mL-1 S.c M刺激的细胞作为试验组,仅用S.c M刺激的细胞作为阳性对照组,单独用NS siRNA或R406处理的细胞作为阴性对照组,未做任何处理的细胞作为空白对照组。刺激4 h后提取上述各组细胞总RNA并进行qPCR反应,以检测SBD-1 mRNA表达变化。同时将收集的细胞培养上清用绵羊防御素β1(DEFβ1)ELISA试剂盒检测SBD-1蛋白表达变化。
1.8 数据统计分析所有数据为至少3个独立试验的x±s。使用GraphPad Prism 5.0软件绘图。数据采用SPSS 20.0软件进行独立样本T检验,多组间的差异通过单因素方差分析(one-way ANOVA)中的最小显著性差异法(LSD)进行多重比较。统计学显著性设定在P < 0.05水平。
2 结果 2.1 Syk在ORECs内表达的检测通过免疫组化、RT-PCR和免疫荧光方法对Syk是否在瘤胃组织及ORECs内的表达情况进行检测。免疫组化结果显示Syk棕黄色阳性信号主要在瘤胃组织黏膜上皮的棘层和基底层表达,黏膜下层未见棕黄色染色,且同型对照组无阳性信号(图 1A);然后通过RT-PCR和免疫荧光两种方法进一步检测Syk在ORECs内的表达情况,PCR产物经1%琼脂糖凝胶电泳分析后,存在约139 bp的单一条带(图 1B),与预期片段大小相一致;免疫荧光结果显示ORECs内有Syk表达的红色阳性信号,且同型对照未见阳性信号(图 1C)。因此,Syk在ORECs内表达。
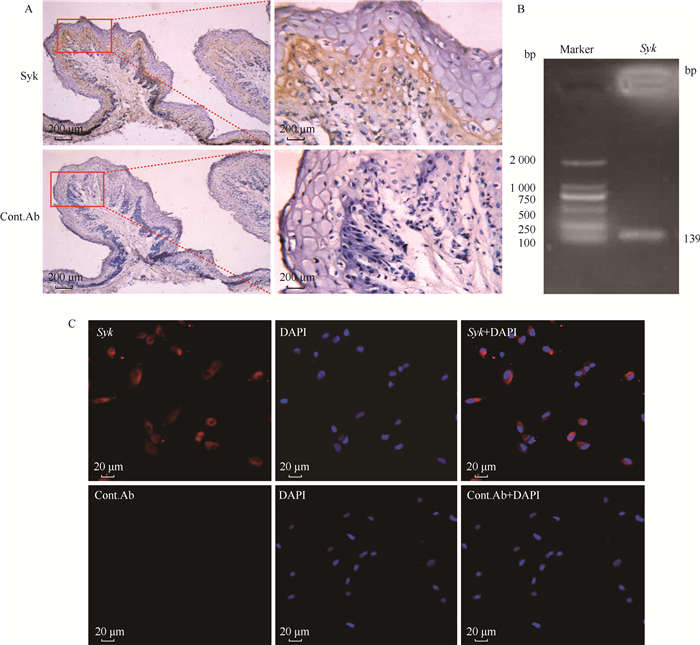
|
A.免疫组织化学结果;B. Syk PCR产物(Marker. D2000);C.免疫荧光结果 A. Immunohistochemical results; B. Syk PCR product (Marker. D2000); C. Immunofluorescence results 图 1 Syk在ORECs内表达的鉴定结果 Fig. 1 Identification results of Syk expression in ORECs |
为了研究Syk在S.c M诱导SBD-1表达过程中的可能作用,用qPCR和Western blot检测S.c M刺激ORECs后Syk的表达变化。结果显示:与未刺激组相比,S.c M刺激ORECs后Syk mRNA和蛋白质表达均显著增加(P < 0.01或P < 0.05,图 2A,2B)。此外,用Western blot检测S.c M刺激ORECs不同时间(5、15、30、45和60 min)后Syk的磷酸化水平。结果发现S.c M刺激ORECs不同时间后均能使Syk发生磷酸化,且刺激15 min后磷酸化水平达到最大,与未刺激组相比呈极显著差异(P < 0.01,图 2C),以上这些结果表明S.c M能够激活Syk。
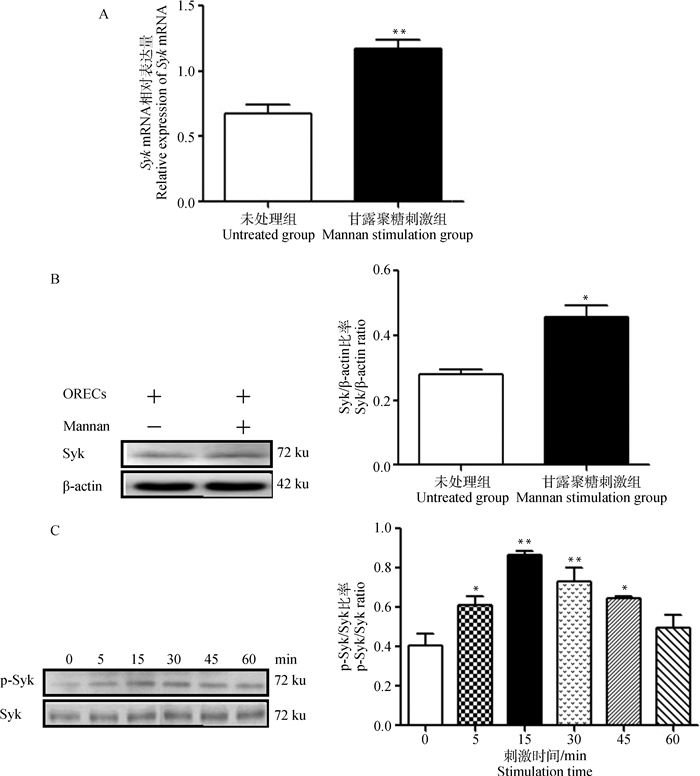
|
A. S.c M对Syk mRNA表达的影响;B. S.c M对Syk蛋白表达的影响;C. S.c M对Syk磷酸化水平的影响。与未刺激组相比,* P < 0.05, ** P < 0.01 A. Effects of mannan on Syk mRNA expression; B. Effects of mannan on Syk protein expression; C. Effects of mannan on Syk phosphorylation. Compared to the unstimulated group, * P < 0.05, ** P < 0.01 图 2 S.c M对Syk的激活情况 Fig. 2 S.c M activation of Syk |
为了检测siRNAs干扰ORECs后对Syk表达的影响,将细胞用Syk siRNAs(#1、#2和#3)和NS siRNA干扰24 h,而后经qPCR检查,结果显示,3条特异性Syk siRNAs均能显著降低Syk的表达(P < 0.01或P < 0.05),且Syk siRNA#2的作用效果最明显(图 3A,P < 0.01)。同时通过MTT测定发现Syk siRNAs和NS siRNA对ORECs的活性基本无影响(图 3B,P>0.05)。然后通过Western blot检测Syk siRNA#2的有效性,结果如图 3C、D所示,与NS siRNA相比,Syk siRNA#2处理ORECs后Syk mRNA和蛋白质表达均极显著降低(P < 0.01)。因此,Syk siRNA#2可阻断Syk的表达,可用于后续试验。
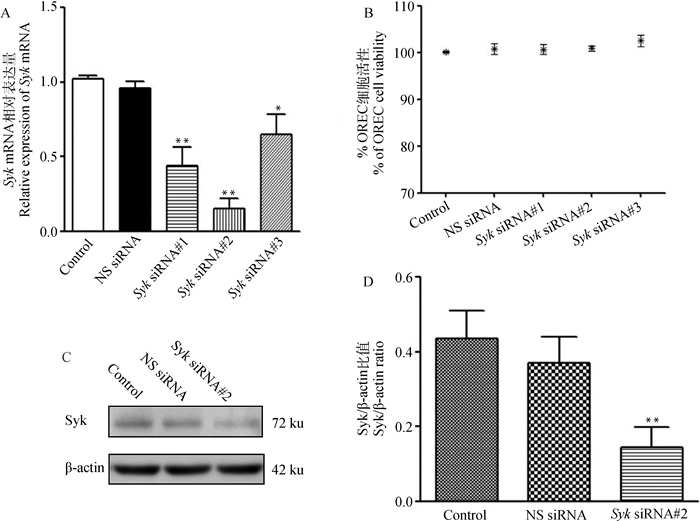
|
A.Syk siRNAs干扰ORECs对Syk mRNA表达影响;B. MTT检测Syk siRNAs对ORECs活性影响;C、D. Syk siRNA#2干扰ORECs对Syk蛋白表达影响。与空白对照组相比,* P < 0.05, ** P < 0.01 A. The effect of Syk siRNAs interference on Syk mRNA expression; B. The effect of Syk siRNAs on ORECs activity by MTT; C, D. The effect of Syk siRNA#2 interference on Syk protein expression. Compared to the control group, * P < 0.05, ** P < 0.01 图 3 Syk siRNA干扰ORECs对Syk表达的影响 Fig. 3 Effects of mannan on Syk expression |
接下来为了检测Syk是否介导S.c M诱导SBD-1的表达。用阻断效果最好的Syk siRNA#2和NS siRNA干扰ORECs 24 h后,再用50 μg·mL-1 S.c M刺激ORECs 4 h。qPCR和ELISA检测结果显示S.c M可以极显著增加SBD-1的表达(相对于空白对照,P < 0.01),并且干扰Syk极显著降低了S.c M诱导SBD-1 mRNA和蛋白的表达(图 4A、B; P < 0.01)。此外用Syk抑制剂R406预处理ORECs后,同样用50 μg·mL-1 S.c M刺激ORECs 4 h,结果显示:R406预处理ORECs后S.c M诱导SBD-1的表达显著降低(图 4C、D; 与阳性对照组相比,P < 0.01或P < 0.05),而单独用抑制剂处理的ORECs组与空白对照组相比,差异不显著(P>0.05)。因此,以上结果表明Syk参与S.c M诱导SBD-1的表达过程。
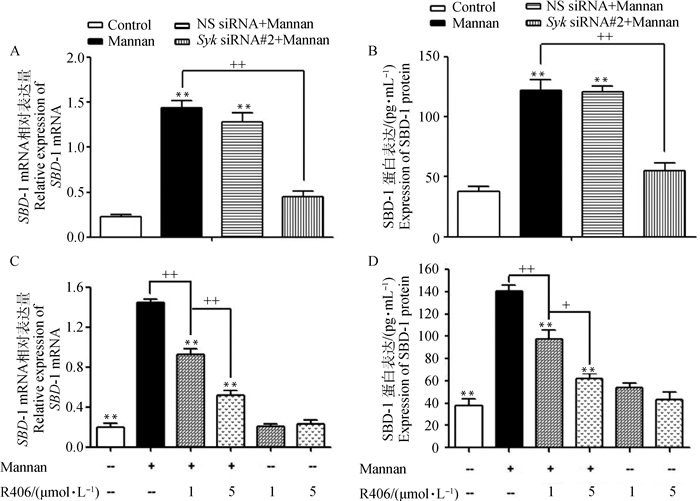
|
A、B.Syk siRNA#2预处理ORECs对SBD-1 mRNA和蛋白表达影响;C、D. R406预处理ORECs对SBD-1 mRNA和蛋白表达影响。与空白组相比,*. P < 0.05, **.P < 0.01;与S.c M刺激组相比,+. P < 0.05, ++.P < 0.01 A, B. Effects of Syk siRNA#2 pretreatment of ORECs on SBD-1 mRNA and protein expression; C, D. Effects of R406 pretreatment of ORECs on SBD-1 mRNA and protein expression. Compared with the control group, *.P < 0.05; **.P < 0.01; Compared with the S.c M-induced group, +. P < 0.05, ++. P < 0.01 图 4 Syk在S.c M诱导SBD-1表达过程中的作用 Fig. 4 The role of Syk in the expression of SBD-1 induced by mannan |
β-防御素作为先天性免疫的效应物、体液和细胞免疫应答的增强剂,具有保护呼吸道、泌尿生殖道和胃肠道的皮肤和黏膜等功能。而将其作为药物防治胃肠道疾病已成为学者们关注的一个新方向。在之前的研究中本团队已经证明来源于酿酒酵母的甘露聚糖具有剂量和浓度依赖性诱导SBD-1表达的作用,同时也检测出该过程主要是由膜受体Dectin-2介导产生的,但对其下游的信号通路并未检测。因此,笔者在以上研究的基础上进一步探索Dectin-2典型的信号衔接蛋白Syk在S.c M诱导SBD-1表达过程中可能扮演的角色。
Syk作为一种非受体蛋白酪氨酸激酶,它可以传递B细胞抗原受体或造血细胞的Fc受体信号,包括肥大细胞、淋巴细胞、中性粒细胞和单核细胞,从而调节免疫反应[21]。在过敏性哮喘和类风湿性关节炎在内的慢性炎症性疾病中,Syk在发病机制中起着至关重要的作用,并已成为一种新的治疗靶点[22]。除了造血细胞外,已有报道显示Syk在人视网膜色素上皮细胞、角膜上皮细胞和近端肾小管上皮细胞中均有表达[23-25],但仍未见在ORECs内表达的报道。因此本研究通过免疫组化、RT-PCR和免疫荧光方法首次证明Syk在ORECs中有表达,并且Syk在ORECs中的分布和人的支气管上皮细胞中的细胞定位一致[26],这提示Syk可能在上皮细胞的表达具有普遍性。
为探究Syk是否参与甘露聚糖诱导ORECs SBD-1的表达过程,用qPCR和Western blot检测发现S.c M刺激ORECs后Syk的mRNA和蛋白表达均升高,表明S.c M刺激ORECs后可以激活Syk的高表达。随后进一步用Western blot证明了S.c M刺激ORECs不同时间后均可以激活Syk发生磷酸化,且Syk在刺激15 min时磷酸化最明显,此结果提示Syk的磷酸化是个持续性过程,而不是一过性的,磷酸化水平随着刺激时间的延长达到最高后又逐渐趋于正常。
有研究表明磷酸化的Syk可以激活下游靶标蛋白[27],2008年Yang等[28]研究发现在培养的人肾小球内皮细胞中,高葡萄糖可能通过激活Syk导致IκBα发生磷酸化,从而激活NF-κB信号通路。2014年Cohen-Kedar等[17]报道在人肠细胞中酵母聚糖诱导IL-8和CCL-2分泌是Syk依赖性的。在本试验中,用Syk siRNA#2和Syk特异性抑制剂R406预处理ORECs后能够减弱S.c M诱导SBD-1的表达,这也同样意味着S.c M诱导ORECs SBD-1的表达是Syk依赖性的。因此,Syk是细胞内信号传递的中间者,能够把膜受体的信号向下游信号通路传递,最终引起效应分子的转录;Syk也可能对机体发挥先天性和适应性免疫反应具有重要作用,这也为阐明S.c M通过调节Syk转录活性影响抗菌肽分泌过程提供了初步的线索和思路。
4 结 论首次证明Syk在绵羊瘤胃组织及ORECs内表达,并且Syk参与S.c M诱导ORECs SBD-1的表达,为进一步研究S.c M诱导SBD-1表达所激活的信号通路奠定了理论基础。
| [1] | ZHU S Y, GAO B. Evolutionary origin of β-defensins[J]. Dev Comp Immunol, 2013, 39(1-2): 79–84. DOI: 10.1016/j.dci.2012.02.011 |
| [2] | BARABAS N, RÖHRL J, HOLLER E, et al. Beta-defensins activate macrophages and synergize in pro-inflammatory cytokine expression induced by TLR ligands[J]. Immunobiology, 2013, 218(7): 1005–1011. |
| [3] | CUPERUS T, COORENS M, VAN DIJK A, et al. Avian host defense peptides[J]. Dev Comp Immunol, 2013, 41(3): 352–369. |
| [4] | GÁCSER A, TISZLAVICZ Z, NÉMETH T, et al. Induction of human defensins by intestinal Caco-2 cells after interactions with opportunistic Candida species[J]. Microbes Infect, 2014, 16(1): 80–85. |
| [5] | JIN X, ZHANG M, ZHU X M, et al. Modulation of ovine SBD-1 expression by Saccharomyces cerevisiae in ovine ruminal epithelial cells[J]. BMC Vet Res, 2018, 14(1): 134. DOI: 10.1186/s12917-018-1445-9 |
| [6] | SHAO Y J, WANG Z, TIAN X Y, et al. Yeast β-D-glucans induced antimicrobial peptide expressions against Salmonella infection in broiler chickens[J]. Int J Biol Macromol, 2016, 85: 573–584. |
| [7] | GARCIA DIAZ T, FERRIANI BRANCO A, JACOVACI F A, et al. Inclusion of live yeast and mannan-oligosaccharides in high grain-based diets for sheep: ruminal parameters, inflammatory response and rumen morphology[J]. PLoS One, 2018, 13(2): e0193313. |
| [8] |
田巧珍, 金鑫, 张曼, 等. 酿酒酵母细胞壁诱导体外培养绵羊瘤胃上皮细胞表达SBD-1的研究[J]. 畜牧兽医学报, 2018, 49(5): 927–934.
TIAN Q Z, JIN X, ZHANG M, et al. Effects of cell wall of Saccharomyces cerevisiae on the expression of SBD-1 in cultured ruminal epithelial cells of sheep[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(5): 927–934. (in Chinese) |
| [9] | MAGNELLI P, CIPOLLO J F, ABEIJON C. A refined method for the determination of Saccharomyces cerevisiae cell wall composition and β-1, 6-glucan fine structure[J]. Anal Biochem, 2002, 301(1): 136–150. |
| [10] | WANG W W, LI Z, HAN Q Q, et al. Dietary live yeast and mannan-oligosaccharide supplementation attenuate intestinal inflammation and barrier dysfunction induced by Escherichia coli in broilers[J]. Br J Nutr, 2016, 116(11): 1878–1888. |
| [11] |
段德鉴, 蒋献, 冉玉平, 等. 白念珠菌对角质形成细胞β防御素-2mRNA表达的影响[J]. 中华皮肤科杂志, 2005, 38(4): 202–204.
DUAN D J, JIANG X, RAN Y P, et al. The effect of Candida albicans on the expression level of human β-defensin-2 mRNA in keratinocytes in vitro[J]. Chinese Journal of Dermatology, 2005, 38(4): 202–204. DOI: 10.3760/j.issn:0412-4030.2005.04.002 (in Chinese) |
| [12] |
金鑫, 张曼, 王云鹤, 等. 酿酒酵母甘露聚糖对绵羊瘤胃上皮细胞β-防御素-1(SBD-1)表达的影响[J]. 中国预防兽医学报, 2018, 40(12): 1117–1121.
JIN X, ZHANG M, WANG Y H, et al. Effects of mannan on the expression of SBD-1 in sheep rumen epithelial cells[J]. Chinese Journal of Preventive Veterinary Medicine, 2018, 40(12): 1117–1121. (in Chinese) |
| [13] | KUROSAKI T, TAKATA M, YAMANASHI Y, et al. Syk activation by the Src-family tyrosine kinase in the B cell receptor signaling[J]. J Exp Med, 1994, 179(5): 1725–1729. |
| [14] | TSUCHIDA S, YANAGI S, INATOME R, et al. Purification of a 72-kDa protein-tyrosine kinase from rat liver and its identification as Syk:involvement of Syk in signaling events of hepatocytes[J]. J Biochem, 2000, 127(2): 321–327. |
| [15] | OKAMURA S, NG C C, KOYAMA K, et al. Identification of seven genes regulated by wild-type p53 in a colon cancer cell line carrying a well-controlled wild-type p53 expression system[J]. Oncol Res, 1999, 11(6): 281–285. |
| [16] | COOPMAN P J P, DO M T H, BARTH M, et al. The Syk tyrosine kinase suppresses malignant growth of human breast cancer cells[J]. Nature, 2000, 406(6797): 742–747. |
| [17] | COHEN-KEDAR S, BARAM L, ELAD H, et al. Human intestinal epithelial cells respond to β-glucans via Dectin-1 and Syk[J]. Eur J Immunol, 2014, 44(12): 3729–3740. |
| [18] | DRUMMOND R A, SAIJO S, IWAKURA Y, et al. The role of Syk/CARD9 coupled C-type lectins in antifungal immunity[J]. Eur J Immunol, 2011, 41(2): 276–281. |
| [19] | TAKADA Y, AGGARWAL B B. TNF activates Syk protein tyrosine kinase leading to TNF-induced MAPK activation, NF-κB activation, and apoptosis[J]. J Immunol, 2004, 173(2): 1066–1077. |
| [20] | KERRIGAN A M, BROWN G D. Syk-coupled C-type lectin receptors that mediate cellular activation via single tyrosine based activation motifs[J]. Immunol Rev, 2010, 234(1): 335–352. |
| [21] | SADA K, TAKANO T, YANAGI S, et al. Structure and function of Syk protein-tyrosine kinase[J]. J Biochem, 2001, 130(2): 177–186. |
| [22] | PATTERSON H, NIBBS R, MCINNES I, et al. Protein kinase inhibitors in the treatment of inflammatory and autoimmune diseases[J]. Clin Exp Immunol, 2014, 176(1): 1–10. |
| [23] | PARK G B, KIM D. Cigarette smoke-induced EGFR activation promotes epithelial mesenchymal migration of human retinal pigment epithelial cells through regulation of the FAK-mediated Syk/Src pathway[J]. Mol Med Rep, 2018, 17(3): 3563–3574. |
| [24] | LIU Y, ZHAO G Q, LIN J, et al. The role of Syk signaling in antifungal innate immunity of human corneal epithelial cells[J]. BMC Ophthalmol, 2015, 15: 55. |
| [25] | YANG W S, KIM J S, HAN N J, et al. Toll-like receptor 4/spleen tyrosine kinase complex in high glucose signal transduction of proximal tubular epithelial cells[J]. Cell Physiol Biochem, 2015, 35(6): 2309–2319. |
| [26] | ULANOVA M, PUTTAGUNTA L, MARCET-PALACIOS M, et al. Syk tyrosine kinase participates in β1-integrin signaling and inflammatory responses in airway epithelial cells[J]. Am J Physiol-Lung Cell Mol Physiol, 2005, 288(3): L497–L507. |
| [27] | PITCHER L A, VAN OERS N S C. T-cell receptor signal transmission: who gives an ITAM?[J]. Trends Immunol, 2003, 24(10): 554–560. |
| [28] | YANG W S, SEO J W, HAN N J, et al. High glucose-induced NF-κB activation occurs via tyrosine phosphorylation of IκBα in human glomerular endothelial cells:involvement of Syk tyrosine kinase[J]. Am J Physiol Renal Physiol-Ren Physiol, 2008, 294(5): F1065–F1075. |



