2. 郑州大学, 郑州 450000;
3. 浙江海隆生物技术有限公司, 绍兴 312000
2. Zhengzhou University, Zhengzhou 450000, China;
3. Zhejiang Novo-biotech Co., Ltd., Shaoxing 312000, China
猪圆环病毒2型(PCV2)是引发猪圆环病毒相关疾病(PCVAD)的主要病原,给我国养殖业造成了巨大的经济损失[1]。患病猪在临床上表现为消瘦、食欲不振、精神状态差,皮肤出现红色或紫色的圆形斑点等症状[2]。安全有效的疫苗是预防猪圆环病毒感染最好的方法[3],现有的商业化疫苗主要分为3种,包括全病毒灭活苗、弱毒疫苗以及亚单位疫苗[4]。重组亚单位疫苗作为第二代新型疫苗,相对于常规灭活疫苗、弱毒疫苗,具有技术先进、安全性高、易于短时间大规模生产等优点[5];此外,亚单位疫苗不含病毒[6],能够起到净化清除病毒的作用,代表着动物疫苗未来的发展方向。
PCV2共有11个开放阅读框(open reading frames,ORFs),然而仅有三个开放阅读框被认为可以编码蛋白[7],目前功能已知的有Rep和Cap蛋白。Cap蛋白构成病毒的核衣壳,是PCV2唯一的结构蛋白[8],在体外可形成病毒样颗粒VLP结构,能诱导中和抗体的产生[9],因此被广泛用于猪圆环病毒亚单位疫苗的研究。
目前,国内外常用的Cap蛋白的表达体系主要包括真核表达体系和原核表达体系。真核表达主要包括杆状病毒、哺乳动物细胞以及毕赤酵母细胞[10]。杆状病毒蛋白表达体系能够进行蛋白转录后加工修饰[11],且已有相关的亚单位疫苗上市,但受到其表达产量的限制,生产成本方面要高于普通疫苗;Ding等[12]利用酵母表达Cap重组蛋白,通过对生产工艺的优化,最终产量达到198 mg·L-1,比传统培养提高了64%。酵母表达系统虽然成本低,却存在着菌体难以破碎、发酵周期长等问题。原核表达系统是一种发展成熟且已被普遍应用的蛋白表达体系,它操作简单,对设备和环境要求也相对较低,但是原核表达系统不能进行蛋白翻译后加工修饰,且易形成蛋白包涵体,不利于后期纯化[13]。因此,建立一种表达量高、蛋白纯度高、易于纯化、适于工业化生产且免疫原性好的PCV2-Cap蛋白新型表达系统至关重要。
中国仓鼠卵巢(CHO)细胞源于中国仓鼠卵巢的上皮细胞系[14],被认为是最具代表性的哺乳动物细胞表达系统。相对于其他的蛋白表达系统,CHO细胞系有以下优势:(1)CHO细胞可以在无血清的、化学成分清晰的培养基中贴壁或者悬浮生长[15];(2)具有翻译后修饰功能,表达的重组蛋白以天然形态存在[16];(3)细胞在生长过程中对外来致病菌有一定的抵抗力;(4)CHO细胞易于形成工程细胞系,稳定表达目的蛋白,并且产量和质量能够达到生产要求[17],有利于进行大规模生产。
本研究利用CHO-K1真核表达体系的优势,拟构建表达PCV2-Cap的CHO-K1悬浮稳转细胞系,并评估蛋白的免疫原性,为开发新型的猪圆环病毒亚单位疫苗奠定基础。
1 材料与方法 1.1 材料 1.1.1 细胞与载体CHO-K1细胞和pEE12.4载体经改造后由浙江海隆生物有限公司提供。
1.1.2 主要试剂Q5MixPCR酶、EcoRⅠ和HindⅢ限制性内切酶购自美国NEB公司;T4 DNA连接酶购自TaKaRa公司;胶回收试剂盒、质粒小提试剂盒、去内毒素质粒大提试剂盒购自上海生工;胎牛血清购自Hyclone公司;胰酶0.25% trypsin-EDTA,DMEM/F12,均购自Gibco公司;LipofectamineTM LTX购自美国Thermo Fisher公司;甲硫氨酸亚砜亚胺(L-methioninesulfoximine,MSX)购于Sigma公司;盐酸嘌呤霉素购自迈晨公司;ISA 201 VG购自法国赛比克公司;BCA蛋白质定量试剂盒购自美国Thermo Fisher公司;PCV2细胞毒由本实验室保存。
1.1.3 引物设计及合成通过对猪圆环病毒2型Cap蛋白核苷酸序列进行密码子优化,得到OPTI-Cap序列,送南京金斯瑞公司合成基因序列。
根据核苷酸序列,用SnapGen设计上、下游引物,序列如下:上游引物5′- CGGAAGCTTATG-GGCAAGAACGGCATCTTCAATAC-3′;下游引物5′-GGCGAATTCTCAATGGTGATGGTGATGGTGC-3′。
1.2 pEE12.4-PCV2-Cap重组质粒的构建 1.2.1 PCR产物及载体双酶切反应PCR扩增出Cap目的片段并做胶回收,将胶回收产物和载体分别做双酶切,酶切体系如下:目的片段和载体各2 μg,5 μL 10×cutsmart,2.5 μL HindⅢ-HF酶,2.5 μL EcoRⅠ-HF酶,ddH2O补足50 μL,37 ℃水浴2~3 h。酶切结束后,用琼脂糖凝胶检测并做胶回收,测回收的浓度。
1.2.2 连接反应用T4 DNA连接酶将目的片段和载体进行连接,连接体系如下:T4 DNA ligase 1 μL,10×T4连接buffer 1 μL,目的片段1 μL,载体4 μL,ddH2O 3 μL,同时设置对照组(不加入目的片段)。将加好的体系放入PCR仪,16 ℃反应2 h后,将连接产物做转化,涂布在氨苄抗性平板上,置于37 ℃恒温培养箱过夜,观察菌落生长情况。
1.2.3 质粒抽提与双酶切鉴定挑取上述平板上的单菌落接种至5 mL氨苄抗性LB液体培养基中,37 ℃ 220 r·min-1摇菌过夜,离心收集菌体,提取重组质粒。利用HindⅢ-HF和EcoRⅠ-HF对质粒进行酶切验证,酶切正确的质粒进一步测序验证。
1.3 无内毒素质粒提取和线性化处理 1.3.1 无内毒素质粒提取测序正确的克隆接种至100 mL含氨苄抗性的培养基中,于37 ℃摇菌过夜。离心收集菌体,无内毒素提取质粒,测量浓度并做电泳检测,-20 ℃保存。
1.3.2 质粒线性化处理取150 μg质粒做单酶切,250 μL反应体系如下:质粒pEE12.4-PCV2-Cap 150 μg,酶PvuⅠ 15 μL,10×cutsmart 25 μL,dd H2O补足250 μL。置于37 ℃酶切过夜。纯化线性化质粒,步骤如下:首先加入十分之一体积的3 mol·L-1醋酸钠缓冲液上下颠倒混匀,再加入2倍体积的预冷无水乙醇,颠倒混匀,冰浴30 min。4 ℃ 12 000 r·min-1离心15 min,弃掉上清。向管中加入预冷的75%乙醇500 μL,混匀漂洗,以除去残余的盐。4 ℃ 12 000 r·min-1,离心2 min,弃掉上清,并重复漂洗一次。室温放置10~15 min,挥发乙醇,用纯水将沉淀的核酸重新溶解,测浓度。
1.4 pEE12.4-PCV2-Cap重组质粒转染CHO-K1细胞与单克隆筛选 1.4.1 CHO-K1细胞转染转染之前要先将细胞培养基换为无抗无血清的DMEM/F12培养基。稀释质粒:125 μL OPTI-MEM中加入2.5 μg质粒,2.5 μL plus reagent,混匀,室温静置5 min。稀释Lipofectamine LTX:125 μL OPTI-MEM中加入9 μL Lipofectamine LTX,2.5 μL plus,轻轻混匀,室温静置5 min。将稀释好的质粒和Lipofectamine LTX混合物轻轻混匀。室温放置5 min,然后逐滴加入六孔板中,边滴加边轻轻晃动六孔板,使脂质体能够均匀分布。另外留出两个孔设置阴性对照和阳性对照,阳性对照:转染表达GFP蛋白的质粒,阴性对照:除不加质粒外,其他组分相同。将六孔板置于37 ℃,5% CO2细胞培养箱中培养4~6 h。换液:弃掉上清培养基,加入2 mL DMEM/F12(含10%血清、1%双抗)。转染96 h后,取上清做Werstern blot蛋白检测。一抗为猪圆环病毒2型Cap蛋白的单克隆抗体(1:1 000倍稀释),二抗为羊抗鼠的辣根过氧化物酶酶标抗体(1:2 000倍稀释),最后用ECL显色液避光显色2 min,并在凝胶成像仪上拍照。
1.4.2 加压筛选单克隆首先要确定嘌呤霉素的加压浓度:在铺好的细胞六孔板中,按照每孔2、3、4、5、6、7、8 μg·mL-1加入嘌呤霉素,并设置对照,观察细胞生长状态,5 d之内导致所有细胞死亡的最小浓度就是进行加压筛选的最佳浓度,最终确定嘌呤霉素的最适浓度为5 μg·mL-1。加压筛选:在转染48 h后开始加压,从37 ℃培养箱中取出六孔板细胞,弃去上清培养基,加入2 mL DMEM/F12(含10%血清、1%双抗+5 μg·mL-1 puromycin),加压7 d,期间观察细胞生长情况,若有漂起的死细胞时可更换培养基DMEM/F12(含10%血清、1%双抗+5 μg·mL-1 puromycin)。当加压至阴性对照细胞全部死亡时,弃去上清培养基,消化细胞后用DMEM/F12(含10%血清、1%双抗+5 μg·mL-1 puromycin+25 μmol·L-1 MSX)重新悬浮细胞,铺96孔板,计数,稀释细胞至1个·孔-1,每孔加入200 μL稀释后的细胞液。待96孔板中单个细胞的孔长满时,取上清,通过Western blot检测Cap蛋白表达情况,高表达的阳性克隆继续扩大培养。
1.5 细胞株悬浮培养驯化将细胞接种至30 mL培养基,终浓度为5×105个·mL-1。细胞培养瓶放置到37 ℃,5% CO2细胞培养箱中的轨道式振荡器上120 r·min-1培养过夜,每隔24 h用细胞计数仪检测细胞密度及活力。驯化期间,培养基中血清含量逐渐降低,在含有10%血清的培养基中培养的细胞称为第一代细胞;在含有5%血清的培养基中培养的细胞为第二代;依次倍减,直至第六代,培养基中不含血清。待第一代细胞存活率达到94%~97%时进行第二代培养,第二代培养得到的细胞存活率大于95%时进行第三代培养;第三至六代培养三次后得到的细胞存活率大于95%。7周后,细胞接种3 d后生长三代,密度达到1×106个·mL-1,同时细胞存活率达到95%,该细胞被认为已经适应悬浮培养。接种密度降低到3×105个·mL-1。
1.6 细胞摇瓶发酵从CO2恒温摇床取出细胞摇瓶,进行计数,稀释细胞至2.5×105~3.5×105个·mL-1接种于60 mL培养基中。细胞培养瓶放置到37 ℃,5% CO2恒温摇床中100 r·min-1培养过夜,每隔24 h计数细胞密度及活力,利用血糖仪检测糖浓度,当糖低于2.5 g·L-1的时候,添加葡萄糖到4 g·L-1;第4天补料:补充79.6 g·L-1 CD Efficient Feed CAGT,添加基础培养基的10%,第5天开始,将CO2培养箱温度调整至32 ℃,第9天,补充79.6 g·L-1 CD Efficient Feed CAGT,添加基础培养基的10%,第12天收获细胞上清,SDS PAGE检测蛋白的表达量。
1.7 蛋白纯化由于在目的基因上加入了His标签,可选用镍柱进行蛋白纯化,步骤如下,(1)平衡:取填料4 mL,用BufferA(20 mmol·L-1 NaH2PO4,500 mmol·L-1 NaCl,0.05% Tween 20,pH 7.4)平衡;(2)上样:收集细胞上清转移到空层析柱中,流穿细胞上清;(3)洗脱:用含250 mmol·L-1咪唑的BufferA洗脱,收集流出液;再用含500 mmol·L-1咪唑的BufferA二次洗脱,收集流出液。(4)透析换液:将含有目的蛋白的咪唑洗脱液倒入透析袋内,用1×PBS透析至少1 000倍,最后取80 μL,利用SDS-PAGE做检测。
1.8 疫苗制备与小鼠免疫将CHO-K1细胞表达的猪圆环病毒2型Cap蛋白加入到ISA 201 VG佐剂中,乳化。选4~6周龄SPF雌性BALB/c小鼠,分为2组,每组5只进行肌内注射,每只注射200 μL含50 μg目的蛋白的疫苗,同时设置对照组,注射PBS作为阴性对照,在第0、14、21天分别进行一次免疫、二次免疫和第三次免疫,并在每次免疫前取小鼠尾尖静脉血,-20 ℃保存,留作检测。
1.9 ELISA检测小鼠免疫后抗体效价包被:50 μL包被液中加入50 μL 104 TCID50·mL-1 PCV2细胞毒,包被酶标反应板,4 ℃过夜,第2天重复洗板3次,每次5 min;封闭:每孔加200 μL 5%脱脂奶粉-PBST,37 ℃封闭2 h后,重复洗板3次,每次4 min;加一抗:小鼠血清按1:100、1:200、1:400、1:800、1:1 600、1:3 200进行倍比稀释,100 μL·孔-1,同时做阴性血清对照,37 ℃封闭1 h后,洗板;加酶标二抗:用5%脱脂奶粉-PBST按照1:1 000倍稀释羊抗鼠IgG-HRP,100 μL·孔-1,37 ℃孵育1 h,洗板;显色:每孔加入100 μL TMB单组分显色液,37 ℃避光反应10 min。每孔加入100 μL终止液以终止显色反应,之后用酶标仪在450 nm波长下读取数值。
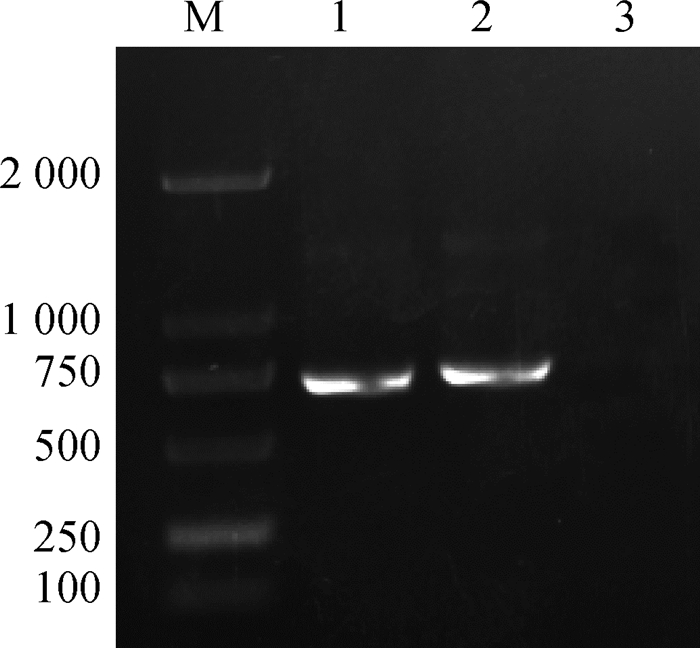
2 结果 2.1 目的片段克隆以合成的OPTI-Cap为模板,PCR扩增目的条带,用1%的琼脂糖凝胶检测,结果如图 1所示,条带大小为660 bp,与理论值相符。
|
M. DL2000 DNA相对分子质量标准;1~2. Cap目的片段;3.阴性对照 M. DL2000 DNA marker; 1-2. Production of Cap gene by PCR; 3. Negative control 图 1 Cap目的片段PCR扩增 Fig. 1 Amplification of Cap target fragment by PCR |
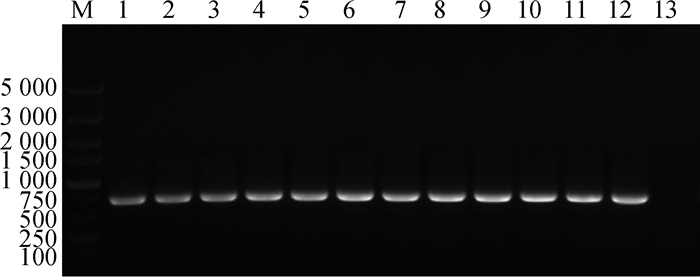
转化重组质粒,挑取12个单菌落做PCR鉴定,结果显示这12个单菌落均出现目的条带,为阳性克隆,如图 2所示。
|
M. DL5000 DNA相对分子质量标准;1~12.单菌落PCR结果;13.阴性对照 M. DL5000 DNA marker; 1-12. PCR results of the single colonies; 13. Negative control 图 2 重组质粒菌液PCR鉴定 Fig. 2 PCR identification of bacterial solution |
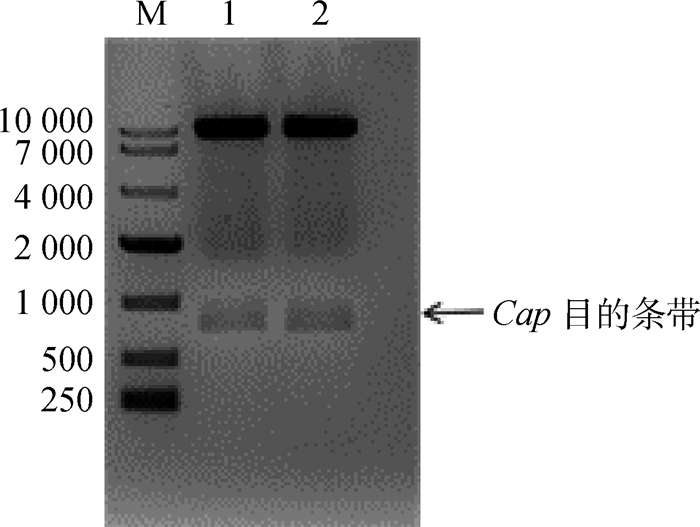
重组质粒经HindⅢ和EcoRⅠ双酶切后,电泳显示两条带,分别为pEE12.4载体(8 262 bp)和目的条带(660 bp),与预期大小一致,如图 3所示。测序结果显示Cap基因序列正确。
|
M. DL10000 DNA相对分子质量标准;1~2. HindⅢ和EcoRⅠ双酶切产物 M. DL10000 DNA marker; 1-2. Recombinant plasmid pEE12.4-PCV2-Cap digested with HindⅢ and EcoRⅠ 图 3 重组质粒pEE12.4-PCV2-Cap的双酶切鉴定 Fig. 3 Identification of recombinant plasmid by double enzyme digestion |
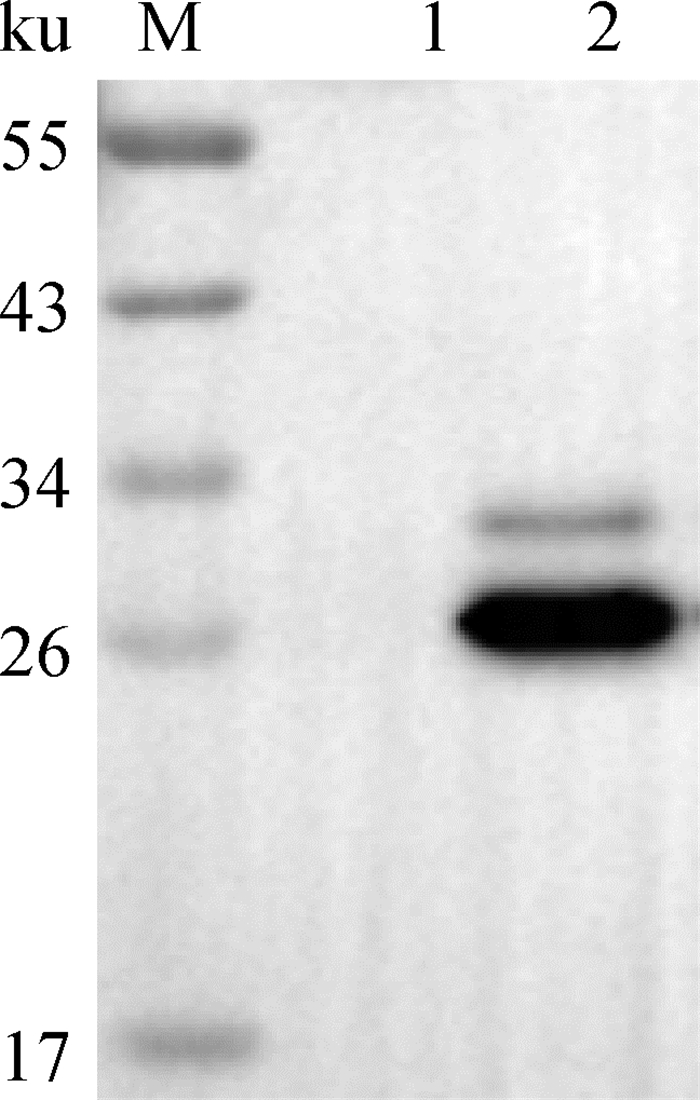
质粒转入CHO-K1细胞,通过Western blot检测96 h PCV2-Cap蛋白表达。结果如图 4所示,在细胞培养上清中,能够检测到Cap蛋白的表达,蛋白条带大小约为26和29 ku,与理论值一致(29 ku条带是由蛋白发生糖基化修饰导致)。
|
M.蛋白质相对分子质量标准;1.阴性对照;2.目的蛋白 M. Protein marker; 1. Negative control; 2. Cap protein 图 4 Cap蛋白表达检测 Fig. 4 Detection of Cap expression |
当96孔板孔内单克隆细胞间的汇合度达到60%时,取细胞培养上清,利用Western blot检测蛋白表达。图 5为代表性单克隆细胞株检测结果,1~7的单克隆细胞株均有Cap蛋白的表达,其中1B2株表达量最高。
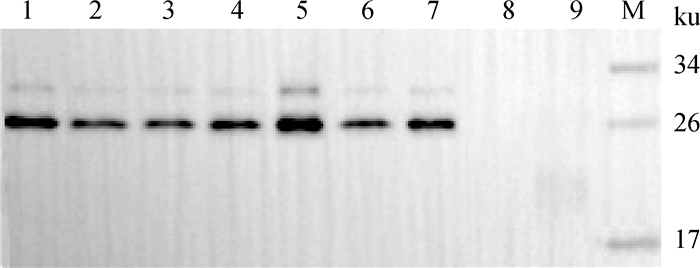
|
M.蛋白质相对分子质量标准;1. 6B4株;2. 6A2株;3. 5C7株;4. 4A3株;5. 1B2株;6. 2G7株;7. 2A6株;8. 2F4株;9.阴性对照 M. Protein marker; 1. 6B4 cell line; 2. 6A2 cell line; 3. 5C7 cell line; 4. 4A3 cell line; 5. 1B2 cell line; 6. 2G7 cell line; 7. 2A6 cell line; 8. 2F4 cell line; 9. Negative control 图 5 单克隆细胞株PCV2-Cap蛋白表达检测 Fig. 5 The expression of PCV2-Cap by monoclonal CHO-K1 cells in 96-hole plate by Western blot |
发酵1B2细胞株,每隔24 h检测细胞密度及活力,发酵周期为12 d。测得结果如图 6所示,证明此细胞株在发酵的过程中细胞活力和细胞密度都处于较高水平,活细胞密度不断增高,活细胞密度最高达到6×106个·mL-1,发酵结束时细胞活力保持在80%左右。
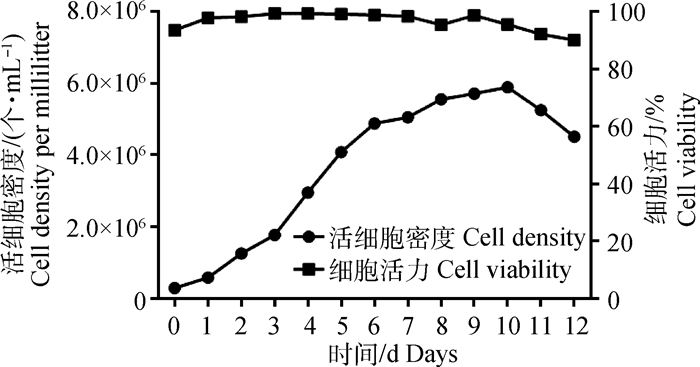
|
图 6 1B2细胞株的细胞活力与活细胞密度 Fig. 6 Cell viability and living cell density of 1B2 cell line |
取发酵过程中第7、9、11天的细胞上清,SDS PAGE检测Cap分泌表达水平,图 7中每孔上样量为10 μL,其中P代表Cap蛋白阳性对照(蛋白含量为3 μg)。

|
M.蛋白质相对分子质量标准;P. Cap蛋白阳性对照 M. Protein marker; P. Positive control 图 7 发酵上清中PCV2-Cap蛋白表达水平检测 Fig. 7 Detection of PCV2-Cap protein expression in fermentation supernatant |
收集细胞发酵液,利用镍柱进行蛋白纯化,纯化之后SDS-PAGE检测结果如图 8所示,采用BCA法测定蛋白浓度,蛋白得率约为370 mg·L-1;采用HPLC方法检测纯度,纯度可达到85%,说明纯化后的蛋白具有较高的纯度。
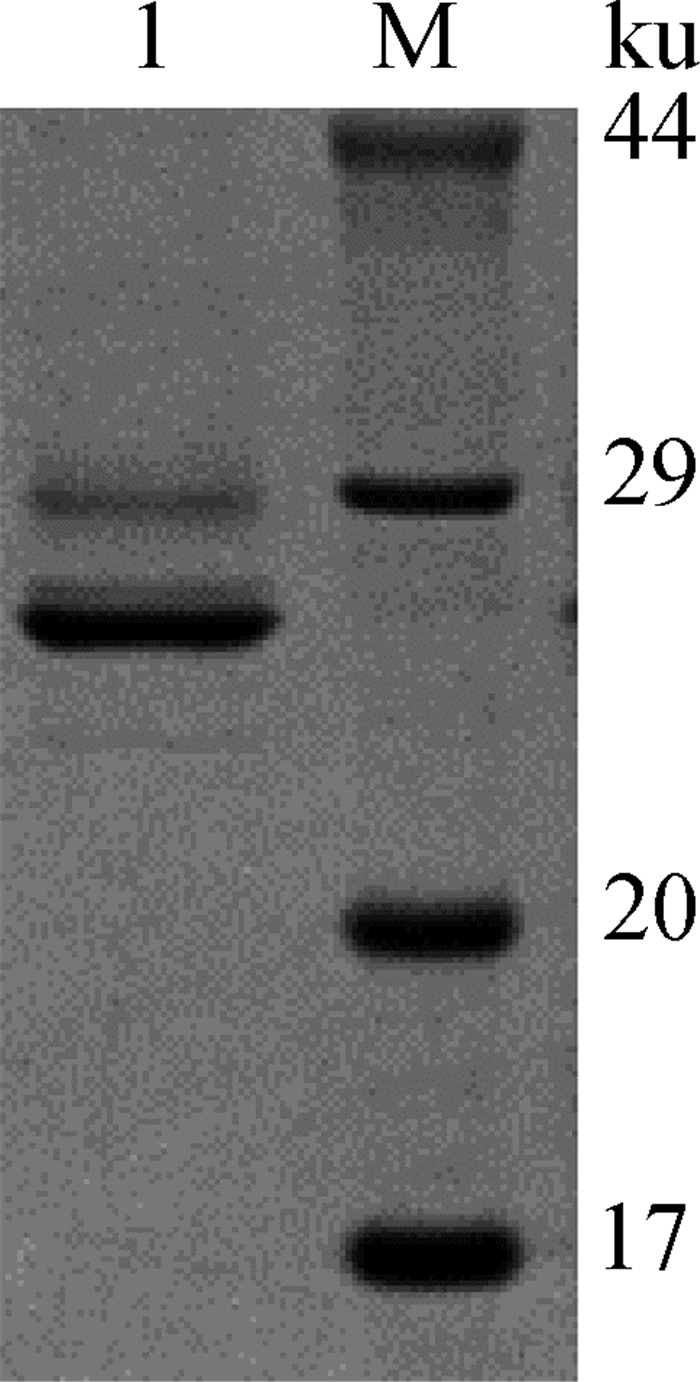
|
M.蛋白质相对分子质量标准;1.PCV2-Cap蛋白 M. Protein marker; 1. Cap protein 图 8 Cap蛋白纯化 Fig. 8 Cap protein purification |
表 1展示了小鼠血清在不同稀释倍数下的抗体效价水平,可以看出小鼠在28 d的时候能够达到1:1 600,抗体水平较高。
|
|
表 1 小鼠血清ELISA检测 Table 1 ELISA result of antiserum after immunization |
从图 9可以看出,免疫重组蛋白的小鼠在免疫后14 d检测到抗体,在28 d抗体水平达到峰值,且试验组与对照组的差异显著(P < 0.05),证明在CHO-K1细胞系上表达的Cap重组蛋白具备良好的免疫原性。
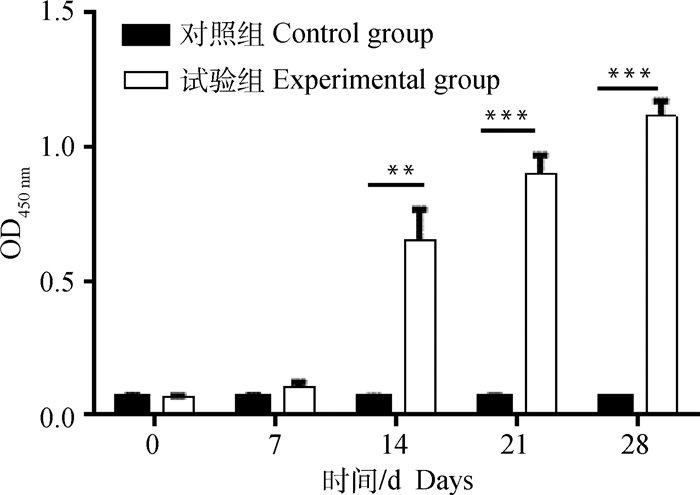
|
图 9 ELISA检测小鼠血清中抗体水平 Fig. 9 Antibody titer detection in mouse serum by ELISA |
猪圆环病毒存在于我国的大小猪场,且患病猪的死亡率可达10%左右,是阻碍我国养猪业发展的重要病原之一[18]。在研究人员的不懈努力下,我国PCV2疫苗整体呈现出良好的发展趋势,相继已有不同种类的疫苗上市,包括普莱柯生物工程有限公司生产的PCV2灭活疫苗“圆健”,青岛易邦生产的亚单位疫苗“易圆净”和武汉中博利用杆状病毒蛋白表达系统生产的基因工程疫苗等。诸多PCV2疫苗虽然能在一定程度上防控猪圆环病毒的传播,降低感染猪群的发病率,然而并不能完全阻断或者控制PCV2的感染[19],并且存在着疫苗的稳定性和安全性等问题,由此可见,猪圆环病毒疫苗市场充满着机遇和挑战。
经过几十年的发展,CHO细胞已经成为生物药物重要的表达和生产系统[20]。与其他的细胞系相比,CHO细胞系具有能够在无血清培养基中悬浮生长,抵抗大多数人类致病病毒的感染,生产的产品安全性高的优点,而且CHO属于哺乳动物细胞系,可以进行蛋白翻译后的加工修饰[21]。在本试验中,为了使Cap蛋白能够分泌到胞外,提高蛋白的表达水平,(1)根据CHO细胞的偏好性对PCV2-Cap的基因序列进行了优化;(2)在Cap蛋白的氨基端,含有41个氨基酸残基,被称为核定位序列(NLS)[22],与病毒的感染和复制密切相关,但NLS具有一个鲜明的特征就是富含精氨酸,带有正电荷,导致蛋白疏水性强,为了使目的蛋白分泌到胞外,截取了Cap蛋白的NLS核定位序列;(3)设计多个信号肽序列,构建质粒后同时做瞬转,检测携带不同信号肽的重组质粒转染CHO-K1细胞后PCV2-Cap蛋白的分泌情况,最终选取其中一条能够使目的蛋白高效分泌的信号肽。通过上述基因水平上的修饰,PCV2-Cap蛋白的表达量得到有效提高,而且蛋白分泌至细胞外,杂蛋白少,易于纯化,从而降低了成本。在后期的发酵过程中,笔者还优化了细胞生长所需的培养基,提高了细胞的密度、活力,进一步提高了蛋白的表达量。据了解,目前还没有利用CHO细胞蛋白表达体系来制备猪圆环亚单位疫苗的相关报道出现,本研究率先建立了表达PCV2-Cap蛋白的CHO-K1悬浮稳转细胞系,且蛋白具有良好的免疫原性,能分泌到胞外,易于纯化,适于工业化生产,为猪圆环病毒亚单位疫苗的制备提供了新思路,有利于推动猪圆环病毒亚单位疫苗的产业化发展。
4 结论通过构建真核表达质粒pEE12.4-PCV2-Cap,转染CHO-K1细胞,经加压筛选得到高表达的单克隆细胞株,并对这些细胞株进行一系列驯化以及发酵,纯化后的蛋白经过Western blot以及ELISA检测,证明此蛋白具有良好的免疫原性,成功建立表达PCV2-Cap蛋白的CHO悬浮稳转细胞系。
| [1] | OLVERA A, CORTEY M, SEGALÉS J. Molecular evolution of porcine circovirus type 2 genomes:phylogeny and clonality[J]. Virology, 2007, 357(2): 175–185. DOI: 10.1016/j.virol.2006.07.047 |
| [2] | ELLIS J. Porcine circovirus:a historical perspective[J]. Vet Pathol, 2014, 51(2): 315–327. DOI: 10.1177/0300985814521245 |
| [3] | SEO H W, HAN K, PARK C, et al. Clinical, virological, immunological and pathological evaluation of four porcine circovirus type 2 vaccines[J]. Vet J, 2014, 200(1): 65–70. DOI: 10.1016/j.tvjl.2014.02.002 |
| [4] | BEACH N M, MENG X J. Efficacy and future prospects of commercially available and experimental vaccines against porcine circovirus type 2(PCV2)[J]. Virus Res, 2012, 164(1-2): 33–42. DOI: 10.1016/j.virusres.2011.09.041 |
| [5] |
徐磊, 宁蓬勃, 郭抗抗, 等. 猪圆环病毒2型疫苗研究进展[J]. 动物医学进展, 2012, 33(10): 64–70.
XU L, NING P B, GUO K K, et al. Research progress on porcine circovirus type 2 vaccine[J]. Progress in Veterinary Medicine, 2012, 33(10): 64–70. DOI: 10.3969/j.issn.1007-5038.2012.10.017 (in Chinese) |
| [6] | GAVA D, SERRÃO V H B, FERNANDES L T, et al. Structure analysis of capsid protein of Porcine circovirus type 2 from pigs with systemic disease[J]. Braz J Microbiol, 2018, 49(2): 351–357. DOI: 10.1016/j.bjm.2017.08.007 |
| [7] | OPRIESSNIG T, GERBER P F, XIAO C T, et al. Commercial PCV2a-based vaccines are effective in protecting naturally PCV2b-infected finisher pigs against experimental challenge with a 2012 mutant PCV2[J]. Vaccine, 2014, 32(34): 4342–4348. DOI: 10.1016/j.vaccine.2014.06.004 |
| [8] | KEKARAINEN T, SEGALÉS J. Porcine circovirus 2 immunology and viral evolution[J]. Porcine Health Manag, 2015, 1(1): 17. DOI: 10.1186/s40813-015-0012-z |
| [9] | SCHILLER J T, LOWY D R. Raising expectations for subunit vaccine[J]. J Infect Dis, 2014, 211(9): 1373–1375. |
| [10] | LI W L, WANG X W, BAI J, et al. Construction and immunogenicity of recombinant porcine circovirus-like particles displaying somatostatin[J]. Vet Microbiol, 2013, 163(1-2): 23–32. DOI: 10.1016/j.vetmic.2012.11.045 |
| [11] |
付强, 程立坤, 董林, 等. 猪圆环病毒Cap蛋白亚单位疫苗研究进展[J]. 畜牧与兽医, 2015, 47(3): 117–120.
FU Q, CHENG L K, DONG L, et al. Advances in research on porcine circovirus Cap protein subunit vaccine[J]. Animal Husbandry & Veterinary Medicine, 2015, 47(3): 117–120. (in Chinese) |
| [12] | DING J, ZHANG C L, GAO M J, et al. Enhanced porcine circovirus Cap protein production by Pichia pastoris with a fuzzy logic DO control based methanol/sorbitol co-feeding induction strategy[J]. J Biotechnol, 2014, 177: 35–44. DOI: 10.1016/j.jbiotec.2014.02.018 |
| [13] | WELLS E, ROBINSON A S. Cellular engineering for therapeutic protein production:product quality, host modification, and process improvement[J]. Biotechnol J, 2017, 12(1): 1600105. DOI: 10.1002/biot.201600105 |
| [14] | WURM F M, HACKER D. First CHO genome[J]. Nat Biotechnol, 2011, 29(8): 718–720. DOI: 10.1038/nbt.1943 |
| [15] | LI F, VIJAYASANKARAN N, SHEN A Y, et al. Cell culture processes for monoclonal antibody production[J]. mAbs, 2010, 2(5): 466–479. DOI: 10.4161/mabs.2.5.12720 |
| [16] | RAJENDRA Y, HOUGLAND M D, ALAM R, et al. A high cell density transient transfection system for therapeutic protein expression based on a CHO GS-knockout cell line:process development and product quality assessment[J]. Biotechnol Bioeng, 2015, 112(5): 977–986. DOI: 10.1002/bit.v112.5 |
| [17] | BETTS Z, DICKSON A J. Improved CHO cell line stability and recombinant protein expression during long-term culture[M]//MELEADY P. Heterologous Protein Production in CHO Cells. New York, NY: Humana Press, 2017: 119-141. |
| [18] |
王一平, 郭龙军, 唐青海, 等. 猪圆环病毒2型疫苗的研究进展[J]. 畜牧兽医学报, 2012, 43(9): 1337–1345.
WANG Y P, GUO L J, TANG Q H, et al. Research progress on vaccine of porcine circovirus type 2[J]. Acta Veterinaria et Zootechnica Sinica, 2012, 43(9): 1337–1345. (in Chinese) |
| [19] |
杨利勇, 李春凤. 猪圆环病毒2型在我国的流行及疫苗研究现状[J]. 畜牧与兽医, 2015, 47(4): 132–134.
YANG L Y, LI C F. Current status of porcine circovirus type 2 in China and vaccine research[J]. Animal Husbandry & Veterinary Medicine, 2015, 47(4): 132–134. (in Chinese) |
| [20] | POPP O, MOSER S, ZIELONKA J, et al. Development of a pre-glycoengineered CHO-K1 host cell line for the expression of antibodies with enhanced Fc mediated effector function[J]. mAbs, 2018, 10(2): 290–303. DOI: 10.1080/19420862.2017.1405203 |
| [21] |
张薇, 闫琰, 白鲁根, 等. 稳定表达犬转铁蛋白受体CHO细胞系的建立和鉴定[J]. 四川大学学报:医学版, 2017, 48(1): 57–60, 80.
ZHANG W, YAN Y, BAI L G, et al. The establishment and identification of stable CHO cell line with canine transferrin receptor expression[J]. Journal of Sichuan University:Medical Science Edition, 2017, 48(1): 57–60, 80. (in Chinese) |
| [22] | YU W T, ZHAN Y, XUE B X, et al. Highly efficient cellular uptake of a cell-penetrating peptide (CPP) derived from the capsid protein of porcine circovirus type 2[J]. J Biol Chem, 2018, 293(39): 15221–15232. DOI: 10.1074/jbc.RA118.004823 |



