2. 青岛易邦生物工程有限公司, 青岛 266114
2. Qingdao Yebio Bioengineering Co., Qingdao, 266114
禽呼肠孤病毒(avian reovirus,ARV)属于呼肠孤病毒科、正呼肠孤病毒属,病毒粒子无囊膜,为20面体对称,基因组为线性双股RNA,分10个节段,极易发生基因重配与突变。该病毒宿主广泛,可感染多种禽类。鸡感染后主要表现病毒性关节炎、腱鞘炎、矮小综合征、吸收障碍综合征等,以病毒性关节炎和腱鞘炎为主[1-4]。近年来,我国鸡呼肠孤病毒不断发生变异,发病日益严重,导致该病的防制难度不断增大,给我国的养禽业带来了巨大的损失[5-7]。笔者从山东潍坊地区跗关节肿胀、出血的商品代肉鸡中分离到一株禽呼肠孤病毒,并通过全基因组测序、动物回归试验、血清交叉中和试验等对其进行了相关研究。
1 材料与方法 1.1 主要试剂与实验动物一步法RT-PCR试剂盒、感受态细胞DH5α购自北京康润诚业生物科技有限公司;M-MLV反转录酶、RNasin、dNTP、LA-Taq酶、SMARTer® RACE 5′/3′ Kit、pMD18-T载体试剂盒购自TaKaRa(大连)公司;RNA提取试剂盒、凝胶回收试剂盒、质粒小量抽提试剂盒购自AXYGEN公司;DMEM、犊牛血清购自GIBCO公司;谷胺酰胺购自Sigma公司;LMH细胞由扬州大学兽医学院惠赠;SPF鸡胚由山东昊泰实验动物繁育公司提供;罗斯308商品代雏鸡由泰安某种鸡场提供。
1.2 病毒分离鉴定 1.2.1 病料来源山东某养殖公司的多批商品代肉鸡陆续出现跗关节发炎、肿胀、出血等症状。部分病鸡跗关节外观呈灰青色斑块,剖检可见皮下出血;大部分病鸡外观无明显异常,但屠宰时跗关节可见明显炎性渗出。发病率波动较大,低的在5%以下,最高可达90%,一般在20%~50%。采集发病鸡跗关节积液用于病毒分离。
1.2.2 病原分离在发病鸡跗关节积液中加入5倍体积的无菌生理盐水,充分振荡,冻融3次,8 000 g离心30 min,取上清用0.22 μm滤器过滤除菌,通过卵黄囊接种于7日龄SPF鸡胚,每天观察两次,直至接种后第7天。观察死亡鸡胚的病变情况,并用其尿囊液继续盲传至第3代,标记为WF17。
1.2.3 病原鉴定 1.2.3.1PCR鉴定:按照常规方法提取WF17第3代尿囊液的DNA和RNA,利用PCR或RT-PCR方法进行禽呼肠孤病毒(ARV)、新城疫病毒(NDV)、禽流感病毒(AIV)、传染性支气管炎病毒(IBV)、传染性法氏囊炎病毒(IBDV)、传染性喉气管炎病毒(ILTV)、Ⅰ群禽腺病毒(FAdV)、禽白血病病毒(ALV)、马立克病毒(MDV)、传染性贫血病毒(CIAV)、网状内皮增殖症病毒(REV)、戊型肝炎病毒(HEV)、滑液囊支原体(MS)等13种常见鸡病病原的核酸检测。ARV的检测引物根据病毒的S4基因设计,大小为329 bp。
1.2.3.2电镜观察:将WF17第3代尿囊液毒接种LMH细胞进行传代,收集第5代细胞毒,10 000 g离心30 min,取上清用磷钨酸负染,置电镜下观察。
1.3 回归试验将WF17第3代尿囊液毒(毒价为105.83ELD50·0.1 mL-1)经颈部皮下接种2日龄罗斯308雏鸡,0.1 mL·只-1,共25只;同时用生理盐水接种25只相同雏鸡作为对照。每天观察试验鸡的症状,直至第21天。从两组试验鸡中随机各选择10只做好标记,分别于接种前和接种后第3、6、9、12、15、18、21天采集泄殖腔棉拭子,利用RT-PCR方法测定试验鸡排毒情况。用无菌棉签采集攻毒第17天发病试验鸡的跗关节积液,离心、过滤后,经卵黄囊接种7日龄SPF鸡胚,观察死亡鸡胚的病变情况,并收集死亡鸡胚的尿囊液,进行禽呼肠孤病毒核酸检测。攻毒后第21天,对两组试验鸡进行称重,计算每组的平均体重。
1.4 基因组测序参考GenBank登录的鸡呼肠孤病毒基因组序列,设计18对引物(表 1),对分离株(WF17)的10个基因片段进行扩增,每个片段的5′和3′末端利用SMARTer® RACE 5′/3′ Kit进行扩增,将获得的每一个扩增产物克隆到pMD18-T载体中,鉴定正确后送英潍捷基(上海)贸易有限公司进行测序。
|
|
表 1 基因组测序引物 Table 1 Primers for the genome sequencing |
利用MEGA软件,将WF17的10个基因片段所编码蛋白的核苷酸序列分别与GenBank登录的有代表性的鸡呼肠孤病毒基因序列进行比对分析,并绘制遗传进化树。
1.6 血清交叉中和试验参考文献[8](P328-330),按照固定病毒稀释血清方法,在LMH细胞上对WF17株和S1133株的阳性血清进行交叉中和效价测定。根据公式
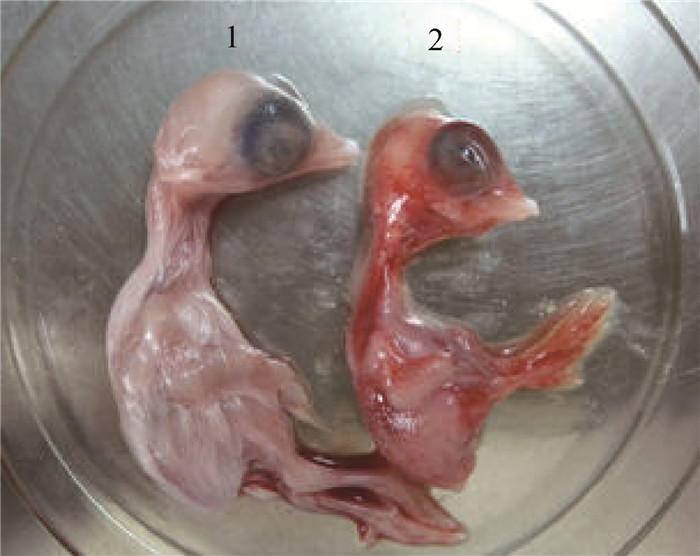
将关节积液处理后经卵黄囊接种7日龄SPF鸡胚,72 h后鸡胚开始出现死亡,死亡鸡胚发育不良,通体出血(图 1)。
|
1.正常鸡胚;2.病料接种鸡胚 1.Normal chicken embryo; 2.Chicken embryo after inoculation 图 1 病料接种后鸡胚病变情况 Fig. 1 Pathological changes of chicken embryo after inoculation |
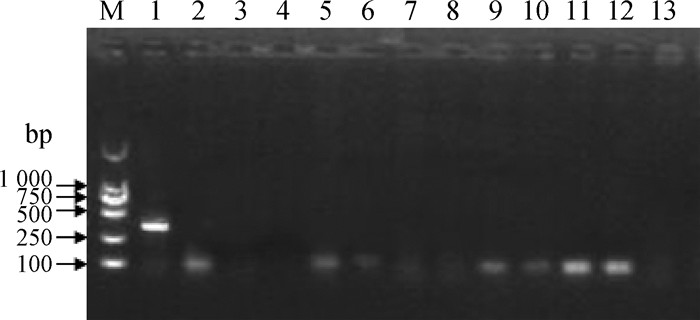
提取WF17的DNA和RNA,利用PCR或RT-PCR方法对13种常见鸡病病原的核酸检测,发现只有禽呼肠孤病毒为阳性,其他都为阴性(图 2)。
|
M. DL2000 DNA相对分子质量标准;1.禽呼肠孤病毒;2.新城疫病毒;3.禽流感病毒;4.传染性支气管炎病毒;5.传染性法氏囊炎病毒;6.传染性喉气管炎病毒;7.Ⅰ群禽腺病毒;8.禽白血病病毒;9.马立克病毒;10.传染性贫血病毒;11.网状内皮增殖症病毒;12.戊型肝炎病毒;13.滑液囊支原体 M. DL2000 DNA marker; 1.ARV; 2.NDV; 3.AIV; 4.IBV; 5.IBDV; 6.ILTV; 7.FAdV; 8.ALV; 9.MDV; 10.CIAV; 11.REV; 12.HEV; 13.MS 图 2 分离毒株WF17的核酸检测电泳图 Fig. 2 Electrophoretic result for nucleic acid detection of isolate WF17 |
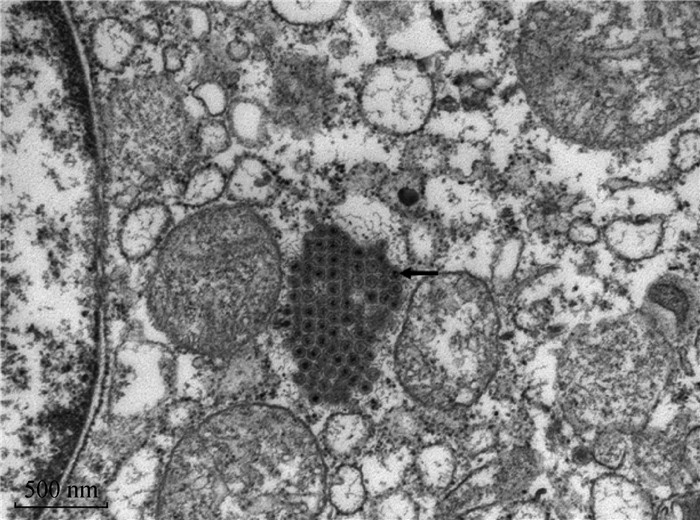
WF17细胞毒在透射电镜下观察,发现病毒呈球形、无囊膜、大小70 nm左右,符合禽呼肠孤病毒特征(图 3)。
|
图 3 分离毒株WF17的透射电镜图像 Fig. 3 Electron microscopic observation of isolated strain WF17 |
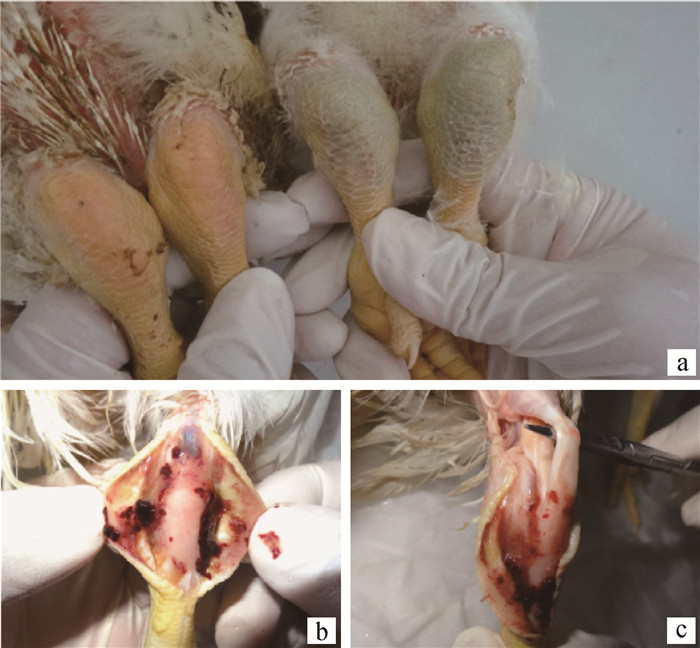
WF17经颈部皮下接种2日龄罗斯308雏鸡后,攻毒试验鸡第4天开始出现瘸腿,第5—7天出现瘸腿的数量最多,至攻毒后第21天,瘸腿率达到33.3%,瘸腿的试验鸡严重发育不良(图 4)。取瘸腿病鸡进行剖检,发现少部分肝有轻微坏死点,其他脏器无明显变化。跗关节外观呈青紫色,剖开发现出血严重,有大量的黏性渗出物,但肌腱无断裂(图 5)。采集发病试验鸡的跗关节积液,接种SPF鸡胚,结果能导致鸡胚死亡,禽呼肠孤病毒核酸检测为阳性。攻毒后定期采集试验鸡的泄殖腔棉拭子,利用RT-PCR方法进行检测,结果发现,攻毒后第3天有50%试验鸡出现排毒,持续到第12天(图 6),而同时采集的对照鸡泄殖腔棉拭子都是阴性。攻毒后第21天,对照组试验鸡的平均体重为1.12 kg·只-1,攻毒组试验鸡的平均体重只有0.88 kg·只-1,明显低于对照组。

|
a.攻毒组;b.对照组 a. Attacked group; b. Control group 图 4 攻毒后第10天试验鸡瘸腿情况 Fig. 4 Lame of experimental chickens at 10 days after challenge |
|
a.外观青紫色(左边为对照);b.皮下出血;c.肌腱不断裂 a. Green purple from appearance (left side as control group); b. Subcutaneous hemorrhage; c. Normal tendon 图 5 攻毒后第17天试验鸡跗关节病变 Fig. 5 Joint lesion of experimental chicken at 17 days after challenge |
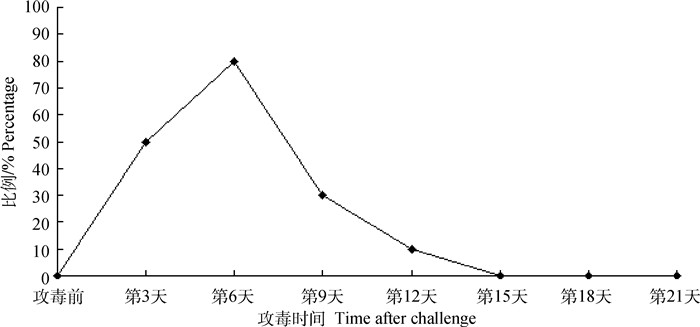
|
图 6 WF17攻毒后试验鸡泄殖腔排毒情况 Fig. 6 Viral shedding through cloaca in experimental chickens post challenge with WF17 strain |
利用本研究设计的引物,对病毒的10个基因片段进行扩增,每个片段的5′和3′末端利用SMARTer® RACE 5′/3′ Kit进行扩增,将测序得到的片段进行拼接,获得了病毒全基因组序列。结果显示,WF17完全符合禽呼肠孤病毒基因组结构特点,除了S1基因编码三个蛋白(p10、p17、σC)外,其余9个基因均编码一个大的蛋白。与经典毒株S1133相比,L1基因相似性最高,达到90.40%;S1基因相似性最低,为60.20%(表 2)。
|
|
表 2 WF17株基因组特征 Table 2 Genomic characteristics of WF17 strain |
将WF17基因组所编码蛋白的核苷酸序列与GenBank登录的有代表性的鸡呼肠孤病毒基因进行比对分析,并绘制遗传进化树(图 7),结果发现,WF17不同蛋白基因在进化树中位置有所不同,其中主要抗原σC蛋白基因与台湾918株最接近,相似性为92.7%,其余蛋白基因相似性在72.8%~92.2%;与经典毒株S1133的相似性只有55.9%,其余9个蛋白基因相似性在73.2%~90.4%。
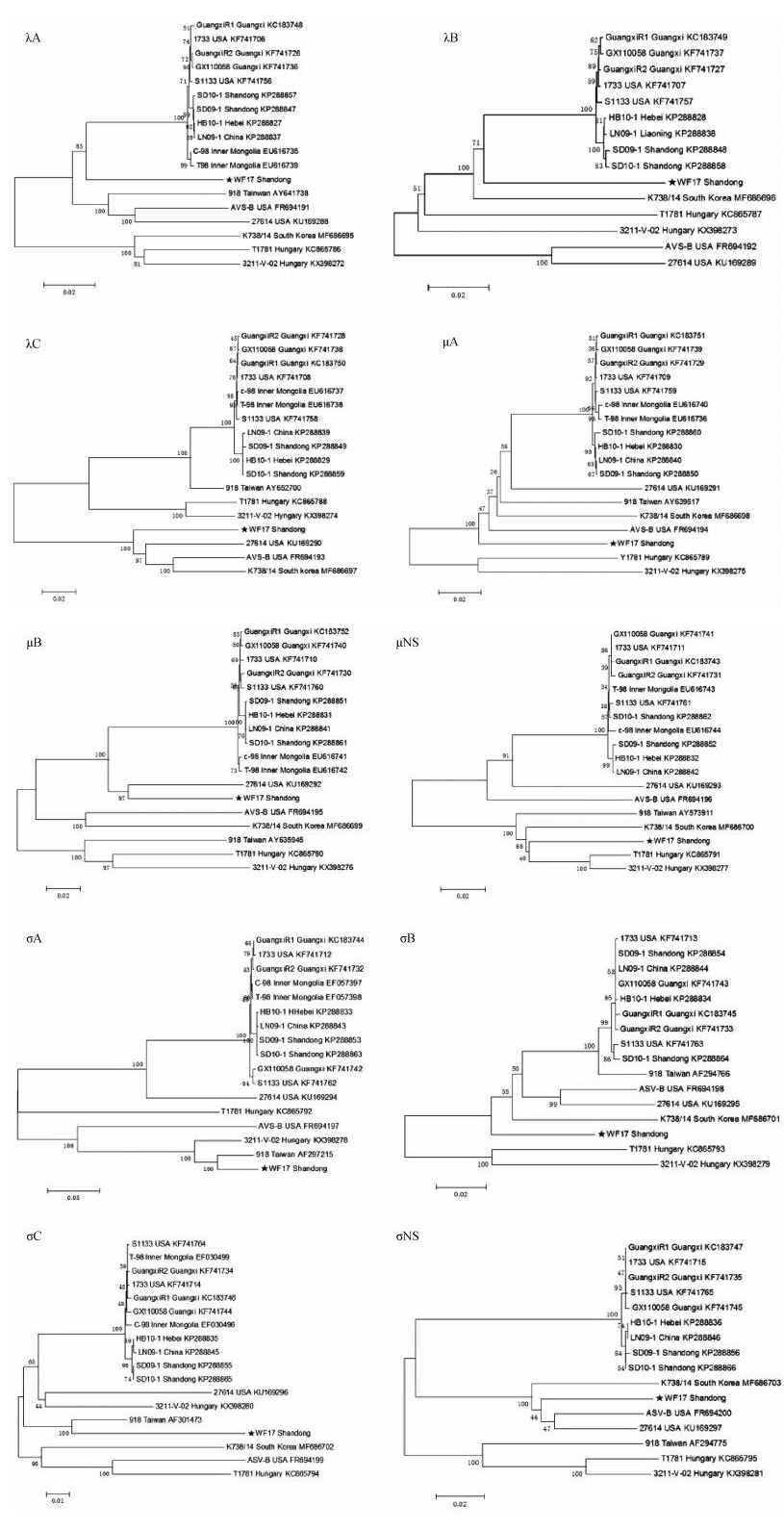
|
图 7 WF17株基因组遗传进化分析 Fig. 7 Genetic evolution analysis of strain WF17 genome |
采用固定血清稀释病毒法,将WF17株和S1133株的阳性血清进行交叉中和效价测定,从表 3可以看出,S1133株阳性血清对WF17株病毒仅能产生非常有限的中和作用,大约只有中和本病毒能力的1/11;而WF17株阳性血清能对S1133株病毒产生较好的中和作用。两者的抗原相关性R值只有0.19。
|
|
表 3 血清交叉中和试验结果 Table 3 Serum cross neutralization test between WF17 strain and S1133 strain |
禽呼肠孤病毒病自20世纪80年代在我国首次报道以来,一直呈现区域性发病的状态,但近几年,由于变异株的不断出现,该病的发病率和危害性更加严重[9-11]。该病虽然死亡率不高,但能严重影响肉鸡的生产性能和屠宰率,另外,由于该病有免疫抑制作用,因此容易发生继发感染,从而加重病情,这些都给家禽养殖业造成巨大的经济损失[12-14]。本次发病的商品肉鸡来源于当地某种鸡场,该种鸡场的多批商品代肉鸡陆续出现跗关节出血、肿胀,跛行,生长性能下降等。笔者从发病鸡的关节腔积液中分离到了病毒WF17,经基因测序和电镜观察,确定为禽呼肠孤病毒,将该病毒回归肉鸡能完全复制出临床症状,并从发病鸡中再次分离到病毒,说明该病例确实是由禽呼肠孤病毒引起。与传统毒株发病相比,本次病例出现了一些新的特点:发病率升高,有的可达90%以上;发病日龄提前,最早7日龄可出现瘸腿症状;跗关节皮下出血病例增多,但腓肠肌腱不断裂;种鸡禽呼肠孤病毒抗体滴度很高,但仍不能避免垂直传播,子代商品肉鸡发病率在5%~90%之间,难以消除。为了确定该分离株的变异情况,笔者进行了全基因组测序与分析,发现其主要抗原蛋白σC的核苷酸序列与经典毒株S1133的相似性只有55.9%,其余9个蛋白基因相似性在73.2%~90.4%之间;与GenBank中的918株最接近,相似性为92.7%,其余蛋白基因相似性在72.8%~92.2%之间。禽呼肠孤病毒918株是由Liu和Huang[15]在1992年从我国台湾地区分离到的,从主要抗原基因序列分析来看,WF17株与918株的抗原性最相关,但有的蛋白基因同源性并不高,其中λC蛋白基因相似性最低,只有72.8%,说明基因片段重配仍是禽呼肠孤病毒这种节段型基因组病毒发生变异的主要方式。禽呼肠孤病毒S1133株是1973年从美国分离到的[15],距今已有40多年,但目前仍然是商品化疫苗使用的主要毒株,WF17株与S1133株主要抗原基因的同源性非常低,S1133株免疫后很难对WF17株产生保护,而S1133株阳性血清对WF17株病毒仅产生非常有限的中和能力进一步证实了这一点。结合其他研究人员的报道[10-13, 15-19],目前我国鸡呼肠孤病毒病的危害日益严重、变异株不断出现,以S1133株为主的传统疫苗已经无法起到有效的保护,疫苗株的更新换代已迫在眉睫。
4 结论从山东潍坊地区跗关节肿胀、出血严重的商品肉鸡中分离到一株禽呼肠孤病毒WF17,其主要抗原σC蛋白基因与台湾918株最接近,相似性为92.7%,与经典毒株S1133的相似性只有55.9%,而WF17株与S1133株的抗原相关指数(R值)只有0.19。因此目前以S1133株为主的禽呼肠孤疫苗已无法对变异株产生有效的保护。
| [1] | NIBERT M L. Structure of mammalian orthoreovirus particles[J]. Curr Top Microbiol Immunol, 1998, 233(Pt 1): 1–30. |
| [2] |
SAIF Y M.禽病学[M].苏敬良, 高福, 索勋, 译. 12版.北京: 中国农业出版社, 2012: 355-365.
SAIF Y M. Diseases of poultry[M]. SU J L, GAO F, SUO X, trans. 12th ed. Beijing: China Agriculture Press, 2012: 355-365. (in Chinese) |
| [3] |
赵圆圆, 黄晓慧, 王蓓, 等. 安徽省禽呼肠孤病毒感染的血清学调查[J]. 中国微生态学杂志, 2011, 23(9): 813–815.
ZHAO Y Y, HUANG X H, WANG B, et al. Serological investigation of Avian reovirus infection in Anhui province[J]. Chinese Journal of Microecology, 2011, 23(9): 813–815. (in Chinese) |
| [4] |
黄莉, 谢芝勋, 谢丽基, 等. 禽呼肠孤病毒强毒株和弱毒疫苗株感染Vero细胞的蛋白质组学研究[J]. 畜牧兽医学报, 2016, 47(2): 331–339.
HUANG L, XIE Z X, XIE L J, et al. Proteomic analysis of Vero cells infected by avian reovirus virulent strain and attenuated vaccine strain[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(2): 331–339. (in Chinese) |
| [5] |
王兴和. 鸡病毒性关节炎的研究进展[J]. 中国动物保健, 2016, 18(11): 81–84.
WANG X H. Research progress of avian viral arthritis in chicken[J]. China Animal Health, 2016, 18(11): 81–84. DOI: 10.3969/j.issn.1008-4754.2016.11.048 (in Chinese) |
| [6] |
张志强.禽呼肠孤病毒Sigma-C蛋白引起宿主细胞凋亡的分子机理研究[D].北京: 中国农业大学, 2015.
ZHANG Z Q. The molecular mechanism underlying ARV Sigma-C-induced apoptosis in host cells[D]. Beijing: China Agricultural University, 2015. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10019-1015583076.htm |
| [7] | TANG Y, LU H G. Genomic characterization of a broiler reovirus field strain detected in Pennsylvania[J]. Infect Genet Evol, 2015, 31: 177–182. DOI: 10.1016/j.meegid.2015.01.029 |
| [8] |
殷震, 刘景华.
动物病毒学[M]. 2版. 北京: 科学出版社, 1997.
YIN Z, LIU J H. Animal virology[M]. 2nd ed. Beijing: Science Press, 1997. (in Chinese) |
| [9] |
孙美玉.禽呼肠孤病毒检测方法的建立及病毒分离鉴定[D].北京: 中国农业科学院, 2012.
SUN M Y. Establishment of detection methods and isolation and identification of avian reovirus[D]. Beijing: Chinese Academy of Agricultural Sciences, 2012. (in Chinese) http://cdmd.cnki.com.cn/article/cdmd-82101-1012414039.htm |
| [10] | LUBLIN A, GOLDENBERG D, ROSENBLUTH E, et al. Wide-range protection against avianreovirus conferred by vaccination with representatives of four defined genotypes[J]. Vaccine, 2011, 29(47): 8683–8688. DOI: 10.1016/j.vaccine.2011.08.114 |
| [11] | TROXLER S, RIGOMIER P, BILIC I, et al. Identification of a newreovirus causing substantial losses in broiler production in France, despite routine vaccination of breeders[J]. Vet Rec, 2013, 172(21): 556. DOI: 10.1136/vr.101262 |
| [12] |
姜晓宁.鸡源呼肠孤病毒的分离鉴定及对肉鸡的致病性研究[D].泰安: 山东农业大学, 2018.
JIANG X N. Isolation and identification of chicken-derived avian reovirus and its pathogenicity to broilers[D]. Tai'an: Shandong Agricultural University, 2018. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10434-1018185540.htm |
| [13] |
钟丽.禽呼肠孤病毒流行株的进化及致病性研究[D].北京: 中国农业科学院, 2017.
ZHONG L. Evolution and pathogenicity of avian reovirus isolates[D]. Beijing: Chinese Academy of Agricultural Sciences, 2017. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-82101-1017255281.htm |
| [14] |
池晓娟, 邵文涵, 陈吉龙, 等. 禽源呼肠孤病毒诱导宿主免疫应答研究进展[J]. 畜牧兽医学报, 2017, 48(12): 2249–2257.
CHI X J, SHAO W H, CHEN J L, et al. The research advance of host immune response induced by avian-origin reovirus[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(12): 2249–2257. (in Chinese) |
| [15] | LIU H J, HUANG P H. Sequence and phylogenetic analysis of the σA-encoding gene of avian reovirus[J]. J Virol Mehtods, 2001, 98(2): 99–107. DOI: 10.1016/S0166-0934(01)00328-7 |
| [16] |
康亚男, 毛雅元, 王寿山, 等. 鸡病毒性关节炎灭活疫苗与同类产品比较研究[J]. 黑龙江畜牧兽医, 2014(4): 97–98.
KANG Y N, MAO Y Y, WANG S S, et al. Comparative study on inactivated vaccine against chicken viral arthritis and similar products[J]. Heilongjiang Animal Science and Veterinary Medicine, 2014(4): 97–98. (in Chinese) |
| [17] | PALOMINO-TAPIA V, MITEVSKI D, INGLIS T, et al. Molecular characterization of emerging avian reovirus variants isolated from viral arthritis cases in Western Canada 2012-2017 based on partial sigma (σ)C gene[J]. Virology, 2018, 522: 138–146. DOI: 10.1016/j.virol.2018.06.006 |
| [18] |
黄莉, 谢芝勋, 蓝元喜, 等. 禽呼肠孤病毒感染对SPF鸡外周血淋巴细胞中天然免疫相关基因转录的影响[J]. 畜牧兽医学报, 2017, 48(1): 116–123.
HUANG L, XIE Z X, LAN Y X, et al. Effects of avian reovirus infection on transcription of innate immune genes in peripheral blood lymphocytes of SPF chickens[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(1): 116–123. (in Chinese) |
| [19] |
吴海洋.禽呼肠孤病毒p10蛋白诱导宿主细胞凋亡及自身降解的分子机理[D].北京: 中国农业大学, 2016.
WU H Y. The molecular mechanism underlying ARV p10-induced apoptosis and its degradation in host cells[D]. Beijing: China Agricultural University, 2016. (in Chinese) |



