2. 淄博市畜牧渔业服务中心, 淄博 255000
2. Zibo Service Center for Animal Husbandry and Fishery, Zibo 255000, China
骨骼肌的正常发育与成肌细胞的增殖分化密不可分,研究指出,诱导骨骼肌成肌细胞的增殖与分化并抑制细胞的凋亡是骨骼肌再生的重要途径[1]。前人普遍认为,自由基是细胞生长和发育过程中的有害因子[2]。经研究发现,较低浓度的过氧化氢(H2O2)等活性氧(ROS)能够作为细胞内的信号分子启动基因程序以诱导细胞增殖,但H2O2的浓度积累达到一定程度后又会对细胞产生损伤作用[3]。因此,ROS水平的变化与细胞的增殖分化和氧化损伤均有着密切的关系。
研究表明,ROS可作为信号分子通过细胞凋亡调控细胞的数量,而自噬能够分解代谢细胞内的受损蛋白质和细胞器,并且受到ROS的氧化调控[4-6]。体外研究指出,氧化应激能够诱导小鼠成肌细胞(C2C12)发生凋亡和自噬[7]。此外,在众多生理条件下,核因子kappa B(NF-κB)信号通路是调控骨骼肌质量最重要的信号通路之一[8]。然而,氧化应激条件下NF-κB信号通路对C2C12细胞凋亡和自噬的调控作用还未见报道。因此,本研究选用C2C12细胞,探讨氧化应激条件下NF-κB信号通路调控细胞凋亡和自噬的过程,以期为阐明高浓度ROS引起的氧化损伤机理提供一定的理论依据。
1 材料与方法 1.1 细胞系和主要试剂小鼠成肌细胞系(C2C12)(MMCL-001)购自赛百慷(上海)生物技术股份有限公司。
3%的H2O2溶液(323381)购自西格玛奥德里奇(上海)贸易有限公司;吡咯烷二硫代氨基甲酸盐(PDTC,纯度>99%)(S1809)购自南通碧云天生物技术研究所;噻唑蓝(MTT)细胞增殖及细胞毒性检测试剂盒(KGA311)和Annexin V-APC/PI细胞凋亡检测试剂盒(KGA1030)购自江苏凯基生物技术股份有限公司;ROS检测试剂盒(E004)购自南京建成生物工程研究所;mRNA反转录试剂盒及荧光定量PCR试剂盒等购自大连宝生物工程有限公司;半胱天冬蛋白酶(caspase)-3(9665S)、微管相关蛋白1轻链(LC)3-II(12741S)、核因子kappa B(NF-κB,8242S)和β-actin(3700S)蛋白一抗均购自CST公司;羊抗兔荧光标记二抗(31210)购自于美国Thermo Pierce公司。
1.2 试剂配制DMEM完全培养基:含10%胎牛血清和1%非必需氨基酸的DMEM培养基。
PBS溶液:含有137 mmol·L-1 NaCl,2.68 mmol·L-1 KCl,10 mmol·L-1 Na2HPO4,1.76 mmol·L-1 KH2PO4,溶液pH为7.4。
1.3 试验设计及方法 1.3.1 C2C12细胞培养将C2C12细胞加入DMEM完全培养基并接种培养瓶,置于培养箱中培养,培养条件:气相条件为95%的空气和5%的二氧化碳,温度为37℃,湿度为70%~80%。次日更换培养基。待培养瓶内的细胞密度达80%以上,用0.25%的胰酶消化传代,传代5次后的细胞用于试验。
1.3.2 C2C12细胞传代传代培养前需确定培养瓶中的细胞密度达到80%~90%时方可进行。步骤:弃去培养瓶中的上清液,然后用PBS洗涤细胞2次。接着向培养瓶中加入2 mL的胰酶消化液,并放置在37 ℃培养箱中消化1 min。显微镜下观察到细胞大部分变圆并脱落后加少量培养基终止消化。按照每瓶8 mL补加培养基并打匀吸出到离心管中,以1 000×g离心4 min,弃去离心管上清液并补加2 mL培养基吹匀。最终将细胞悬液按1:3的比例分配到新的培养瓶中,每瓶补加8 mL的培养基。
1.3.3 C2C12细胞处理和分组将细胞以大约2.5×105·mL-1的密度接种于6孔板上,待细胞融合后开始试验。将PDTC和H2O2添加到培养基中,每个处理6个重复,分组如下:1)对照组(Control),以DMEM培养基培养的细胞作为空白对照,培养24 h;2)PDTC组(PDTC),以每孔1 mL的PDTC(20 μmol·L-1)孵育24 h;3)H2O2组(H2O2),加入MTT法筛选出的安全浓度(0.50 mmol·L-1)的H2O2处理24 h。
1.3.4 MTT法鉴定C2C12细胞活性将C2C12细胞以1×104·mL-1的密度接种于96孔板上,培养24 h后添加不同浓度的(0、0.05、0.10、0.25、0.50、1.00和2.00 mmol·L-1)H2O2处理24 h以制备损伤模型,之后加入20 μL 5 g·L-1的MTT放置到培养箱中孵育4 h。吸出上清后每孔加入150 μL的DMSO作用15 min,震荡5 min后用酶标仪测定570 nm处的吸光度值(OD值),细胞存活率(%)=(试验组细胞OD值/对照组细胞OD值)×100。
1.3.5 化学荧光法测定C2C12细胞内ROS水平采用酶消化法制备C2C12细胞悬液,离心收集细胞沉淀用于荧光检测。利用敏感荧光(二氯荧光素)探针检测单细胞悬液中细胞内的ROS水平,测定过程按照试剂盒说明书操作。采用流式细胞仪测定荧光素氧化后的衍生物,激发波长为488 nm,发射波长为525 nm,细胞荧光信号强度与细胞内的ROS水平成正比。计算各试验组与对照组平均荧光度值的百分比作为测定ROS水平的结果。
1.3.6 Annexin V-APC/PI流式细胞分析法检测C2C12细胞凋亡加入1 mL不含EDTA的胰酶于6孔板中消化1 min,用培养基终止消化制备细胞悬液,1 000 × g离心10 min收集细胞,用PBS洗涤并离心,重复2次后收集细胞。然后加入500 μL的Binding Buffer悬浮细胞,再加入5 μL Annexin V-APC/PI和5 μL PI染液混匀,室温下避光反应10 min,采用流式细胞仪进行检测,激发波长为633 nm,最大发射波长为660 nm。流式细胞分析图左下区显示的是正常活细胞的数量,右下区显示早期凋亡细胞的数量,右上区显示晚期凋亡或死亡细胞的数量。计算凋亡率作为结果。
1.3.7 实时荧光定量方法检测C2C12细胞中相关因子的mRNA表达采用Trizol试剂提取细胞中总RNA[9]。用核酸蛋白分析仪检测RNA的纯度和浓度。其中,RNA纯度采用A260 nm/A280 nm的比值来衡量,比值需在1.8~2.0之间。
采用反转录试剂盒将RNA反转录为cDNA,步骤按照说明书进行。试验仪器为热循环仪,反应体系为60 μL:12 μL的PrimeScript® RT Master Mix,6 μL的总RNA,用Rnase Free dH2O加至60 μL。反转录条件:37 ℃孵育15 min,然后85 ℃变性5 s,最后4 ℃冷却。
所有基因序列均从GenBank中获取,并以此为模板设计引物,小鼠GAPDH内参引物(B661304)购自上海生工生物工程股份有限公司。目的基因引物设计见表 1。
|
|
表 1 目的基因引物 Table 1 Primer sequence for amplifying target genes |
本试验使用PCR试剂盒配制反应体系为20 μL:10 μL SYBR Primerx Ex Taq(2 ×),0.4 μL上游引物(10 μmol·L-1),0.4 μL下游引物(10 μmol·L-1),0.4 μL ROX Reference Dye I(50 ×),1 μL cDNA(0.5 μg·μL-1)以及7.8 μL的dH2O。反应条件:95 ℃ 30 s;95 ℃ 5 s,40个循环,60 ℃ 30 s;然后95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。每个样品测定3个平行的平均值为样品的Ct值。每个样品靶基因的相对mRNA表达水平用2-ΔΔCt法表示[10]。
1.3.8 Western blot检测C2C12细胞中相关因子的蛋白表达细胞样品总蛋白的提取采用总蛋白提取试剂盒,采用BCA定量试剂盒对总蛋白进行定量。以40 μg总蛋白上样后进行SDS-PAGE电泳,湿法转膜转印蛋白至PVDF膜,5%脱脂牛奶室温封闭1 h,一抗4℃孵育过夜(caspase-3一抗稀释比例为1:500,LC3-Ⅱ一抗稀释比例为1:1 000,NF-κB一抗稀释比例为1:1 000,β-actin抗体稀释比例为1:500),洗膜,二抗室温孵育2 h,洗膜,ECL发光,显影。采用BandScan 5.0软件分析条带的光密度值,目的蛋白光密度值与内参光密度值的比值作为目的蛋白相对表达量。
1.4 数据统计与分析数据的统计学处理应用SAS V9.2统计软件,采用One-way ANOVA程序进行单因素方差分析,多重比较采用Tukey法。P < 0.05表示差异显著。
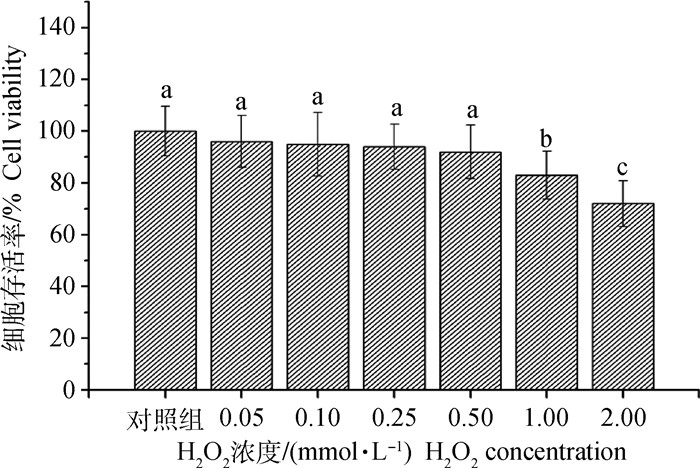
2 结果 2.1 不同浓度H2O2对C2C12细胞存活率的影响如图 1所示,对照组及不同浓度H2O2组的细胞存活率(%)数值如下:对照组为(100±9.61)%,0.05 mmol·L-1组为(96±10.00)%,0.10 mmol·L-1组为(95±12.26)%,0.25 mmol·L-1组为(94±8.75)%,0.50 mmol·L-1组为(92±10.30)%,1.00 mmol·L-1组为(83±9.20)%,2.00 mmol·L-1组为(72±8.80)%;H2O2浓度为1.00 mmol·L-1时,细胞存活率显著低于前5组(P < 0.05),因此本研究选择0.50 mmol·L-1的H2O2进行后续试验。
|
对照组为常规培养基培养24 h;0.05、0.10、0.25、0.50、1.00、2.00 mmol·L-1组为不同浓度H2O2与常规培养基共培养24 h。数据为“mean± SE” (n=6);不同字母表示差异显著(P < 0.05),下图同 Control treatment is cultured in DMEM for 24 h; 0.05, 0.10, 0.25, 0.50, 1.00, 2.00 mmol·L-1 H2O2 treatments are cultured in DMEM with different concentrations of H2O2 for 24 h. All data are represented as "mean±SE" (n=6); The different letters indicate significant difference (P < 0.05), the same as the following figures 图 1 H2O2对C2C12细胞存活率的影响 Fig. 1 Effects of H2O2 on cell viability of C2C12 myoblasts |
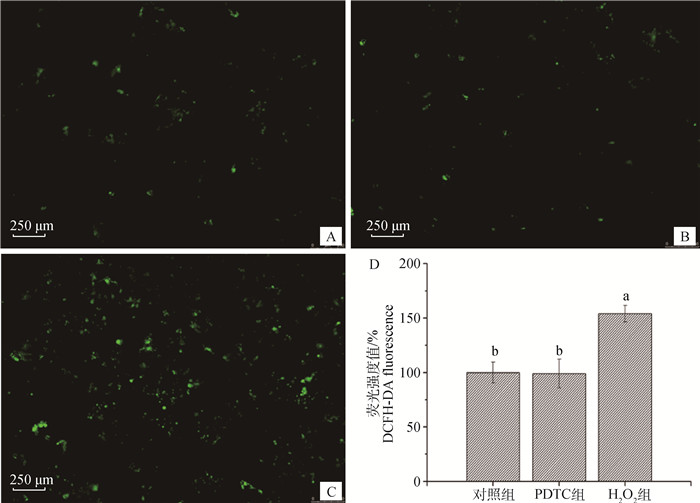
采用化学荧光法测定C2C12细胞内ROS水平,荧光显微镜进行荧光拍照,并通过流式细胞仪检测各组细胞的荧光强度,各试验组与对照组平均荧光度值的百分比作为ROS水平的结果。如图 2(A、B、C)所示,H2O2组的荧光强度明显高于对照组和PDTC组;图 2D的荧光强度值结果为:对照组为(100±9.47)%,PDTC组为(99±13.22)%,H2O2组为(154±7.55)%,H2O2组的细胞ROS水平显著高于对照组和PDTC组(P < 0.05)。
|
A. Control组;B. PDTC组;C. H2O2组;D.各组的荧光强度值 A. Control treatment; B. PDTC treatment; C. H2O2 treatment; D. DCFH-DA fluorescence 图 2 H2O2对C2C12细胞ROS水平的影响 Fig. 2 Effects of H2O2 on the ROS level in C2C12 myoblasts |
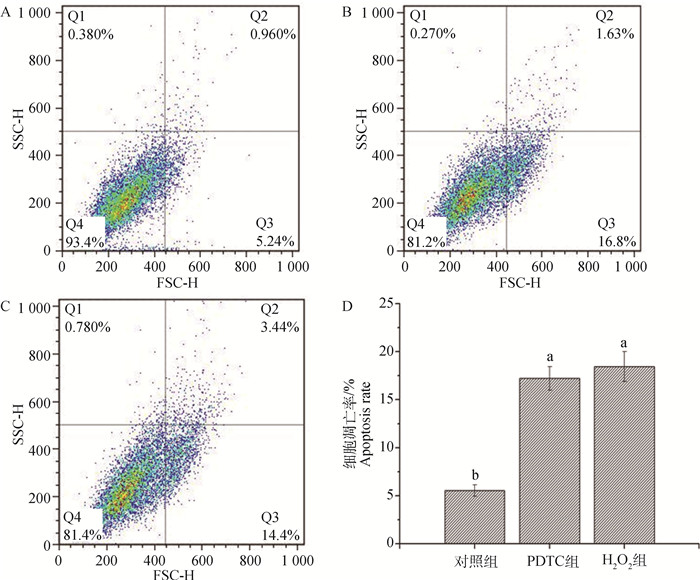
如图 3(A、B、C)所示,PDTC组和H2O2组的凋亡细胞数量均明显多于对照组;图 3D中各组细胞凋亡率的数值如下:对照组为(5.54±0.61)%,PDTC组为(17.22±1.22)%,H2O2组为(18.45±1.55)%;与对照组相比,PDTC组和H2O2组细胞的总凋亡率均显著增加(P < 0.05)。
|
A. Control组;B. PDTC组;C. H2O2组;D.各组的细胞凋亡率 A. Control treatment; B. PDTC treatment; C. H2O2 treatment; D. Apoptosis rate of different treatments 图 3 H2O2对C2C12细胞凋亡率的影响 Fig. 3 Effects of H2O2 on apoptosis rate of C2C12 myoblasts |
表 2以及图 4结果表明,与对照组组相比,PDTC组细胞的caspase-3、caspase-6、caspase-9的mRNA表达量显著升高(P < 0.05);H2O2组细胞的caspase-3、caspase-6、caspase-8、caspase-9的mRNA表达量显著升高(P < 0.05);PDTC组和H2O2组细胞caspase-3的蛋白表达水平均显著升高(P < 0.05)。
|
|
表 2 H2O2对C2C12细胞caspase家族基因和蛋白表达的影响 Table 2 Effects of H2O2 on the mRNA and protein levels of the caspases in C2C12 myoblasts |

|
图 4 H2O2对C2C12细胞Caspase-3蛋白表达的影响 Fig. 4 Effects of H2O2 on the expression of Caspase-3 protein in C2C12 myoblasts |
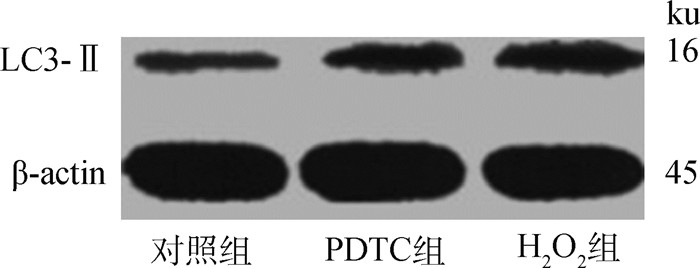
表 3和图 5结果显示,PDTC组和H2O2组细胞的Beclin 1 mRNA表达量和LC3-Ⅱ/Ⅰ的值均显著高于对照组(P < 0.05);PDTC和H2O2组细胞LC3-Ⅱ的蛋白表达水平均显著高于对照组(P < 0.05)。
|
|
表 3 H2O2对C2C12细胞自噬相关基因和蛋白表达的影响 Table 3 Effects of H2O2 on the mRNA and protein levels of genes related to autophagy of C2C12 myoblasts |
|
LC3.微管相关蛋白1轻链3 LC3. Microtubule-associated protein 1 light chain 3 图 5 H2O2对C2C12细胞LC3-Ⅱ蛋白表达的影响 Fig. 5 Effects of H2O2 on the expression of LC3-Ⅱ protein in C2C12 myoblasts |
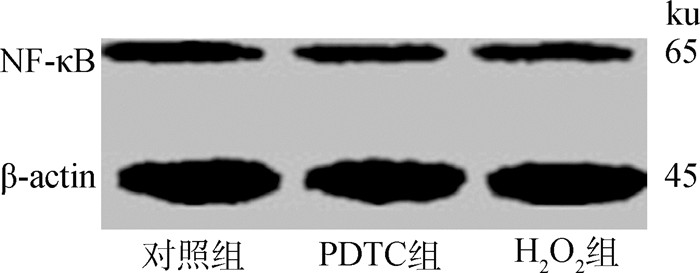
如表 4及图 6所示,与对照组相比,PDTC组细胞的核因子kappa B副族1(p50)、B型白细胞/2型淋巴细胞样蛋白(Bcl-2)、v-rel禽网状内皮增生病病毒癌基因同源物A(RelA)以及环氧合酶(Cox)-2的mRNA表达量显著降低(P < 0.05);H2O2组细胞的p50、Bcl-2、RelA以及Cox-1和Cox-2的mRNA表达量也显著降低(P < 0.05),Bcl-2相关X蛋白(Bax)的mRNA表达量则显著升高(P < 0.05);此外,PDTC组和H2O2组细胞NF-κB的蛋白表达水平显著低于对照组(P < 0.05)。
|
|
表 4 H2O2对C2C12细胞NF-κB信号通路相关基因和蛋白表达的影响 Table 4 Effects of H2O2 on the mRNA and protein levels in NF-κB signal pathway in C2C12 myoblasts |
|
图 6 H2O2对C2C12细胞NF-κB蛋白表达的影响 Fig. 6 Effects of H2O2 on the expression of NF-κB protein in C2C12 myoblasts |
氧化应激一旦发生,会使细胞的ROS含量升高,过多的ROS就会攻击细胞内的大分子,最终造成氧化损伤[11-12]。H2O2是细胞内主要的内源性ROS,有报道指出,H2O2几乎可以由所有的氧化应激源产生,并且能够自由扩散进出细胞,造成氧化-抗氧化系统的失衡[13-14]。报道指出,MTT法测定细胞存活率可以筛选H2O2的最大安全浓度[15]。本研究结果表明,当H2O2浓度达到1.00 mmol·L-1时,C2C12细胞的数量开始显著下降。因此本研究选择0.50 mmol·L-1为H2O2最大安全浓度进行细胞的氧化损伤处理。本研究结果表明,H2O2能够增加C2C12细胞的ROS水平。类似的研究指出,用H2O2处理猪脱去卵丘的卵母细胞,细胞内ROS水平会明显提高[16]。此外,PDTC是一种特异性的NF-κB抑制剂,本研究选择20 μmol·L-1的PDTC处理C2C12细胞,发现ROS水平无显著变化,这与杨金莲[17]采用20 μmol·L-1的PDTC处理人类肝癌(HepG2)细胞会抑制酒精引起的ROS升高的结果相类似,说明PDTC可能具有抗氧化作用。因此,在本研究条件下,H2O2能够对C2C12细胞造成氧化应激。
骨骼肌的正常发育与成肌细胞的增殖分化密不可分[1]。在当前的养殖模式下,畜禽肌肉对氧化应激的影响反应愈加敏感,其损伤的机制也需系统的探讨。已有的研究表明,H2O2能够诱导心肌细胞发生凋亡,并且可同时激活内源和外源途径引起C2C12细胞的凋亡[18-19]。本研究中,H2O2增加了C2C12细胞的凋亡率,并促进caspase-3、caspase-6、caspase-8、caspase-9的表达。细胞凋亡主要包括内源和外源路径,caspase-8和caspase-9分别为外源和内源路径的启动因子,进而激活执行因子caspase-3或caspase-6以完成凋亡[20-21]。因此,ROS可能是诱导细胞凋亡的一个重要信号分子[22]。此外,在本研究条件下,PDTC处理细胞后也能够引起凋亡发生。在人骨髓瘤U266细胞上的研究表明,PDTC能够促进Caspase家族蛋白的表达,进而引起细胞凋亡[23]。这可能与PDTC在细胞信号传导和细胞结构改变方面的作用有关[23]。研究证实,自噬能够通过自噬体分解代谢细胞内的蛋白和细胞器,这一过程受到ROS的氧化调控[5]。本研究中,H2O2能够促进C2C12细胞的自噬发生。相似的报道指出,H2O2能够通过增加Beclin 1的表达和LC3-Ⅱ/Ⅰ的比值促进大鼠胶质瘤C6细胞和人类胶质瘤U251细胞的自噬[24-25]。但值得注意的是,自噬在不同试验中发挥的作用有所差别,会出现自噬性细胞死亡和保护性自噬两种结果,这可能是由于自噬的氧化还原调节机制与细胞所处的环境和自噬刺激物的类型有关所导致的[26-27]。在本研究中,PDTC同样促进了细胞自噬的发生,这与Gao等[28]采用PDTC处理猪颗粒细胞的结果一致。近年来有报道指出,异荭草苷和H2O2引起的ROS升高能够同时促进HepG2细胞和C2C12细胞的凋亡和自噬发生[29-30]。并且有研究表明,自噬和细胞凋亡是相互关联的[31-32]。因此,本研究条件下H2O2导致的ROS水平升高能够促进C2C12细胞的凋亡和自噬同时发生。
在众多生理和病理条件下,NF-κB信号通路是调控骨骼肌质量最重要的信号通路之一[8]。本研究采用NF-κB抑制剂PDTC处理细胞,结果表明,NF-κB蛋白的表达受到抑制,信号通路下游因子的表达也发生了显著变化。H2O2处理组的结果与PDTC组保持一致。活化后的NF-κB与细胞凋亡有密切联系,具有抑制细胞凋亡和促进细胞凋亡的双向作用,其参与多种凋亡相关基因的转录调控,如Bcl-2家族和Cox家族[33]。并且有学者认为,在动物氧化应激过程中自噬的发生可能与NF-κB蛋白的激活作用有关[30]。本研究结果表明,H2O2和PDTC处理C2C12细胞会抑制NF-κB信号通路相关因子的表达,并引起细胞凋亡和自噬的发生。类似的报道指出,伪狂犬病病毒可以通过抑制NF-κB信号通路相关因子结合诱导猪肾上皮细胞凋亡和自噬发生[32]。此外,对HepG2细胞的研究结果表明,异荭草苷引起的ROS升高会通过抑制NF-κB信号通路促进凋亡和自噬发生[29]。课题组前期的研究结果也表明,H2O2引起的ROS升高能够通过抑制NF-κB信号通路诱发肉鸡肝和肌肉的细胞凋亡和自噬[34-35]。因此认为,H2O2引起的ROS升高能够通过抑制NF-κB信号通路促进C2C12细胞的凋亡和自噬发生。
4 结论本试验条件下,H2O2会引起C2C12细胞的ROS升高,并且具有同PDTC相类似的作用,即通过抑制NF-κB信号通路介导细胞凋亡和自噬的发生。这些结果为阐明高浓度ROS可引起细胞氧化损伤的机理提供一定的理论依据。
| [1] |
赖桂华, 邱小忠, 余磊, 等. 氧化应激对C2C12成肌细胞增殖与凋亡的影响[J]. 中国组织工程研究与临床康复, 2007, 11(2): 278–281.
LAI G H, QIU X Z, YU L, et al. Effect of oxidative stress on myoblast C2C12 proliferation and apoptosis[J]. Journal of Clinical Rehabilitative Tissue Engineering Research, 2007, 11(2): 278–281. DOI: 10.3321/j.issn:1673-8225.2007.02.026 (in Chinese) |
| [2] |
邱小忠, 余磊, 廖华, 等. 活性氧促使L6成肌细胞的分化[J]. 第一军医大学学报, 2005, 25(11): 1384–1386.
QIU X Z, YU L, LIAO H, et al. Oxidative stress-induced differentiation of L6 myoblasts[J]. Journal of First Military Medical University, 2005, 25(11): 1384–1386. DOI: 10.3321/j.issn:1673-4254.2005.11.011 (in Chinese) |
| [3] | FLANDIN P, DONATI Y, BARAZZONE-ARGIROFFO C, et al. Hyperoxia-mediated oxidative stress increases expression of UCP3 mRNA and protein in skeletal muscle[J]. FEBS Lett, 2005, 579(16): 3411–3415. DOI: 10.1016/j.febslet.2005.04.084 |
| [4] | SIMON H U, HAJ-YEHIA A, LEVI-SCHAFFER F. Role of reactive oxygen species (ROS) in apoptosis induction[J]. Apoptosis, 2000, 5(5): 415–418. DOI: 10.1023/A:1009616228304 |
| [5] | SCHERZ-SHOUVAL R, ELAZAR Z. Regulation of autophagy by ROS:physiology and pathology[J]. Trends Biochem Sci, 2011, 36(1): 30–38. DOI: 10.1016/j.tibs.2010.07.007 |
| [6] | JIANG Y, ZHANG W H, GAO F, et al. Micro-encapsulated sodium butyrate attenuates oxidative stress induced by corticosterone exposure and modulates apoptosis in intestinal mucosa of broiler chickens[J]. Anim Prod Sci, 2014, 55(5): 587–594. |
| [7] | YIN Y, LU L, WANG D T, et al. Astragalus polysaccharide inhibits autophagy and apoptosis from peroxide-induced injury in C2C12 myoblasts[J]. Cell Biochem Biophys, 2015, 73(2): 433–439. |
| [8] | LI H, MALHOTRA S, KUMAR A. Nuclear factor-kappa B signaling in skeletal muscle atrophy[J]. J Mol Med, 2008, 86(10): 1113–1126. DOI: 10.1007/s00109-008-0373-8 |
| [9] |
赵敏孟.胚蛋注射丙酮酸肌酸调控肉鸡能量代谢和肌肉发育的作用机理研究[D].南京: 南京农业大学, 2017.
ZHAO M M.Regulatory mechanism of in ovo feeding of creatine pyruvate on energy metabolism and muscle development of broiler chickens[D]. Nanjing: Nanjing Agricultural University, 2017.(in Chinese) |
| [10] | LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the method[J]. Methods, 2001, 25(4): 402–408. |
| [11] |
陈伟, 林映才, 马现永, 等. 一些抗氧化剂的抗/促氧化作用及其机制[J]. 动物营养学报, 2012, 24(4): 595–605.
CHEN W, LIN Y C, MA X Y, et al. Anti/pro-oxidative functions of antioxidants and their mechanisms[J]. Chinese Journal of Animal Nutrition, 2012, 24(4): 595–605. (in Chinese) |
| [12] | YIN J, REN W K, WU X S, et al. Oxidative stress-mediated signaling pathways:a review[J]. J Food Agric Environ, 2013, 11(2): 132–139. |
| [13] | LEE J C, SON Y O, CHOI K C, et al. Hydrogen peroxide induces apoptosis of BJAB cells due to formation of hydroxyl radicals via intracellular iron-mediated Fenton chemistry in glucose oxidase-mediated oxidative stress[J]. Mol Cells, 2006, 22(1): 21–29. |
| [14] | ESSICK E E, WILSON R M, PIMENTEL D R, et al. Adiponectin modulates oxidative stress-induced autophagy in cardiomyocytes[J]. PLoS One, 2013, 8(7): e68697. DOI: 10.1371/journal.pone.0068697 |
| [15] |
韩飞, 周孟良. 过氧化氢诱导HepG2细胞产生氧化应激细胞模型的建立[J]. 食品科学, 2011, 32(5): 55–57.
HAN F, ZHOU M L. An experimental HepG2 cell model of hydrogen peroxide induced DNA oxidative injury[J]. Food Science, 2011, 32(5): 55–57. (in Chinese) |
| [16] | YAZAKI T, HIRADATE Y, HOSHINO Y, et al. L-arnitine improves hydrogen peroxide-induced impairment of nuclear maturation in porcine oocytes[J]. Anim Sci J, 2013, 84(5): 395–402. DOI: 10.1111/asj.12016 |
| [17] |
杨金莲.酒精刺激激活NF-κB信号通路促进肝癌的生长和转移[D].合肥: 安徽医科大学, 2012.
YANG J L.NF-κB activation mediates ethanol-promoted liver cancer progression[D]. Hefei: Anhui Medical University, 2012.(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10366-1012468141.htm |
| [18] |
程何祥, 张荣庆, 马颖艳, 等. 过氧化氢诱导乳鼠心肌细胞凋亡及半胱天冬酶-3抑制剂的作用[J]. 第四军医大学学报, 2001, 22(21): 1953–1956.
CHENG H X, ZHANG R Q, MA Y Y, et al. Apoptosis of neonatal rat cardiomyocytes induced by exogenous hydroxyl free radical and the effect of caspase-3 antagonist[J]. Journal of the Fourth Military Medical University, 2001, 22(21): 1953–1956. DOI: 10.3321/j.issn:1000-2790.2001.21.011 (in Chinese) |
| [19] |
肖卫民, 蒋碧梅, 石永忠, 等. 过氧化氢诱导C2C12细胞凋亡的机制初探[J]. 医学临床研究, 2004, 21(11): 1288–1291.
XIAO W M, JIANG B M, SHI Y Z, et al. Preliminary investigation on the mechanism of C2C12 cell apoptosis induced by hydrogen peroxide[J]. Journal of Clinical Research, 2004, 21(11): 1288–1291. DOI: 10.3969/j.issn.1671-7171.2004.11.023 (in Chinese) |
| [20] | JIANG B M, XIAO W M, SHI Y Z, et al. Role of Smac/DIABLO in hydrogen peroxide-induced apoptosis in C2C12 myogenic cells[J]. Free Radical Bio Med, 2005, 39(5): 658–667. DOI: 10.1016/j.freeradbiomed.2005.04.018 |
| [21] | WYLLIE A H. "Where, O death, is thy sting?" A brief review of apoptosis biology[J]. Mol Neurobiol, 2010, 42(1): 4–9. |
| [22] | KIFFIN R, BANDYOPADHYAY U, CUERVO A M. Oxidative stress and autophagy[J]. Antioxid Redox Sign, 2006, 8(1-2): 152–162. DOI: 10.1089/ars.2006.8.152 |
| [23] |
易蓓, 袁海汀, 许永会, 等. NF-κB抑制剂PDTC对人骨髓瘤U266细胞增殖和凋亡的影响[J]. 中国病理生理杂志, 2017, 33(7): 1177–1183.
YI B, YUAN H T, XU Y H, et al. Effect of NF-κB inhibitor pyrrolidine dithiocarbamate on proliferation and apoptosis of human multiple myeloma U266 cells[J]. Chinese Journal of Pathophysiology, 2017, 33(7): 1177–1183. DOI: 10.3969/j.issn.1000-4718.2017.07.004 (in Chinese) |
| [24] | BYUN Y J, KIM S K, KIM Y M, et al. Hydrogen peroxide induces autophagic cell death in C6 glioma cells via BNIP3-mediated suppression of the mTOR pathway[J]. Neurosci Lett, 2009, 461(2): 131–135. DOI: 10.1016/j.neulet.2009.06.011 |
| [25] | ZHANG H Y, KONG X X, KANG J S, et al. Oxidative stress induces parallel autophagy and mitochondria dysfunction in human glioma U251 cells[J]. Toxicol Sci, 2009, 110(2): 376–388. |
| [26] | YU L, WAN F Y, DUTTA S, et al. Autophagic programmed cell death by selective catalase degradation[J]. Proc Natl Acad Sci USA, 2006, 103(13): 4952–4957. DOI: 10.1073/pnas.0511288103 |
| [27] | SCHERZ-SHOUVAL R, SHVETS E, FASS E, et al. Reactive oxygen species are essential for autophagy and specifically regulate the activity of Atg4[J]. EMBO J, 2007, 26(7): 1749–1760. DOI: 10.1038/sj.emboj.7601623 |
| [28] | GAO H, LIN L, HAQ I U, et al. Inhibition of NF-κB promotes autophagy via JNK signaling pathway in porcine granulosa cells[J]. Biochem Biophys Res Commun, 2016, 473(1): 311–316. DOI: 10.1016/j.bbrc.2016.03.101 |
| [29] | YUAN L, WEI S P, WANG J, et al. Isoorientin induces apoptosis and autophagy simultaneously by reactive oxygen species (ROS)-related p53, PI3K/Akt, JNK, and p38 signaling pathways in HepG2 cancer cells[J]. J Agric Food Chem, 2014, 62(23): 5390–5400. DOI: 10.1021/jf500903g |
| [30] | YIN J, DUAN J L, CUI Z J, et al. Hydrogen peroxide-induced oxidative stress activates NF-κB and Nrf2/Keap1 signals and triggers autophagy in piglets[J]. RSC Adv, 2015, 5(20): 15479–15486. DOI: 10.1039/C4RA13557A |
| [31] |
刘庆羊, 孙自强, 赵鸿雁, 等. 自噬在骨保护素对破骨细胞及其前体凋亡过程的调控机制[J]. 畜牧兽医学报, 2018, 49(8): 1761–1769.
LIU Q Y, SUN Z Q, ZHAO H Y, et al. Effects of autophagy on the apoptosis of osteoclasts and osteoclast precursors mediated by osteoprotegerin[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(8): 1761–1769. (in Chinese) |
| [32] |
胡林, 南良康, 张敏, 等. 猪Beclin1基因调控伪狂犬病病毒诱导细胞自噬和凋亡的机制分析[J]. 畜牧兽医学报, 2018, 49(6): 1274–1281.
HU L, NAN L K, ZHANG M, et al. The mechanism of porcine Beclin1 gene on autophagy and apoptosis[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(6): 1274–1281. (in Chinese) |
| [33] |
张勇, 崔岩. NF-κB在细胞凋亡中的调节作用和应用前景[J]. 动物营养学报, 2011, 23(5): 715–719.
ZHANG Y, CUI Y. NF-κB:modulation in apoptosis and application prospects[J]. Chinese Journal of Animal Nutrition, 2011, 23(5): 715–719. DOI: 10.3969/j.issn.1006-267x.2011.05.002 (in Chinese) |
| [34] | CHEN X X, ZHANG L, LI J L, et al. Hydrogen peroxide-induced change in meat quality of the breast muscle of broilers is mediated by ROS generation, apoptosis, and autophagy in the NF-κB signal pathway[J]. J Agric Food Chem, 2017, 65(19): 3986–3994. DOI: 10.1021/acs.jafc.7b01267 |
| [35] | CHEN X, GU R, ZHANG L, et al. Induction of nuclear factor-κB signal-mediated apoptosis and autophagy by reactive oxygen species is associated with hydrogen peroxide-impaired growth performance of broilers[J]. Animal, 2018, 12(12): 2561–2570. DOI: 10.1017/S1751731118000903 |



