2. 河北农业大学动物医学院&中兽医学院, 保定 071001
2. College of Veterinary Medicine & Traditional Chinese Veterinary Medicine, Hebei Agricultural University, Baoding 071001, China
双酚A (bisphenol A,BPA)是合成聚碳酸脂塑料和环氧树脂的化学单体[1]。添加了BPA的塑料可制成各种日常生活用品如婴儿的奶瓶、食品包装、热敏纸以及牙齿填充剂等医学用品[2]。据估计,全世界每年BPA生产量在680万吨以上[3]。而在亚洲尤其是中国,BPA的生产和消费量每年剧增[4]。BPA是一种环境雌激素,具有拟雌激素样特性,可导致性早熟[5]。短期低剂量接触BPA并不会造成严重损伤,但长期低剂量接触BPA的危害却需要加以重视,因其具有干扰生殖内分泌的特性,长期接触极有可能对后代产生严重影响[6]。
有资料报道,BPA可引起雄性睾丸萎缩[7],生殖细胞核DNA断裂[8],导致细胞凋亡[9]。BPA表现出类雌激素活性和抗雄激素活性[10]。雄激素受体(androgen receptor, AR)对于雄性性表型的发育和维持至关重要[11],而BPA可与AR结合并作为其拮抗剂扰乱睾丸发育[12],长时间低剂量染毒BPA可导致动物雌雄比失调[13]。转录组学测序常应用于差异基因筛选及功能注释[14],目前研究转录组的方法主要基于测序技术[15]。与传统的分析技术相比,转录组测序分析可以获得更全面的数据[16]。转录组测序数据常通过基因功能数据库(gene ontology, GO)[17]和基因代谢通路数据库(kyoto encyclopedia of genes and genomes, KEGG)进行注释分析[18]。
关于BPA对幼年期小鼠睾丸发育影响的研究报道很少,多围绕于某一基因或蛋白进行。本研究通过转录组测序技术探究BPA对性成熟期小鼠睾丸整体转录水平的影响,以期获取BPA对睾丸发育影响较为全面的数据,为进一步研究提供基础资料,为有效防控BPA的危害提供有价值的参考数据。
1 材料与方法 1.1 动物分组与处理8周龄SPF级昆明小鼠雌性200只,雄性100只,体重18~22 g,购于北京斯贝福实验动物中心,许可证号:SCXK(京)2016-0002。经环境适应1周,雌雄2:1合笼过夜,次日早晨检出阴栓为孕0 d。将孕0 d母鼠随机分为7组,每组4个重复,每个重复5只。A组为空白对照组,B组为0.05 mg·kg-1 BPA处理组,C组为0.5 mg·kg-1 BPA组,D组为5 mg·kg-1 BPA组,E组为10 mg·kg-1 BPA组,F组为20 mg·kg-1 BPA组,G组为50 mg·kg-1 BPA组。F0代母鼠自孕0 d起至哺乳期结束,饮水染毒BPA,共计39 d。
将固体BPA (纯度≥ 99%,Sigma,美国)配成50 mg·mL-1的BPA母液,置于4 ℃保存,使用时按需要用蒸馏水配制成所需浓度。为了保证饮水量的准确,使用防漏水的小鼠饮水瓶,同时每3 d称量小鼠体重,测量饮水量,以确保饮水给药(BPA)剂量的准确性。
1.2 样品采集与分析F1代雄鼠于断奶(21日龄)眼眶静脉丛采血,脱颈处死。分离血清后置于-80℃保存。摘取睾丸,称重,按双侧睾丸重(mg)占体重(g)的百分比计算睾丸器官指数。将一部分新鲜睾丸立刻进行单细胞凝胶电泳(彗星试验);一部分睾丸置于液氮冷冻保存,用于后续睾丸组织提取总RNA进行转录组测序,匀浆后进行组织BPA含量测定;一部分置于4%多聚甲醛固定保存,用于H&E染色后进行组织病理学观察和雄激素受体(AR)免疫组化。
使用小鼠双酚A检测试剂盒(上海润裕生物科技有限公司,Lot No, RY-12919),按照说明书操作,检测子代雄鼠血清及睾丸匀浆BPA含量。
小鼠睾丸组织使用4%多聚甲醛固定,石蜡切片。一部分切片进行H&E染色,观察不同剂量BPA对睾丸组织的病理损伤情况。一部分切片用于检测小鼠睾丸组织AR表达变化(一抗为兔抗鼠AR单克隆抗体,ab133273,Abcam公司,美国;二抗为羊抗兔多克隆抗体,SV0001,博士德生物技术有限公司,中国)。
彗星试验检测睾丸DNA损伤:将睾丸组织剪碎后加入RMPI 1640培养基,震荡得到细胞悬液,细胞悬液加入低熔点琼脂糖溶液中,混匀后涂抹至载玻片上进行电泳,电泳结束后使用溴化乙锭染色,通过图像分析系统CASP量化DNA损伤[19]。
使用Illumina测序平台Illumina HiSeq对空白对照组、50 mg·kg-1组睾丸进行转录组测序。测序结果经比对得到差异表达基因,将差异表达基因导入GO数据库和KEGG数据库进行注释分析。对差异表达基因进行荧光定量PCR验证,引物设计合成委托大连宝生物公司完成,序列见表 1。荧光定量PCR采用两步法,扩增程序:95 ℃ 600 s;95 ℃ 30 s,60 ℃10 s,45个循环。熔解曲线程序:95 ℃ 10 s,65 ℃ 60 s;然后,以0.2 ℃·s-1的速度升温至97 ℃;最后,37 ℃冷却30 s。
|
|
表 1 荧光定量PCR引物序列 Table 1 Real-time PCR primer sequences |
使用Image J对免疫组化结果进行灰度值分析,使用CASP软件对彗星试验结果进行分析。试验数据录入SPSS 19.0软件进行分析,结果以“平均值±标准误(x±SE)”表示。数据进行单因素方差分析(one-way ANOVA)和卡方检验(χ2)。与空白对照进行比较,P < 0.05表示差异显著。
2 结果 2.1 母鼠染毒BPA对子代小鼠血清和睾丸组织BPA含量的影响根据试剂盒所含的标准品计算得到标准曲线线性回归系数R2和回归方程,当R2≥0.92时,测量结果可信。本次试验中 R2=0.998 5。测定结果显示,母鼠染毒BPA剂量大于等于5 mg·kg-1时,子代雄鼠血清和睾丸组织BPA含量均显著高于空白对照组(P<0.05,表 2)。
|
|
表 2 子代雄性小鼠血清和睾丸中BPA的含量 Table 2 BPA content in serum and testis of male offspring mice |
从睾丸器官指数的结果可以看出,F组、G组睾丸器官指数与A组相比显著增加(P<0.05),即染毒BPA剂量大于等于20 mg·kg-1时可导致子代雄鼠睾丸显著增大(表 3)。
|
|
表 3 子代雄鼠睾丸器官指数 Table 3 Testicular organ index of male offspring mice |
由H & E染色结果可以看出,A组睾丸生精小管之间充满睾丸间质细胞,几乎无空隙。而随着染毒剂量的增加各组生精小管均不同程度地出现空腔,生精小管之间的间隙变大。从图 1可以看出,母鼠BPA染毒剂量大于等于10 mg·kg-1时子代小鼠睾丸生精小管明显萎缩,小管间隙变大。
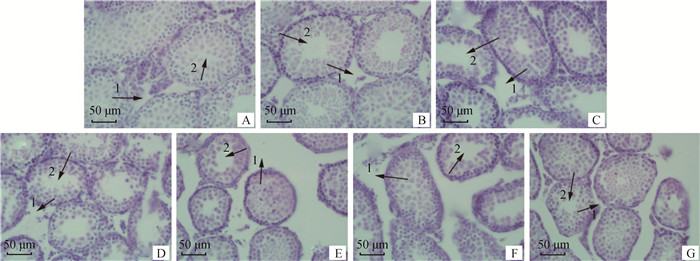
|
A.空白对照组;B.0.05 mg·kg-1 BPA组;C.0.5 mg·kg-1 BPA组;D.5 mg·kg-1 BPA组;E. 10 mg·kg-1 BPA组;F.20 mg·kg-1 BPA组;G. 50 mg·kg-1 BPA组。箭头1所指位置为生精小管间隙,箭头2所指位置为生精小管空腔。下同 A. Control group; B.0.05 mg·kg-1 BPA group; C. 0.5 mg·kg-1 BPA group; D. 5 mg·kg-1 BPA group; E. 10 mg·kg-1 BPA group; F.20 mg·kg-1 BPA group; G.50 mg·kg-1 BPA group. Arrow 1 point to the location of the seminiferous tubule gap, and arrow 2 point to the seminiferous tubule cavity. The same as the following figures 图 1 睾丸组织病理学变化(400×) Fig. 1 Testicular histopathological changes (400×) |
由图 2和表 4可知,D组、E组、F组、G组睾丸生殖细胞DNA损伤显著大于空白对照组(P<0.05),这表明母鼠染毒BPA剂量大于等于5 mg·kg-1时子代小鼠睾丸生殖细胞DNA受到严重损伤。
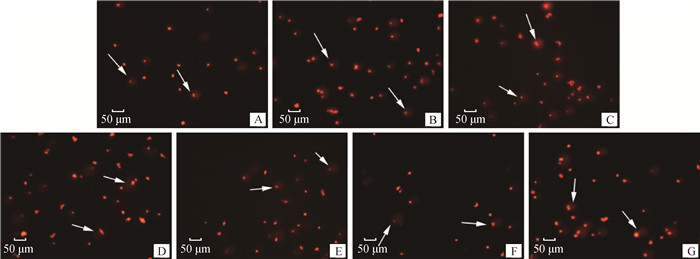
|
箭头所指为荧光染色的生殖细胞的DNA The arrow point to the stained germ cell DNA by fluorescence staining 图 2 睾丸中生殖细胞核DNA损伤结果(200×) Fig. 2 Results of germ cell nuclear DNA damage in testes (200×) |
|
|
表 4 睾丸生殖细胞DNA损伤结果 Table 4 Testicular germ cell DNA damage results |
由免疫组化结果可以看出,AR主要表达于睾丸间质细胞(图 3箭头所指)。F组和G组AR表达量显著低于A组(P<0.05,表 5),即母鼠染毒BPA剂量大于等于20 mg·kg-1时可导致子代雄鼠睾丸AR表达量显著减少。
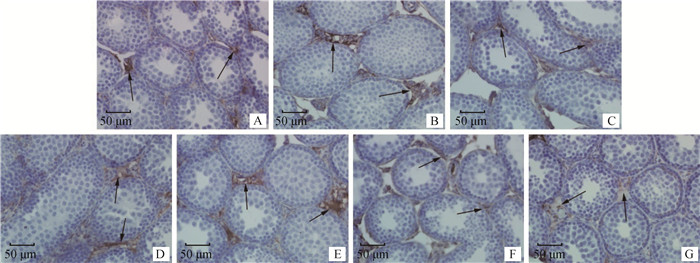
|
箭头所指为AR阳性表达细胞 Arrow point to the AR-positive cells 图 3 子代小鼠睾丸中AR表达(400×) Fig. 3 AR expression in testicular of male offspring mice(400×) |
|
|
表 5 子代小鼠睾丸AR表达量 Table 5 AR expression in testicular of male offspring mice |
样品间基因表达水平相关性是检验试验可靠性和样本选择是否合格的重要指标。相关系数越接近1,表明样品之间表达模式的相似度越高, 证明样本属于同种组织,从而排除因污染或取错组织产生的差异。R2>0.8表示取样无污染,本试验中,50 mg·kg-1 BPA组与空白对照组样品间相关系数为0.974,证明本试验取样无污染,测序结果可信(图 4)。
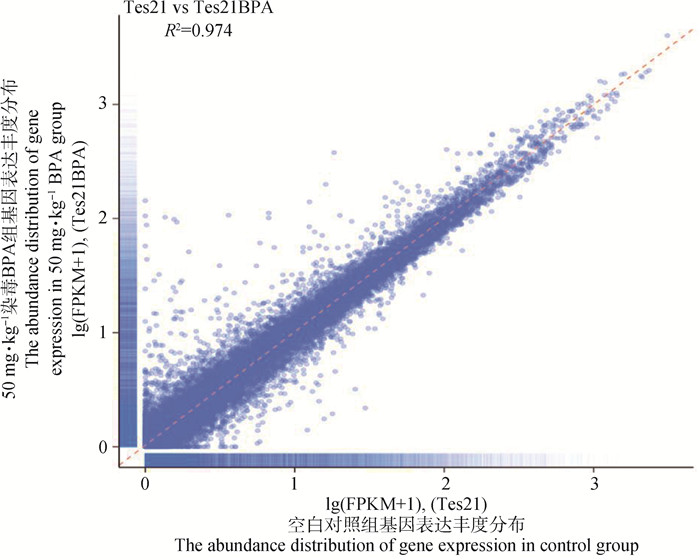
|
横坐标为空白对照组,纵坐标为50 mg·kg-1 BPA处理组,FPKM (expected number of fragments per kilobase of transcript sequence per millions base pairs sequenced)是每百万碱基片段中来自某一基因每千碱基长度的碱基片段数目 The abscissa is control group, and the ordinate is 50 mg·kg-1 BPA treatment group. FPKM (expected number of fragments per kilobase of transcript sequence per millions base pairs sequenced) is from a certain million base fragment number of base fragments per kilobase length of the gene 图 4 样品间基因表达水平相关性散点图 Fig. 4 Correlation scatter plot of gene expression level between samples |
将G组(50 mg·kg-1组)和A组(空白对照组)的子代雄鼠睾丸进行转录组测序比较,结果显示,母鼠染毒BPA后,其子代雄鼠相较于空白对照组共有129个显著差异表达基因,其中116个基因上调,13个基因下调(图 5)。
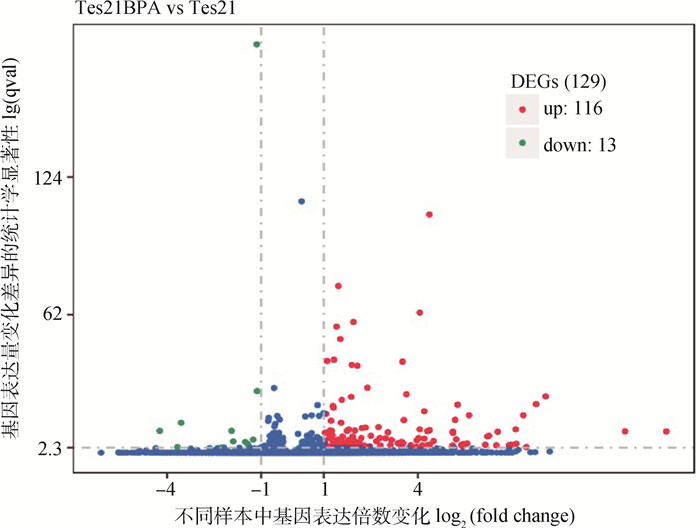
|
有显著性差异表达的基因用红色点(上调)和绿色点(下调)表示,无显著性差异表达的基因用蓝色点表示 Genes with significant differential expression are indicated by red dots (up-regulated) and green dots (down-regulated), genes with no significant differential expression are represented by blue dots 图 5 差异表达基因火山图 Fig. 5 Volcano map of differentially expressed genes |
差异表达基因功能按照生物进程、细胞组分和分子功能3个基因功能分类。根据基因功能的包含关系,将富集的基因功能绘制有向无环图(directed acyclic graph,DAG),DAG图可以将相似功能基因集合,并通过从属关系得到最准确的功能注释。F1代21 d睾丸生物过程DAG图显示,GO富集条目在生物过程中指向蛋白质入核运输(图 6),在细胞组分中指向细胞外基质蛋白、运动纤毛、中间丝(图 7),在分子功能中指向结构分子活动、转录因子结合、蛋白质同源二聚化活性(图 8)。
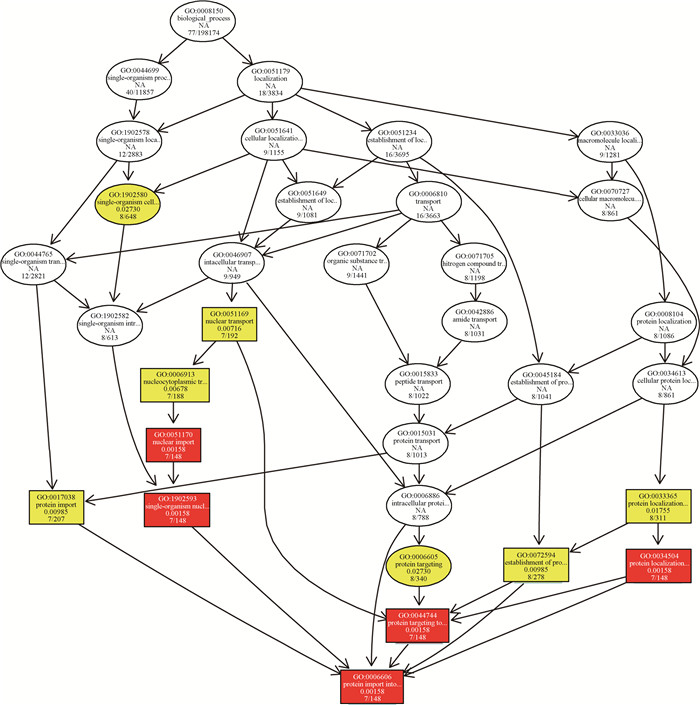
|
图中每个节点代表一个GO术语,方框代表的是富集的GO,颜色的深浅代表富集程度,颜色越深就表示富集程度越高。图 7、8同 Each node in the figure represents a GO term. The box represents the enriched GO. The depth of the color represents the degree of enrichment. The darker the color, the higher the enrichment. The same as figure 7, 8 图 6 差异表达基因生物进程基因功能的DAG图 Fig. 6 DAG map of differentially expressed gene biological process gene function |
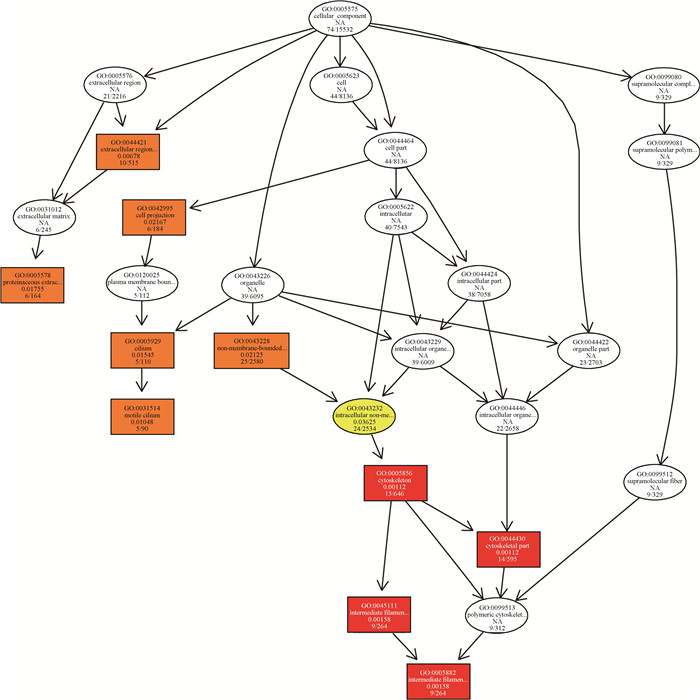
|
图 7 差异表达基因细胞组分基因功能的DAG图 Fig. 7 DAG map of differentially expressed gene cell component gene function |
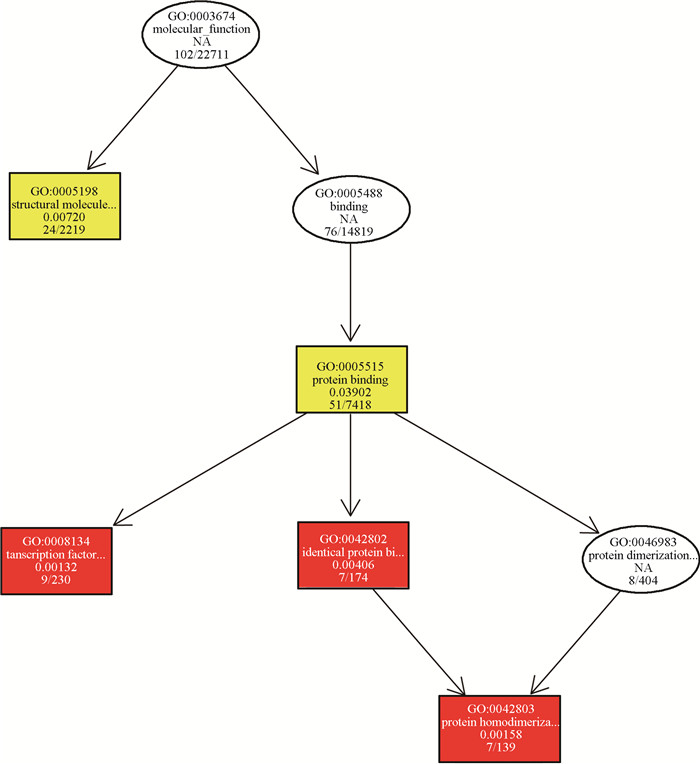
|
图 8 差异表达基因分子功能基因功能的DAG图 Fig. 8 DAG map of differentially expressed gene molecular functional gene function |
在GO富集结果中,差异基因的功能与转录相关,而与转录相关的代谢通路中剪切体通路富集,剪切体代谢通路见图 9。本研究中,50 mg·kg-1 BPA染毒母鼠后,子代雄鼠睾丸相较于空白对照组剪切体U5 snRNA的编码基因Snrnp40表达上调,剪切体通用载体组件编码基因Hnrnpu表达下调。
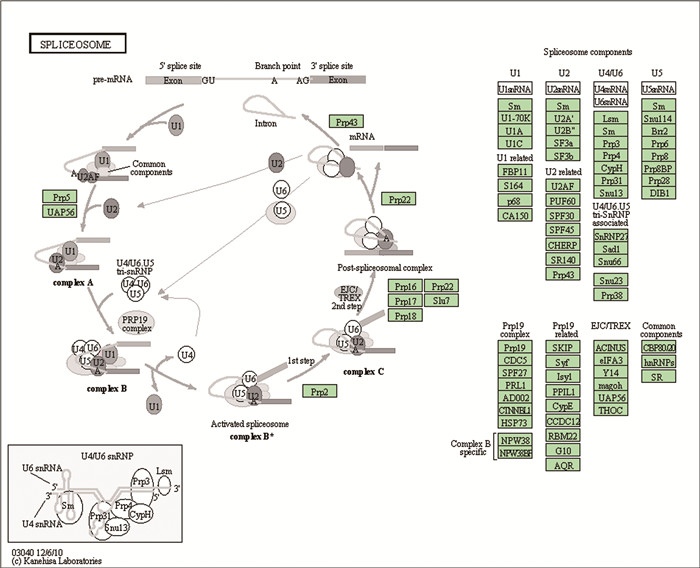
|
图 9 剪切体KEGG代谢通路图 Fig. 9 Spliceosome KEGG metabolic pathway map |
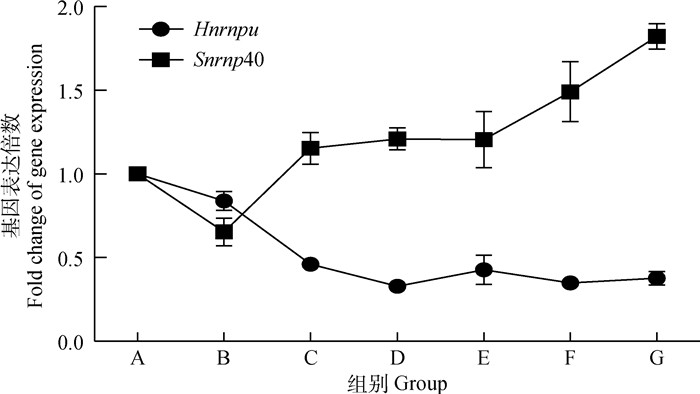
荧光定量PCR检测了全部7组小鼠睾丸组织Snrnp 40和Hnrnpu表达水平,并以β-actin为内参基因校正不同组织RNA得率的误差,荧光定量PCR扩增结果良好(图 10),熔解曲线为单峰,证明引物特异性良好且无引物二聚体(图 11)。结果显示,Snrnp 40表达随BPA染毒剂量增加而增加,而Hnrnpu表达随BPA染毒剂量增加而减少,与转录组测序结果一致(图 12)。
|
图 10 Snrnp40和Hnrnpu基因荧光定量PCR扩增曲线 Fig. 10 Fluorescence quantitative PCR amplification curve of Snrnp40 and Hnrnpu genes |
|
图 11 Snrnp40和Hnrnpu基因荧光定量PCR熔解曲线 Fig. 11 Fluorescence quantitative PCR melting curve of Snrnp40 and Hnrnpu genes |
|
图 12 Snrnp40和Hnrnpu基因相对表达量 Fig. 12 Relative expression levels of Snrnp40 and Hnrnpu genes |
BPA可导致雌性性早熟已被证实[20],研究显示,BPA可影响雌性生殖功能[21]和胚胎的发育[22],体外研究也证实了BPA可影响黄体的功能[23],但母体染毒BPA对子代生殖系统的发育影响尚未见报道。本研究将孕期和哺乳期母鼠暴露于BPA,探究子代雄鼠通过胎盘和乳汁而非直接接触BPA对其睾丸发育的影响。试验中,一方面由于染毒BPA时间长,采用灌胃染毒不仅操作困难,对小鼠也有很大刺激,另一方面,日常摄取BPA的方式一般经口摄入,因此采用饮水染毒BPA。低剂量染毒BPA一般指经口染毒剂量为0.05~50 mg·kg-1[24]。基于已有的文献报道,本试验在低剂量范围内设立了6个试验组和1个对照组,并使用ELISA试剂盒检测了睾丸和血清BPA含量,称量睾丸重并计算睾丸指数,使用彗星试验检测睾丸中未成熟生殖细胞DNA损伤,使用H & E染色观察睾丸组织病理变化,使用免疫组化观察睾丸AR表达的变化,结果显示,低剂量的BPA亦可引起睾丸组织的病理变化,使得睾丸生精小管萎缩,小管间隙变大,睾丸器官指数变大,睾丸细胞凋亡,同时AR表达减少。充分证明了BPA的毒性,但为了全面地研究BPA染毒对子代小鼠睾丸的影响,更深一步的研究BPA对睾丸的损伤机制,本研究选择将空白对照组和最大染毒剂量组进行转录组测序,结果显示,BPA可影响睾丸组织剪切体基因的表达,影响mRNA转录后修饰,转录组测序得到的剪切体相关差异表达基因使用RT-qPCR对全部7组睾丸组织进行验证试验,验证了转录组结果,并进一步证明BPA对子代睾丸剪切体的影响与染毒剂量呈正相关。
本试验中,母鼠染毒BPA 5 mg·kg-1以上时,子代雄鼠血清和睾丸组织BPA含量均高于空白对照组(P<0.05),这表明BPA可以通过亲代间接传递给子代。从睾丸器官指数和睾丸石蜡切片H & E染色的结果可以看出,母鼠染毒BPA大于等于10 mg·kg-1可导致睾丸生精小管萎缩,小管间隙变大,20 mg·kg-1以上染毒剂量导致睾丸器官指数显著增大,与Hiyama等[25]的研究结果一致。
彗星试验可以灵敏地检测出细胞DNA损伤[26]。彗星试验中,当细胞核DNA未损伤时,每个生殖细胞染色区域呈圆形,核DNA (亮点)的位置在圆形中央。当核DNA发生损伤时,会产生大量50~200 bp的DNA碎片,在低电压电场中,这些碎片会从核DNA的位置随电场方向偏移,使得染色细胞出现一条DNA“尾巴”,DNA碎片越多,“尾巴”的亮度越大,DNA碎片越小,“尾巴”越长[27]。慧尾的亮度和长度经过加权得到OTM值,OTM值越大细胞损伤越严重。本试验中,子代雄鼠睾丸彗星试验结果显示,母鼠染毒BPA 5 mg·kg-1以上可导致子代雄鼠睾丸中生殖细胞DNA损伤显著大于空白对照(P<0.05),这证明BPA在较低剂量(≥5 mg·kg-1)就可以通过母鼠间接损伤后代睾丸。
本研究结果显示,母鼠染毒BPA剂量在20 mg·kg-1以上时,子代睾丸AR表达量显著减少(P<0.05)。BPA作为一种环境抗雄激素,可抑制AR活性[28],而AR作为调节基因表达的DNA结合转录因子[29],对于雄性性表型的发育和维持至关重要。目前对BPA的研究均集中于其抗雄激素活性,而本研究则进一步证明了其可减少AR表达水平的能力,AR缺失可导致睾丸精子发生异常[30],这表示BPA对睾丸的发育和成熟有着不可忽视的影响。
为了探究母鼠染毒BPA对子代睾丸发育的影响机制,本试验对空白对照组和50 mg·kg-1 BPA组子代睾丸进行转录组测序,共得到129个显著差异表达基因,其中116个基因上调,13个基因下调。差异表达基因通过GO数据库进行注释,富集得到的基因功能中,蛋白质入核运输、转录因子结合、蛋白质同源二聚化活性功能均与基因转录相关。其中蛋白质入核运输显著上调,蛋白质入核运输功能与生物大分子的核质分配,如亲核蛋白的核输入、RNA分子及RNP颗粒的核输出有关[31]。转录因子结合显著上调,转录因子结合功能与基因转录相关,真核生物转录起始过程十分复杂,往往需要多种蛋白因子的协助,转录因子与RNA聚合酶Ⅱ形成转录起始复合体,共同参与转录起始过程[32]。本试验中,转录因子结合相关基因表达显著上调,但转录因子AR表达量降低,证明BPA通过影响RNA转录后修饰影响睾丸发育。蛋白质同源二聚化活性基因表达显著上调,转录因子常以同源二聚体的形式发挥作用,AR单体位于胞浆,无生物学活性,聚合成为同源二聚体后进入细胞核,发挥转录因子活性[33]。该基因功能的上调证明BPA可促使子代睾丸转录。从差异表达基因GO富集结果不难看出,BPA是通过影响转录后修饰,从而影响睾丸发育的,而转录相关功能基因的上调则是受到机体的负反馈调节。
差异表达基因经KEGG数据库注释归类后,与转录后修饰相关的剪切体代谢通路富集。剪接体是真核生物mRNA前体去内含子转变成熟工具,由5个小核RNA (snRNA U1、U2、U4、U5和U6)和150多种蛋白质组成的核糖核蛋白复合物(snRNP)[34]。剪接的最初步骤是将U1 snRNP及通用蛋白组件与hnRNA的5′剪接端结合[35],然后,U2 snRNP被募集到剪接体结合位点并形成复合物A[36],U2 snRNP改变hnRNA-snRNP复合物的构象,在构象改变后,U4/U5/U6 tri-snRNP复合物与复合物A结合形成复合物B,重排后形成复合物C,在剪接体活性基团作用下切除内含子,形成成熟mRNA[37]。本试验中,BPA染毒母鼠后,其子代断奶雄鼠睾丸剪切体U5 snRNA编码基因Snrnp40表达上调,剪切体通用蛋白组件编码基因Hnrnpu表达下调。RT-qPCR验证了全部7组Snrnp40和Hnrnpu基因相对表达量,并绘制趋势图,结果与转录组测序一致,验证了测序结果,并进一步证实BPA对睾丸Snrnp40和Hnrnpu基因的影响呈剂量效应。Hnrnpu基因下调导致通用蛋白表达受阻,剪切的第一步即无法进行,而U5亚基编码基因的上调可能是由于剪切功能受阻后机体代偿的结果,然而由于剪切过程第一步无法进行,U5亚基表达的增加并不能恢复剪切体功能。剪切体功能受阻可能是BPA影响睾丸发育的重要原因。
4 结论本研究结果表明,母鼠暴露于低剂量BPA可以引起子代睾丸发育异常,其分子机制可能与剪切体进行mRNA转录后修饰第一步反应受阻有关。
| [1] | BELFROID A, VAN VELZEN M, VAN DER HORST B, et al. Occurrence of bisphenol A in surface water and uptake in fish:evaluation of field measurements[J]. Chemosphere, 2002, 49(1): 97–103. DOI: 10.1016/S0045-6535(02)00157-1 |
| [2] | PIVNENKO K, PEDERSEN G A, ERIKSSON E, et al. Bisphenol A and its structural analogues in household waste paper[J]. Waste Manag, 2015, 44: 39–47. DOI: 10.1016/j.wasman.2015.07.017 |
| [3] | ZHANG J Z, LI X Y, ZHOU L, et al. Analysis of effects of a new environmental pollutant, bisphenol A, on antioxidant systems in soybean roots at different growth stages[J]. Sci Rep, 2016, 6: 23782. DOI: 10.1038/srep23782 |
| [4] | HUANG Y Q, WONG C K C, ZHENG J S, et al. Bisphenol A (BPA) in China:a review of sources, environmental levels, and potential human health impacts[J]. Environ Int, 2012, 42: 91–99. DOI: 10.1016/j.envint.2011.04.010 |
| [5] | MIRMIRA P, EVANS-MOLINA C. Bisphenol A, obesity, and type 2 diabetes mellitus:genuine concern or unnecessary preoccupation?[J]. Transl Res, 2014, 164(1): 13–21. DOI: 10.1016/j.trsl.2014.03.003 |
| [6] | GRAY G M, COHEN J T, CUNHA G, et al. Weight of the evidence evaluation of low-dose reproductive and developmental effects of bisphenol A[J]. Hum Ecol Risk Assess, 2004, 10(5): 875–921. DOI: 10.1080/10807030490513883 |
| [7] | FANG Z, LIU X, YANG X, et al. Effects of Wnt/β-catenin signaling on bisphenol A exposure in male mouse reproductive cells[J]. Mol Med Rep, 2015, 12(4): 5561–5571. DOI: 10.3892/mmr.2015.4028 |
| [8] | DOBRZYŃSKA M M, RADZIKOWSKA J. Genotoxicity and reproductive toxicity of bisphenol A and X-ray/bisphenol A combination in male mice[J]. Drug Chem Toxicol, 2013, 36(1): 19–26. DOI: 10.3109/01480545.2011.644561 |
| [9] | KAUR S, SALUJA M, BANSAL M P. Bisphenol A induced oxidative stress and apoptosis in mice testes:modulation by selenium[J]. Andrologia, 2018, 50(3): e12834. DOI: 10.1111/and.2018.50.issue-3 |
| [10] | CONROY-BEN O, GARCIA I, TESKE S S. In silico binding of 4, 4'‐bisphenols predicts in vitro estrogenic and antiandrogenic activity[J]. Environ Toxicol, 2018, 33(5): 569–578. DOI: 10.1002/tox.v33.5 |
| [11] | DAVEY R A, GROSSMANN M. Androgen receptor structure, function and biology:from bench to bedside[J]. Clin Biochem Rev, 2016, 37(1): 3–15. |
| [12] | PAN J X, WANG F F, LIU Y, et al. Bisphenol a (BPA) induces abnormal androgen accumulation via androgen-androgen receptor (AR) mdiated cyp19a1 transcription inhibition in granulosa cells (GCs)[J]. Fertil Steril, 2013, 100(S3): S13. |
| [13] | CHEN J F, XIAO Y Y, GAI Z X, et al. Reproductive toxicity of low level bisphenol A exposures in a two-generation zebrafish assay: evidence of male-specific effects[J]. Aquat Toxicol, 2015, 169: 204–214. DOI: 10.1016/j.aquatox.2015.10.020 |
| [14] | COSTA V, APRILE M, ESPOSITO R, et al. RNA-Seq and human complex diseases:recent accomplishments and future perspectives[J]. Eur J Hum Genet, 2013, 21(2): 134–142. DOI: 10.1038/ejhg.2012.129 |
| [15] | ZHANG H, HE L, CAI L.Transcriptome sequencing: RNA-Seq[M]//NETTO G J, KAUL K L.Genomic Applications in Pathology.Cham: Springer, 2018: 41-63. |
| [16] | LACHMANN A, TORRE D, KEENAN A B, et al. Massive mining of publicly available RNA-Seq data from human and mouse[J]. Nat Commun, 2018, 9: 1366. DOI: 10.1038/s41467-018-03751-6 |
| [17] | YOUNG M D, WAKEFIELD M J, SMYTH G K, et al. Gene ontology analysis for RNA-Seq:accounting for selection bias[J]. Genome Biol, 2010, 11(2): R14. DOI: 10.1186/gb-2010-11-2-r14 |
| [18] | KANEHISA M, GOTO S. KEGG:Kyoto encyclopedia of genes and genomes[J]. Nucleic Acids Res, 2000, 28(1): 27–30. DOI: 10.1093/nar/28.1.27 |
| [19] | SPEIT G, HARTMANN A. The comet assay:a sensitive genotoxicity test for the detection of DNA damage and repair[J]. Methods Mol Biol, 2006, 314: 275–286. DOI: 10.1385/1592599737 |
| [20] | CHEN Y, WANG Y C, DING G D, et al. Association between bisphenol a exposure and idiopathic central precocious puberty (ICPP) among school-aged girls in Shanghai, China[J]. Environ Int, 2018, 115: 410–416. DOI: 10.1016/j.envint.2018.02.041 |
| [21] | SANTANGELI S, MARADONNA F, GIOACCHINI G, et al. BPA-induced deregulation of epigenetic patterns:effects on female zebrafish reproduction[J]. Sci Rep, 2016, 6: 21982. DOI: 10.1038/srep21982 |
| [22] | FERRIS J, MAHBOUBI K, MACLUSKY N, et al. BPA exposure during in vitro oocyte maturation results in dose-dependent alterations to embryo development rates, apoptosis rate, sex ratio and gene expression[J]. Reprod Toxicol, 2016, 59: 128–138. DOI: 10.1016/j.reprotox.2015.12.002 |
| [23] | MANSUR A, ADIR M, YERUSHALMI G, et al. Does BPA alter steroid hormone synthesis in human granulosa cells in vitro?[J]. Hum Reprod, 2016, 31(7): 1562–1569. DOI: 10.1093/humrep/dew088 |
| [24] | VOM SAAL F S, HUGHES C. An extensive new literature concerning low-dose effects of bisphenol A shows the need for a new risk assessment[J]. Environ Health Perspect, 2005, 113(8): 926–933. DOI: 10.1289/ehp.7713 |
| [25] | HIYAMA M, CHOI E K, WAKITANI S, et al. Bisphenol-A (BPA) affects reproductive formation across generations in mice[J]. J Vet Med Sci, 2011, 73(9): 1211–1215. DOI: 10.1292/jvms.11-0135 |
| [26] | FIC A, ŽEGURA B, SOLLNER DOLENC M, et al. Mutagenicity and DNA damage of bisphenol A and its structural analogues in HepG2 cells[J]. Arh Hig Rada Toksikol, 2013, 64(2): 189–200. DOI: 10.2478/10004-1254-64-2013-2319 |
| [27] | DOBRZYŃSKA M M. The effects in mice of combined treatments to X-rays and antineoplastic drugs in the Comet assay[J]. Toxicology, 2005, 207(2): 331–338. DOI: 10.1016/j.tox.2004.10.002 |
| [28] | WANG H, DING Z, SHI Q M, et al. Anti-androgenic mechanisms of Bisphenol A involve androgen receptor signaling pathway[J]. Toxicology, 2017, 387: 10–16. DOI: 10.1016/j.tox.2017.06.007 |
| [29] | GIBSON D A, SAUNDERS P T K, MCEWAN I J. Androgens and androgen receptor:above and beyond[J]. Mol Cell Endocrinol, 2018, 465: 1–3. DOI: 10.1016/j.mce.2018.02.013 |
| [30] | ZHANG C X, YEH S, CHEN Y T, et al. Oligozoospermia with normal fertility in male mice lacking the androgen receptor in testis peritubular myoid cells[J]. Proc Natl Acad Sci U S A, 2006, 103(47): 17718–17723. DOI: 10.1073/pnas.0608556103 |
| [31] | IZAURRALDE E, KUTAY U, VON KOBBE C, et al. The asymmetric distribution of the constituents of the Ran system is essential for transport into and out of the nucleus[J]. EMBO J, 1997, 16(21): 6535–6547. DOI: 10.1093/emboj/16.21.6535 |
| [32] | DEPLANCKE B, ALPERN D, GARDEUX V. The genetics of transcription factor DNA binding variation[J]. Cell, 2016, 166(3): 538–554. DOI: 10.1016/j.cell.2016.07.012 |
| [33] | JIA J X, CUI C L, YAN X S, et al. Effects of testosterone on synaptic plasticity mediated by androgen receptors in male SAMP8 mice[J]. J Toxicol Environ Health A, 2016, 79(19): 849–855. DOI: 10.1080/15287394.2016.1193113 |
| [34] | GUO Z J, KARUNATILAKA K S, RUEDA D. Single-molecule analysis of protein-free U2-U6 snRNAs[J]. Nat Struct Mol Biol, 2009, 16(11): 1154–1159. DOI: 10.1038/nsmb.1672 |
| [35] | LEGRAIN P, SERAPHIN B, ROSBASH M. Early commitment of yeast pre-mRNA to the spliceosome pathway[J]. Mol Cell Biol, 1988, 8(9): 3755–3760. DOI: 10.1128/MCB.8.9.3755 |
| [36] | NEWBY M I, GREENBAUM N L. Sculpting of the spliceosomal branch site recognition motif by a conserved pseudouridine[J]. Nat Struct Biol, 2002, 9(12): 958–965. DOI: 10.1038/nsb873 |
| [37] | VALADKHAN S. snRNAs as the catalysts of pre-mRNA splicing[J]. Curr Opin Chem Biol, 2005, 9(6): 603–608. DOI: 10.1016/j.cbpa.2005.10.008 |



