抗生素的滥用严重危害人类与家畜的健康以及畜牧业的发展[1]。目前抗菌肽是最有潜力的抗生素替代物之一。根据来源通常可将抗菌肽(AMPs)分为以下几类,分别是来自昆虫、两栖动物、哺乳动物、细菌以及病毒的抗菌肽[2]。研究发现,抗菌肽具有广谱抗菌、抗病毒和抗癌活性等优点,还可以增强上皮伤口愈合而用于人类疾病的治疗[3-6]。抗菌肽很难产生耐药性,因为它以物理方式作用于细菌的细胞膜,通过破坏细胞膜导致细胞质溢出以快速杀死目标细菌,或者通过与细菌核糖体结合干扰DNA合成以达到杀菌作用[7-10]。但由于其在生物体中的含量很少,提取和合成过程复杂,因此合成的成本极高[11]。此外,许多体内的酶化学反应会造成抗菌肽的生物活性降低或消失,这些问题都阻碍了抗菌肽的应用。因此,有必要寻找或人工设计出具有低毒副作用,稳定性强,低成本和高抗菌特性的抗菌肽。
目前,通过肽序列模板全新设计抗菌肽,改变肽链的氨基酸序列和物理化学参数,可提高肽的抑菌活性,且降低毒副作用[12]。α-螺旋阳离子肽具有完整的疏水表面和亲水表面,是一种研究广泛的抗菌肽模型结构。疏水性对于抗菌肽的生物活性有重要影响,研究发现通过替换或增加肽序列中疏水性氨基酸具有改善抗菌肽生物活性的作用[13-14];疏水性可直接影响抗菌肽对细胞膜的透化作用,多项研究发现肽的脂质体渗透性和杀菌活性随着疏水性的增加而增加[15-17]。Zhu等[18]采用苯丙氨酸和亮氨酸分别取代第5和第9个脯氨酸后得到的序列TP(VRRFPWWWWWPFLRR-NH2)具有较好的抗菌活性。Hu等[19]通过研究异亮氨酸对线性禽类β-防御素-4(RL38)类似物的生物活性和肽膜相互作用的影响,发现用疏水性氨基酸替换后的肽GLI19具有更高的穿透生物膜活性和广谱抗菌活性。Chen等[20]用Leu替换Ala,通过在合理疏水值的范围内调节α-螺旋肽V13KL的疏水性使所得抗菌肽具有较高的细胞选择性。不同疏水性氨基酸还能通过对α-螺旋肽的结构产生不同程度的影响来增强或减弱抗菌肽的生物活性[21]。
本研究以GRX2RX3RX2RG[22]为模板设计了一系列肽(GW、GF、GV、GI、GA和GL),X代表Trp、Phe、Val、Ala、Leu和Ile,探讨不同疏水性氨基酸对α-螺旋抗菌肽生物学活性的影响以及其抑菌机制。利用圆二色谱法分析了α-螺旋肽的二级结构,并检测抗菌肽的抑菌活性、溶血活性、最小抑菌浓度以及盐离子稳定性。同时通过扫描电子显微镜和内膜通透性试验观察肽对E.coli ATCC 25922和S. aureus ATCC 29213形态的影响,探索抗菌肽的抑菌机制。本研究为高细胞选择性抗菌肽设计提供了新的设计方法,对抗菌肽产品的研发具有重要意义。
1 材料与方法 1.1 试验材料 1.1.1 肽的合成所有的肽均由吉尔生化公司(中国上海)合成,采用反相高效液相色谱纯化(纯度95%),电喷射质谱鉴定。将肽以2.56 mmol·L-1的浓度溶解于DI水中,-20 ℃储存。
1.1.2 菌株和试剂大肠杆菌ATCC 25922 (Escherichia coli ATCC 25922)、肠沙门菌血清型鼠伤寒沙门菌C7731(Salmonella enterica serovar Typhimurium C7731)、大肠杆菌UB1005 (Escherichia coli UB1005)、铜绿假单胞菌ATCC 27853 (Pseudomonas aeruginosa ATCC 27853)、鸡白痢沙门菌C7913(Salmonella pullorum C7913)、金黄色葡萄球菌ATCC 29213 (Staphylococcus aureus ATCC 29213)、表皮葡萄球菌ATCC 12228 (Staphylococcus epidermidis ATCC 12228)、枯草芽胞杆菌CMCC 63501 (Bacillus subtilis CMCC 63501)和金黄色葡萄球菌ATCC 43300(Salmonella aureus ATCC 43300)由东北农业大学兽医学院(哈尔滨)馈赠。
Mueller-Hinton肉汤(MHB)培养基(牛肉粉5 g·L-1,酪蛋白水解物17.5 g·L-1,可溶性淀粉1.5 g·L-1,pH=7.0±0.2),购自中国上海奥博星;氯化钠、氯化钾、氯化铵、氯化镁、氯化钙、氯化锌和氯化铁,中国Kermel化学试剂公司产品(全为分析级);十二烷基硫酸钠(SDS)、Triton X-100、N-苯基-1-萘胺(NPN)、3, 3′-二丙基硫代二羰基碘化物(diSC3-5)、HEPES、碘化丙啶(PI)和丙酮(分析级,99%),美国Sigma-Aldrich公司产品;乙醇(分析级,99%)、叔丁醇(分析级,99%)、戊二醛(合成级)和葡萄糖(分析级),中国致远化学试剂有限公司产品。
1.2 圆二色光谱(CD)分析通过圆二色光谱检测抗菌肽的二级结构[23]。首先将抗菌肽溶于10 mmol·L-1磷酸盐缓冲溶液(PBS)(pH=7.4)和50%三氟乙醇(TFE),使肽的浓度为150 μmol·L-1。依照已有的方法测量CD光谱来研究不同环境中肽的二级结构。并使用J-820分光偏振计(Jasco,Tokyo,Japan),在25 ℃下测量肽的CD光谱。以10 nm·min-1的扫描速度和190~250 nm的波长记录光谱。分别对每种肽进行三次扫描。然后将获得的CD光谱按以下等式转换为平均残基摩尔椭圆度:
θM=(θobs·1000)/(c·l·n)
其中θM代表残基摩尔椭圆度(°cm2·dmol-1),θobs为实测椭圆率(m°),c为肽浓度(mmol·L-1),l表示光径(mm),n表示氨基酸的数量。
1.3 溶血活性的测定采集新鲜健康的人血红细胞(hRBCs),以1 000 r·min-1离心5 min。用磷酸盐缓冲液(PBS)(pH=7.2)将红细胞洗三次,并重悬于PBS中。使用PBS稀释肽并与100 μL的hRBC样品混合,在37 ℃条件下温育1 h。然后将红细胞样品在4 ℃下以1 000 r·min-1离心5 min,并将上清液移至96孔微量滴定板。用酶标仪测定OD570 nm条件下的吸光值,以PBS孵育的hRBC作为阴性对照,0.1% Triton X-100作为阳性对照。溶血活性根据下面公式进行计算:溶血(%)=(OD测定值-OD阴性对照)/(OD阳性对照-OD阴性对照)×100%。
1.4 抗菌活性的测定将细菌于37 ℃生长过夜至对数中期,用MHB培养基稀释细菌使最终浓度范围为2×105~7×105 CFU·mL-1。将肽溶解在0.01%乙酸和0.2%牛血清白蛋白混合液中。然后使100 μL的细菌溶液与100 μL肽的MHB溶液在37 ℃下孵育18~24 h。进行三次独立试验,每个试验重复3次。以含有细菌的MHB溶液作为阳性对照,不含细菌的MHB溶液为阴性对照。阴性对照孔溶液保持清亮,与阳性对照孔相比,测试孔呈浑浊状,说明未抑制细菌生长;若无肉眼可见生长菌,则相应的药物浓度即为测定抗菌肽的最小抑菌浓度(minimal inhibitory concentration,MIC)。
1.5 盐离子稳定性的测定参考文献方法[24],将GV或蜂毒肽(melittin)与E. coli ATCC 25922和S.aureus ATCC 29213在不同盐离子溶液(分别为150 mmol·L-1 NaCl、4.5 mmol·L-1 KCl、6 μmol·L-1 NH4Cl、8 μmol·L-1 ZnCl2、1 mmol·L-1 MgCl2和4 μmol·L-1 FeCl3)中共同孵育[25]。按照“1.4”的方法测定在盐离子溶液中的MIC值。
1.6 扫描电子显微镜(FE-SEM)分析将处于生长对数期的E. coli ATCC 25922和S. aureus ATCC 29213以1 000 r·min-1离心10 min,用PBS洗涤两次,并重悬至OD600 nm为0.1~0.2。再将细菌与1×MIC浓度肽混匀后,以37 ℃孵育1 h。再将样品以5 000 r·min-1离心5 min,收集细菌沉淀。然后用PBS洗涤三次,在2.5%戊二醛中4 ℃固定过夜,分别用50%、70%、90%和100%乙醇溶液将细菌沉淀脱水10 min。脱水后,将干燥的细菌转移到100%乙醇和叔丁醇的混合物(1:1)中处理30 min,然后加入纯叔丁醇干燥样品。最后,在扫描电子显微镜(Hitachi S-4800,Japan)下观察样品。
1.7 内膜通透性的测定根据Chen等[26]的方法,通过测定细胞内β-半乳糖苷酶活性反映细胞内膜通透性的改变。ONPG是人工合成的β-半乳糖苷酶反应底物,本身无色,但抗菌肽引起内膜通透性增加,使ONPG进入到质膜内,在β-半乳糖苷酶的作用下,ONPG可降解为黄色的ONP,在420 nm下测定吸光度,颜色越深,表示通透性越高。将冻存于-20 ℃的细菌接种到2%乳糖的MHB中,37 ℃过夜培养,再转接到新的含2%乳糖的MHB中继续培养,待细菌达到指数生长期时,5 000 r·min-1离心5 min,收集细菌沉淀。用无菌PBS冲洗3遍,用含有1.5 mmol·L-1 ONPG的无菌PBS重悬细菌,调整细菌浓度至OD600 nm=0.05;取2 mL菌液加入到比色皿中,加入抗菌肽后,在420 nm条件下测定吸光度,每隔2 min测定一次数值,测定时间30 min。
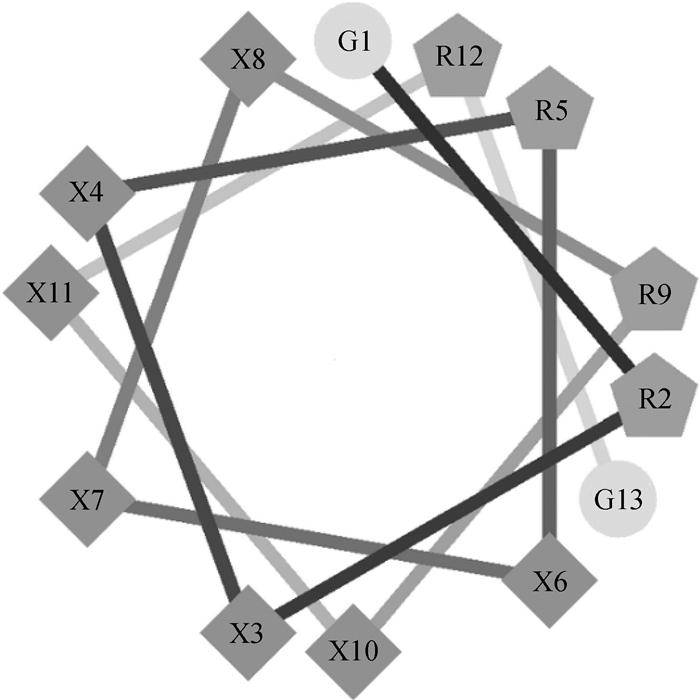
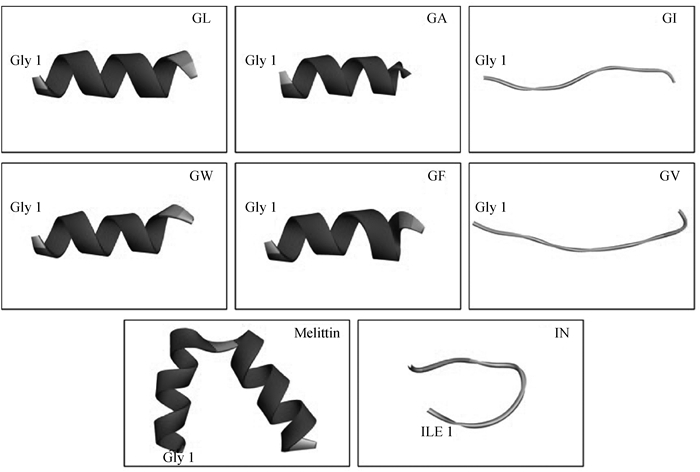
2 结果 2.1 抗菌肽的设计试验中所有的α-螺旋肽的设计结构和关键的物理化学参数如图 1、2和表 1所示。根据之前的研究[22],肽的对称性有利于肽的活性增强,笔者采用对称结构的α-螺旋肽GRX2RX3RX2RG作为模板设计了一系列含疏水氨基酸的肽。模板中的Arg是一种带有正电荷的碱性氨基酸,可与细菌表面的负电荷发生静电吸引作用。所有肽所带电荷数为+4。通过CCS计算出GW、GF、GI和GL的相对疏水力矩(μHrel)比较相近,而GV和GA显著小于其他肽[27]。根据保留时间,通过疏水性对肽进行分级:GI > GA > GL > GF > GV > GW。其中GI具有最强的疏水性。
|
图 1 α-螺旋肽的轮状图 Fig. 1 Helical wheel projections of the α-helix peptides |
|
图 2 α-螺旋抗菌肽的三维结构 Fig. 2 Three-dimensional structure projections of the α-helix antimicrobial peptides |
|
|
表 1 α-螺旋肽设计和关键物理化学参数 Table 1 α-helix peptides design and key physicochemical parameters |
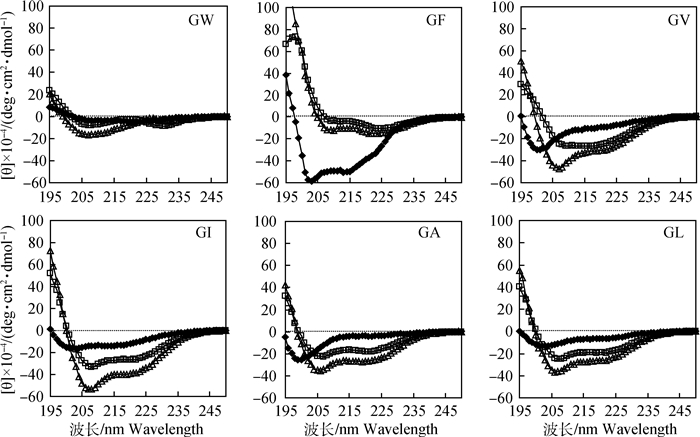
图 3为抗菌肽分别在10 mmol·L-1 PBS(pH 7.4)(◆)、30 mmol·L-1 SDS(□)和50%TFE(Δ)中的CD光谱。所有肽在PBS中均不呈现α螺旋二级结构。GF、GI、GA和GL的CD光谱在208和222 nm附近出现两个特征性的最小峰值,说明在细胞膜模拟环境中均保持α螺旋结构,而在PBS中呈现无规卷曲的形态。GV在PBS和SDS中呈无规卷曲状,但在TFE中呈现出明显的α螺旋结构。而GW在三种溶液中均不呈现α螺旋结构。
|
◆. 10 mmol·L-1 PBS(pH 7.4); □. 30 mmol·L-1 SDS; Δ. 50%TFE 图 3 α-螺旋抗菌肽的CD光谱 Fig. 3 The CD spectra of the α-helix antimicrobial peptides |
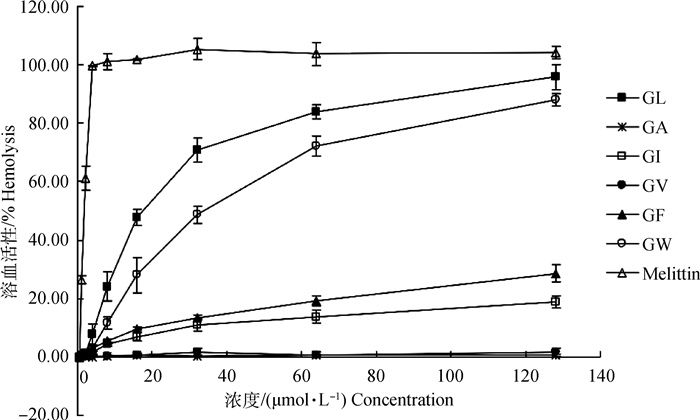
图 4显示了所有α-螺旋肽对hRBC的溶血活性。可以看出,在浓度为128 μmol·L-1时,没有检测到GA和GV的溶血活性,GF和GI溶血率在20%左右。而在浓度为16 μmol·L-1时,GL溶血率为50%左右,GW溶血率也几乎达到30%,在浓度为128 μmol·L-1时溶血率都超过80%,说明GL和GW溶血活性较高。
|
图 4 α-螺旋肽对hRBCs的溶血活性 Fig. 4 Hemolytic activity of the α-helix peptides against hRBCs |
试验结果表明所有抗菌肽对革兰阳性细菌和革兰阴性细菌均有不同程度的抑菌活性。如表 2所示,GL对9种菌的MIC值在2~4 μmol·L-1之间,GF和GV的MIC值在2~8 μmol·L-1之间。表明GF、GV和GL具有明显的抗革兰阴性和革兰阳性细菌的作用。根据几何平均治疗指数TI(GM/MHB)结果发现GV的TI值(69.1)最高。因此,在6种肽中GV的细胞选择性最高。
|
|
表 2 α-螺旋肽对革兰阴性和革兰阳性细菌菌株的抑菌活性与溶血活性 Table 2 Antibacterial activity and hemolysis of the α-helix peptides against gram-negative and gram-positive bacterial strains |
检测了在不同盐离子下抗菌肽GV的抗菌效率,如表 3所示。在Ca2+、Na+和Mg2+中,GV对E.coli ATCC 25922的抗菌活性均有降低。而在NH4+、Zn2+和Fe3+中,GV对E.coli ATCC 25922的抗菌活性没有变化,但在所有盐离子中GV对革兰阳性菌株S. aureus ATCC 29213的抗菌效率均有下降。
|
|
表 3 α-螺旋肽的盐离子稳定性 Table 3 MIC values of α-helix peptides containing heptad repeats in the presence of physiological salts |
图 5展示了在扫描电子显微镜下观察到的细菌形态。在对照组中(图 5A和D)E.coli ATCC 25922和S.aureus ATCC 29213的表面完整,但在用2 μmol·L-1 GV和8 μmol·L-1 Melittin处理后,细菌表面均出现与Melittin处理时相似的皱缩形态,同时S. aureus ATCC 29213细菌膜破裂,并且细胞内容物流出。该结果说明抗菌肽GV能够作用于细菌细胞膜。

|
图 5 GV和蜂毒肽处理的大肠杆菌25922和金黄色葡萄球菌29213的扫描电子显微镜照片 Fig. 5 Scanning electron micrographs of E. coli 25922 and S. aureus 29213 treated with GV and melittin |
图 6显示,抗菌肽GV在1~128 μmol·L-1浓度之间均以时间依赖的形式引起E.coli ATCC 25922内膜通透性增加,且当肽浓度为8~32 μmol·L-1时,在30 min后可迅速增加内膜的通透性。
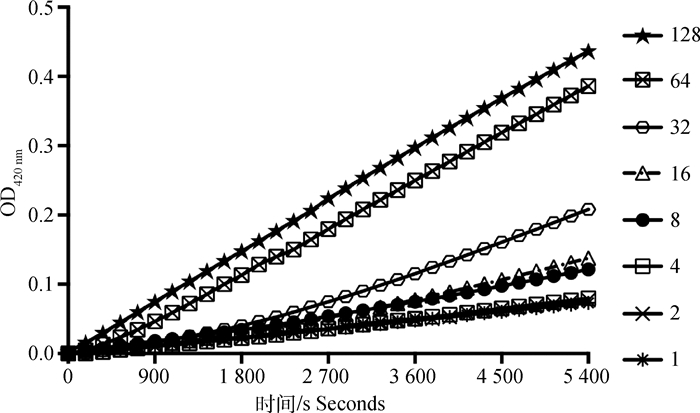
|
利用E. coli ATCC 25922胞内β-半乳糖苷酶水解ONPG的方法测定内膜通透性,抗菌肽处理的终浓度分别为1、2、4、8、16、32、64、128 μmol·L-1,水解产物在420 nm条件下测定吸光度 Inner membrane permeability was determined by hydrolysis of ONPG with E.coli ATCC 25922 intracellular β-galactosidase. The final concentrations of antimicrobial peptide were 1, 2, 4, 8, 16, 32, 64, 128 μmol·L-1. The absorbance of hydrolysates was detected at 420 nm 图 6 GV的内膜通透性 Fig. 6 Inner membrane permeability of GV |
α-螺旋抗菌肽在动物体内分布广泛。其长度短、结构简单、易于分析,因此成为抗菌肽结构功能关系研究领域的重要对象[28]。作者全新设计了一系列含有疏水氨基酸的α-螺旋抗菌肽。研究表明具有α螺旋结构的抗菌肽具有有效破坏和解离细菌的特性,当肽与细菌细胞膜结合时,α螺旋结构使细胞膜形成孔洞并且使细胞质溢出,从而导致细菌死亡[29-32]。α螺旋结构对于保持抗菌肽的两亲性以及抗菌活性有着重要作用[33-34]。本研究通过CD光谱试验评估了不同疏水氨基酸对抗菌肽在不同模拟环境下的二级结构的影响。TFE通常用来模拟真核细胞疏水性环境,而SDS用来模拟细菌细胞膜环境。结果表明疏水氨基酸的种类可能是影响抗菌肽二级结构的原因。
抗菌肽的疏水性是影响溶血的重要因素,溶血活性随着肽的疏水性增加而增加[34]。研究发现通过用亲水性氨基酸取代Leu可以降低肽的溶血或细胞毒性[35]。在本研究中,GL具有与GV同样高的抗微生物活性,但其溶血活性在20 μmol·L-1时高达50%。从结果中发现GV和GL之间的重要区别在于平均疏水值(表 1)。因此,GL过高的疏水性可能是产生高溶血活性的原因。平均疏水性最低的GA几乎没有溶血活性,而GV平均疏水性虽高,但是它的相对疏水力矩较低,说明其两亲性较弱,这也表明了肽的两亲性对其溶血活性的高低有关键作用[36]。
疏水性越强抗菌肽的生物活性越高,研究表明增强肽的疏水性可通过增加肽对膜的穿透速率提高肽的活性[15, 37]。本研究发现,与其他α-螺旋肽相比,GF、GV和GL具有更高的抗菌活性,可能由于GF、GV和GL具有较高的平均疏水值。富含Val的GV抗菌活性较高,并且无溶血活性,说明Val对于提高α-螺旋肽的生物活性有一定的作用。不同的疏水氨基酸会影响肽的疏水值,在一定范围内提高疏水性可提高抗菌肽的细胞选择性。
在体外具有良好抗菌活性的抗菌肽进入机体后可能会受到盐离子的影响,所以进一步评价了α-螺旋抗菌肽在盐离子中的稳定性。GV对革兰阴性菌株E. coli ATCC 25922的抑菌活性在Ca2+中有所降低,这可能由于过量的二价离子Mg2+和Ca2+参与了阳离子抗菌肽与细菌膜竞争的结合作用,阻碍了抗菌肽进入细胞膜的过程[38]。同时,Na+存在时GV的抗菌活性有所降低,这可能因为Na+阻碍肽的阳离子电荷与细胞膜静电的相互作用[39]。GV对E. coli ATCC 25922的抗菌活性在8 μmol·L-1 Zn2+中没有变化,但在1 mmol·L-1 Mg2+和2 mmol·L-1 Ca2+中降低,可能是高浓度二价阳离子使肽的活性受到了抑制[40]。在所有盐离子溶液中,GV对E. coli ATCC 25922抑菌活性更加稳定。
作者进一步分析了抗菌肽GV抑菌机制,通过扫描电子显微镜(FE-SEM)检测了抗菌肽GV作用细菌细胞后细菌膜的变化情况。结果表明,对照组的细菌表面光滑,细胞表面完好;在GV处理后细胞膜表面出现皱缩,并且GV对 S. aureus 29213的细胞膜穿透力比对E. coli 25922的更强,这可能是由于抗菌肽对革兰阴性菌和革兰阳性菌的作用机制存在差异,作用于革兰阴性菌时主要是抗菌肽的正电荷与脂多糖和荚膜多糖结合,而对革兰阳性菌的作用是通过与带负电荷的磷壁酸结合[41-42]。α-螺旋肽对细胞膜的穿透力主要依靠螺旋结构的双层破坏性质以及螺旋截面与疏水性脂肪酰基链和极性端基团的相互作用[43]。因此,GV通过其螺旋结构以及疏水性基团进入E. coli ATCC 25922和S. aureus ATCC 29213细菌细胞膜使细胞内容物流出而抑制或杀灭细菌。
同时,抗菌肽对内膜的通透性也是其发挥溶解细胞膜机制的特征。细菌内膜或质膜对于维持细菌生命活动非常重要,当细菌内膜受到破坏时,生长会受到抑制,甚至死亡。这主要是由于内膜通透性的改变导致细胞膜电势的破坏。通过测定内膜通透性表明抗菌肽GV能够以时间和剂量依赖的方式破坏细菌内膜,进一步说明GV通过破坏细菌的膜结构发挥了抗菌作用。
4 结论通过溶血、抗菌活性检测及电镜观察表明,不同疏水性氨基酸对α-螺旋肽的生物学活性有显著影响。抗菌肽GV具有高细胞选择性并能通过穿透革兰阴性菌和革兰阳性菌的细胞膜抑制细菌生长。以上结果表明抗菌肽GV有潜力成为一种新型抗菌药物。
| [1] | BASSEGODA A, IVANOVA K, RAMON E, et al. Strategies to prevent the occurrence of resistance against antibiotics by using advanced materials[J]. Appl Microbiol Biotechnol, 2018, 102(5): 2075–2089. DOI: 10.1007/s00253-018-8776-0 |
| [2] | XIA X J, CHENG L K, ZHANG S P, et al. The role of natural antimicrobial peptides during infection and chronic inflammation[J]. Antonie van Leeuwenhoek, 2018, 111(1): 5–26. DOI: 10.1007/s10482-017-0929-0 |
| [3] | LIANG X, NONG X H, HUANG Z H, et al. Antifungal and antiviral cyclic peptides from the deep-sea-derived fungus Simplicillium obclavatum EIODSF 020[J]. J Agric Food Chem, 2017, 65(25): 5114–5121. DOI: 10.1021/acs.jafc.7b01238 |
| [4] | BOTO A, DE LA LASTRA J M P, GONZÁLEZ C C. The road from host-defense peptides to a new generation of antimicrobial drugs[J]. Molecules, 2018, 23(2): E311. DOI: 10.3390/molecules23020311 |
| [5] | KUMAR P, KIZHAKKEDATHU J N, STRAUS S K. Antimicrobial peptides:diversity, mechanism of action and strategies to improve the activity and biocompatibility in vivo[J]. Biomolecules, 2018, 8(1): E4. DOI: 10.3390/biom8010004 |
| [6] | AGHAZADEH H, MEMARIANI H, RANJBAR R, et al. The activity and action mechanism of novel short selective LL-37-derived anticancer peptides against clinical isolates of Escherichia coli[J]. Chem Biol Drug Des, 2018. DOI: 10.1111/cbdd.13381 |
| [7] | BROGDEN K A. Antimicrobial peptides:pore formers or metabolic inhibitors in bacteria?[J]. Nat Rev Microbiol, 2005, 3(3): 238–250. DOI: 10.1038/nrmicro1098 |
| [8] | CHAN D I, PRENNER E J, VOGEL H J. Tryptophan- and arginine-rich antimicrobial peptides:structures and mechanisms of action[J]. Biochim Biophys Acta - Biomembr, 2006, 1758(9): 1184–1202. DOI: 10.1016/j.bbamem.2006.04.006 |
| [9] | DIAS S A, FREIRE J M, PÉREZ-PEINADO C, et al. New potent membrane-targeting antibacterial peptides from viral capsid proteins[J]. Front Microbiol, 2017, 8: 775. DOI: 10.3389/fmicb.2017.00775 |
| [10] | GRAF M, MARDIROSSIAN M, NGUYEN F, et al. Proline-rich antimicrobial peptides targeting protein synthesis[J]. Nat Prod Rep, 2017, 34(7): 702–711. DOI: 10.1039/C7NP00020K |
| [11] | LI J G, KOH J J, LIU S P, et al. Membrane active antimicrobial peptides:translating mechanistic insights to design[J]. Front Neurosci, 2017, 11: 73. |
| [12] | CAO X Q, WANG Y, WU C Y, et al. Cathelicidin-OA1, a novel antioxidant peptide identified from an amphibian, accelerates skin wound healing[J]. Sci Rep, 2018, 8(1): 943. DOI: 10.1038/s41598-018-19486-9 |
| [13] | WIRADHARMA N, SNG M Y S, KHAN M, et al. Rationally designed α-helical broad-spectrum antimicrobial peptides with idealized facial amphiphilicity[J]. Macromol Rapid Commun, 2013, 34(1): 74–80. DOI: 10.1002/marc.v34.1 |
| [14] | RODRíGUEZ A, VILLEGAS E, SATAKE H, et al. Amino acid substitutions in an alpha-helical antimicrobial arachnid peptide affect its chemical properties and biological activity towards pathogenic bacteria but improves its therapeutic index[J]. Amino Acids, 2011, 40(1): 61–68. |
| [15] | TAN J J, HUANG J F, HUANG Y B, et al. Effects of single amino acid substitution on the biophysical properties and biological activities of an amphipathic α-helical antibacterial peptide against Gram-negative bacteria[J]. Molecules, 2014, 19(8): 10803–10817. DOI: 10.3390/molecules190810803 |
| [16] | STRANDBERG E, ZERWECK J, HORN D, et al. Influence of hydrophobic residues on the activity of the antimicrobial peptide magainin 2 and its synergy with PGLa[J]. J Pept Sci, 2015, 21(5): 436–445. DOI: 10.1002/psc.v21.5 |
| [17] | RINGSTAD L, NORDAHL E A, SCHMIDTCHEN A, et al. Composition effect on peptide interaction with lipids and bacteria:Variants of C3a peptide CNY21[J]. Biophys J, 2007, 92(1): 87–98. DOI: 10.1529/biophysj.106.088161 |
| [18] | ZHU W L, LAN H L, PARK Y, et al. Effects of Pro → peptoid residue substitution on cell selectivity and mechanism of antibacterial action of tritrpticin-amide antimicrobial peptide[J]. Biochemistry, 2006, 45(43): 13007–13017. DOI: 10.1021/bi060487+ |
| [19] | HU W N, JIAO W J, MA Z, et al. The influence of isoleucine and arginine on biological activity and peptide- membrane interactions of antimicrobial peptides from the bactericidal domain of AvBD4[J]. Protein Pept Lett, 2013, 20(11): 1189–1199. DOI: 10.2174/09298665113209990042 |
| [20] | CHEN Y X, GUARNIERI M T, VASIL A I, et al. Role of peptide hydrophobicity in the mechanism of action of α-helical antimicrobial peptides[J]. Antimicrob Agents Chemother, 2007, 51(4): 1398–1406. DOI: 10.1128/AAC.00925-06 |
| [21] | LEE E, SHIN A, JEONG K W, et al. Role of phenylalanine and valine10 residues in the antimicrobial activity and cytotoxicity of piscidin-1[J]. PLoS One, 2014, 9(12): e114453. DOI: 10.1371/journal.pone.0114453 |
| [22] | DONG N, ZHU X, CHOU S L, et al. Antimicrobial potency and selectivity of simplified symmetric-end peptides[J]. Biomaterials, 2014, 35(27): 8028–8039. DOI: 10.1016/j.biomaterials.2014.06.005 |
| [23] | BALAKRISHNAN V S, VAD B S, OTZEN D E. Novicidin's membrane permeabilizing activity is driven by membrane partitioning but not by helicity:A biophysical study of the impact of lipid charge and cholesterol[J]. Biochim Biophys Acta - Prot Proteom, 2013, 1834(6): 996–1002. DOI: 10.1016/j.bbapap.2013.03.025 |
| [24] | ZHU X, SHAN A S, MA Z, et al. Bactericidal efficiency and modes of action of the novel antimicrobial peptide T9W against Pseudomonas aeruginosa[J]. Antimicrob Agents Chemother, 2015, 59(6): 3008–3017. DOI: 10.1128/AAC.04830-14 |
| [25] | MAISETTA G, DI LUCA M, ESIN S, et al. Evaluation of the inhibitory effects of human serum components on bactericidal activity of human beta defensin 3[J]. Peptides, 2008, 29(1): 1–6. DOI: 10.1016/j.peptides.2007.10.013 |
| [26] | CHEN A M, SHI Q S, OUYANG Y S, et al. Effect of Ce3+ on membrane permeability of Escherichia coli cell[J]. J Rare Earths, 2012, 30(9): 947–951. DOI: 10.1016/S1002-0721(12)60159-8 |
| [27] | LIU Y F, XIA X, XU L, et al. Design of hybrid β-hairpin peptides with enhanced cell specificity and potent anti-inflammatory activity[J]. Biomaterials, 2013, 34(1): 237–250. DOI: 10.1016/j.biomaterials.2012.09.032 |
| [28] | GIANGASPERO A, SANDRI L, TOSSI A. Amphipathic α helical antimicrobial peptides:a systematic study of the effects of structural and physical properties on biological activity[J]. FEBS J, 2001, 268(21): 5589–5600. |
| [29] | SONG R, WEI R B, LUO H Y, et al. Isolation and characterization of an antibacterial peptide fraction from the pepsin hydrolysate of half-fin anchovy (Setipinna taty)[J]. Molecules, 2012, 17(3): 2980–2991. DOI: 10.3390/molecules17032980 |
| [30] | WEI L, YANG J J, HE X Q, et al. Structure and function of a potent lipopolysaccharide-binding antimicrobial and anti-inflammatory peptide[J]. J Med Chem, 2013, 56(9): 3546–3556. DOI: 10.1021/jm4004158 |
| [31] | CHEN C X, HU J, ZHANG S Z, et al. Molecular mechanisms of antibacterial and antitumor actions of designed surfactant-like peptides[J]. Biomaterials, 2012, 33(2): 592–603. DOI: 10.1016/j.biomaterials.2011.09.059 |
| [32] | ZHANG L J, ROZEK A, HANCOCK R E W. Interaction of cationic antimicrobial peptides with model membranes[J]. J Biol Chem, 2001, 276(38): 35714–35722. DOI: 10.1074/jbc.M104925200 |
| [33] | HUANG Y B, WANG X F, WANG H Y, et al. Studies on mechanism of action of anticancer peptides by modulation of hydrophobicity within a defined structural framework[J]. Mol Cancer Ther, 2011, 10(3): 416–426. DOI: 10.1158/1535-7163.MCT-10-0811 |
| [34] | WANG J J, CHOU S L, XU L, et al. High specific selectivity and membrane-active mechanism of the synthetic centrosymmetric α-helical peptides with Gly-Gly pairs[J]. Sci Rep, 2015, 5: 15963. DOI: 10.1038/srep15963 |
| [35] | KIM S, HYUN S, LEE Y, et al. Nonhemolytic cell-penetrating peptides:site specific introduction of glutamine and lysine residues into the α-helical peptide causes deletion of its direct membrane disrupting ability but retention of its cell penetrating ability[J]. Biomacromolecules, 2016, 17(9): 3007–3015. DOI: 10.1021/acs.biomac.6b00874 |
| [36] | PATHAK N, SALAS-AUVERT R, RUCHE G, et al. Comparison of the effects of hydrophobicity, amphiphilicity, and α-helicity on the activities of antimicrobial peptides[J]. Proteins, 1995, 22(2): 182–186. DOI: 10.1002/(ISSN)1097-0134 |
| [37] | KHARA J S, LIM F K, WANG Y, et al. Designing α-helical peptides with enhanced synergism and selectivity against Mycobacterium smegmatis:discerning the role of hydrophobicity and helicity[J]. Acta Biomater, 2015, 28: 99–108. DOI: 10.1016/j.actbio.2015.09.015 |
| [38] | HUANG J F, HAO D M, CHEN Y, et al. Inhibitory effects and mechanisms of physiological conditions on the activity of enantiomeric forms of an α-helical antibacterial peptide against bacteria[J]. Peptides, 2011, 32(7): 1488–1495. DOI: 10.1016/j.peptides.2011.05.023 |
| [39] | AROURI A, DATHE M, BLUME A. The helical propensity of KLA amphipathic peptides enhances their binding to gel-state lipid membranes[J]. Biophys Chem, 2013, 180-181: 10–21. DOI: 10.1016/j.bpc.2013.05.003 |
| [40] | AQUILA M, BENEDUSI M, KOCH K W, et al. Divalent cations modulate membrane binding and pore formation of a potent antibiotic peptide analog of alamethicin[J]. Cell Calcium, 2013, 53(3): 180–186. DOI: 10.1016/j.ceca.2012.11.012 |
| [41] | KOO Y S, KIM J M, PARK I Y, et al. Structure-activity relations of parasin I, a histone H2A-derived antimicrobial peptide[J]. Peptides, 2008, 29(7): 1102–1108. DOI: 10.1016/j.peptides.2008.02.019 |
| [42] | SCHIBLI D J, EPAND R F, VOGEL H J, et al. Tryptophan-rich antimicrobial peptides:comparative properties and membrane interactions[J]. Biochem Cell Biol, 2002, 80(5): 667–677. DOI: 10.1139/o02-147 |
| [43] | MARQUETTE A, BECHINGER B. Biophysical investigations elucidating the mechanisms of action of antimicrobial peptides and their synergism[J]. Biomolecules, 2018, 8(2): 18. DOI: 10.3390/biom8020018 |



