2. 农业部动物疾病临床诊疗技术重点试验室, 呼和浩特 010018
2. Key Laboratory of Clinical Diagnosis and Treatment Technology in Animal Disease of Ministry of Agriculture, Hohhot 010018, China
近年来,在畜牧业生产中抗生素一直被用于预防动物疾病和促进动物的生长[1]。然而,由于细菌对抗生素耐药性负面影响的不断增加[2],寻找替代抗生素的物质已经成为研究热点。而目前的研究显示,通过免疫调节提高畜禽抗病力不仅能够促进动物健康和生产性能,还可以减少畜牧业生产中抗生素的使用[3-6]。
β-防御素是一种由38~42个氨基酸组成,且存在于许多脊椎动物体内的阳离子抗菌肽[7],其在先天和适应性免疫方面发挥关键作用,能够杀死各种病原体,包括细菌、真菌、病毒和寄生虫。此外,β-防御素还是免疫细胞的趋化性引诱剂,能够参与免疫调节[8]。研究显示,防御素可以通过化学方法合成[9-10]。然而,由于化学合成肽的高成本,通过膳食调节诱导防御素表达可能是更有效的替代方法。以往的研究表明,益生菌、灵芝菇和脂多糖等均可以诱导人、大鼠和母鸡体内防御素的表达,并增强机体对疾病的抵抗力[11-13]。因此,选择一种安全有效的诱导剂来诱导防御素的表达已经成为控制和预防疾病的良好办法。而β-葡聚糖是一种广泛存在于细菌、真菌、藻类和植物中的多糖,其因能够增强免疫力、抗肿瘤、抗菌、抗病毒、促进伤口愈合以及刺激先天和适应性免疫反应而被关注[14-15]。
尽管β-葡聚糖已经被证明能够诱导虹鳟鱼、大西洋白姑鱼和肉鸡体内防御素的表达[16-18],但关于β-葡聚糖对反刍动物瘤胃上皮细胞内防御素表达影响的机制尚未见相关报道。Dectin-1是一种C型凝集素受体,可独特地识别在大多数真菌表面上表达的β-葡聚糖,并且在对许多真菌物种的宿主防御中起到非冗余作用[19-21]。TLR-2作为一种天然的免疫细胞受体能够识别几种病原体,包括细菌肽聚糖、脂蛋白和酵母多糖,从而介导相关免疫因子的表达和相应的免疫应答反应[22-23]。而最近的报道显示,β-葡聚糖在人巨噬细胞和角膜上皮细胞中能够通过TLR-2和Dectin-1受体诱导TNF-α的产生[23-25]。因此,本研究在证明β-葡聚糖能够诱导ORECs内SBD-1的表达基础上[26],进一步探讨了膜受体Dectin-1和TLR-2在β-葡聚糖诱导SBD-1表达过程中的参与情况,为更好地开发和利用β-葡聚糖制剂提供理论基础。
1 材料与方法 1.1 主要仪器与试剂CO2培养箱(Thermo,USA)、显微成像系统(CKX41,Olympus)、多功能酶标仪(SynergyTM H4,Biotek)、实时荧光定量PCR仪(VIIA7,ABI)、激光共聚焦显微镜(LSM 800, Zeiss, Germany)、AxyPrep总RNA小量制备试剂盒(AP-MN-MS-RNA-250,USA)、TaKaRa反转录试剂盒(RR047A,Japan)、TaKaRa荧光定量PCR酶(RR820A,Japan)、TaKaRa的PCR试剂盒(RR901A,Japan)、武汉新启迪生物公司的绵羊防御素β1(DEFβ1)ELISA试剂盒(ELA06599Sh,China)、Thermo公司BCA测定试剂盒(23250,USA)。
1.2 ORECs传代培养ORECs由本试验室进行原代培养后经纯化和鉴定冻存保留。将冷冻的ORECs在37 ℃下解冻,并用DMEM/F12以1 200×g离心6 min进行洗涤。之后用含20%胎牛血清、200 μg·mL-1青霉素、100 μg·mL-1链霉素、50 μg·mL-1庆大霉素、2.5 μg·mL-1两性霉素、2 μg·mL-1胰岛素-转铁蛋白-硒添加剂、0.1 mol·L-1 β-巯基乙醇、2 mol·L-1L-谷氨酰胺的DMEM/F12液体培养基于37 ℃、5% CO2培养箱中静置培养。在培养瓶中达到85%~95%后将细胞进行传代培养,传于6孔板用于后续的细胞刺激试验。
1.3 引物设计本试验所有引物均由生工生物工程(上海)股份有限公司设计和合成(表 1)。
|
|
表 1 引物序列 Table 1 Primer sequences used in this study |
ORECs总RNA的提取按照RNA提取试剂盒操作,而后将提取的总RNA按照TaKaRa的去除基因组DNA反转录试剂盒进行反转录反应。首先为了去除基因组DNA,将6.5 μL RNA、0.5 μL RNase free dH2O、1.0 μL gDNAEraser和2.0 μL 5×g DNA混合后于42 ℃温育2 min。接下来,将10 μL上述反应液、4.0 μL RNase free dH2O、4.0 μL 5×Prime Script Buffer 2、1.0 μL PrimeScript RT Enzyme Mix I、1.0 μL RT Primer Mix混合后于37 ℃ 15 min,85 ℃ 5 s进行反转录反应,并将得到的cDNA于-20 ℃保存备用。
1.5 qPCR方法检测SBD-1的表达以反转录得到的cDNA为模板,按照SYBR Green Ⅱ荧光染料说明书进行qPCR反应,每20 μL反应物含有:SYBR Premin Ex Taq(2×)10 μL,正向和反向引物(10 μmol·L-1)各0.8 μL,cDNA模板2 μL,ddH2O 6.4 μL。反应程序:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火34 s,45个循环;熔解程序:95 ℃ 5 s;60 ℃ 30 s;95 ℃ 15 s,每个样品分别做5个重复。使用2-ΔΔCt方法计算mRNA的相对表达量。
1.6 ELISA方法检测SBD-1的表达收集细胞培养上清液,采用绵羊防御素β1(DEFβ1)ELISA试剂盒,按其说明书进行操作,然后用Synergy H4 Hybrid酶标仪检测各样品OD值(450 nm)。
1.7 ORECs中Dectin-1的表达检测 1.7.1 免疫组化方法检测Dectin-1在绵羊瘤胃组织内表达绵羊瘤胃组织的免疫组织化学染色按照试剂盒说明书进行操作,一抗为兔抗小鼠Dectin-1多克隆抗体(ab140039,Abcam,UK),对照组一抗用同型对照IgG抗体代替(ab171870,Abcam,UK)。最后经DAB显色、苏木精复染、脱水、透明和中性树胶封片,光镜观察和照相。
1.7.2 PCR方法检测Dectin-1在ORECs表达以反转录得到的cDNA为模板,目的基因Dectin-1和内参基因β-actin的PCR反应按照TaKaRa PCR试剂盒说明书进行操作。反应完成后将PCR产物经1%琼脂糖凝胶电泳检测。
1.7.3 免疫荧光方法检测Dectin-1在ORECs表达细胞经4%多聚甲醛固定20~30 min, 用PBS洗涤6次,0.5% Triton X-100通透20 min,并在室温下用5%的BSA封闭1 h,然后加入稀释好的一抗Dectin-1湿盒内4 ℃孵育过夜。PBS(含0.25%吐温)洗3次,然后加上相对应的二抗孵育2 h洗涤,用DAPI(1 μg·mL-1)对切片进行核染色。在激光共聚焦显微镜下获得图像(LSM 800, Zeiss, Oberkochen, Germany)。
1.7.4 Western blot方法检测Dectin-1在ORECs表达根据RIPA裂解液试剂盒说明书(碧云天)提取ORECs的总蛋白,并使用BCA测定试剂盒测量蛋白质浓度。用10%聚丙烯酰胺凝胶电泳(PAGE)分离蛋白质,然后将蛋白转移至聚偏氟乙烯膜。膜转移后,将膜在5%脱脂奶粉中封闭2 h,并根据制造商的说明与Dectin-1抗体(1:750)和β-actin抗体(1:1 000)4 ℃孵育过夜。经TBST洗涤后,将膜与适当的二抗孵育。最后,使用信号化学发光检测系统(Chem Studio,GER)对膜进行可视化。通过使用Image-Pro Plus 6.0软件分析每个条带的光密度。
1.8 Dectin-1在β-葡聚糖诱导SBD-1表达中的作用 1.8.1 β-葡聚糖刺激ORECs后检测Dectin-1的表达变化为了检测Dectin-1的表达变化,将上皮细胞分为空白对照组和β-葡聚糖刺激组。刺激组用浓度为10 μg·mL-1的β-葡聚糖进行刺激,对照组用基础培养基DMEM/F12代替β-葡聚糖,刺激2或4 h后提取各组细胞总RNA和总蛋白,分别用qPCR和Western blot检测Dectin-1的表达变化。
1.8.2 阻断Dectin-1后检测β-葡聚糖诱导SBD-1的表达变化为了检测Dectin-1在β-葡聚糖诱导SBD-1表达过程中的作用,用不同浓度的Dectin-1阻断剂昆布多糖(10、50、100、200、500 μg·mL-1)对ORECs进行预处理30 min,再用10 μg·mL-1的β-葡聚糖刺激ORECs作为试验组。同时设置阴性对照组:仅用昆布多糖处理,而不添加β-葡聚糖的细胞;阳性对照组:仅用β-葡聚糖而不用昆布多糖处理的细胞;空白对照组:未接受任何处理的细胞。而后,提取各组细胞总RNA并收集上清,分别用qPCR和ELISA检测SBD-1的表达变化。
1.9 TLR-2在β-葡聚糖诱导SBD-1表达中的作用 1.9.1 β-葡聚糖刺激ORECs后检测TLR-2的表达变化将细胞分为β-葡聚糖刺激组和未刺激组,以检测TLR-2的表达变化。刺激组用浓度为10 μg·mL-1的β-葡聚糖进行刺激,不加任何处理的细胞作为对照组。刺激2或4 h后提取各组细胞总RNA和总蛋白,分别用qPCR和Western blot检测TLR-2的表达变化。
1.9.2 阻断TLR-2后检测β-葡聚糖诱导SBD-1的表达变化为了研究TLR-2在β-葡聚糖诱导SBD-1表达过程中的作用,用不同浓度(0.1、1、10 μg·mL-1)的TLR-2特异性封闭抗体处理ORECs 30 min,然后用10 μg·mL-1的β-葡聚糖刺激细胞作为试验组,仅用β-葡聚糖刺激的细胞作为阳性对照组,用同型IgG抗体预处理后用β-葡聚糖刺激的细胞作为阴性对照组,未做任何处理的细胞作为空白对照组,刺激2或4 h后提取各组细胞总RNA并收集细胞培养上清液,分别用qPCR和ELISA检测SBD-1的表达变化。
1.10 统计分析使用GraphPad Prism软件对数据进行绘图。所有数据表示为至少3个独立试验的“平均值±标准差”。数据采用SPSS 20.0软件进行独立样本T检验和单因素方差分析(one-way ANOVA)。统计学显著性设定在P < 0.05水平。
2 结果 2.1 Dectin-1在ORECs内的表达检测结果为了检测Dectin-1是否在ORECs中表达,本研究通过免疫组化、RT-PCR、免疫荧光和Western blot 4种方法进行了检测。首先用抗Dectin-1抗体和同型对照抗体对绵羊瘤胃组织制作的石蜡切片进行免疫组化染色,结果发现,Dectin-1的棕黄色免疫阳性信号主要分布在黏膜上皮的棘细胞层和基底层,但以基底层为主,但同型对照并未出现阳性信号(图 1A)。其次,为了进一步了解Dectin-1在ORECs内的表达情况,本研究通过RT-PCR方法获得长度约为163 bp的Dectin-1片段(图 1B)。免疫荧光结果显示,ORECs表面有红色的免疫阳性信号(图 1C)。最后,通过Western blot检测出约28 ku的蛋白条带(图 1D)。本研究结果表明ORECs表达Dectin-1。
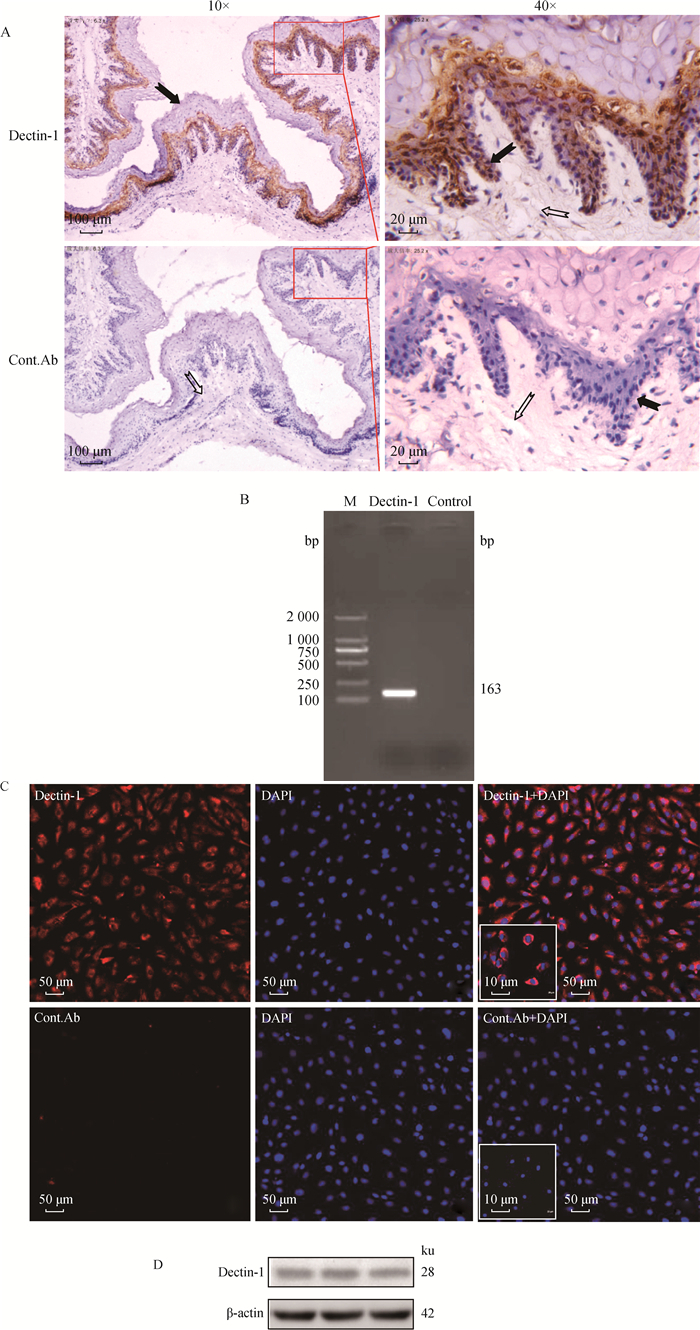
|
A.免疫组织化学结果:实心箭头表示上皮层, 空心箭头表示固有层; B. Dectin-1 PCR产物琼脂凝胶电泳图; C.免疫荧光结果; D. Western blot结果 A. Immunohistochemical results: Solid arrows indicate the epithelial layer, hollow arrows indicate the lamina propria; B. The agarose gel electrophoresis of amplified products of Dectin-1 by PCR; C. Immunofluorescence results; D. Western blot results 图 1 Dectin-1在ORECs内表达的鉴定结果 Fig. 1 Identification results of Dectin-1 expression in ORECs |
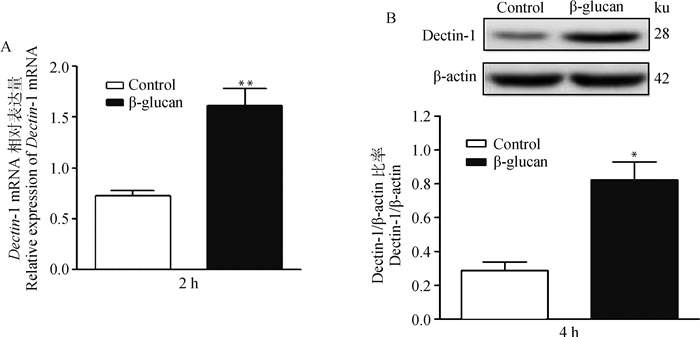
为了检测Dectin-1在β-葡聚糖诱导SBD-1表达过程中可能的作用,用β-葡聚糖刺激ORECs,并通过qPCR和Western blot检测Dectin-1的表达情况。结果表明,β-葡聚糖刺激ORECs 2和4 h后Dectin-1的mRNA表达极显著增加(图 1A,P < 0.01),而蛋白的表达显著增加(图 1B,P < 0.05)。说明β-葡聚糖刺激ORECs后对其表面的膜受体Dectin-1有一定的激活作用。
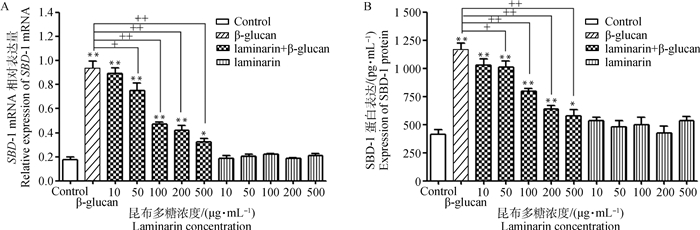
2.3 阻断Dectin-1对β-葡聚糖诱导SBD-1表达的影响为了检测Dectin-1在β-葡聚糖诱导SBD-1表达过程中的作用,用不同浓度的昆布多糖预处理ORECs,再用10 μg·mL-1的β-葡聚糖刺激细胞。结果如图 3A和3B所示,与阳性对照组相比, 用100 μg·mL-1昆布多糖预处理ORECs导致β-葡聚糖诱导的SBD-1表达极显著降低(P < 0.01),并且用500 μg·mL-1昆布多糖预孵育ORECs导致SBD-1的表达最低,而阴性对照组与空白对照组比较差异无统计学意义(P>0.05)。这表明β-葡聚糖在ORECs上诱导SBD-1表达是Dectin-1介导的。
|
A. β-葡聚糖刺激ORECs 2 h对Dectin-1 mRNA表达的影响; B. β-葡聚糖刺激ORECs 4 h对Dectin-1蛋白表达的影响。与空白对照组相比:*. P < 0.05; **. P < 0.01,图 4同 A. Effects of β-glucan on Dectin-1 mRNA expression by stimulating ORECs for 2 h; B. Effects of β-glucan on Dectin-1 protein expression by stimulating ORECs for 4 h.*. P < 0.05, **. P < 0.01, compared with the control group, the same as figure 4 图 2 β-葡聚糖对Dectin-1表达的影响 Fig. 2 Effects of β-glucan on Dectin-1 expression |
|
A.昆布多糖处理ORECs对β-葡聚糖诱导SBD-1 mRNA表达的影响; B.昆布多糖处理ORECs对β-葡聚糖诱导SBD-1蛋白表达的影响。与空白对照组相比:*. P < 0.05; **. P < 0.01;与阳性对照组相比:+. P < 0.05,+ +. P < 0.01 A. Effects of laminarin on the β-glucan-induced SBD-1 mRNA expression; B. Effects of laminarin on the β-glucan-induced SBD-1 protein expression. *. P < 0.05, **. P < 0.01, compared with the control group; +. P < 0.05, + +. P < 0.01, compared with the positive control group 图 3 Dectin-1在β-葡聚糖诱导SBD-1表达过程中的作用 Fig. 3 The role of Dectin-1 in the expression of SBD-1 induced by β-glucan |
|
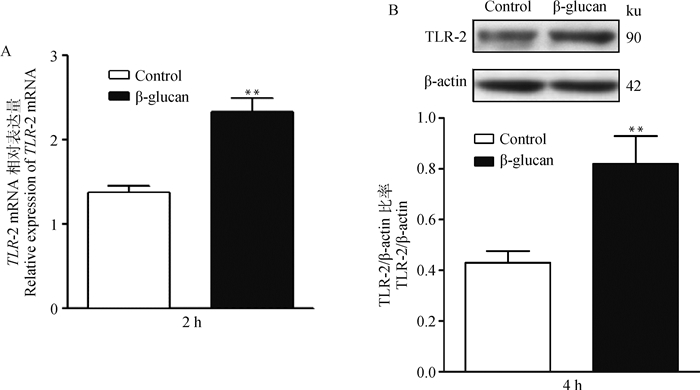
A. β-葡聚糖刺激ORECs 2 h对TLR-2 mRNA表达的影响; B. β-葡聚糖刺激ORECs 4 h对TLR-2蛋白表达的影响 A. Effects of β-glucan on TLR-2 mRNA expression by stimulating ORECs for 2 h; B Effects of β-glucan on TLR-2 protein expression by stimulating ORECs for 4 h 图 4 β-葡聚糖对TLR-2表达的影响 Fig. 4 Effects of β-glucan on TLR-2 expression |
为了检测TLR-2在β-葡聚糖诱导SBD-1表达中可能的作用,本研究采用qPCR和Western blot方法分析β-葡聚糖刺激ORECs对TLR-2表达的影响。结果表明,β-葡聚糖刺激ORECs 2和4 h后TLR-2的mRNA和蛋白表达极显著增加(图 4A、4B,P < 0.01)。说明β-葡聚糖在刺激ORECs后对表面膜受体TLR-2有一定的激活作用。
2.5 阻断TLR-2对β-葡聚糖诱导SBD-1表达的影响为了确定β-葡聚糖诱导SBD-1表达的信号通路是否通过常见的先天免疫受体TLR-2发出信号,用抗TLR-2和同型IgG抗体(0.1、1、10 μg·mL-1)处理ORECs后,用10 μg·mL-1的β-葡聚糖刺激2或4 h,结果发现,用抗TLR-2抗体处理的ORECs中,β-葡聚糖诱导的SBD-1表达与阳性对照组相比显著降低(图 5A、5B,P < 0.05),而同型对照组中β-葡聚糖刺激ORECs对SBD-1表达与阳性对照组无差异(P>0.05)。说明β-葡聚糖诱导SBD-1的表达是由膜受体TLR-2介导的。
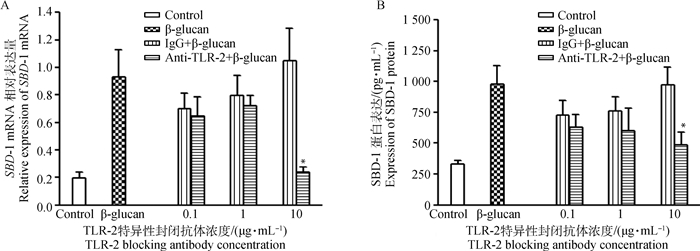
|
A. qPCR方法检测SBD-1的表达; B. ELISA方法检测SBD-1的表达 A. The expression of SBD-1 detected by qPCR; B. The expression of SBD-1 detected by ELISA 图 5 TLR-2在β-葡聚糖诱导SBD-1表达过程中的作用 Fig. 5 The role of TLR-2 in the expression of SBD-1 induced by β-glucan |
研究显示,黏膜上皮细胞在免疫应答的启动和调节中发挥重要作用。先天免疫是抵御外来微生物的第一道防线,而防御素在这种免疫反应中发挥着重要作用[27]。报道显示,衍生自酿酒酵母等酵母细胞壁的β-葡聚糖具有免疫调节活性,可上调肠上皮细胞中β-防御素的表达[16]。本试验室先前的研究显示,β-葡聚糖能够诱导SBD-1的表达增加[26]。然而,有关β-葡聚糖诱导ORECs中SBD-1表达上调的潜在机制仍未见报道。
Dectin-1是一种识别真菌β-葡聚糖的C型凝集素受体,能够介导先天免疫反应并触发信号转导[28-30]。Dectin-1由树突状细胞、巨噬细胞、单核细胞、嗜中性粒细胞和T细胞亚群表达[31]。近年来的研究显示,Dectin-1也能够在人类角膜上皮细胞、支气管上皮细胞和肠上皮细胞中表达[32-34]。此外,在绵羊脾、肠系膜淋巴结、肩胛前淋巴结、肺、肾、皮肤和膀胱中已鉴定出Dectin-1表达[35]。然而,仍未见有关Dectin-1在绵羊瘤胃中表达的报道。本研究为了检测在绵羊瘤胃中是否表达Dectin-1,通过免疫组织化学、RT-PCR、免疫荧光和Western blot方法检测发现,Dectin-1在瘤胃黏膜组织和培养的ORECs上均表达。这种表达不仅意味着绵羊瘤胃能够识别真菌,也为接下来研究β-葡聚糖在ORECs中诱导SBD-1表达机制提供了基础。研究显示,在人肠上皮细胞系Caco-2中用包封在酵母β-葡聚糖颗粒中的卵白蛋白刺激后[36]、在支气管上皮细胞中用烟曲霉菌刺激后[33]以及本研究中ORECs用β-葡聚糖刺激后均能够诱导Dectin-1的表达。说明Dectin-1可能在除髓细胞样细胞以外的细胞类型(如上皮细胞)中发挥作用,并且可以参与β-葡聚糖在瘤胃黏膜表面诱导的应答反应。据报道,β-葡聚糖能够通过Dectin-1信号通路诱导人角膜上皮细胞中hBD2和LL37的上调[37]。本研究同样发现,在ORECs中用β-葡聚糖刺激后SBD-1表达量显著增加。然而,使用Dectin-1拮抗剂昆布多糖预处理后,β-葡聚糖对SBD-1的诱导作用降低,这与Iliev[38]报道的结果相同。说明β-葡聚糖刺激ORECs后能够激活Dectin-1,并参与诱导SBD-1的表达过程。
虽然,本研究已经证明β-葡聚糖诱导SBD-1的表达依赖于Dectin-1。然而,研究者不能排除其他受体也参与诱导SBD-1表达的可能性。2008年Lee等[39]发现,在巨噬细胞中用特异性抗体阻断Dectin-1和TLR-2后能够显著抑制香菇β-葡聚糖介导的NO产生。2016年Wang[25]等报道显示,β-葡聚糖刺激巨噬细胞中TNF-α和IL-10的产生是通过TLR-2和Dectin-1受体介导的。本研究采用qPCR和Western blot方法检测发现,β-葡聚糖可以上调TLR-2 mRNA转录水平和蛋白分泌。说明TLR-2可能也参与β-葡聚糖在瘤胃黏膜表面诱导的应答反应。因此,为了进一步了解β-葡聚糖诱导SBD-1的表达是否由常见的先天免疫受体TLR-2介导,用抗TLR-2特异性封闭抗体与β-葡聚糖刺激ORECs,qPCR和ELISA分析结果显示,阻断TLR-2后显著降低了SBD-1表达,这与Lee等[39]的研究结果类似。说明除Dectin-1以外,膜受体TLR-2也参与β-葡聚糖诱导SBD-1的表达过程,但是两种膜受体是协同介导,还是以某一种膜受体为主还有待于进一步研究。
本研究结果表明,β-葡聚糖可能通过ORECs表面膜受体Dectin-1和TLR-2诱导SBD-1的表达,从而起到免疫调节功能。但体外细胞培养模型并不能完全模拟体内复杂的微环境。因此,在未来的研究中将使用动物模型以检测β-葡聚糖是否在绵羊瘤胃内也能够发挥其免疫刺激效力,以及Dectin-1和TLR-2是否在体内免疫调节中起作用。
4 结论本研究证明,Dectin-1在绵羊瘤胃组织及ORECs内均表达,并且酿酒酵母β-葡聚糖在ORECs中诱导SBD-1的表达是由Dectin-1和TLR-2介导产生的。此结果可能对理解真菌类益生菌在动物体内如何发挥益生作用提供了一种新解释,也为更好的开发利用真菌类益生菌制剂提供实践指导。
| [1] | THACKER P A. Alternatives to antibiotics as growth promoters for use in swine production:a review[J]. J Anim Sci Biotechnol, 2013, 4(1): 35. DOI: 10.1186/2049-1891-4-35 |
| [2] | O′SHEA E F, COTTER P D, STANTON C, et al. Production of bioactive substances by intestinal bacteria as a basis for explaining probiotic mechanisms:bacteriocins and conjugated linoleic acid[J]. Int J Food Microbiol, 2012, 152(3): 189–205. DOI: 10.1016/j.ijfoodmicro.2011.05.025 |
| [3] | KLASING K C. Nutritional modulation of resistance to infectious diseases[J]. Poult Sci, 1998, 77(8): 1119–1125. DOI: 10.1093/ps/77.8.1119 |
| [4] | KLASING K C. Nutrition and the immune system[J]. Br Poult Sci, 2007, 48(5): 525–537. DOI: 10.1080/00071660701671336 |
| [5] | KIDD M. Nutritional modulation of immune function in broilers[J]. Poult Sci, 2004, 83(4): 650–657. DOI: 10.1093/ps/83.4.650 |
| [6] | BERGE A C, WIERUP M. Nutritional strategies to combat Salmonella in mono-gastric food animal production[J]. Animal, 2012, 6(4): 557–564. DOI: 10.1017/S1751731111002217 |
| [7] | CASADEI E, WANG T H, ZOU J, et al. Characterization of three novel β-defensin antimicrobial peptides in rainbow trout (Oncorhynchus mykiss)[J]. Mol Immunol, 2009, 46(16): 3358–3366. DOI: 10.1016/j.molimm.2009.07.018 |
| [8] | ELLIS A E. Innate host defense mechanisms of fish against viruses and bacteria[J]. Dev Comp Immunol, 2001, 25(8-9): 827–839. DOI: 10.1016/S0145-305X(01)00038-6 |
| [9] | GANZ T, LEHRER R I. Antimicrobial peptides of vertebrates[J]. Curr Opin Immunol, 1998, 10(1): 41–44. |
| [10] | OUELLETTE A J.Paneth cell α-defensin synthesis and function[M]//SHAFER W M.Antimicrobial Peptides and Human Disease. Berlin, Heidelberg: Springer, 2006, 306: 1-25. |
| [11] | SCHLEE M, HARDER J, KÖTEN B, et al. Probiotic lactobacilli and VSL#3 induce enterocyte β-defensin 2[J]. Clin Exp Immunol, 2008, 151(3): 528–535. DOI: 10.1111/(ISSN)1365-2249 |
| [12] | KUBOTA A, KOBAYASHI M, SARASHINA S, et al. Reishi mushroom Ganoderma lucidum Modulates IgA production and alpha-defensin expression in the rat small intestine[J]. J Ethnopharmacol, 2018, 214: 240–243. DOI: 10.1016/j.jep.2017.12.010 |
| [13] | ABDELSALAM M, ISOBE N, YOSHIMURA Y. Effects of lipopolysaccharide and interleukins on the expression of avian β-defensins in hen ovarian follicular tissue[J]. Poult Sci, 2012, 91(11): 2877–2884. DOI: 10.3382/ps.2012-02312 |
| [14] | VOLMAN J J, RAMAKERS J D, PLAT J. Dietary modulation of immune function by β-glucans[J]. Physiol Behav, 2008, 94(2): 276–284. DOI: 10.1016/j.physbeh.2007.11.045 |
| [15] | QI C J, CAI Y H, GUNN L, et al. Differential pathways regulating innate and adaptive antitumor immune responses by particulate and soluble yeast-derived β-glucans[J]. Blood, 2011, 117(25): 6825–6836. DOI: 10.1182/blood-2011-02-339812 |
| [16] | SCHMITT P, WACYK J, MORALES-LANGE B, et al. Immunomodulatory effect of cathelicidins in response to a β-glucan in intestinal epithelial cells from rainbow trout[J]. Dev Comp Immunol, 2015, 51(1): 160–169. |
| [17] | SHAO Y J, WANG Z, TIAN X Y, et al. Yeast β-D-glucans induced antimicrobial peptide expressions against Salmonella infection in broiler chickens[J]. Int J Biol Macromol, 2016, 85: 573–584. DOI: 10.1016/j.ijbiomac.2016.01.031 |
| [18] | CAMPOVERDE C, MILNE D J, ESTÉVEZ A, et al. Ontogeny and modulation after PAMPs stimulation of β-defensin, hepcidin, and piscidin antimicrobial peptides in meagre (Argyrosomus regius)[J]. Fish Shellfish Immunol, 2017, 69: 200–210. DOI: 10.1016/j.fsi.2017.08.026 |
| [19] | BROWN G D, GORDON S. Immune recognition.A new receptor for β-glucans[J]. Nature, 2001, 413(6851): 36–37. |
| [20] | WILLMENT J A, GORDON S, BROWN G D. Characterization of the human β-glucan receptor and its alternatively spliced isoforms[J]. J Biol Chem, 2001, 276(47): 43818–43823. DOI: 10.1074/jbc.M107715200 |
| [21] | HARDISON S E, BROWN G D. C-type lectin receptors orchestrate antifungal immunity[J]. Nat Immunol, 2012, 13(9): 817–822. DOI: 10.1038/ni.2369 |
| [22] | SUKHITHASRI V, NISHA N, BISWAS L, et al. Innate immune recognition of microbial cell wall components and microbial strategies to evade such recognitions[J]. Microbiol Res, 2013, 168(7): 396–406. DOI: 10.1016/j.micres.2013.02.005 |
| [23] | LI D Q, ZHOU N, ZHANG L L, et al. Suppressive effects of azithromycin on zymosan-induced production of proinflammatory mediators by human corneal epithelial cells[J]. Invest Ophthalmol Vis Sci, 2010, 51(11): 5623–5629. DOI: 10.1167/iovs.09-4992 |
| [24] | ROY S, DICKERSON R, KHANNA S, et al. Particulate β-glucan induces TNFα production in wound macrophages via a redox-sensitive NFκB-dependent pathway[J]. Wound Repair Regen, 2011, 19(3): 411–419. DOI: 10.1111/j.1524-475X.2011.00688.x |
| [25] | WANG Q, ZHAO G Q, LIN J, et al. Role of the mannose receptor during Aspergillus fumigatus infection and interaction with dectin-1 in corneal epithelial cells[J]. Cornea, 2016, 35(2): 267–273. DOI: 10.1097/ICO.0000000000000710 |
| [26] |
张曼, 金鑫, 王云鹤, 等. 酿酒酵母β-葡聚糖对绵羊瘤胃上皮细胞β-防御素-1表达的影响[J]. 畜牧兽医学报, 2018, 49(11): 2416–2424.
ZHANG M, JIN X, WANG Y H, et al. Effects of Saccharomyces cerevisiae β-glucan on the expression of SBD-1 in ovine ruminal epithelial cells[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(11): 2416–2424. (in Chinese) |
| [27] | ZHAO L, LU W. Defensins in innate immunity[J]. Curr Opin Hematol, 2014, 21(1): 37–42. DOI: 10.1097/MOH.0000000000000005 |
| [28] | BATBAYAR S, LEE D H, KIM H W. Immunomodulation of fungal β-glucan in host defense signaling by Dectin-1[J]. Biomol Ther, 2012, 20(5): 433–445. DOI: 10.4062/biomolther.2012.20.5.433 |
| [29] | MARAKALALA M J, KERRIGAN A M, BROWN G D. Dectin-1:a role in antifungal defense and consequences of genetic polymorphisms in humans[J]. Mamm Genome, 2011, 22(1-2): 55–65. DOI: 10.1007/s00335-010-9277-3 |
| [30] | MARAKALALA M J, VAUTIER S, POTRYKUS J, et al. Differential adaptation of Candida albicans in vivo modulates immune recognition by dectin-1[J]. PLoS Pathog, 2013, 9(4): e1003315. DOI: 10.1371/journal.ppat.1003315 |
| [31] | TAYLOR P R, BROWN G D, REID D M, et al. The β-glucan receptor, dectin-1, is predominantly expressed on the surface of cells of the monocyte/macrophage and neutrophil lineages[J]. J Immunol, 2002, 169(7): 3876–3882. DOI: 10.4049/jimmunol.169.7.3876 |
| [32] | ZHAO G Q, QIU X Y, LIN J, et al. Co-regulation of Dectin-1 and TLR2 in inflammatory response of human corneal epithelial cells induced by Aspergillus fumigates[J]. Int J Ophthalmol, 2016, 9(2): 185–190. |
| [33] | SUN W K, LU X, LI X, et al. Dectin-1 is inducible and plays a crucial role in Aspergillus-induced innate immune responses in human bronchial epithelial cells[J]. Eur J Clin Microbiol Infect Dis, 2012, 31(10): 2755–2764. DOI: 10.1007/s10096-012-1624-8 |
| [34] | FUKATA M, ARDITI M. The role of pattern recognition receptors in intestinal inflammation[J]. Mucosal Immunol, 2013, 6(3): 451–463. DOI: 10.1038/mi.2013.13 |
| [35] | NALUBAMBA K S, GOSSNER A G, DALZIEL R G, et al. Differential expression of pattern recognition receptors in sheep tissues and leukocyte subsets[J]. Vet Immunol Immunopathol, 2007, 118(3-4): 252–262. DOI: 10.1016/j.vetimm.2007.05.018 |
| [36] | DE SMET R, DEMOOR T, VERSCHUERE S, et al. β-Glucan microparticles are good candidates for mucosal antigen delivery in oral vaccination[J]. J Control Release, 2013, 172(3): 671–678. DOI: 10.1016/j.jconrel.2013.09.007 |
| [37] | KOLAR S S, BAIDOURI H, MCDERMOTT A M. Role of pattern recognition receptors in the modulation of antimicrobial peptide expression in the corneal epithelial innate response to F.solani[J]. Invest Ophthalmol Vis Sci, 2017, 58(5): 2463–2472. DOI: 10.1167/iovs.16-20658 |
| [38] | ILIEV I D. Dectin-1 exerts dual control in the gut[J]. Cell Host Microbe, 2015, 18(2): 139–141. DOI: 10.1016/j.chom.2015.07.010 |
| [39] | LEE J Y, KIM J Y, LEE Y G, et al. Molecular mechanism of macrophage activation by exopolysaccharides from liquid culture of Lentinus edodes[J]. J Microbiol Biotechnol, 2008, 18(2): 355–364. |

 图 1(Fig. 1)
图 1(Fig. 1)


