2. 中国农业科学院北京畜牧兽医研究所, 农业部畜禽遗传资源与种质创新重点实验室, 北京 100193
2. Key Laboratory of Farm Animal Genetic Resources and Germplasm Innovation of Ministry of Agriculture, Institute of Animal Science, Chinese Academy of Agricultural Sciences, Beijing 100193, China
促性腺激素释放激素(GnRH)通过下丘脑-垂体-性腺轴(HPG axis)紧密调控动物的生殖功能和行为,是动物生殖生理的中枢启动激素和调控激素[1]。GnRH主动免疫,即给动物注射GnRH疫苗刺激动物免疫系统产生抗GnRH抗体,该抗体通过血液循环运送到达垂体门脉,与下丘脑合成和释放的内源性GnRH特异性结合,从而抑制促性激素/性激素的分泌和配子的发生,以达到免疫去势目的[2-3]。GnRH主动免疫已成为目前最有望取代传统外科阉割去势的安全友好的去势方法[4-6]。然而,GnRH主动免疫后动物个体间免疫反应存在一定差异,少数动物反应较小或没有反应[7-10];此外,为了达到良好的去势效果,每次注射抗原用量大且需要2次或2次以上注射[2],导致使用成本高。上述问题一定程度上阻碍了GnRH免疫去势的疫苗大规模生产及应用。因此,如何设计和制备GnRH抗原,以增强GnRH分子抗原免疫原性,从而减少免疫后动物个体间免疫反应差异及抗原用量是目前亟待解决的问题。
本研究通过改变GnRH抗原构型及增大GnRH分子量两种思路,构建和制备了3种不同蛋白构型的GnRH抗原,并对比研究了3种抗原间的免疫学和生物学效果。研究结果为研发高效GnRH免疫去势疫苗及推动GnRH主动免疫去势大规模应用提供理论参考。
1 材料和方法 1.1 新蛋白构型GnRH免疫原构建及乳化 1.1.1 新蛋白构型GnRH免疫原构建及制备本研究新蛋白构型GnRH抗原设计的核心思路:1)优化GnRH蛋白分子构型及增加GnRH拷贝数;2)增大抗原分子量。天然哺乳动物GnRH由10个氨基酸组成,其多肽序列:Glu-His-Trp-Ser-Tyr-Gly-Leu-Arg-Pro-Gly-NH2。为了便于将GnRH分子与载体蛋白偶联,以D型赖氨酸(D-lysine)取代天然GnRH 10肽第6位甘氨酸(Glysine)形成GnRH与载体蛋白偶联位点,即利用D型赖氨酸上的-NH2为偶联位点(G6K-GnRH):Glu-His-Trp-Ser-Tyr- Lys -Leu-Arg-Pro-Gly-NH2。化学合成G6K-GnRH并列体作为新蛋白构型GnRH抗原制备的基本单元(G6K-GnRH-tandem,G6KT):Glu-His-Trp-Ser-Tyr- Lys - Leu-Arg-Pro-Gly-Glu-His-Trp-Ser -Tyr-Lys -Leu-Arg-Pro-Gly。G6KT化学合成由上海强耀生物科技公司完成,合成后经高效液相色谱纯化,纯度>98%。将化学合成的高纯度G6K-GnRH-tandem二聚化形成新蛋白构型GnRH抗原Ⅰ:G6K-GnRH-tandem-dimer(G6KTD)。二聚化过程:1)用去离子水配置20%的DMSO溶液、2% NH4HCO3备用;2)称取一定量的G6KTD(100 μg·mL-1)溶解于20% DMSO溶液中;3)以2% NH4HCO3和1%~ 10%的HCl调整溶液pH为5.5;3)室温磁珠低速搅拌过夜(至少5 h以上使G6KT充分二聚化);4)使用3 000分子量透析膜蒸馏水透析,每2 h换1次水,透析8 h以上;5)冻干,称取重量计算二聚化效率,该步二聚化效率>95%。
将化学合成的G6K-GnRH-tandem(G6KT)与卵清蛋白(OVA)偶联形成新蛋白构型GnRH抗原Ⅱ(G6KT-OVA)。其制备过程:1)称取等量的G6KT和OVA分别溶解于去离子水(15 mg·mL-1),磁力搅拌溶解1 h;2)称取10倍量的碳二亚胺(EDC)溶解于去离子水(0.2 g·mL-1);3)G6KT和OVA分别搅拌1 h,将二者溶液混合,磁力搅拌10 min,用滴管将EDC溶液滴加到G6KT与OVA的混合溶液中,滴加过程保持磁力搅拌,EDC滴加完后,持续搅拌过夜;5)10 000分子量透析膜蒸馏水透析除去EDC,每2 h换1次水,透析8 h以上;5)冻干,称取重量计算偶联效率, 偶联效率约为30%,即0.5 mg G6KT·mg-1 OVA。
将上述新蛋白构型抗原Ⅰ(G6KTD)与卵清蛋白偶联形成新蛋白构型GnRH抗原Ⅲ,G6KTD-OVA。其制备过程:1)称取等量的G6KTD和OVA分别溶解于去离子水(15 mg·mL-1),磁力搅拌溶解1 h;2)称取10倍量的碳二亚胺(EDC)溶解于去离子水(0.2 g·mL-1);3)G6KTD和OVA分别搅拌1 h,将二者溶液混合,磁力搅拌10 min,用滴管将EDC溶液滴加到G6KTD与OVA的混合溶液中,滴加过程保持磁力搅拌,EDC滴加完后,持续室温搅拌过夜;4)蒸馏水透析除去EDC,每2 h换1次水,透析8 h以上;5)冻干,称取重量计算偶联效率,偶联效率约为30%,即0.5 mg G6KTD·mg-1 OVA。
1.1.2 乳化选择温和矿物佐剂Specol为疫苗佐剂。Specol乳化疫苗最终形成油包水结构,由水溶液部分(用于抗原溶解),矿物油及乳化剂3部分构成。疫苗乳化过程参照Bokhout方法[11]:1)分别称取3种新蛋白构型GnRH抗原溶于0.85% NaCl(最终3种抗原浓度为100 μg当量新蛋白构型GnRH·mL-1疫苗);2)制备Specol乳化剂,量取Span85和Tween85(Sigma)按54/46(V/V)充分混匀待用;3)量取9体积矿物油(Mineral oil)Marcol 52(Sigma)和1体积Specol乳化剂于玻璃量筒(300 mL)中,使用Turaxx 50搅拌匀浆器(T50,IKA,German)8 000 r·min-1混匀1 min;4)保持匀浆器转速为8 000 r·min-1,用滴管缓慢向乳化量筒滴入8体积的0.85% NaCl GnRH抗原,滴加抗原水溶液过程上下移动乳化量筒以充分乳化抗原;5)抗原水溶液全部滴入乳化量筒后,将Turaxx 50搅拌匀浆器转速调到10 000~13 000 r·min-1,再持续搅拌1 min,整个乳化过程保持乳化量筒处于水中(防止因搅拌产生的高温损害抗原活性);6)乳化结束后,用自来水快速冷却疫苗温度至室温,立即使用或4 ℃保存待用。
1.2 试验动物处理及样品采集将60只3~4周龄健康的SD雄鼠(150~210 g) (购自四川大学华西试验动物中心)随机分5组(n=12):完整对照组(不做任何处理,intact controls)、外科阉割去势组(surgical castrates)及3种新蛋白构型GnRH免疫组(G6KTD、G6KT-OVA及G6KTD-OVA免疫组)。免疫组雄鼠于6周龄时腿部肌肉注射1 mL乳化抗原(含相应新蛋白构型GnRH 100 μg),8周后加免1次,注射剂量与方法同初次免疫。初次免疫当天记为0 wpv(weeks post vaccination)。手术去势组雄鼠,在4周龄时(免疫组初次免疫前2周)通过外科手术摘除睾丸。所有试验动物自由采食(商品日粮)和饮水,试验鼠房温度控制在(21±1)℃,湿度控制在50%~60%,每天光照/黑暗时长为12/12 h。
免疫当天及免疫后4、8、12 wpv尾动脉采血约2 mL。2 000 g离心20 min分离血清,-20 ℃保存待用。加免4周后,颈椎脱臼处死所有试验鼠,采集垂体及两侧睾丸组织,称取睾丸重量,游标卡尺测量睾丸长度与宽度,用公式v=(4π(宽度/2)2×(长度/2))/3计算睾丸体积。垂体和一侧睾丸液氮速冻后,转移到-80 ℃保存待用。另一侧睾丸10%福尔马林固定8 h后,石蜡包被,组织切片,分析睾丸组织学变化。
1.3 血清GnRH抗体滴度及生殖激素浓度测定放射免疫法(RIA)测定血清GnRH抗体滴度,试剂购自上海第二军医大学神经生物学教研室。具体测定过程严格参照试剂盒说明书进行。抗体滴度以稀释度为1:3 200时血清的125I-GnRH百分结合率表示。以免疫前血清测得血清抗体非特异性结合率 < 1%。
酶联免疫吸附法(ELISA)测定血清睾酮(T)、抑制素B(inhibin B),LH和FSH的浓度。大鼠专用酶联免疫试剂盒购自Cusabio Biotech CO., Ltd。所有样品重复测定两次。T、抑制素B、LH及FSH检测灵敏度分别为0.06 ng·mL-1、0.50 pg·mL-1、0.15 mIU·mL-1和0.25 mIU·mL-1。所有激素测定的批内批间变异系数(intra- and inter-assay variation coefficients)均 < 15%。
1.4 睾丸组织学分析完整对照组和免疫组雄鼠睾丸10%福尔马林固定8 h,经1%四氧化锇固定15 min。接着进行浓度梯度乙醇脱水(70%、80%、95%、95%、100%、100%、100%)每步3 min。固定、脱水后石蜡包被,石蜡切片机进行切片,切片厚度为5 μm。切片进行伊红染色法(hematoxylin-eosinstaining,H&E)染色。染色完成后,每个睾丸随机挑选5个切片用组织形态分析软件(Images Advanced 3.2, MOTIC)进行组织形态学分析。
1.5 生殖相关基因RT-qPCR定量分析将垂体及睾丸放入液氮预冷的研钵中,通过加入少量液氮充分迅速研磨至粉状。通过苯酚法提取总RNA,Trizol购自大连宝生物(TaKaRa)公司。Nanodrop分析RNA浓度及OD260 nm /OD208nm,OD230 nm /OD260 nm吸光度比值。每个样品取40 μg总RNA用于反转录生成cDNA,转录体系按反转录试剂盒说明书进行(TaKaRa)。以反转录获得的cDNA为模板在特定引物下进行定量检测,所采用的仪器为CFX96 (BIO-RAD, Inc.),每个样品重复3次,PCR程序:95 ℃ 10 s;然后进行40循环:95 ℃变性5 s, 58~61 ℃退火+延伸25 s;最后进行熔解曲线以检测PCR扩增产物的特异性。目的基因mRNA相对表达水平采用标准曲线法进行计算。待检测基因及基因检测所采用的引物序列见表 1。
|
|
表 1 引物序列 Table 1 Primer sequences |
利用SAS 9.2统计学软件(SAS institute, Cary, NC, USA)对数据进行统计分析。试验处理分为完整对照组、手术去势组和3个免疫去势组。试验处理对睾丸重量、体积、形态学及对垂体、睾丸生殖相关基因mRNA表达的影响,采样GLM过程进行单因素方差分析,Duncan法进行多重比较。对于血清重复测量指标:GnRH抗体滴度及生殖激素含量,采用混合模型(mixed model)重复性测量(repeated statement)方差分析。模型固定因素:试验处理、采样时间及两种间的交互作用,随机因素包括各处理组中大鼠个体。血清GnRH抗体浓度、抑制素B及睾酮浓度统计分析前进行lg转化,让数据分布满足正态分布,其它指标满足正态分布,不需进行数据转化。所有数据以“平均值±标准差(SD)”表示,P < 0.05表示差异显著;P < 0.01表示差异极显著。
2 结果 2.1 血清抗GnRH抗体滴度3种新蛋白构型GnRH抗原主动免疫SD雄鼠均能引起良好的抗体反应(图 1)。血清GnRH抗体滴度受试验处理、时间及两者间的交互作用影响。初免后4周(4 wpv)和加免8周,3种不同新蛋白构型抗原免疫组血清GnRH抗体滴度均显著高于检测背景值(完整对照组)(P < 0.05)。加免12周试验结束时抗体滴度达到最大值,G6KTD、TG6KT-OVA、G6KTD-OVA 3组抗体滴度分别达到40%、82%及76%的结合率。自初免4周(4 wpv)起,其中G6KT-OVA及G6KTD-OVA免疫组血清抗体滴度显著高于G6KTD组血清抗体滴度,直至试验结束(P < 0.05)。在整个试验期内,G6KT-OVA与G6KTD-OVA免疫组抗体滴度变化相似,两组间抗体滴度在所测时间点上均没有显著差异(P>0.05)。
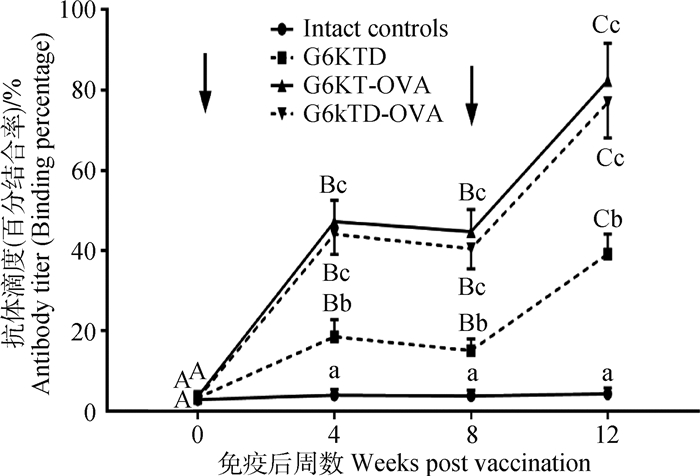
|
不同大写字母表示不同时间点组内差异显著(P < 0.05);不同小写字母表示同一时间点组间差异显著(P < 0.05);箭头表示初免和加免疫时间点。图 3、4和7(A~C)同 Within a treatment group, different capital letters indicate a significant difference at different time points (P < 0.05).At the same time, different lowercase letters indicate significant differences among diffrent groups (P < 0.05); Arrows indicate the time points of primary vaccination and subsequent booster.The same as Fig. 3, Fig. 4 and Fig. 7A, B, C 图 1 3种新蛋白构型GnRH抗原主动免疫SD雄鼠血清GnRH抗体滴度 Fig. 1 Serum anti-GnRH antibody titers in SD male rats immunized with 3 different constructs of GnRH-like peptides |
如图 2所示,与完整对照组相比,G6KT-OVA与G6KTD-OVA免疫组雄鼠睾丸发育严重受阻,试验结束时睾丸明显萎缩(图 2A),G6KT-OVA与G6KTD-OVA免疫组睾丸重量和体积均比完整对照组显著下降(P < 0.05);G6KTD免疫组睾丸重量与体积均与完整对照组差异不显着(P>0.05);G6KT-OVA与G6KTD-OVA免疫组睾丸重量和体积均显著低于G6KTD免疫组睾丸重量和体积(P < 0.05)。(图 2B,C)
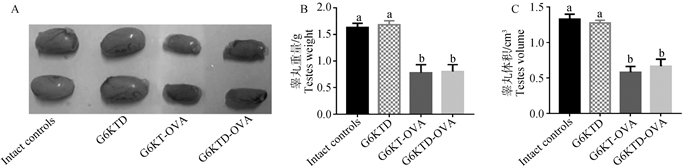
|
A.各处理组睾丸图;B.睾丸重量;C.睾丸体积。不同字母表示组间差异显著(P < 0.05) A.Testes from different treatment groups; B.Testes weight; C.Testes volume. Different letters indicate significant differences among groups (P < 0.05) 图 2 不同新蛋白GnRH主动免疫对SD雄鼠睾丸发育的影响 Fig. 2 Effects of active immunization against different GnRH-like peptide constructs on testis development in SD male rats |
血清睾酮和抑制素B浓度受试验处理、时间及两者间交互作用影响。完整对照组血清睾酮和抑制素B浓度,从0~4 wpv随着年龄的增长而升高(P < 0.05),从4 wpv至试验结束血清睾酮和抑制素B浓度维持在相对稳定的水平(图 3)。
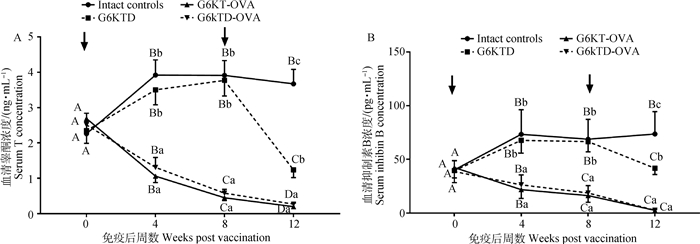
|
图 3 3种新蛋白构型GnRH抗原主动免疫SD雄鼠血清睾酮(A)和抑制素B(B)浓度 Fig. 3 Serum testosterone(A)and inhibin B(B)concentrations in SD male rats immunized with 3 different GnRH-like peptide constructsc |
在免疫当天,各免疫组血清睾酮和抑制素B浓度没有显著差异(P>0.05);与完整对照组相比,G6KT-OVA与G6KTD-OVA主动免疫后血清睾酮和抑制素B浓度降低,4 wpv时达到显著水平(P < 0.05),加免后两者继续降低到不可测水平;与完整对照组相比,G6KTD初始免疫对血清睾酮和抑制素B浓度无显著变化,但加免后血清睾酮和抑制素B均显著下降(P < 0.05);但试验结束时,G6KTD免疫组血清睾酮和抑制素B浓度仍显著高于G6KT-OVA与G6KTD-OVA免疫组相应激素浓度(P < 0.05,图 3)。
2.4 不同新蛋白构型GnRH抗原主动免疫对SD雄鼠血清LH和FSH含量的影响血清LH和FSH浓度受试验处理、时间及两者间的交互作用影响(图 4)。图 4表明:完整对照组血清LH和FSH浓度,从0~4 wpv随着年龄的增长而升高(P < 0.05),从8 wpv至试验结束血清LH和FSH浓度维持在相对稳定水平。手术去势组(surgical castrates)血清LH和FSH浓度,在去势后显著升高,并且整个试验期间持续高于完整对照组(P < 0.05)。在免疫当天,与完整对照组相比,各免疫组血清LH和FSH浓度没有显著差异(P>0.05)。G6KT-OVA与G6KTD-OVA免疫组雄鼠,抗原主动免疫后血清LH和FSH浓度缓慢降低,4 wpv时达到显著水平(P < 0.05),加免后两者继续降低到不可测水平。与完整对照组相比,G6KTD初始免疫对血清LH和FSH浓度无显著影响,但加免后血清LH和FSH均显著下降(P < 0.05)。但试验结束时,G6KTD免疫组血清LH和FSH浓度仍显著高于G6KT-OVA与G6KTD-OVA免疫组相应激素水平(P < 0.05)。
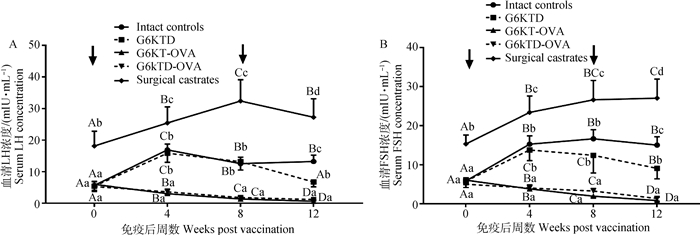
|
图 4 3种新蛋白构型GnRH抗原主动免疫SD雄鼠血清LH(A)和FSH(B)浓度 Fig. 4 Serum LH(A) and FSH(B) concentrations in SD male rats immunized with 3 different GnRH-like peptide constructs |
如图 5所示,正常对照鼠睾丸曲精细管(ST)内各级生精细胞层次清晰,管内包含精原细胞(短箭头)、初级精母细胞(长箭头)、精子细胞(圆形)及精子(矩形), 睾丸间质组织内间质细胞(LC)清晰饱满(图 5A)。而G6KTD睾丸组织结构变化根据大鼠个体免疫反应,变化不一,部分免疫个体与正常对照鼠睾丸组织结构相似,曲精细管内各级生精细胞层次清晰,排列紧密,分化明显,上皮组织完整,间质细胞分布均匀(图 5B)。G6KT-OVA免疫去势雄鼠睾丸曲精细管(ST)明显萎缩,间质细胞(LC)萎缩且数量明显减少,精子(方框)发生停止,官腔空荡,仅见少量退化的精原细胞(短箭头)和初级精母细胞(长箭头) (图 5C)。G6KTD-OVA免疫去势雄鼠睾丸曲细精管(ST)也明显萎缩,间质细胞(LC)数量明显减少,精子发生停止,仅见少量精原细胞(短箭头) (图 5D)。
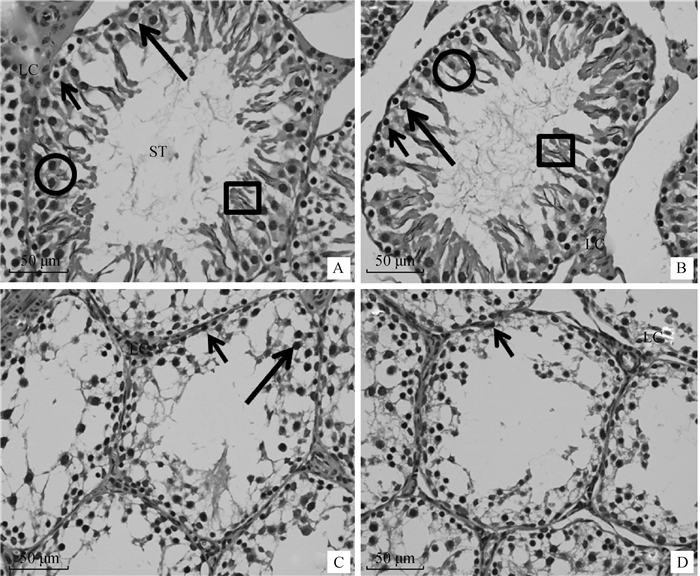
|
A.正常对照;B. G6KTD; C. G6KT-OVA; D. G6KTD-OVA。ST.睾丸曲精细管; LC.间质细胞。短箭头.精原细胞; 长箭头.初级精母细胞; 圆形.精子细胞; 矩形.精子。睾丸切片进行H&E染色 A-D.Photomicrographs of testes from intact, G6KTD, G6KT-OVA and G6KTD-OVA immunized SD male rats, respectively.ST.Seminiferous tubules; LC.Leydig cells.Short arrows.Spermatogonia; Long arrows.Primary spermococyte; Round area. Spermatid; Square area.Spermatozoa.Testicular tissues were stained by H & E stain 图 5 不同新蛋白构型GnRH抗原主动免疫对SD雄鼠睾丸组织结构的影响(400×) Fig. 5 Effects of active immunization against different types of new GnRH-like constructs on testis histology in SD male rats (400×) |
如图 6A所示,与完整对照组相比,3种不同新蛋白构型GnRH主动免疫均显著下调SD大鼠垂体GnRHR、LHβ与FSHβ mRNA表达水平(P < 0.05)。G6KT-OVA免疫组与G6KT-OVA免疫组垂体所测基因mRNA表达水平均差异不显着(P>0.05),均显著低于G6KTD免疫组相应基因GnRHR、LHβ mRNA表达水平(P < 0.05)。与完整对照组相比,手术去势显著上调垂体GnRHR、LHβ和FSHβ mRNA的表达水平(P < 0.05)。
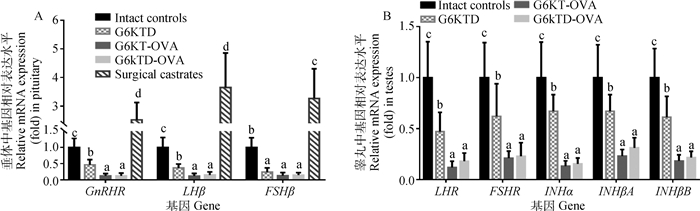
|
同一基因不同字母表示差异显著(P < 0.05)。图 7D, E同 Different letters of the same gene indicate significant differences (P < 0.05). The same as Fig. 7D, E 图 6 不同新蛋白构型GnRH主动免疫对垂体-睾丸生殖相关基因mRNA表达水平的影响 Fig. 6 Effects of active immunization against different GnRH-like peptide constructs on mRNA expression of reproduction-associated genes in pituitary-testis axis of SD male rats |
与完整对照组相比,3种不同新蛋白构型GnRH主动免疫均显著下调SD雄鼠睾丸LHR、FSHR、INHα、INβA及INHβB基因mRNA表达水平(P < 0.05);G6KT-OVA免疫组与G6KT-OVA免疫组睾丸所测基因mRNA表达水平均差异不显著(P>0.05),均显著低于G6KTD免疫组相应基因mRNA表达水平(P < 0.05) (图 6B)。
2.7 SD雄鼠G6KTD免疫组指标重分析在G6KTD免疫的12只SD雄鼠中,其中9只雄鼠加免后抗体反应明显,同时生殖激素LH、FSH和睾酮显著下降,而剩余的3只则加免后抗体反应不大,生殖激素LH、FSH和睾酮与完整对照组相比没有显著变化。为了更好地分析G6KTD主动免疫对雄鼠生殖功能的影响,将有生物学反应的9只雄鼠单独归为一组,称为免疫反应组(responders),另外3只没有生物学反应的雄鼠单独归为另一组,称为免疫“逃逸”组(nonresponders),然后进行组间数据比对分析。
结果显示,免疫反应雄鼠G6KTD初免后血清抗体滴度(图 7A)显著升高(P < 0.05),加免后进一步大幅升高(P < 0.05);与完整对照组相比,免疫反应雄鼠初免后血清睾酮(图 7B)和抑制素B(图 7C)浓度无显著变化(P>0.05),但加免后均显著降低(P < 0.05);而免疫“逃逸”雄鼠在初免和加免后血清抗体浓度小幅升高(P < 0.05),但血清抗体滴度一直低于免疫反应组雄鼠(P < 0.05) (图 7A)。整个试验期间,免疫“逃逸”雄鼠血清睾酮、抑制素B浓度与完整对照组雄鼠无显著差别(P>0.05),加免后均显著高于免疫反应组雄鼠血清睾酮、抑制素B浓度(P < 0.05) (图 7B和C)。
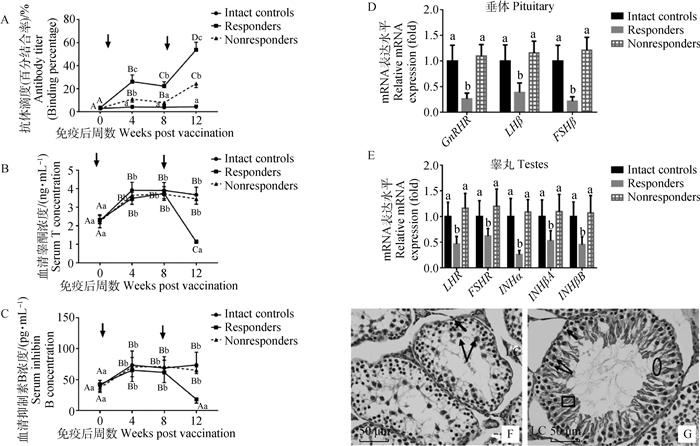
|
A.血清GnRH抗体滴度;B.血清睾酮浓度;C.血清抑制素B浓度。D、E.垂体-睾丸生殖相关基因mRNA表达。F.免疫反应鼠睾丸组织学变化;G.“逃逸”鼠睾丸组织学变化。短箭头.精元细胞;长箭头.初级精母细胞;椭圆.精子细胞;矩形.精子;LC.间质细胞;睾丸组织切片进行H&E染色 A-C.Serum concentrations of antibody titers, testosterone and inhibin B, respectively. D-E.mRNA expression levels of reproduction-related genes in pituitary and testes, respectively; F, G. Testicular tissues of a responder rat and a nonresponder. Cells in spermatogensis are shown as spermatogonia (short arrows), primary spermatocyte (long arrows), spermatid (ellipse) and spermatozoa (square), LC.Leydig cell. Testicular tissues were stained with H & E 图 7 G6KTD免疫组免疫反应鼠和“逃逸”鼠间指标对比分析(400×) Fig. 7 Comparative analysis between G6KTD immunized responder rats and nonresponder rats (400×) |
在发现血清生殖激素指标在G6KTD免疫反应鼠和“逃逸”鼠间存在差异后,进一步分析垂体和睾丸基因表达(图 7D,E)。与血清激素浓度变化一致,G6KTD免疫反应组垂体GnRHR、LHβ和FSHβ以及睾丸LHR、FSHR、INHα、INβA及INHβB基因mRNA表达水平显著低于完整对照和G6KTD免疫“逃逸”组雄鼠(P < 0.05)。垂体和睾丸所检测基因在G6KTD免疫“逃逸”组雄鼠和完整对照组间无显著差异(P>0.05)。睾丸组织形态学分析如图 7F、G和表 2所示,G6KTD免疫反应雄鼠睾丸重量和体积显著低于完整对照雄鼠(intact controls) (P < 0.05)。而免疫“逃逸”雄鼠和完整对照雄鼠睾丸重量和体积差异不显著(P>0.05)。组织切面显示,免疫反应雄鼠睾丸发育和精子发生受到抑制(图 7F,G)。组织形态分析软件分析结果显示,免疫反应雄鼠睾丸曲精细管直径及各级生精细胞数量均显著降低(P < 0.05);而免疫“逃逸”雄鼠睾丸曲精细管直径及各级生精细胞数量均与完整对照雄鼠相似,两者间差异不显著(P>0.05)(表 2)。
|
|
表 2 睾丸形态学指标分析 Table 2 Effects of treatment on testes characteristics |
下丘脑合成和分泌的GnRH作为生殖系统的总开关。给动物主动免疫外源性GnRH,利用动物自身免疫系统产生抗GnRH抗体,从而抑制或彻底终止垂体-性腺轴功能,继而抑制或终止生殖激素合成,致使性腺组织萎缩,终止配子发生,从而达到去势或避孕的效果[12]。因此,GnRH主动免疫已经成为替代传统外科手术阉割去势的技术,以便于动物管理、去势或避孕、改善肉质及提高动物生产性能,治疗性激素依赖性疾病和控制野生动物及城市流浪动物群体数量等[3, 12-13]。
GnRH是仅由10个氨基酸组成短肽,本身没有免疫原性[14]。因此,开发GnRH生殖免疫调控疫苗,首要解决的问题就是如何制备具有免疫原性的GnRH抗原。一个分子免疫原性的有无或强弱很大程度上取决于其分子量的大小。因此,使天然GnRH获得免疫原性的常用策略:1)将GnRH分子与高免疫原性大分子载体蛋白偶联;2)利用基因工程生产GnRH融合蛋白等方法[3]。基因工程生产GnRH融合蛋白,过程繁琐,分离纯化高纯度的GnRH抗原特别困难,难于进行质量控制。因此,该方法目前几乎仅停留在实验室研究阶段,生产实践中尚未得到实际应用。将GnRH分子与大分子载体蛋白偶联、制备及纯化过程相对简单,易于进行质量控制和标准化生产,同时GnRH偶联物免疫原性也相对较高。因此,该领域一直是GnRH生殖免疫调控疫苗研发和应用的主要方向。
本研究针对这一现实难点,在坚持将GnRH分子与载体蛋白偶联制备GnRH抗原这一基本设计思路的前提下,对GnRH分子自身的构型进行修饰,以期提高GnRH抗原免疫原性和降低使用量。本研究制备了3种不同蛋白构型的GnRH抗原,并在SD雄鼠上进行免疫去势效果的对比评价研究。以D型赖氨酸(D-lysine)取代天然GnRH 10肽第6位甘氨酸(glysine)为偶联大分子载体提供偶联位点,即以D型赖氨酸上的-NH2为偶联位点(G6K-GnRH):Glu-His-Trp-Ser-Tyr- Lys -Leu-Arg-Pro-Gly-NH2。以化学合成法,合成G6K-GnRH并列体(G6K-GnRH-tandem,G6KT:Glu-His-Trp-Ser-Tyr- Lys -Leu-Arg-Pro-Gly-Glu-His- Trp-Ser-Tyr- Lys -Leu -Arg-Pro-Gly。使GnRH自身分子量增加一倍。在此基础上,进一步通过化学反应将G6K-GnRH-tandem进行二聚化,形成G6K-GnRH-tandem-dimer(G6KT),在改变GnRH自身构型的基础上,将GnRH分子量增大4倍。将G6KT及G6KTD分别与卵清蛋白(OVA)进行偶联,形成新蛋白构型抗原G6KT-OVA及G6KTD-OVA。将G6KTD、G6KT-OVA及G6KTD-OVA配与温和矿物佐剂Specol主动免疫SD雄鼠。每次使用100 μg当量的GnRH蛋白多肽,主动免疫2次,间隔为8周,G6KTD、G6KT-OVA及G6KTD-OVA三免疫组均产生了良好的抗体反应。其中,G6KT-OVA及G6KTD-OVA免疫组仅初免就能诱发较高水平的抗体反应,单次免疫后就能显著降低雄鼠体内LH、FSH及睾酮激素浓度。在试验结束时,两免疫组睾酮重量及体积均下降到完整对照组50%以下,精子发生完全被终止,垂体睾丸生殖相关基因mRNA表达显著下降。血清抑制素B由睾丸支持细胞(Sertoli cells)合成和分泌,与睾丸精子生成密切相关[15]。笔者前期研究结果表明,抑制素B完全可以替代替睾酮作为GnRH免疫去势成功与否的判定标准[16]。本试验所制备3种新蛋白构型GnRH抗原主动免疫SD雄鼠后其血清抑制素B显著降低,表明该3种新蛋白构型GnRH作为免疫去势抗原的有效性。而同等情况下,目前市场上已经商业化应用的GnRH单体与载体蛋白偶联的典型代表抗原IMPROVAC,则需要加强免疫后才能有效的诱发抗体反应和降低动物体内生殖激素含量[17]。
本研究在免疫原用量和免疫程序一致的情况下,未发现G6KT-OVA及G6KTD-OVA两新蛋白构型免疫原,在免疫去势效果上的差异。笔者早期在公猪上研究了G6KTD-OVA的剂量效应,发现G6KTD-OVA免疫去势效果呈现剂量效应,在一定范围内随着G6KTD-OVA剂量的增加,免疫去势效果增强,但当抗原用量超过一定量后,免疫去势效果不再随着抗原用量增加而增加[8]。在该研究中,发现仅使用10 μg剂量的G6KTD-OVA就能在公猪体内引起良好的抗体反应和生物学反应[8]。因此,本研究中,G6KT-OVA及G6KTD-OVA的用量可能均超过了两者剂量效应的用量范围。在低剂量时,G6KT-OVA及G6KTD-OVA两抗原间是否存在免疫学和生物学的差异性,有待进一步研究。
本研究中在不偶联载体蛋白的情况下,仅将G6KTD配以Specol佐剂主动免疫大鼠,虽然初次免疫几乎没有明显的效果,但随着加强免疫后血清抗体滴度的迅速增加,血清LH、FSH和睾丸激素浓度受到抑制。在G6KTD免疫的12只雄鼠中,其中9只雄鼠加免后抗体反应明显,同时生殖激素LH、FSH和睾酮显著下降,而剩余的3只则加免后抗体反应不大,生殖激素LH、FSH和睾酮与完整对照组相比没有显著变化。为了更好地分析G6KTD主动免疫对雄鼠生殖功能的影响,将有抗体和生物学反应的9只雄鼠单独为一组进行分析(称为G6KTD免疫反应鼠,responders),另外3只免疫反应弱,没有生物学反应的雄鼠也单独为一组进行分析(称为G6KTD免疫“逃逸”鼠,non-responders)。对比研究免疫反应鼠和“逃逸”鼠各项指标后,发现G6KTD免疫反应组雄鼠试验结束时其睾丸重量和体积分别减少到完整对照的64%和62%,且睾丸发育和精子生成都显著受到抑制。此外,垂体和睾丸生殖重要基因mRNA表达水平也显著降低。与本研究结果相同,Oonk等[14]证实,G6KTD主动免疫能有效抑制仔猪的繁殖功能。然而使用弗氏佐剂乳化G6KTD,弗氏佐剂由于能引起强烈的炎症反应,因此在实际应用中不可接受[14]。本研究在使用温和佐剂Specol乳化G6KTD后,主动免疫也有效诱导SD雄鼠产生抗体并抑制生殖功能。免疫G6KTD后的生物反应模式与商业化的GnRH疫苗Improvac(Pfizer)相似,其中血清生殖激素浓度的降低和睾丸发育的抑制也仅在加强免疫后才发生[17]。虽然,本研究中25%免疫鼠在主动免疫G6KTD后没有产生有效的免疫学和生物学反应,但笔者仅注射100 μg的抗原剂量和加强免疫1次。如果增加免疫原用量或增加免疫次数,能进一步增强G6KTD免疫去势效果。因此,在不偶联载体蛋白的情况下,G6KTD可单独作为GnRH抗原,配上Specol佐剂可用作免疫去势和避孕疫苗。GnRH分子偶联载体蛋白过程浪费大量GnRH抗原,同时偶联后也需要纯化,单独使用G6KTD作为GnRH去势抗原则能有效避开GnRH分子与载体蛋白偶联中所面临的问题。
4 结论本研究结果表明,增加GnRH的拷贝数能显著改善新蛋白构型GnRH抗原效果,新蛋白构型G6K-GnRH并列体二聚物(G6KTD)具有较强的免疫原性,可不与载体蛋白偶联单独作为GnRH去势抗原,继而能有效避开GnRH分子与载体蛋白偶联所面临的GnRH抗原损失严重及与载体偶联后需纯化等问题。新蛋白构型G6KT-OVA和G6KTD-OVA具有极强的免疫原性,初次免疫就能达到抑制生殖轴生殖激素分泌的目的,在作为单剂量GnRH疫苗方面具良好的开发前景。
| [1] | CLARKE H, DHILLO W S, JAYASENA C N. Comprehensive review on kisspeptin and its role in reproductive disorders[J]. Endocrinol Metab, 2015, 30(2): 124–141. DOI: 10.3803/EnM.2015.30.2.124 |
| [2] | D'OCCHIO M J. Immunological suppression of reproductive functions in male and female mammals[J]. Anim Reprod Sci, 1993, 33(1-4): 345–372. DOI: 10.1016/0378-4320(93)90123-9 |
| [3] | THOMPSON D L Jr. Immunization against GnRH in male species (comparative aspects)[J]. Anim Reprod Sci, 2000, 60-61: 459–469. DOI: 10.1016/S0378-4320(00)00116-0 |
| [4] | ALUWÉ M, TUYTTENS F A M, MILLET S. Field experience with surgical castration with anaesthesia, analgesia, immunocastration and production of entire male pigs:performance, carcass traits and boar taint prevalence[J]. Animal, 2015, 9(3): 500–508. DOI: 10.1017/S1751731114002894 |
| [5] | HAN X F, ZHOU Y Q, ZENG Y, et al. Effects of active immunization against GnRH versus surgical castration on hypothalamic-pituitary function in boars[J]. Theriogenology, 2017, 97: 89–97. DOI: 10.1016/j.theriogenology.2017.04.038 |
| [6] | APONTE P M, GUTIERREZ-REINOSO M A, SANCHEZ-CEPEDA E G, et al. Active immunization against GnRH in pre-pubertal domestic mammals:testicular morphometry, histopathology and endocrine responses in rabbits, guinea pigs and ram lambs[J]. Animal, 2018, 12(4): 784–793. DOI: 10.1017/S1751731117002129 |
| [7] | ZENG X Y, TURKSTRA J A, TSIGOS A, et al. Effects of active immunization against GnRH on serum LH, inhibin A, sexual development and growth rate in Chinese female pigs[J]. Theriogenology, 2002, 58(7): 1315–1326. DOI: 10.1016/S0093-691X(02)01036-1 |
| [8] | ZENG X Y, TURKSTRA J A, MELOEN R H, et al. Active immunization against gonadotrophin-releasing hormone in Chinese male pigs:effects of dose on antibody titer, hormone levels and sexual development[J]. Anim Reprod Sci, 2002, 70(3-4): 223–233. DOI: 10.1016/S0378-4320(02)00014-3 |
| [9] | HAN X F, CAO X H, TANG J, et al. Active immunization against GnRH reduces the synthesis of GnRH in male rats[J]. Theriogenology, 2013, 80(9): 1109–1116. DOI: 10.1016/j.theriogenology.2013.08.014 |
| [10] |
韩兴发, 曹晓涵, 杜小刚, 等. GnRH主动免疫对SD雄鼠下丘脑GnRH合成及性腺反馈系统的影响[J]. 畜牧兽医学报, 2013, 44(4): 562–569.
HAN X F, CAO X H, DU X G, et al. Effects of active immunization against GnRH on the hypothalamus GnRH biosynthesis and gonadal feedback system in sprague-dawley male rats[J]. Acta Veterinaria et Zootechnica Sinica, 2013, 44(4): 562–569. (in Chinese) |
| [11] | BOKHOUT B A, VAN GAALEN C, VAN DER HEIJDEN P J. A selected water-in-oil emulsion:composition and usefulness as an immunological adjuvant[J]. Vet Immunol Immunopathol, 1981, 2(5): 491–500. DOI: 10.1016/0165-2427(81)90009-X |
| [12] | FAGERSTONE K A, MILLER L A, KILLIAN G, et al. Review of issues concerning the use of reproductive inhibitors, with particular emphasis on resolving human-wildlife conflicts in North America[J]. Integr Zool, 2010, 5(1): 15–30. |
| [13] | LEVY J K. Contraceptive vaccines for the humane control of community cat populations[J]. Am J Reprod Immunol, 2011, 66(1): 63–70. DOI: 10.1111/j.1600-0897.2011.01005.x |
| [14] | OONK H B, TURKSTRA J A, SCHAAPER W M M, et al. New GnRH-like peptide construct to optimize efficient immunocastration of male pigs by immunoneutralization of GnRH[J]. Vaccine, 1998, 16(11-12): 1074–1082. DOI: 10.1016/S0264-410X(98)80101-1 |
| [15] | DEMYASHKIN G A. Inhibin B in seminiferous tubules of human testes in normal spermatogenesis and in idiopathic infertility[J]. Syst Biol Reprod Med, 2018. DOI: 10.1080/19396368.2018.1478470 |
| [16] | HAN X F, LI J L, ZHOU Y Q, et al. Active immunization with GnRH-tandem-dimer peptide in young male rats reduces serum reproductive hormone concentrations, testicular development and spermatogenesis[J]. Asian J Androl, 2016, 18(3): 485–491. DOI: 10.4103/1008-682X.156856 |
| [17] | CLAUS R, LACORN M, DANOWSKI K, et al. Short-term endocrine and metabolic reactions before and after second immunization against GnRH in boars[J]. Vaccine, 2007, 25(4): 4689–4696. |



