2. 甘肃农业大学, 兰州 730070
2. Gansu Agricultural University, Lanzhou 730070, China
绵羊按照尾型来划分,可分为5种类型:长痩尾、短痩尾、长脂尾、短脂尾和肥臀尾。目前普遍认为,脂尾型绵羊是在痩尾型绵羊驯化以后,经过长期的人工选择和自然环境选择进化而来。但随着科学技术的进步和人类生活水平的提高,绵羊尾脂在抗寒和食用方面的重要性逐渐降低。相反,脂尾型绵羊在饲料利用率和繁殖中的弱势逐渐表现出来。因此,找出控制绵羊尾型的基因,从分子水平改变脂尾性状,对提高经济效益具有重要意义。
本实验室前期基因组重测序、GWAS及选择信号的研究结果均表明,血小板源性生长因子-D(platelet -derived growth factor-D, PDGF-D)可能是控制绵羊尾型的关键基因。2001年,研究人员在寻找血管内皮生长因子(vascular endothelial growth factor, VEGF)同源体的过程中,意外发现一段独特的DNA互补序列,其编码区被预测为PDGF家族新成员,并命名为PDGF-D[1-2]。PDGF-D是一种促细胞分裂剂,能够促进平滑肌和纤维母细胞的分裂[3],在促进血管形成和成熟的过程中起到了重要作用[4-6]。此外,研究显示,PDGF-D基因的表达对肿瘤细胞增殖具有促进作用,并且可通过Notch信号通路来调节肿瘤转移。转录因子NF-κB的持续激活会导致细胞增殖失控,促进肿瘤转移。下调PDGF-D能使得Notch-1下调,进而使NF-κB和其靶基因失活,最终抑制肿瘤的侵袭及其周围血管的形成[5, 7]。不仅如此,PDGF-D还可介导肾[8]、肝[9]和心[10-11]的组织纤维化,在纤维化的组织和器官中均有着较高表达,但PGFD-D在组织纤维化中的具体作用机制还有待研究。
本试验主要从分子水平探索PDGF-D与绵羊尾型的关系。以往的研究显示,PDGF家族可以促进前体脂肪细胞的增殖,抑制其分化[12-13];PDGF-B能够促进成纤维细胞进行成脂分化,PDGF的级联反应可能成为甲状腺相关疾病治疗的新靶点[14]。另有研究表明,PDGF-D可通过PI3K/Akt信号通路调节脂肪源性干细胞的增殖和迁移,通过线粒体活性氧的生成和线粒体的分裂来促进其增殖和迁移[15]。自2001年PDGF-D被发现以来,针对PDGF-D的研究主要集中在人心血管疾病及肿瘤的研究,在脂肪代谢或尾型上的研究极少。本实验室之前对肥尾羊和痩尾羊的选择信号分析发现,PDGF-D与绵羊尾型及尾部脂肪沉积呈显著相关关系。因此,基于前人的试验结果,本研究重新选择了新的试验群体,对533只不同尾型的绵羊进行了混池DNA测序,利用飞行质谱分型技术检测PDGF-D基因多态性位点,随后将位点与尾型性状进行关联分析,以期寻找到与尾型相关的分子标记,为今后的育种工作提供依据。
1 材料与方法 1.1 试验材料本研究共采集了3个品种绵羊的血样并测量记录了尾长、尾宽和尾周长,其中包括:湖羊208只,其中108只来自河南洛阳,100只来自甘肃武威;藏羊171只采自甘肃天柱;154只杂交羊(杜泊羊×湖羊)采自河南洛阳。所有血样均采自颈部静脉,EDTA抗凝,-20 ℃保存,用于基因组DNA提取。
血液基因组DNA提取试剂盒购自于北京天根生化科技有限公司;dNTP Mixture、LA酶购自TaKaRa公司;分型试剂及仪器均来自于北京博淼生物科技有限公司。
1.2 试验方法 1.2.1 绵羊尾型表型性状的数据采集本试验判定的表型性状有尾长、尾宽及尾周长。尾长为脂尾羊从第一尾椎前缘到尾端的距离;尾宽为尾腹最宽处的直线距离;尾周长为软尺绕尾巴一周的长度。
1.2.2 绵羊血液全基因组DNA提取及质量检测DNA提取方法参照天根血液DNA全基因组提取试剂盒说明书,用1%琼脂糖凝胶电泳检测样本DNA质量,利用Nano drop 2000检测浓度。
1.2.3 绵羊DNA混池构建及PCR引物设计在藏羊和湖羊的DNA样本中,分别随机选择30个DNA样本,均稀释至50 ng·μL-1,每个样品取2 μL,混合均匀,分别构建藏羊和湖羊2个DNA混池用作PCR扩增。根据GenBank数据库中PDGF-D基因mRNA(登录号:XM_012095300.2)的序列信息,利用Primer 3在线设计软件(http://primer3.ut.ee/)和UCSC(http://genome.ucsc.edu/cgi-bin/hgBlat)对该基因的全部外显子和上、下游1 000 bp设计引物,并进行扩增,引物信息如表 1所示。引物由北京天一辉远生物科技有限公司合成。
|
|
表 1 筛选绵羊PDGF-D基因SNPs的引物信息 Table 1 Information of primer sequences for scanning SNPs within sheep PDGF-D gene |
PCR扩增体系为50 μL:GC buffer 25 μL,1×dNTP mixture 8 μL,LA酶0.5 μL,上下游引物各1.5 μL,DNA模板1 μL,再用ddH2O将总体积补至50 μL。扩增程序:94 ℃预变性5 min;95 ℃变性30 s,退火30 s(退火温度见表 1),72 ℃延伸30 s,35个循环;72 ℃延伸10 min,4 ℃保存。经1%凝胶电泳检测目的条带后送往北京博淼生物科技有限公司进行测序。根据测序结果,通过DNAMAN和Chromas2软件比对分析,确定SNP位点。
1.2.5 试验绵羊基因分型SNP基因分型的方法多种多样,其中高通量的分型方法有Affimatrix公司的GeneChip技术和IIumina公司的BeadArray技术等,中等通量分型方法以SEGUENOM公司的飞行时间质谱基因分型技术和PE公司的荧光偏振光基因分型技术为代表[16]。飞行时间质谱基因分型技术可同时最多对30个位点进行基因分型,准确性高。本试验中采用该方法,针对确定的SNP位点,对533只绵羊进行基因分型。
1.3 数据处理与统计分析利用SPSS19.0软件将个体基因型与尾长、尾宽和尾周长进行关联分析,数据以“平均值±标准误”表示;利用Haploview 4.1软件进行连锁不平衡分析;利用Microsoft Excel 2013统计各个位点的等位基因频率、基因型频率、多态信息含量(PIC)、纯合度(Ho)、杂合度(He)和有效等位基因数(Ne)。统计方法如下:
| $\begin{array}{l} PIC = 1 - \left( {\sum\nolimits_{i = 1}^n {P_i^2} } \right) - \left( {\sum\nolimits_{i = 1}^{n - 1} {\sum\nolimits_{j = i + 1}^n {2P_i^2P_j^2} } } \right);\\ {H_O} = \sum\nolimits_{i = 1}^n {P_i^2} {\rm{; }}{H_e} = 1 - \sum\nolimits_{i = 1}^n {P_i^2} {\rm{; }}{N_e} = 1/\sum\nolimits_{i = 1}^n {P_i^2} . \end{array}$ |
其中,n为等位基因个数,Pi和Pj为第i个和第j个等位基因在群体中的频率。
单基因效应方差分析统计模型:Y=μ+G+p+m+e。
其中,Y为性状测定值,μ为群体均值,G为PDGF-D基因型效应,p为场效应,m为性别效应,e为随机残差。
组合基因型效应方差分析统计模型:Y12=μ+G1+G2+G12+p+m+e。
其中,Y12为性状测定值,μ为群体均值,G1为rs6位点的基因型效应,G2为rs13位点的基因型效应,G12为rs6和rs13两个位点的交互效应,p为场效应,m为性别效应,e为随机残差。
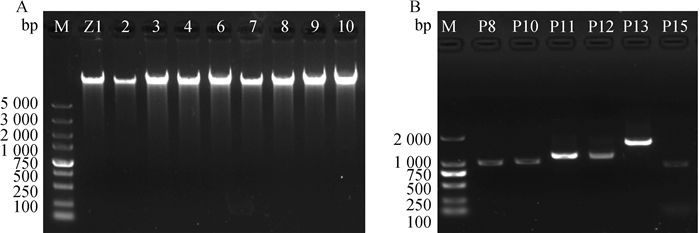
2 结果 2.1 绵羊基因组DNA的提取和PDGF-D基因及其上下游1 000 bp的PCR扩增如图 1所示,基因组DNA电泳条带完整清晰,无前后拖尾现象,说明所提取DNA完整且纯度较高。PDGF-D基因及上下游1 000 bp的PCR扩增产物电泳条带单一清晰,无杂带,目的片段纯度较高。
|
A.全基因组DNA凝胶电泳;B. PDGF-D基因及上下游1 000 bp的PCR扩增产物凝胶电泳 A. Agarose gel electrophoresis of gDNA; B. Agarose gel electrophoresis of PCR products of PDGF-D and 1 000 bp of upstream and downstream 图 1 基因组DNA电泳胶图及PCR扩增产物凝胶图 Fig. 1 Agarose gel electrophoresis of gDNA and PCR products |
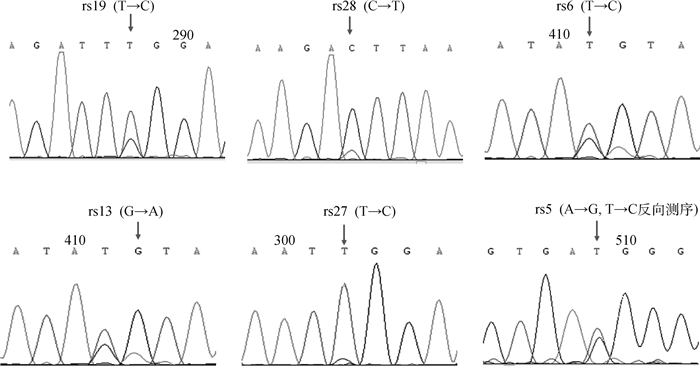
根据混池测序的结果(图 2),PDGF-D基因内及其上下游1 000 bp共发现了6个突变位点。第八外显子内有1个T→C的突变(rs19);第三内含子内发现3个突变位点:rs28(C→T)、rs6(T→C)、rs13(G→A);第五内含子内发现1个T→C的突变(rs27);上游调控区0~500 bp之间发现1个A→G的突变(rs5)。
|
图 2 绵羊PDGF-D基因及上下游1 000 bp突变位点序列 Fig. 2 The sequence of mutant sites of PDGF-D and 1 000 bp of upstream and downstream |
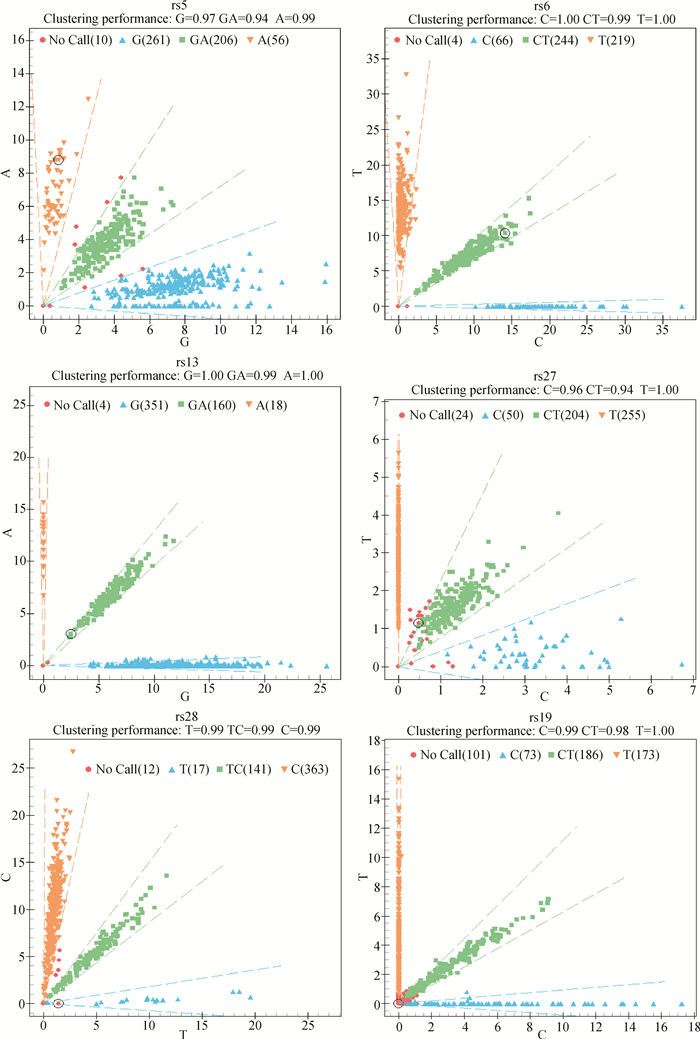
飞行质谱的结果表明,PDGF-D基因及上下游1 000 bp的6个突变位点均分别检测到3种基因型,各位点分型结果如图 3所示。
|
黄色、蓝色和绿色区域分别代表一种基因型,括号里的数字表示该基因型的个体数 Yellow, blue and green regions represent different genotypes, respectively. Numbers in brackets means number of individuals of the 3 genotypes 图 3 突变位点的质谱分型结果 Fig. 3 Mass spectrometry results of mutation sites |
对6个突变位点进行遗传多态性分析发现,rs5位点处有3种基因型:AA、GA和GG,其频率分别是0.11、0.39和0.50,优势等位基因是G,其频率为0.70。rs6位点处的优势基因型为CT,其频率为0.46,优势等位基因为T,其频率达到0.64。rs13位点处的3种基因型分别是AA、GA和GG,基因型频率分别为0.03、0.30和0.66,优势等位基因为G,其频率高达0.82。rs27位点处3种基因型为CC、CT和TT,优势等位基因为T,其频率为0.70,优势基因型为TT,其频率为0.49。rs19位点处的优势等位基因为T,其频率达0.62,优势基因型为CT,其频率为0.45。rs28位点处有CC、TC和TT 3种基因型,优势基因型为CC,其频率为0.69,优势等位基因为C,其频率高达0.83(表 2)。
|
|
表 2 绵羊PDGF-D基因6个位点的基因型频率和等位基因频率 Table 2 The genotype frequency and allele frequency of 6 SNPs of ovine PDGF-D gene |
由表 3可知,在试验群体中,rs28位点的杂合度最低,为0.28,rs19的杂合度最高,为0.47。6个位点中除了rs28表现为低度多态以外(PIC < 0.25),其余5个位点均表现现出中度多态(0.25 < PIC < 0.5)。Hardy-Weinberg平衡检验的P值显示,6个位点在试验群体中均处于Hardy-Weinberg平衡状态(P>0.05)。从有效等位基因数来看,均较为接近2,表明这些位点的等位基因分布较为均匀。
|
|
表 3 6个突变位点的遗传多态性及Hardy-Weinberg平衡检验 Table 3 The genetic diversity of 6 SNPs and the Hardy-Weinberg equilibrium test |
使用SPSS 19.0软件对绵羊PDGF-D基因多态位点的基因型与尾型性状(尾长、尾宽和尾周长)进行关联分析。单个位点与尾长、尾宽和尾周长的关联分析结果表明,rs5位点的3个基因型个体在尾长、尾宽和尾周长上几乎均存在着极显著差异(P < 0.01);rs6位点上,3种基因型个体只在尾长上存在差异,CC型个体与CT型个体的尾长差异显著(P < 0.05),与TT型个体差异极显著(P < 0.01);rs13位点处,3种基因型在尾长上差异不显著,AA型个体与GG型个体在尾宽和尾周长上差异极显著(P < 0.01),而GG型个体与GA型个体在尾宽上差异显著(P < 0.05),在尾周长上差异不显著;rs27位点上,TT型个体与CT型个体在尾长上差异显著(P < 0.05),CC型和TT型差异极显著(P < 0.01),而CT型和CC型的尾长差异不显著。TT型个体与CT、CC型个体尾宽均差异显著(P < 0.05),但CT和CC型个体间尾宽差异不显著,仅CC型和TT型尾周长差异显著(P < 0.05);rs19位点处,TT型个体与CT、CC型个体尾长差异显著(P < 0.05),尾宽和尾周长无明显差异;rs28位点处,TT型个体与CC、TC型个体尾长差异极显著(P < 0.01),TT型个体与CC型个体相比较,尾宽和尾周长差异极显著(P < 0.01),与TC型个体相比较,尾宽和尾周长差显著(P < 0.05),CC型和TC型间尾长、尾宽和尾周长均差异不显著(表 4)。
|
|
表 4 绵羊PDGF-D基因各突变位点与尾型性状关联分析 Table 4 Association of genotypes at different mutation sites of the PDGF-D gene with tail traits in sheep |
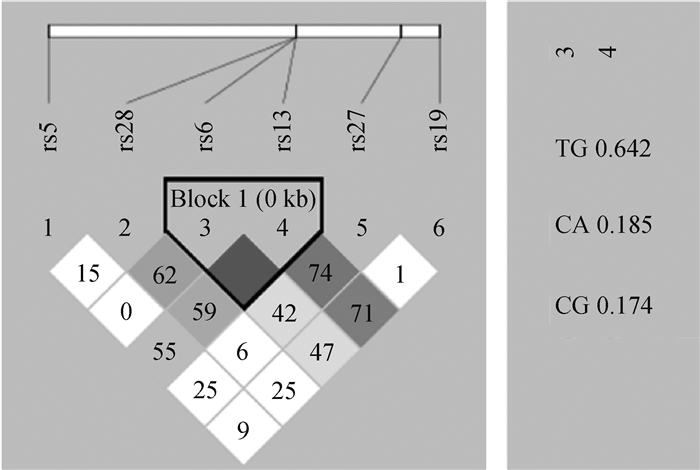
利用Haploview 4.1对这6个位点进行连锁不平衡分析(图 4),结果表明,rs6和rs13位点之间存在强连锁,在本试验群体中构建了3种单倍型,其中TG是主要单倍型,比例达0.642(图 4),其次是CA和CG,比例分别是0.185和0.174(图 4)。将rs6和rs13两个位点的基因型组合发现,共有6种组合基因型(表 5),其中TTGG为优势基因型,其基因型频率为0.411。
|
图 4 绵羊PDGF-D基因rs6~rs13位点连锁不平衡分析 Fig. 4 The loci linkage disequilibrium analysis of rs6-rs13 of PDGF-D gene in sheep |
|
|
表 5 绵羊PDGF-D基因rs6~rs13位点组合基因型与尾型性状关联分析 Table 5 Association of rs6-rs13 combined genotypes of PDGF-D gene with tail traits in sheep |
对rs6~rs13两个位点的组合基因型与尾型性状关联分析(表 5),结果表明,TTGG为优势基因型,但CCAA型个体在尾长、尾宽和尾型3个性状中几乎均显著或者极显著高于其他组合基因型(P < 0.05或P < 0.01)。其中TTGG的平均尾长最长,但除了与CCGG基因型在尾长上差异极显著(P < 0.01)以外,与其他组合基因型差异并不显著。CCAA型的平均尾宽及平均尾周长与其他组合基因型相比,呈现出显著差异(P < 0.05)或者极显著差异(P < 0.01)。值得一提的是,CCGG型的个体无论是在尾长、尾宽还是在尾周长上,其平均值均显著(P < 0.05)或者极显著(P < 0.01)低于其他组合基因型。
3 讨论 3.1 试验绵羊PDGF-D基因遗传特征分析研究显示,人PDGF-D基因多态性与心血管疾病以及肿瘤发生密切相关[17-20],该基因多态性对表型的改变具有一定的影响作用。而绵羊PDGF-D基因多态性丰富度较低,外显子保守性高,突变少,本试验筛选到的6个SNPs位点大多处于基因上下游及内含子区。其他一些研究显示,绵羊尾型形成的确受基因调控,且不止受一种基因调控。焦小丽等[21]研究表明,Lpin2基因中-663 dup ATT位点的突变降低了广灵大尾羊和小尾寒羊尾长和尾宽;高中元等[22]研究表明,PLIN基因外显子4和6的多态性与绵羊尾脂呈显著相关;张静等[23]研究显示,ANGPTL4基因内多个突变位点对广灵大尾羊和小尾寒羊尾重、尾长及尾宽有着显著影响。但目前对于PDGF-D多态性在绵羊尾型上的研究几乎是空白。遗传特征分析发现,rs13和rs28相较于其他位点,杂合度较低(0.30和0.28),且rs13和rs28的有效等位基因数较低,在群体中分布不均匀。其中,rs28还处于低度多态(0.24)。杂合度(He)、有效等位基因数(Ne)和多态信息量(PIC)常用来衡量一个群体的遗传变异程度,其数值越大,表明试验群体遗传变异度越高,遗传丰富度越高。rs13和rs28的低度多态与不均匀分布和试验群体的品种及在育成过程中受到高度选育有着极大关系。Hardy-Weinberg平衡检验发现,所有位点均处于平衡状态。本试验中所用群体均处于牧区或农户养殖状态,生长于相对闭锁的繁育环境,因此导致了这种动态平衡。
3.2 绵羊PDGF-D基因多态性与尾型的关联分析用600K的高密度芯片对大尾寒羊、阿勒泰羊和藏羊进行全基因组拷贝数变异(CNV)检测发现,PDGF-A与绵羊尾部脂肪沉积相关[24];另外,对10个代表性中国地方绵羊的种群结构进行全基因组分析和选择发现,PDGF-D在肥尾型绵羊中受到强烈选择,可能与肥尾形成有关[25-26]。袁泽湖和刘真等[27-28]用50K的基因芯片分型,利用FST和hapFLK方法对肥尾型绵羊和痩尾型绵羊进行选择信号分析,结果同样也显示,PDGF-D可能与绵羊尾部的脂肪沉积或者与尾型形成有关。Yang等[29]对来自21个地区的77只地方绵羊品种和3只野羊品种进行重测序和GO分析发现,PDGF-D在控制藏羊体型方面可能起到主导作用。此外,对44个中国地方绵羊品种和2个野羊品种共计1 061个个体进行50K基因芯片分型也发现PDGF-D可能与绵羊尾型形成有关[30]。Mastrangelo等[31]对国外13个痩尾羊品种和6个肥尾羊品种的选择信号分析发现,PDGF-D基因同样受到强烈选择。本试验中,rs5位点处GA基因型在尾长、尾宽和尾周长几乎均极显著低于纯合子(GG和AA)。rs5位于上游调控区,有研究表明,上游调控区发生突变能够改变基因的转录能力[32],对生长发育[33]以及某些疾病的发生[34]有着一定影响。此外,上游调控区发生突变会造成转录因子结合位点改变[35],可能产生新的转录因子结合位点,也可能使原有的结合位点缺失,使得基因的转录发生变化,出现不同的表型。本试验中,上游调控区突变如何影响尾型形成可在细胞水平进一步研究。rs6、rs13、rs28和rs27位点分别位于基因的第三和第五内含子区,关联分析结果显示,这些位点的突变与绵羊尾型呈相关关系,提示第三内含子和第五内含子区可能存在着未知的基因区。内含子虽然常常不被表达,但是在基因的转录调控中却起到了重要作用[36-38]:充当增强子增强基因表达[39];充当启动子启动基因表达[40];参与可变剪切产生不同mRNA,使基因翻译成不同蛋白质[41];编码小核RNA[42]等。本试验中,由内含子突变造成表型变化的具体作用机制还有待进一步研究。rs19位于第八外显子,是1个T→C突变,突变基因型CC在尾长上显著高于TT型。但是,通过比对发现,第八外显子存在于PDGF-D基因的mRNA上,而编码区只含有第八外显子的部分区域,rs19位于非编码区,这表明第八外显子大部分可能位于调控区。目前普遍认为,3′端调控区参与了转录后调控,对mRNA稳定、基因的转录效率及表达定位都有着重要作用[43-44]。rs19对绵羊尾长的转录后调控还需进一步研究。
动物的表型不仅受单个突变位点的影响,多个突变位点的组合效应对表型也会产生重大影响[45]。将多个位点进行组合产生的组合基因型分析能够考虑非等位基因的相互作用以及突变位点之间的连锁不平衡[46],具有更好的统计效力。本试验组合基因型分析发现,无论是从尾长、尾宽还是尾周长的角度,CCGG型个体尾型性状的平均值均低于其他组合基因型且多数达到显著水平,与CC和GG型相比也优于单个基因型。与之相反,CCAA型个体的尾长、尾宽以及尾周长平均值高于其他组合基因型且多达到显著水平。rs6与rs13均是内含子突变,二者连锁后相互影响使得调控效应增强,两个位点基因型组合后产生优化尾型的基因型。CCGG型均是纯合子的组合基因型,有利于基因型固定,但是在群体中比重较少。在今后的育种过程中可以加大对CCGG型个体的人工选育,扩大数目,而CCAA型个体则可以选择淘汰,不断优化和固定小尾基因型。
4 结论本研究以湖羊(肥尾)、藏羊(痩尾)和杂交羊(杜泊×湖羊,中间型尾型)为试验对象,采用DNA混池测序、质谱分型等技术对PDGF-D基因的多态性与尾型性状进行关联分析。结果显示,rs5、rs27和rs28 3个位点的3种基因型间在尾长、尾宽以及尾周长上均存在显著差异,rs6和rs19位点仅与尾长相关,rs13位点与尾宽和尾周长相关。rs6~rs13连锁不平衡分析发现,CCGG型个体的尾长、尾宽及尾周长均小于其他基因型,可考虑将CCGG型作为筛选小尾绵羊的潜在分子标记,但是该基因型个体在群体中所占的比重较小,可适当增强人工选育以扩大数目。
| [1] | HAMADA T, UI-TEI K, IMAKI J, et al. Molecular cloning of SCDGF-B, a novel growth factor homologous to SCDGF/PDGF-C/fallotein[J]. Biochem Biophs Res Commun, 2001, 280(3): 733–737. DOI: 10.1006/bbrc.2000.4187 |
| [2] | LAROCHELLE W J, JEFFERS M, MCDONALD W F, et al. PDGF-D, a new protease-activated growth factor[J]. Nat Cell Biol, 2001, 3(5): 517–521. DOI: 10.1038/35074593 |
| [3] | KURASAWA K, ARAI S, OWADA T, et al. Autoantibodies against platelet-derived growth factor receptor alpha in patients with systemic lupus erythematosus[J]. Mod Rheumatol, 2010, 20(5): 458–465. DOI: 10.3109/s10165-010-0310-x |
| [4] | CHEN J H, YUAN W Z, WU L, et al. PDGF-D promotes cell growth, aggressiveness, angiogenesis and EMT transformation of colorectal cancer by activation of Notch1/Twist1 pathway[J]. Oncotarget, 2017, 8(6): 9961–9973. |
| [5] | WANG Z W, KONG D J, BANERJEE S, et al. Down-regulation of platelet-derived growth factor-D inhibits cell growth and angiogenesis through inactivation of Notch-1 and nuclear factor-κB signaling[J]. Cancer Res, 2007, 67(23): 11377–11385. DOI: 10.1158/0008-5472.CAN-07-2803 |
| [6] | UUTELA M, WIRZENIUS M, PAAVONEN K, et al. PDGF-D induces macrophage recruitment, increased interstitial pressure, and blood vessel maturation during angiogenesis[J]. Blood, 2004, 104(10): 3198–3204. DOI: 10.1182/blood-2004-04-1485 |
| [7] | AHMAD A, WANG Z W, KONG D J, et al. RETRACTED ARTICLE:Platelet-derived growth factor-D contributes to aggressiveness of breast cancer cells by up-regulating Notch and NF-κB signaling pathways[J]. Breast Cancer Res Trea, 2011, 126(1): 15–25. |
| [8] | BUHL E M, DJUDJAJ S, BABICKOVA J, et al. The role of PDGF-D in healthy and fibrotic kidneys[J]. Kidney Int, 2016, 89(4): 848–861. DOI: 10.1016/j.kint.2015.12.037 |
| [9] | BORKHAM-KAMPHORST E, VAN ROEYEN C R C, OSTENDORF T, et al. Pro-fibrogenic potential of PDGF-D in liver fibrosis[J]. J Hepatol, 2007, 46(6): 1064–1074. DOI: 10.1016/j.jhep.2007.01.029 |
| [10] | ZHAO T Q, ZHAO W Y, CHEN Y J, et al. Platelet-derived growth factor-D promotes fibrogenesis of cardiac fibroblasts[J]. Am J Physiol:Heart Circ Physiol, 2013, 304(12): H1719–H1726. DOI: 10.1152/ajpheart.00130.2013 |
| [11] |
张银辉, 于晖, 宋燕, 等. 血小板源性生长因子D抗体制备及其在人心脏纤维化组织中的表达[J]. 中国分子心脏病学杂志, 2012, 12(6): 337–340.
ZHANG Y H, YU H, SONG Y, et al. PDGF-D promoted myocardial fibrosis byupregulation of collagen Ⅰ[J]. Molecular Cardiology of China, 2012, 12(6): 337–340. DOI: 10.3969/j.issn.1671-6272.2012.06.005 (in Chinese) |
| [12] | ARTEMENKO Y, GAGNON A, AUBIN D, et al. Anti-adipogenic effect of PDGF is reversed by PKC inhibition[J]. J Cell Physiol, 2005, 204(2): 646–653. DOI: 10.1002/(ISSN)1097-4652 |
| [13] | HOLMSTRÖM T E, MATTSSON C L, FÄLTING J M, et al. Differential signalling pathways for EGF versus PDGF activation of Erk1/2 MAP kinase and cell proliferation in brown pre-adipocytes[J]. Exp Cell Res, 2008, 314(19): 3581–3592. DOI: 10.1016/j.yexcr.2008.09.007 |
| [14] | VIRAKUL S, DALM V A S H, PARIDAENS D, et al. Platelet-derived growth factor-bb enhances adipogenesis in orbital fibroblasts[J]. Invest Ophthalmol Vis Sci, 2015, 56(9): 5457–5464. DOI: 10.1167/iovs.15-17001 |
| [15] | HYE KIM J, GYU PARK S, KIM W K, et al. Functional regulation of adipose-derived stem cells by PDGF-D[J]. Stem Cells, 2015, 33(2): 542–556. |
| [16] |
赵辉, 王威, 张清润, 等. 高通量飞行时间质谱基因分型方法的研究[J]. 生物化学与生物物理进展, 2005, 32(7): 667–672.
ZHAO H, WANG W, ZHANG Q R, et al. The study of high throughput MALDI-TOF genotyping assay[J]. Progress in Biochemistry and Biophysics, 2005, 32(7): 667–672. DOI: 10.3321/j.issn:1000-3282.2005.07.015 (in Chinese) |
| [17] | BAI Y Y, CHEN J Z, SUN K, et al. A functional variant in promoter region of Platelet-derived Growth Factor-D is probably associated with intracerebral hemorrhage[J]. J Neuroinflammation, 2012, 9: 26. |
| [18] |
高静, 刘相飞, 陈玉东. 黄三角地区人群中PDGF-D基因多态性与冠心病的相关性[J]. 中国动脉硬化杂志, 2016, 24(9): 944–948.
GAO J, LIU X F, CHEN Y D. Correlation of PDGF-D gene polymorphism with coronary artery disease in huangsanjiao population[J]. Chinese Journal of Arteriosclerosis, 2016, 24(9): 944–948. (in Chinese) |
| [19] |
刘相飞, 陈玉东, 高静. 血小板源性生长因子基因多态性与冠状动脉粥样斑块性质的相关性[J]. 实用医学杂志, 2016, 32(5): 758–760.
LIU X F, CHEN Y D, GAO J. Correlation of PDGF-D gene polymorphism with coronary atherosclerotic plaque[J]. The Journal of Practical Medicine, 2016, 32(5): 758–760. DOI: 10.3969/j.issn.1006-5725.2016.05.021 (in Chinese) |
| [20] |
杨志伟, 王燕锋, 朱大勇, 等. 血小板源性生长因子-D基因多态性与大肠癌遗传易感性关系的研究[J]. 医学研究杂志, 2014, 43(9): 60–63.
YANG Z W, WANG Y F, ZHU D Y, et al. Study on Association of platelet-derived growth factor-d gene polymorphism with genetic susceptibility to colorectal cancer[J]. Journal of Medical Research, 2014, 43(9): 60–63. (in Chinese) |
| [21] |
焦小丽, 景炅婕, 乔利英, 等. 绵羊Lpin2基因多态性及其与尾型和屠宰性状的关联分析[J]. 中国畜牧兽医, 2017, 44(4): 1037–1045.
JIAO X L, JING J J, QIAO L Y, et al. Polymorphisms of Lpin2 gene and its association with tail type and slaughter traits in sheep[J]. China Animal Husbandry & Veterinary Medicine, 2017, 44(4): 1037–1045. (in Chinese) |
| [22] |
高中元, 林婄婄, 袁亚男, 等. PLIN基因多态性及其与绵羊尾形和屠宰性状的关联研究[J]. 山西农业大学学报:自然科学版, 2012, 32(2): 158–164.
GAO Z Y, LIN P P, YUAN Y N, et al. Study on the polymorphism of PLIN gene and its association with tail and slaughter traits in sheep[J]. Journal of Shanxi Agricultural University:Natural Science Edition, 2012, 32(2): 158–164. (in Chinese) |
| [23] |
张静, 景炅婕, 张方, 等. 绵羊ANGPTL4基因的多态性及其与尾型和屠宰性状的关联研究[J]. 中国畜牧杂志, 2016, 52(5): 12–18.
ZAHNG J, JING J J, ZHANG F, et al. Study on polymorphisms of ovine ANGPTL4 gene and the associations with tail type and slaughter traits[J]. Chinese Journal of Animal Science, 2016, 52(5): 12–18. DOI: 10.3969/j.issn.0258-7033.2016.05.003 (in Chinese) |
| [24] | ZHU C Y, FAN H Y, YUAN Z H, et al. Genome-wide detection of CNVs in Chinese indigenous sheep with different types of tails using ovine high-density 600K SNP arrays[J]. Sci Rep, 2016, 6: 27822. DOI: 10.1038/srep27822 |
| [25] | WEI C H, WANG H H, LIU G, et al. Genome-wide analysis reveals population structure and selection in Chinese indigenous sheep breeds[J]. BMC Genomics, 2015, 16: 194. DOI: 10.1186/s12864-015-1384-9 |
| [26] |
王慧华. 中国地方绵羊群体结构分析及基因组选择痕迹挖掘[D]. 北京: 中国农业科学院, 2015.
WANG H H, Genome-wide analysis reveals population structure and selection in Chinese indigenous sheep breeds[D]. Beijing: Chinese Academy of Agricultural Sciences, 2015. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-82101-1015378859.htm |
| [27] |
袁泽湖. 利用选择信号分析方法筛选与绵羊尾型相关的基因[D]. 北京: 中国农业科学院, 2016.
YUAN Z H. Analysis of selection signatures identify genes associated with tail type in sheep[D]. Beijing: Chinese Academy of Agricultural Sciences, 2016. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-82101-1016174589.htm |
| [28] |
刘真, 王慧华, 刘瑞凿, 等. 不同尾型绵羊全基因组选择信号检测[J]. 畜牧兽医学报, 2015, 46(10): 1721–1732.
LIU Z, WANG H H, LIU R Z, et al. Genome-wide detection of selection signatures of distinct tail types in sheep populations[J]. Chinese Journal of Animal and Veterinary Sciences, 2015, 46(10): 1721–1732. (in Chinese) |
| [29] | YANG J, LI W R, LV F H, et al. Whole-genome sequencing of native sheep provides insights into rapid adaptations to extreme environments[J]. Mol Biol Evol, 2016, 33(10): 2576–2592. DOI: 10.1093/molbev/msw129 |
| [30] | ZHAO Y X, YANG J, LV F H, et al. Genomic reconstruction of the history of native sheep reveals the peopling patterns of nomads and the expansion of early pastoralism in East Asia[J]. Mol BiolEvol, 2017, 34(9): 2380–2395. |
| [31] | MASTRANGELO S, MOIOLI B, AHBARA A, et al. Genome-wide scan of fat-tail sheep identifies signals of selection for fat deposition and adaptation[J]. Anim Prod Sci, 2018. DOI: 10.1071/AN17753 |
| [32] | SUZUKI S, ZONG W Y, HIRAI M, et al. Genetic variations at urotensin Ⅱ and urotensin Ⅱ receptor genes and risk of type 2 diabetes mellitus in Japanese[J]. Peptides, 2004, 25(10): 1803–1808. DOI: 10.1016/j.peptides.2004.03.030 |
| [33] |
姜运良, 李宁, 杜立新, 等. 猪肌肉生长抑制素基因5'调控区T→A突变与生长性状的关系分析[J]. 遗传学报, 2002, 29(5): 413–416.
JIANG Y L, LI N, DU L X, et al. Relationship of T→A mutation in the promoter region of myostatin gene with growth traits in swine[J]. Journal of Genetics and Genomics, 2002, 29(5): 413–416. (in Chinese) |
| [34] |
余勐. 新疆维吾尔妇女宫颈癌组织中HPV16上游调控区突变及其与宫颈癌发生关系的研究[D]. 乌鲁木齐: 新疆大学, 2006.
YU M. Studies on the relationship between the mutation of HPV16 URR from cervical carcinoma biopsies and the occurrence of cervical cancer in Xinjiang Uygur[D]. Urumqi: Xinjiang University, 2016. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10755-2006132475.htm |
| [35] |
许艳丽. 牛FSHβ基因上游调控区连锁突变对其转录的影响分析[D]. 长春: 吉林大学, 2011.
XU Y L. Effect of chain mutation of FSHβ gene upstream regulatory region on transcription in bovine[D]. Changchun: Jilin University, 2011. (in Chinese) http://cdmd.cnki.com.cn/article/cdmd-10183-1011102188.htm |
| [36] | BHATTACHARYYA N, BANERJEE D. Transcriptional regulatory sequences within the first intron of the chicken apolipoproteinAI (apoAI) gene[J]. Gene, 1999, 234(2): 371–380. DOI: 10.1016/S0378-1119(99)00183-3 |
| [37] | CLEMENT J Q, WILKINSON M F. Rapid induction of nuclear transcripts and inhibition of intron decay in response to the polymerase Ⅱ inhibitor DRB[J]. J Mol Biol, 2000, 299(5): 1179–1191. DOI: 10.1006/jmbi.2000.3745 |
| [38] | KINCH L N, GRISHIN N V. Evolution of protein structures and functions[J]. Curr Opin Struct Biol, 2002, 12(3): 400–408. DOI: 10.1016/S0959-440X(02)00338-X |
| [39] |
王以婷, 杨卫红, 赵云龙, 等. CYP3A4内含子10对CYP3A4基因表达的增强子作用[J]. 昆明医科大学学报, 2017, 38(1): 13–17.
WANG Y T, YANG W H, ZHAO Y L, et al. The Enhancer role of CYP3A4 intron 10 in CYP3A4 gene expression[J]. Journal of Kunming Medical University, 2017, 38(1): 13–17. DOI: 10.3969/j.issn.1003-4706.2017.01.003 (in Chinese) |
| [40] |
王金发. 人雄激素芳香化酶基因内含子中启动子的研究[J]. 中山大学学报:自然科学版, 1997, 36(6): 6–10.
WANG J F. The studies of the promoter in the intron Ⅱ of the human aromatase gene[J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 1997, 36(6): 6–10. (in Chinese) |
| [41] |
谢晓玲, 马思雨, 吴希, 等. 两种新的F8内含子突变导致剪接异常的机制研究[J]. 诊断学理论与实践, 2018, 17(1): 32–37.
XIE X L, MA S Y, WU X, et al. Molecular pathogenesis of two novel splice site mutations ofF8 in hemophilia A[J]. Journal of Diagnostics Concepts & Practice, 2018, 17(1): 32–37. (in Chinese) |
| [42] | MIKOL D D, RONGNOPARUT P, ALLWARDT B A, et al. The oligodendrocyte-myelin glycoprotein of mouse:primary structure and gene structure[J]. Genomics, 1993, 17(3): 604–610. DOI: 10.1006/geno.1993.1379 |
| [43] |
胡守旺, 梁希若, 吴淑华. 突变和修饰IFN-α2b基因的5'和3'端对其在E. coli表达的调控作用[J]. 免疫学杂志, 2000, 16(5): 355–358.
HU S W, LIANG X R, WU S H. Mutagenesis and modifications of IFN-α 2b gene affect the expression level in E. coli[J]. Immunological Journal, 2000, 16(5): 355–358. DOI: 10.3969/j.issn.1000-8861.2000.05.011 (in Chinese) |
| [44] |
石统东, 吴玉章, 朱锡华. 真核mRNA 3'非翻译区在基因表达中的作用[J]. 生物化学与生物物理进展, 1998, 25(3): 195–196, 253.
SHI T D, WU Y Z, ZHU X H. 3' untranslated region of eukaryotic mRNA in gene regulation[J]. Progress in Biochemistry and Biophysics, 1998, 25(3): 195–196, 253. DOI: 10.3321/j.issn:1000-3282.1998.03.001 (in Chinese) |
| [45] | OROZCO G, HINKS A, EYRE S, et al. Combined effects of three independent SNPs greatly increase the risk estimate for RA at 6q23[J]. Hum Mol Genet, 2009, 18(14): 2693–2699. DOI: 10.1093/hmg/ddp193 |
| [46] | HORNE B D, CAMP N J. Principal component analysis for selection of optimal SNP-sets that capture intragenic genetic variation[J]. Genet Epidemiol, 2004, 26(1): 11–21. DOI: 10.1002/(ISSN)1098-2272 |



