双氢青蒿素(C15H24O5,dihydroartemisinin,DHA)是一种通过硼氢化钠还原青蒿素而制备的抗疟药物,具有多种药理活性,如抗菌、抗肿瘤和抗纤维化等[1-3]。它是体内青蒿素类药物的主要代谢产物[4]。与青蒿素相比,DHA具有较好的水溶性、易吸收、排泄代谢快、高效低毒等特点。研究表明,DHA不仅具有抗疟疾的作用,同时具有预防肥胖和改善由肥胖引起的相关代谢紊乱的能力[5]。此外,DHA可以通过提高抗氧化酶的活性以及Nrf2的基因和蛋白表达来缓解机体由癌症所引起的氧化应激[6]。Nrf2/ARE信号通路作为内源性抗氧化应答机制信号通路之一在氧化应激中占有重要的地位[7]。当Nrf2被亲电子物质或者氧化剂刺激时,它将从细胞质转移到细胞核与抗氧化反应元件(ARE)结合并通过调节抗氧化酶的表达水平而在防御氧化应激中发挥着重要作用[8]。研究认为,血红素加氧酶1(HO-1)等细胞内氧化还原基因是Nrf2/ARE信号途径调节的主要内源性保护基因[9]。Yang等[10]发现,DHA可以通过激活Nrf2/ARE信号通路来减轻由博莱霉素诱导的大鼠肺纤维化所引起的氧化应激。这些结果表明,DHA可以改善体内氧化应激,从而减轻氧化应激引起的机体损伤。
脂多糖(LPS)是革兰阴性细菌外膜的主要成分,能够引起多种疾病,如内毒素休克和组织损伤等,对人和动物造成致命的伤害[11]。脂多糖除了产生和释放各种促炎性细胞因子和介质外,还会导致组织和器官损伤,尤其会增加活性氧中间产物的生成,如超氧化物自由基(O2-)、脂质过氧化物和一氧化氮等,最终引起氧化应激[12]。仔猪在由母乳过渡到饲料的过程中,由于饲料组成、环境及自身免疫系统发育尚未成熟等因素,在LPS刺激下,极易导致机体发生氧化应激反应[13]。日粮中添加抗氧化剂有助于减轻由LPS引起的氧化应激对机体的损害,并且可以用来预防由自由基所介导的疾病。因此,寻找有效、无毒、具有抗氧化性能的药物,有效地抑制活性氧自由基的产生,对于预防和治疗LPS诱导的氧化应激是非常重要的。本研究通过腹腔注射LPS建立仔猪氧化应激模型,首次将DHA应用于断奶仔猪,探讨了DHA通过调节Nrf2/ARE信号通路对LPS断奶仔猪氧化应激的改善,以期为揭示DHA提高动物机体抗氧化能力的机制提供一定的理论依据。
1 材料与方法 1.1 试验材料双氢青蒿素购自南京道斯夫生物科技有限公司(江苏,中国),生产批号为180526R,化学物质登录号为7193950-50-9,纯度为99%。
1.2 试验动物与饲养管理本试验仔猪来自上海农场晚庄畜牧场。试验选用健康的三元杂交(杜×长×大)仔猪30头,公母各半。4周龄断奶,断奶重为5.58 kg±0.08 kg,断奶后仔猪随机分成3组,每组10个重复。对照组(CON):饲喂基础日粮,宰前4 h腹腔注射无菌生理盐水。模型组(LPS):饲喂基础日粮,宰前4 h腹腔注射100 μg·kg-1 LPS。处理组(LD):饲喂基础日粮+80 mg·kg-1 DHA(DHA添加量经预试验确定),宰前4 h腹腔注射100 μg·kg-1 LPS。仔猪在注射LPS后出现了体温(直肠温度)升高、呕吐、无力、寒颤、厌食、嗜睡等症状,这一系列临床表现表明LPS氧化应激模型制备成功。各组饲喂相应日粮21 d。基础日粮营养组成符合NRC(2012)饲养标准,试验基础日粮表见表 1。本试验所有试验仔猪饲养在环境卫生良好的猪舍中,每天清扫和消毒猪舍,猪舍温度控制在25~28 ℃。自由采食和饮水,按照猪场的正常免疫措施进行饲养。
|
|
表 1 日粮配方和营养水平 Table 1 The composition and nutrient content of diets |
各组饲喂相应日粮至21 d时,在注射LPS或者无菌生理盐水4 h后,分别从各组选择8头接近平均体重的仔猪进行屠宰,公母各半。屠宰前1 d空腹12 h。仔猪屠宰后,迅速分离出肝,在肝同一叶上固定位置取肝样本装入冻存管中,液氮速冻后于-80 ℃超低温冰箱保存。
1.4 测定指标及方法 1.4.1 肝氧化损伤指标测定取0.4 g冻存的肝,加入0.9%冷生理盐水,冰水浴条件下机械匀浆,3 000 r·min-1,离心15 min后立即吸取上清液,放置于-20 ℃冰箱保存待用。匀浆上清液中总蛋白含量采用BCA蛋白质检测试剂盒(南京建成生物科技有限公司,江苏,中国)。肝中丙二醛(malondialdehyde, MDA)、蛋白质羰基(protein carbonyl, PC)、8羟基脱氧鸟苷(8-hydroxy-2-deoxyguanosine, 8-OHdG)含量采用试剂盒(上海易利生物科技有限公司,上海,中国)的方法进行测定。
1.4.2 肝抗氧化相关指标测定取上述制备好的肝匀浆液,肝中过氧化氢(H2O2)含量以及总抗氧化能力(total antioxidant capacity, T-AOC)、总超氧化物歧化酶(total superoxide dismutase,T-SOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)和还原型谷胱甘肽(reduced glutathione,GSH)均采用试剂盒(南京建成生物科技有限公司,江苏,中国)的方法进行测定。
1.4.3 肝中目的基因mRNA表达量测定测定肝中Nrf2、HO-1、GPx1、CAT、SOD1的mRNA表达量的变化。取60 mg肝组织样品加入1 mL Trizol(试剂购自Invitrogen公司),按照说明书的步骤进行RNA提取。使用NanoDrop1000测定所提取的RNA的纯度和浓度,RNA的完整性通过10 g·L-1琼脂糖凝胶电泳确认。按照PrimeScriptTM说明书要求进行反转录后,其产物cDNA于-20 ℃保存。使用SYBR® Premix Ex TaqTM试剂盒(TaKaRa生物公司,大连,中国)进行qRT-PCR。特异性引物见表 2。PCR程序: 95 ℃ 30 s,95 ℃ 5 s,60 ℃ 31 s,40个循环。目的基因的相对表达含量以GAPDH为内参,采用比较2-ΔΔCt法进行计算。
|
|
表 2 RT-PCR引物序列 Table 2 The primer sequences used in the real-time PCR |
Nrf2(稀释度1:600)、HO-1(稀释度1:600)和β-actin(稀释度1:4 000)抗体购自武汉三鹰生物技术有限公司(湖北,中国)。使用RIPA溶解缓冲液(南通碧云天生物技术研究所,江苏,中国)从40 mg左右的冷冻肝中提取蛋白质。使用BCA蛋白质检测试剂盒(南通碧云天生物技术研究所,江苏,中国)测量蛋白质浓度。以60 μg总蛋白的上样量进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,电泳结束后转移至聚偏二氟乙烯膜。在室温下用封闭缓冲液(5%脱脂奶粉)封闭膜2 h。然后将膜在TBST中洗涤三次,并与一抗孵育过夜。接着将膜用TBST洗涤三次并用二抗(稀释度1:5 000,武汉三鹰生物技术有限公司,湖北,中国)处理。用发光图像分析仪LAS-4000系统(富士公司,东京,日本)拍摄照片,并通过Gel-Pro Analyzer 4.0软件进行量化分析。
1.5 数据统计分析试验数据经过Excel初步处理后,采用SPSSStatistics 20进行分析,结果以 x±sx表示。所有数据采用单因素方差分析中的Duncan’s法进行多重比较,以P<0.05作为差异显著性的判断标准。
2 结果 2.1 DHA对LPS应激处理断奶仔猪肝MDA、PC和8-OHdG含量的影响由图 1可以看出,与CON组相比,LPS组肝MDA、PC和8-OHdG含量显著升高(P < 0.05)。与LPS组相比,LD组中MDA、PC和8-OHdG含量显著降低(P < 0.05)。同时LD组中MDA、PC和8-OHdG含量与CON组差异不显著(P>0.05)。
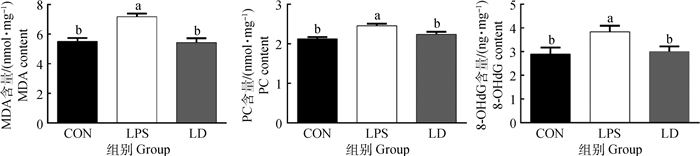
|
CON.饲喂基础日粮,宰前4 h腹腔注射无菌生理盐水;LPS.饲喂基础日粮,宰前4 h腹腔注射100 μg·kg-1LPS;LD.饲喂基础日粮+80 mg·kg-1DHA,宰前4 h腹腔注射100 μg·kg-1LPS。组间标注小写字母不同表示差异显著(P < 0.05)。下同 CON. Fed the basal diet and injected sterile saline intraperitoneally 4 hours before slaughter; LPS. Fed the basal diet and injected 100 μg·kg-1LPS intraperitoneally 4 hours before slaughter; LD. Fed the basal diet + 80 mg·kg-1DHA and injected 100 μg·kg-1LPS intraperitoneally 4 hours before slaughter. The difference of lowercase letters between peers was significant (P < 0.05). The same as follows 图 1 DHA对LPS应激处理断奶仔猪肝MDA、PC和8-OHdG含量的影响 Fig. 1 Effects of DHA on MDA, PC and 8-OHdG contents in liver of LPS-injected weanled piglets |
由表 3可以看出,与CON组相比,LPS组肝CAT、T-AOC、GPx活力和GSH含量显著下降(P < 0.05),H2O2含量显著升高(P < 0.05)。T-SOD活力无显著变化(P>0.05)。与LPS组相比,LD组CAT、T-AOC和GPx活力显著升高(P < 0.05),H2O2含量显著下降(P < 0.05)。同时LD组CAT、T-AOC、GPx活力和GSH含量显著低(P < 0.05)于CON组,但是H2O2含量与CON组差异不显著(P>0.05)。
|
|
表 3 DHA对LPS应激处理断奶仔猪肝抗氧化功能的影响(x±sx) Table 3 Effects of DHA on antioxidant function of liver in LPS-injected weanled piglets (x±sx) |
由图 2可以看出,与CON组相比,LPS组肝中Nrf2和CAT mRNA表达量显著降低(P < 0.05)。HO-1、GPx1和SOD1 mRNA表达量无显著变化(P>0.05)。与LPS组相比,LD组肝中Nrf2、CAT和GPx1 mRNA表达量显著升高(P < 0.05),HO-1和SOD1 mRNA表达量无显著变化(P>0.05)。且LD组肝中Nrf2、CAT和GPx1 mRNA表达量与CON组相比没有显著差异(P>0.05)。
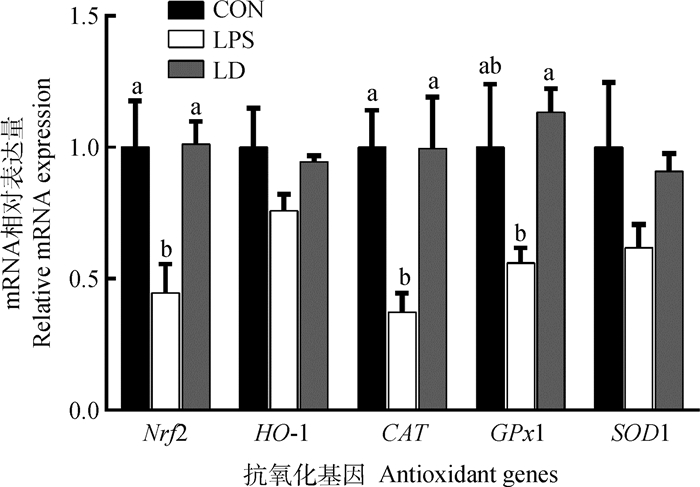
|
图 2 DHA对LPS应激处理断奶仔猪肝抗氧化基因mRNA表达量的影响 Fig. 2 Effects of DHA on mRNA expressions of antioxidant genes in liver of LPS-injected weanled piglets |
由图 3可以看出,与CON组相比,LPS组肝中Nrf2和HO-1蛋白表达显著降低(P < 0.05)。与LPS组相比,LD组肝中Nrf2和HO-1蛋白表达显著升高(P < 0.05),且LD组肝中Nrf2和HO-1蛋白表达与CON组相比差异不显著(P>0.05)。
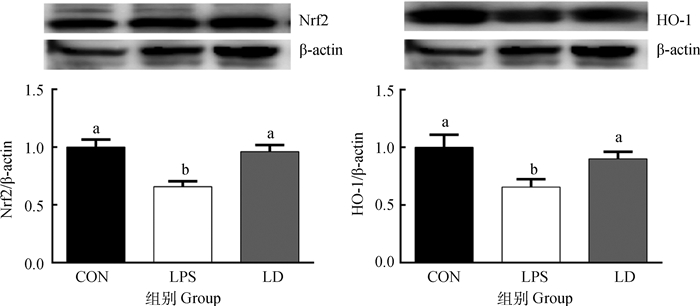
|
图 3 DHA对LPS应激处理断奶仔猪肝Nrf2和HO-1蛋白表达量的影响 Fig. 3 Effects of DHA supplementation on Nrf2 and HO-1 protein contents in liver of LPS-injected weanled piglets |
研究表明,LPS能够通过增加活性氧中间产物以及脂质过氧化物使体内的各种器官(尤其是肝)受到损害[14-15]。LPS通常积聚在富含网状内皮系统细胞的组织中,如肝和脾[16]。在肝中,LPS激活后会导致肝产生过量的O2·-。由此可见LPS在肝中能够引起严重的氧化应激。本研究通过宰前4 h注射100 μg·kg-1 LPS,建立断奶仔猪氧化应激模型来探究DHA对LPS断奶仔猪氧化应激的保护机制。
在正常状态下,机体内部存在着氧化与抗氧化系统的平衡,当机体受到外界的毒害作用时会导致这种平衡被破坏,而氧化应激就是氧化与抗氧化系统失衡的结果[17]。自由基的过量产生导致脂质过氧化,这是细胞损伤的重要原因之一。MDA是脂质过氧化的主要产物。PC被广泛用作肝蛋白质氧化的标志物[18]。通过对8-OHdG含量的测定可以反映内源性氧化DNA损伤的情况[19]。另外,机体内CAT能有效清除自由基,是动物体内主要的抗氧化酶,与GSH和GPx构成了对活性氧的第一道防线,其活性与机体内的活性氧自由基水平密切相关[20]。此外,T-AOC反映了非酶抗氧化防御系统的活性和抗氧化酶的水平,是衡量机体抗氧化系统功能状况的综合性指标。本试验发现,LPS组仔猪肝中MDA、PC和8-OHdG含量都显著高于CON组,且CAT、T-AOC、GPx活力和GSH含量均显著下降,而H2O2含量显著升高。这与Molinett等[21]的试验结果相似。本试验发现H2O2含量显著升高,这可能是由于CAT活力的降低所致。张海文等[22]研究发现,LPS可导致肝中GSH-Px、T-SOD和CAT水平显著降低,并且提高了肝中MDA的浓度,其结果表明LPS导致了仔猪肝发生严重的氧化应激。Ben-Shaul等[23]发现注射LPS的大鼠心中MDA含量显著升高,并且显著降低了SOD和CAT活力。由此可见,LPS会导致机体各器官发生严重的氧化应激。本试验研究发现,通过日粮中添加DHA可以显著抑制LPS导致的仔猪肝中MDA、PC和8-OHdG含量升高。同时,CAT、T-AOC和GPx活力都显著升高,并且H2O2含量显著下降。Yang等[10]发现日粮添加50 mg·kg-1 DHA显著降低由博莱霉素诱导的大鼠肺中MDA含量,同时显著提高SOD活力和GSH含量,与本试验结果相似。
为了进一步探究DHA对LPS诱导的仔猪肝氧化应激的保护机制,本试验对抗氧化相关基因mRNA表达量以及蛋白含量进行了测定。Nrf2/ARE信号通路作为内源性抗氧化应答机制信号通路之一,在氧化应激中占有重要的地位。Nrf2是抗氧化系统中的关键转录因子。当机体暴露于氧化应激源时,Nrf2进入细胞核并与抗氧化反应元件(ARE)结合,启动ARE调控的多种Ⅱ相解毒酶(HO-1等)和抗氧化酶(SOD、CAT等)的基因转录,提高细胞的抗氧化应激能力[24]。本试验研究发现,LPS组仔猪肝中Nrf2和CAT基因表达量显著降低,但GPx1和SOD1表达量无显著变化。李欢等[25]研究发现,LPS会导致断奶仔猪回肠黏膜中CAT表达量显著降低,同时对SOD和GPx无显著影响,这与本试验结果相似。日粮中添加DHA后,显著增加了Nrf2基因的表达,同时使与Nrf2/ARE信号通路相关的抗氧化基因(CAT和GPx1)的表达量显著增加。此外,本试验研究发现,LPS组肝中Nrf2和HO-1蛋白表达量显著降低,LD组肝中Nrf2和HO-1蛋白表达量显著提高,并与CON组无显著差异。这与Yang等[10]的结果一致。这些结果表明,DHA可能通过Nrf2/ARE信号通路来调节由LPS引起的氧化应激。
本研究首次将DHA应用于断奶仔猪,探究了DHA对LPS诱导的断奶仔猪氧化应激的修复作用,为畜牧生产中对氧化应激的治疗提供了一定的理论依据,但DHA的生产应用仍需进一步的研究与评价。
4 结论LPS刺激可导致断奶仔猪肝发生严重的氧化应激,日粮中添加80 mg·kg-1 DHA可显著抑制该氧化应激反应,且DHA可能通过调节Nrf2/ARE信号通路抑制了LPS诱导的断奶仔猪氧化应激。
| [1] | AKPALOO W, PURSSELL E. Does the use of dihydroartemisinin-piperaquine in treating patients with uncomplicated falciparum malaria reduce the risk for recurrent new falciparum infection more than artemether-lumefantrine?[J]. Malar Res Treat, 2014, 2014: 263674. |
| [2] | ZHANG X G, LI G X, ZHAO S S, et al. A review of dihydroartemisinin as another gift from traditional Chinese medicine not only for malaria control but also for schistosomiasis control[J]. Parasitol Res, 2014, 113(5): 1769–1773. DOI: 10.1007/s00436-014-3822-z |
| [3] | FENG M X, HONG J X, WANG Q, et al. Dihydroartemisinin prevents breast cancer-induced osteolysis via inhibiting both breast cancer cells and osteoclasts[J]. Sci Rep, 2016, 6: 19074. DOI: 10.1038/srep19074 |
| [4] | LU Z H, PENG J H, ZHANG R X, et al. Dihydroartemisinin inhibits colon cancer cell viability by inducing apoptosis through up-regulation of PPARγ expression[J]. Saudi J Biol Sci, 2018, 25(2): 372–376. DOI: 10.1016/j.sjbs.2017.02.002 |
| [5] | LU P, ZHANG F C, QIAN S W, et al. Artemisinin derivatives prevent obesity by inducing browning of WAT and enhancing BAT function[J]. Cell Res, 2016, 26(10): 1169–1172. DOI: 10.1038/cr.2016.108 |
| [6] | POSNER G H, PLOYPRADITH P, PARKER M H, et al. Antimalarial, antiproliferative, and antitumor activities of artemisinin-derived, chemically robust, trioxane dimers[J]. J Med Chem, 1999, 42(21): 4275–4280. DOI: 10.1021/jm990363d |
| [7] | JIANG Y M, WANG Y, TAN H S, et al. Schisandrol B protects against acetaminophen-induced acute hepatotoxicity in mice via activation of the NRF2/ARE signaling pathway[J]. Acta Pharmacol Sin, 2016, 37(3): 382–389. DOI: 10.1038/aps.2015.120 |
| [8] | MOTOHASHI H, KATSUOKA F, ENGEL J D, et al. Small Maf proteins serve as transcriptional cofactors for keratinocyte differentiation in the Keap1-Nrf2 regulatory pathway[J]. Proc Natl Acad Sci U S A, 2004, 101(17): 6379–6384. DOI: 10.1073/pnas.0305902101 |
| [9] | XIA B, LIU H Y, XIE J, et al. Akt enhances nerve growth factor-induced axon growth via activating the Nrf2/ARE pathway[J]. Int J Mol Med, 2015, 36(5): 1426–1432. DOI: 10.3892/ijmm.2015.2329 |
| [10] | YANG D X, QIU J, ZHOU H H, et al. Dihydroartemisinin alleviates oxidative stress in bleomycin-induced pulmonary fibrosis[J]. Life Sci, 2018, 205: 176–183. DOI: 10.1016/j.lfs.2018.05.022 |
| [11] | WESTPHAL M, STUBBE H, SIELENKÄMPER A, et al. Terlipressin dose response in healthy and endotoxemic sheep:impact on cardiopulmonary performance and global oxygen transport[J]. Intensive Care Med, 2003, 29(2): 301–308. DOI: 10.1007/s00134-002-1546-5 |
| [12] | SUGINO K, DOHI K, YAMADA K, et al. The role of lipid peroxidation in endotoxin-induced hepatic damage and the protective effect of antioxidants[J]. Surgery, 1987, 101(6): 746–752. |
| [13] | KAUR G, TIRKEY N, BHARRHAN S, et al. Inhibition of oxidative stress and cytokine activity by curcumin in amelioration of endotoxin-induced experimental hepatoxicity in rodents[J]. Clin Exp Immunol, 2006, 145(2): 313–321. DOI: 10.1111/j.1365-2249.2006.03108.x |
| [14] | KONO H, ASAKAWA M, FUJⅡ H, et al. Edaravone, a novel free radical scavenger, prevents liver injury and mortality in rats administered endotoxin[J]. J Pharmacol Exp Ther, 2003, 307(1): 74–82. DOI: 10.1124/jpet.103.053595 |
| [15] | MATSUDA H, ISHIKADO A, NISHIDA N, et al. Hepatoprotective, superoxide scavenging, and antioxidative activities of aromatic constituents from the bark of Betula platyphylla var. japonica[J]. Bioorg Med Chem Lett, 1998, 8(21): 2939–2944. DOI: 10.1016/S0960-894X(98)00528-9 |
| [16] | LI Q, LIU Y L, CHE Z Q, et al. Dietary L-arginine supplementation alleviates liver injury caused by Escherichia coli LPS in weaned pigs[J]. Innate Immun, 2012, 18(6): 804–814. DOI: 10.1177/1753425912441955 |
| [17] | CENTINI G, KENANIDIS A, ROSIGNOLI L, et al. P08. 05:intrauterine oxidative stress and Doppler flussimetry in fetuses with IUGR[J]. Ultrasound Obstet Gynecol, 2004, 24(3): 314. |
| [18] | CHAUDHURI A R, DE WAAL E M, PIERCE A, et al. Detection of protein carbonyls in aging liver tissue:a fluorescence-based proteomic approach[J]. Mech Ageing Dev, 2006, 127(11): 849–861. DOI: 10.1016/j.mad.2006.08.006 |
| [19] |
文镜, 张春华, 董雨, 等. 蛋白质羰基含量与蛋白质氧化损伤[J]. 食品科学, 2003, 24(10): 153–157.
WEN J, ZHANG C H, DONG Y, et al. Review on relationship between protein carbonyl content and protein oxidative injury[J]. Food Science, 2003, 24(10): 153–157. DOI: 10.3321/j.issn:1002-6630.2003.10.039 (in Chinese) |
| [20] |
陈伟, 林映才, 马现永, 等. 一些抗氧化剂的抗/促氧化作用及其机制[J]. 动物营养学报, 2012, 24(4): 595–605.
CHEN W, LIN Y C, MA X Y, et al. Anti/pro-oxidative functions of antioxidants and their mechanisms[J]. Chinese Journal of Animal Nutrition, 2012, 24(4): 595–605. (in Chinese) |
| [21] | MOLINETT S, NUNEZ F, MOYA-LEÓN M A, et al. Chilean strawberry consumption protects against LPS-induced liver injury by anti-inflammatory and antioxidant capability in sprague-dawley rats[J]. Evid Based Complement Alternat Med, 2015, 2015: 320136. |
| [22] |
张海文, 施平伟, 洪枫, 等. 抗菌肽对脂多糖导致的仔猪肝脏氧化应激的影响[J]. 饲料工业, 2017, 38(10): 5–8.
ZHANG H W, SHI P W, HONG F, et al. Effect of antimicrobial peptide on LPS induced liver oxidative stress of piglets[J]. Feed Industry, 2017, 38(10): 5–8. (in Chinese) |
| [23] | BEN-SHAUL V, LOMNITSKI L, NYSKA A, et al. The effect of natural antioxidants, NAO and apocynin, on oxidative stress in the rat heart following LPS challenge[J]. Toxicol Lett, 2001, 123(1): 1–10. |
| [24] | KENSLER T W, WAKABAYASHI N, BISWAL S. Cell survival responses to environmental stresses via the Keap1-Nrf2-ARE pathway[J]. Annu Rev Pharmacol Toxicol, 2007, 47: 89–116. DOI: 10.1146/annurev.pharmtox.46.120604.141046 |
| [25] |
李欢, 黄牛, 何流琴, 等. 谷氨酰胺对脂多糖诱导的断奶仔猪氧化应激的影响[J]. 动物营养学报, 2017, 29(4): 1350–1358.
LI H, HUANG N, HE L Q, et al. Effects of glutamine on oxidative stress of weaned piglets challenged by lipopolysaccharide[J]. Chinese Journal of Animal Nutrition, 2017, 29(4): 1350–1358. DOI: 10.3969/j.issn.1006-267x.2017.04.033 (in Chinese) |



