哺乳动物唾液腺主要由腮腺、颌下腺和舌下腺组成,口腔内多数唾液由颌下腺分泌,具有防御及内分泌等功能[1]。颌下腺合成和分泌多种生物活性物质参与机体内生理反应,也有学者将其归为消化道弥散性神经内分泌系统的一部分[2]。反刍动物瘤胃主要进行微生物发酵,山羊颌下腺是混合腺,是瘤胃液的主要来源,其中浆液细胞主要合成和分泌酶类,黏液细胞内含黏原蛋白,有润滑、细胞信号通路及化学屏障等功能。唾液的pH在6.0~7.0,有利于唾液酸的消化吸收,且唾液的理化特性与其消化机能有密切关系[3]。
藏绵羊及兰州大尾羊均是高原牧区的经济畜种。藏绵羊是高原牧区土著动物,具有丰富的遗传多样性和高原适应性繁殖繁育特点。兰州大尾羊生活在海拔1 500~3 000 m的西部黄土高原,由陕西大荔一带引进的同羊与当地蒙古羊杂交选育而成[4]。微卫星标记研究表明,蒙古羊与藏绵羊有一定的遗传亲缘关系,已被列入我国受威胁的地方品种。表皮生长因子(epidermal growth factor, EGF)是从小鼠颌下腺分离的由53个氨基酸组成的多肽;可发挥不同的生物学作用,影响细胞内增殖、分化和功能活性[5]。研究表明,唾液腺发育情况与EGF浓度密切相关,颌下腺主要由腺上皮构成,体外培养表明,EGF有利于诱导颌下腺上皮细胞的分化[6]。EGF在一定浓度和时间范围内对大鼠颌下腺导管细胞具有促增殖作用[7]。EGF与表皮生长因子受体(epidermal growth factor receptor,EGFR)结合以EGF/EGFR信号转导通路在上皮细胞的增殖、分化和迁移中发挥重要作用[8]。不同生理及病理条件下,EGF及EGFR在上皮组织的分布及表达相应发生改变,研究表明,干燥综合征患者颌下腺唾液中EGF含量降低,同时舌上皮细胞EGFR表达降低,使舌上皮细胞增殖、分化受到抑制,角化障碍[9]。EGF与EGFR基因随着胎儿汗腺形成及发育表达量明显增加[10]。研究表明,世居高原牧区的藏绵羊在高原低氧环境中内皮型NOS (endothelial NOS,eNOS)与组织氧化活性变化密切相关,eNOS参与附睾局部血管舒缩以调节微循环对氧的摄取[11]。研究人员对小猪进行低氧驯化12 d后发现肺中eNOS表达量降低了约40%[12],Droma等[13]发现eNOS等位基因频率在高原世居者夏尔巴人显著高于非夏尔巴人,提示eNOS有利于高原低氧适应或耐受。高原动物在形态、生理及基因表达的代偿性遗传性适应变化均可在高寒低氧环境更好地生存,而在生产实践中高原牧区藏绵羊与大尾羊颌下腺的疾病亦屡见不鲜,如颌下腺炎、颌下腺水肿、颌下腺癌等[14],影响了养殖场经济效益。因此,本研究通过组织学观察,比较分析同期生活在平均海拔3 000 m高原牧区藏绵羊和兰州大尾羊颌下腺的组织结构异同点,进而用免疫组织化学法比较EGF、EGFR及eNOS在颌下腺内的表达定位,分析在高原环境中颌下腺结构及发育的变化及其氧化机能的影响,以期为探讨唾液腺疾病提供参考。
1 材料与方法 1.1 试验动物2017年1月在甘肃省甘南州合作市屠宰场(平均海拔3 000 m)分别采集健康的成年藏绵羊(平均体重45.3 kg)和成年大尾羊(平均体重44.6 kg)颌下腺各5对,经齿龄鉴别法确定2岁龄,4%多聚甲醛固定液固定。
1.2 主要仪器与试剂兔源多克隆抗体eNOS (bs-0163R)、EGF(bs-2008R)、EGFR(bsm-33050M)及Alexa Fluor 488标记的羊抗兔IgG (bs-0295G-AF488)均购自北京博奥森生物技术有限公司;DAB显色试剂盒(ZLI-9018,购自北京中杉金桥生物技术有限公司);免疫组化染色试剂盒(SP-0023,由美国ZYMED生产,购自北京博奥森生物技术有限公司);标准阿利新蓝染色液(试剂盒)pH=2.5 (G1560,购自北京索莱宝科技有限公司)。
1.3 组织化学样本制备及观察样本采集:切取上述动物颌下腺浅叶部分经4%多聚甲醛溶液固定,取约1 cm×1 cm×0.6 cm组织数块,常规梯度酒精脱水,石蜡包埋,Epon 812包埋机进行包埋,LKB8800型超薄切片机连续切片,切片厚4 μm,相邻切片分为13套,其中8套分别用于EGF、EGFR、eNOS、阴性对照组免疫组织化学SP法及免疫荧光染色,剩余5套用于苏木精-伊红(hematoxylin eosin, HE)常规染色、奥辛蓝(Alcian blue, AB)染色、过碘酸雪夫(periodic acid-Schiff, PAS)染色、奥辛蓝过碘酸雪夫(AB-PAS)特殊组化染色。
HE细胞核显示蓝紫色,其余均为红色;AB染色,pH=2.5,显示酸性黏液物质,阳性反应物呈蓝色;PAS反应法显示多糖类和中性黏液物质及酶原,阳性反应物呈红色;AB-PAS反应法,pH=2.5,显示和区分酸性黏液物质和中性黏液物质,酸性黏液物质呈蓝色,中性黏液物质呈红色。
1.4 免疫组化染色采用免疫组化SP (streptavidin-perosidase)法进行染色,石蜡切片常规脱蜡水化;高压修复抗原,加30 g·L-1 H2O2水溶液封闭过氧化物酶10 min,正常山羊血清白蛋白孵育15 min;分别滴加50 μL一抗eNOS (稀释度1:300)、EGF (稀释度1:300)及EGFR (稀释度1:200),阴性对照组用0.01 mol·L-1的PBS代替一抗;37 ℃孵育2 h,PBS振洗后滴加50 μL二抗生物素标记山羊抗兔IgG工作液,37 ℃放置20 min;PBS冲洗2次,滴加50 μL辣根酶标记链霉卵白素工作液,37 ℃孵育20 min;显微镜下DAB显色,蒸馏水阻断显色;苏木素复染3 min,自来水蓝化;切片脱水、脱蜡,封片。免疫荧光染色在滴加一抗37 ℃孵育2 h后,直接滴加荧光二抗,37 ℃孵育2 h,直接在显微镜下观察结果。免疫组织化学染色结果:阳性呈棕黄色,蓝化后细胞核呈蓝色。免疫荧光染色结果:eNOS、EGF及EGFR阳性细胞呈荧光绿色。
1.5 数据统计将每一品种羊分为一组,每组取10个组织块,每块随机取15张切片,分为3组用于HE、免疫组织化学及免疫荧光染色,每张切片随机选取6个不重复视野(400×)。
HE切片在NIKON ECLIPSE 80i显微摄像系统照相,用Image Pro Plus 6.0软件统计每个视野下横切面浆液细胞数、黏液细胞数、浆液性腺泡面积及黏液性腺泡面积,进而计算细胞数及腺泡面积比值。浆液性腺泡与黏液性腺泡面积比值=浆液性腺泡面积/黏液性腺泡面积;黏液性腺泡细胞与浆液性腺泡细胞比值=黏液性腺泡细胞/浆液性腺泡细胞。Image Pro Plus 6.0软件对免疫组织化学染色结果进行测量,检测阳性反应物的平均光密度,并用统计软件SPSS 21.0对同一蛋白不同组间表达量差异进行单因素方差分析,Duncan进行多重比较; 结果用平均值±标准差(x±s)表示,P < 0.05为差异显著,P < 0.01为差异极显著。免疫荧光切片在Revolve RVL-100-G荧光显微摄像系统照相,采用半定量的形式对免疫荧光染色结果的分布密度进行描述,-:无阳性表达;+/-:偶有阳性表达;+:阳性表达;++:中等强度阳性表达;+++:强阳性表达;++++:高密度强阳性。
2 结果 2.1 藏绵羊和大尾羊组织学观察光镜下(图 1),藏绵羊颌下腺实质由分泌部和导管部组成,分泌部以浆液性腺泡和黏液性腺泡为主,浆液性细胞呈月牙状包裹黏液性腺泡,形成明显的浆半月,有少量混合性腺泡,黏液性腺泡呈不规则的圆形,细胞呈锥形,核大而圆,细胞质透明,内含有大量空泡。导管包括闰管、纹状管和小叶间导管(图 1A)。PAS染色显示颌下腺黏液性腺泡及混合性腺泡紫色阳性表达明显,浆液性腺泡、导管及细胞核显示蓝色(图 1C);AB染色显示颌下腺黏液性腺泡及混合性腺泡蓝色阳性表达明显,浆液性腺泡、导管及细胞核显示红色(图 1E);AB-PAS染色显示颌下腺黏液性腺泡及混合性腺泡蓝色阳性表达明显,浆液性腺泡、导管及细胞核显示红色(图 1G)。1 000倍油镜下可见闰管较小,由立方形细胞构成,细胞质着色淡,细胞核较大,位于细胞中央,染色深。纹状管为单层柱状上皮,基底部有垂直基底面的纵纹,细胞质较少,细胞核大,位于细胞中部,染色深(图 1I)。

|
A.藏绵羊HE染色;B.大尾羊HE染色;C.藏绵羊PAS染色;D.大尾羊PAS染色;E.藏绵羊AB染色;F.大尾羊AB染色;G.藏绵羊AB-PAS染色;H.大尾羊AB-PAS染色;I.藏绵羊PAS染色;J.大尾羊PAS染色;A~H标尺示20 μm;I~J标尺示10 μm;K.藏绵羊与大尾羊黏液性腺泡细胞与浆液性腺泡细胞数;L.藏绵羊与大尾羊浆液性腺泡与黏液性腺泡面积比值;M.藏绵羊与大尾羊黏液性腺泡细胞数与浆液性腺泡细胞数比值图示。SA.浆液性腺泡;MA.黏液性腺泡;MiA.混合性腺泡;StD.纹状管;SD.浆半月;ID.闰管 A.Tibetan sheep, HE staining; B.Big-tail sheep, HE staining; C.Tibetan sheep, PAS staining; D. Big-tail sheep, PAS staining; E. Tibetan sheep, AB staining; F. Big-tail sheep, AB staining; G.Tibetan sheep, AB-PAS staining; H. Big-tail sheep, AB-PAS staining; I. Tibetan sheep, PAS staining; J. Big-tail sheep, PAS staining; A-H, Bar=20 μm; I-J, Bar=10 μm; K. The number of mucinous acinus cells and serous acinus cells in Tibetan sheep and Big-tail sheep; L. The ratio of serous acinars to mucinous acinar area in Tibetan sheep and Big-tail sheep; M.The ratio of mucinous acinus cells and serous acinus cells in Tibetan sheep and Big-tail sheep. SA.Serous acinars; MA.Mucous acinus; MiA. Mixed acinus; StD.Striated ducts; SD. Serous demilunes; ID. Intercalated ducts 图 1 藏绵羊与大尾羊颌下腺形态学染色及统计分析 Fig. 1 Morphological staining and statistical analysis of submandibular gland in Tibetan sheep and Big-tail sheep |
兰州大尾羊分泌部以浆液性腺泡和黏液性腺泡为主,混合性腺泡较多(图 1B),PAS染色显示颌下腺黏液性腺泡及混合性腺泡紫色阳性表达明显,浆液性腺泡、导管及细胞核未表达(图 1D);AB染色显示颌下腺黏液性腺泡及混合性腺泡内黏液性腺泡蓝色阳性表达明显,浆液性腺泡、导管及细胞核未表达(图 1F);AB-PAS染色显示颌下腺黏液性腺泡及混合性腺泡蓝色阳性表达明显,浆液性腺泡、导管及细胞核显示红色(图 1H)。油镜下闰管及纹状管清晰明显,闰管直接与腺泡相连,纹状管由单层高柱状上皮组成,与闰管相连(图 1J)。
统计学分析表明,藏绵羊颌下腺浆液细胞数多于大尾羊,而大尾羊则以黏液性细胞为多(图 1K)。浆液性腺泡面积与黏液性腺泡面积比值,藏绵羊大于大尾羊;相应地,浆液性腺泡面积与总面积比值,藏绵羊也是大于大尾羊;黏液性腺泡面积与总面积比值,大尾羊稍小于藏绵羊(图 1L)。
2.2 藏绵羊与大尾羊免疫组织化学比较分析免疫组织化学结果显示(图 2),藏绵羊颌下腺中EGF在浆液性腺泡、纹状管及闰管呈阳性表达,黏液性腺泡细胞不表达(图 2A);EGFR仅在浆液性腺泡内呈阳性表达,其他部位表达不明显(图 2E);eNOS在浆液性腺泡、纹状管内呈阳性表达,黏液性腺泡及闰管内不表达(图 2I)。阴性对照无表达(图 2M)。免疫荧光结果显示,藏绵羊颌下腺组织中EGF在纹状管基底膜强阳性表达,纹状管、闰管上皮细胞及浆液细胞呈中等阳性表达,而在黏液细胞无表达(图 2B);EGFR在浆液细胞及纹状管基底膜强阳性表达,纹状管上皮细胞呈中等阳性表达,而黏液细胞及闰管上皮细胞无表达(图 2F);eNOS在浆液细胞及纹状管基底膜呈中等阳性表达,而在黏液细胞及闰管上皮细胞无表达(图 2J)。阴性对照无表达(图 2N)。
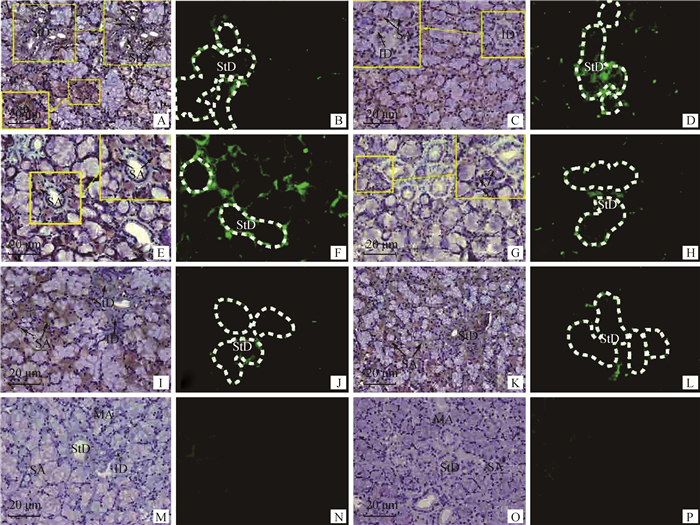
|
A、B. EGF在藏绵羊颌下腺的免疫组化及免疫荧光表达;C、D. EGF在大尾羊颌下腺的免疫组化及免疫荧光表达;E、F. EGFR在藏绵羊颌下腺的免疫组化及免疫荧光表达;G、H. EGFR在大尾羊颌下腺的免疫组化及免疫荧光表达;I、J. eNOS在藏绵羊颌下腺的免疫组化及免疫荧光表达;K、L. eNOS在大尾羊颌下腺的免疫组化及免疫荧光表达;M~P.免疫组化及免疫荧光阴性对照。SA.浆液性腺泡;MA.黏液性腺泡;MiA.混合性腺泡;StD.纹状管;SD.浆半月;ID.闰管 A, B.Immunohistochemical and immunofluorescence expression of EGF in submandibular gland of Tibetan sheep; C, D.Immunohistochemical and immunofluorescence expression of EGF in submandibular gland of Big-tail sheep; E, F.Immunohistochemical and immunofluorescence expression of EGFR in submandibular gland of Tibetan sheep; G, H.Immunohistochemical and immunofluorescence expression of EGFR in submandibular gland of Big-tail sheep; I, J.Immunohistochemical and immunofluorescence expression of eNOS in submandibular gland of Tibetan sheep; K, L.Immunohistochemical and immunofluorescence expression of eNOS in submandibular gland of Big-tail sheep; M-P.The control of the immunohistochemical and immunofluorescence staining. SA.Serous acinars; MA.Mucous acinus; MiA. Mixed acinus; StD.Striated ducts; SD.Serous demilunes; ID.Intercalated ducts 图 2 藏绵羊与大尾羊颌下腺免疫组织化学染色(标尺示20 μm) Fig. 2 Immunohistochemical staining and immunofluorescence staining scale of submandibular gland of Tibetan sheep and Big-tail sheep (Bar=20 μm) |
大尾羊颌下腺中EGF在浆液性腺泡内表达明显,纹状管及闰管内弱阳性表达(图 2C),黏液性腺泡内不表达;EGFR在浆液性腺泡内呈阳性表达,其他部位亦无表达(图 2G);eNOS在浆液性腺泡、纹状管内呈阳性表达,黏液性腺泡及闰管内不表达(图 2K),阴性对照无表达(图 2O)。EGF、EGFR及eNOS在大尾羊黏液性腺泡内均无表达。免疫荧光结果,大尾羊颌下腺组织中EGF在浆液细胞、纹状管基底膜、纹状管及闰管上皮细胞强阳性表达,黏液细胞无表达(图 2D);EGFR在纹状管基底膜、纹状管上皮细胞及浆液细胞呈强阳性表达,而在黏液细胞及闰管上皮细胞无表达(图 2H);eNOS在浆液细胞及纹状管上皮细胞呈强阳性表达,黏液细胞及闰管上皮细胞内无表达(图 2L)。阴性对照无表达(图 2P)。藏绵羊与大尾羊EGF、EGFR及eNOS免疫荧光组织化学中在黏液细胞内均无表达(表 1)。
|
|
表 1 免疫荧光检测EGF、EGFR、eNOS在高原牧区藏绵羊和大尾羊颌下腺的分布情况 Table 1 Distribution of EGF, EGFR and eNOS in submandibular gland of Tibetan sheep and Big-tail sheep |
光密度统计结果显示(图 3),藏绵羊颌下腺EGF与eNOS光密度值均小于大尾羊,差异极显著(P < 0.01)。藏绵羊颌下腺EGFR光密度值大于大尾羊,差异显著(P < 0.05)。
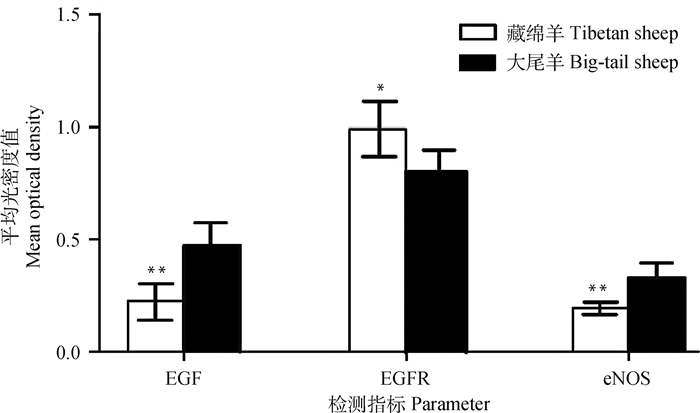
|
**.P < 0.01, 表示EGF和eNOS表达平均吸光度组间差异极显著;*.P < 0.05, 表示EGFR表达平均吸光度组间差异显著 **.P < 0.01, means the significant difference of the average absorbance of EGF and eNOS expression between different groups; *.P < 0.05, means the difference of the average absorbance of EGFR expression between different groups accordingly 图 3 EGF、EGFR和eNOS在高原地区藏绵羊和大尾羊颌下腺组织中免疫组织化学表达 Fig. 3 The immunohistochemistry expression of EGF, EGFR and eNOS in submandibular gland of the Tibetan sheep and the Big-tail sheep |
反刍动物颌下腺实质由分泌部和导管部组成,分泌部以浆液性腺泡或黏液性腺泡为主,有少量混合性腺泡,浆液性腺泡形成的浆半月,细胞质嗜碱性粒,内含酶原颗粒,主要合成和储存蛋白质。黏液性腺泡内含黏原颗粒,主要为形成酸性黏液(糖蛋白)。研究认为羊的颌下腺以黏液性腺泡为主[15]。Carpenter[16]认为,黏液性腺泡与浆液性腺泡相比,黏液性腺泡更容易在分泌物的合成和释放上保持平衡。PAS阳性反应的糖原、糖蛋白以及蛋白多糖很典型的存在于结缔组织、黏液以及基膜中,黏液细胞为PAS染色阳性,细胞质内见大量红色颗粒。本研究中藏绵羊与大尾羊黏液性腺泡呈PAS紫红色阳性,混合性腺泡略显蓝色,提示黏液性腺泡及混合性腺泡含有中性及酸性黏液物质;张昕等[17]在研究颌下腺组织AB-PAS染色时显示,人、小型猪与猕猴在黏液细胞为蓝紫色阳性表达。小鼠的颌下腺AB-PAS染色可见成熟腺泡细胞质呈紫红色,小部分腺泡呈蓝色。本研究AB染色在藏绵羊与大尾羊黏液性腺泡及混合性腺泡均呈蓝色阳性表达,纹状管及闰管中呈红色阴性表达,AB-PAS染色在藏绵羊与大尾羊黏液性腺泡显示蓝紫色阳性条带,浆半月、纹状管及闰管表达红色,细胞核呈蓝色,提示浆液性腺泡所含酸性唾液黏蛋白较少。本研究统计结果表明,藏绵羊浆液性腺泡明显多于大尾羊,提示藏绵羊颌下腺中性黏蛋白分泌较多。反刍动物瘤胃液来自于唾液,颌下腺分泌的弱碱性唾液流入瘤胃对其发酵有重要影响[18],瘤胃液pH是反应发酵水平的重要指标,正常瘤胃液pH在6.2~6.8,动物饲喂高精料日粮瘤胃液pH值显著降低。藏羊以游牧养殖为主,富含粗纤维的天然牧草是其主要食物来源,藏羊瘤胃液pH在6.09~7.28[3],大尾羊以青贮料为主,较藏绵羊饲料中粗纤维少,本研究中藏绵羊颌下腺以浆液性腺泡为主,提示藏绵羊颌下腺中性黏蛋白分泌较多,有利于形成pH较高的瘤胃液以加强对于粗纤维的分解。
3.2 藏绵羊与大尾羊颌下腺中EGF、EGFR及eNOS组织化学比较分析哺乳动物颌下腺闰管连接腺泡与纹状管,与纹状管一起可导流唾液及转运水和电解质。研究表明,颌下腺具有内分泌样功能。鼠类颌下腺纹状管粗而长,上皮细胞顶端可分泌EGF、NGF等多种酶和因子及一些分泌颗粒,故称颗粒曲管[19]。啮齿类动物颌下腺颗粒曲管细胞内有近30种生物活性多肽直接入血或随唾液进入消化道,对机体多种组织的生理活动起重要调节作用。研究发现,人类唾液中EGF的含量比啮齿动物中的含量低很多[20]。本研究表明,高原牧区藏绵羊及大尾羊颌下腺内EGF在纹状管基底膜强阳性表达,提示EGF在二者均主要以纹状管分泌为主。研究表明,EGF表达量与颌下腺的发育程度呈正相关,新生大鼠颗粒曲管内EGF呈上升趋势[21],而衰老大鼠EGF明显降低[22]。EGF可在上皮细胞的增殖、分化和迁移中发挥重要作用[7]。不同浓度的EGF对细胞增殖能力的影响不同,一定浓度内细胞的增殖与EGF浓度呈正相关,而继续增加EGF浓度会导致导管细胞增殖能力下降。研究表明干燥综合征患者唾液中EGF浓度降低[9]。本研究中藏绵羊颌下腺纹状管、闰管上皮细胞及浆液性腺泡表达量显著低于大尾羊,提示EGF可能与其腺泡细胞增殖能力密切相关,主要表达于浆液性腺泡亦可能与藏绵羊浆液性腺细胞数量较多有关。
EGFR具有络氨酸激酶活性,EGF与EGFR结合后激活体内一系列参与调控或诱导细胞增殖的基因。EGFR信号传导途经在肿瘤细胞增殖、损伤修复、缺氧及转移形成等方面起重要作用[8]。EGFR蛋白表达在涎腺肿瘤中较为常见,EGFR的激活与上皮细胞黏蛋白合成和分泌的增加有关。研究表明EGFR在人唾液腺黏液细胞细胞质的基底外侧和黏液滴检测到了特异反应,但未在细胞表面检测到[23]。与此相一致,本研究中藏绵羊及兰州大尾羊颌下腺内EGFR也是主要表达于纹状管基底膜、纹状管上皮细胞。研究表明,在人唾液腺中浆液性和黏液性成分在EGFR的表达上没有差异,EGF通过EGFR在两种上皮细胞中发挥作用相似[10]。哺乳动物唾液腺中EGFR定位因动物不同存在差异,但EGFR的激活会引起黏蛋白的产生。研究表明,EGFR表达于人的腮腺腺泡细胞与纹状管细胞基底细胞表面附近的小的细胞质小泡中,并在此处形成配体-受体复合体[24]。本研究中EGF与EGFR均表达于颌下腺浆液性腺泡纹状管基底膜,提示藏绵羊与大尾羊颌下腺中EGF与EGFR的主要结合位置亦在纹状管基底膜处。研究报道,低氧时大鼠肺血管EGFR的合成增多[25]。本研究统计表明,藏绵羊颌下腺EGFR光密度值显著大于大尾羊,提示在藏绵羊EGF与EGFR结合后积极参与调控或诱导了浆液性细胞的增殖。
eNOS作为钙依赖性一氧化氮合酶(NOS),在哺乳动物组织中广泛表达。Kim等[26]研究表明,eNOS在单克隆小鼠唾液腺广泛表达于动脉内皮层、颗粒曲管及纹状管,闰管及黏液性腺泡表达较弱或无表达,提示eNOS可能与腺体的分泌与血流有关。eNOS是导致NO水平异常和氧自由基水平升高的重要机制;高山动物在低氧环境下,经过eNOS催化使NOS活性和NO含量增加[11]。NO作为血管扩张物,能防止组织缺氧引起的肺动脉高压,改善动脉摄氧能力并利于动物对高原低氧环境的适应[11]。研究表明高原低氧环境藏鸡NOS活力明显高于寿光鸡,藏鸡表现出较好的高原适应性,可能与NOS在机体内低氧信号传导有关[27]。宋笑等[28]研究高原环境中小尾寒羊生精上皮eNOS表达强于藏绵羊,这可能与小尾寒羊低氧应激反应有关。金肆等[29]通过模拟高原低氧检测Wistar大鼠在肺血管内皮与支气管上皮eNOS蛋白表达较高原鼠兔均显著升高,提示平原动物急性高原低氧耐受过程中,eNOS表达升高是一个重要调节机制。本研究统计分析表明,浆液细胞及纹状管上皮细胞中eNOS的表达量在藏绵羊显著低于兰州大尾羊,提示与久居高原的藏绵羊相比,大尾羊在高原环境中颌下腺局部亦表现出低氧应激反应,其对唾液分泌的影响有待于进一步生理功能的分析。
4 结论高原牧区藏绵羊颌下腺内EGF在纹状管基底膜强阳性表达,提示EGF在藏绵羊及兰州大尾羊颌下腺均主要以纹状管分泌为主,且EGF与EGFR结合部位主要在纹状管基底膜处,在浆液性腺泡细胞增殖及分泌等方面发挥重要作用。兰州大尾羊颌下腺内eNOS在浆液细胞及纹状管上皮细胞呈强阳性表达可能与高寒低氧环境中应激反应有关。
| [1] |
俞光岩.颌下腺分泌功能的调控[C]//第三次全国涎腺疾病学术会议论文汇编.西安: 中华口腔医学会口腔颌面外科专业委员会涎腺疾病学组, 2006.
YU G Y. Regulation of secretory function of submandibular gland[C]//National Conference on Salivary Gland Diseases. Xi'an: Salivary Gland Disease Group, Committee of Oral and Maxillofacial Surgery, Chinese Society of Stomatology, 2006. (in Chinese) http://cpfd.cnki.com.cn/Article/CPFDTOTAL-KQHM200610001004.htm |
| [2] |
黄绍辉.体外培养构建组织工程化颌下腺导管组织的实验研究[D].沈阳: 中国医科大学, 2003.
HUANG S H. The experiment research on construction of tissue engineering the ductal cells of SMG in vitro[D]. Shenyang: China Medical University, 2003. (in Chinese) http://cdmd.cnki.com.cn/article/cdmd-10159-2003091693.htm |
| [3] |
佟瑛.精料补饲水平对藏系绵羊育肥效果及瘤胃内环境参数的影响[D].兰州: 甘肃农业大学, 2004.
TONG Y. Effects of concentrate supplementing level on performance and ruminal environmental parameters of fattening Tibetan sheep[D]. Lanzhou: Gansu Agricultural University, 2004. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10733-2005013327.htm |
| [4] |
张成虎. 兰州大尾羊种质资源的保护和发展[J]. 中国畜牧杂志, 2010, 46(18): 7–9.
ZHANG C H. Protection and development of germplasm resources of Lanzhou Big Tail sheep[J]. Chinese Journal of Animal Science, 2010, 46(18): 7–9. (in Chinese) |
| [5] | CARPENTER G, WAHL M I. The epidermal growth factor family[M]//SPORN M B, ROBERTS A B. Peptide Growth Factors and Their Receptors I. New York: Springer, 1991. |
| [6] | KERA H, YUKI S, NOGAWA H. FGF7 signals are relayed to autocrine EGF family growth factors to induce branching morphogenesis of mouse salivary epithelium[J]. Dev Dyn, 2014, 243(4): 552–559. DOI: 10.1002/dvdy.24097 |
| [7] | HABATA I, YASUI T, FUJIMORI O, et al. Immunohistochemical aspects of anti-microbial properties in goat submandibular glands[J]. Anat Histol Embryol, 2012, 41(1): 54–59. DOI: 10.1111/j.1439-0264.2011.01102.x |
| [8] | STÖKL J, HERZNER G. Morphology and ultrastructure of the allomone and sex-pheromone producing mandibular gland of the parasitoid wasp Leptopilina heterotoma (Hymenoptera: Figitidae)[J]. Arthropod Struct Dev, 2016, 45(4): 333–340. DOI: 10.1016/j.asd.2016.06.003 |
| [9] |
袁昌青, 曹颖秀, 刘斌, 等. 表皮生长因子与干燥综合征伴发萎缩性舌炎的相关性研究[J]. 上海口腔医学, 2014, 23(6): 731–735.
YUAN C Q, CAO Y X, LIU B, et al. Study on the correlation of epidermal growth factor and Sjögren's syndrome with atrophic glossitis[J]. Shanghai Journal of Stomatology, 2014, 23(6): 731–735. (in Chinese) |
| [10] | PILUDU M, LANTINI M S, ISOLA M, et al. Localisation of epidermal growth factor receptor in mucous cells of human salivary glands[J]. Eur J Morphol, 2003, 41(2): 107–109. DOI: 10.1080/09243860412331282219 |
| [11] |
袁莉刚, 张勇, 鲁玉荣, 等. 高原地区成年藏绵羊和小尾寒羊附睾组织中eNOS的差异表达研究[J]. 中国兽医科学, 2017, 47(5): 649–654.
YUAN L G, ZHANG Y, LU Y R, et al. Comparison of distribution characteristics of eNOS in the epididymis tissues of adult Tibetan sheep and Small-Tail Han sheep in Plateau[J]. Chinese Veterinary Science, 2017, 47(5): 649–654. (in Chinese) |
| [12] | HISLOP A A, SPRINGALL D R, OLIVEIRA H, et al. Endothelial nitric oxide synthase in hypoxic newborn porcine pulmonary vessels[J]. Arch Dis Child Fetal Neonatal Ed, 1997, 77(1): F16–F22. DOI: 10.1136/fn.77.1.F16 |
| [13] | DROMA Y, HANAOKA M, BASNYAT B, et al. Genetic contribution of the endothelial nitric oxide synthase gene to high altitude adaptation in Sherpas[J]. High Alt Med Biol, 2006, 7(3): 209–220. DOI: 10.1089/ham.2006.7.209 |
| [14] | COHEN S. Isolation of a mouse submaxillary gland protein accelerating incisor eruption and eyelid opening in the new-born animal[J]. J Biol Chem, 1962, 237: 1555–1562. |
| [15] |
徐文漭, 李霞, 和占龙, 等. 六种实验动物主要消化腺的比较组织学研究[J]. 实验动物与比较医学, 2014, 34(6): 454–462.
XU W M, LI X, HE Z L, et al. Study on comparative histology of digestive glands in 6 species of laboratory animals[J]. Laboratory Animal and Comparative Medicine, 2014, 34(6): 454–462. DOI: 10.3969/j.issn.1674-5817.2014.06.005 (in Chinese) |
| [16] | CARPENTER G. Epidermal growth factor: biology and receptor metabolism[J]. J Cell Sci, 1985, Suppl 3: 1-9. http://cn.bing.com/academic/profile?id=8c4efe88c8287093db165fdc7ad058eb&encoded=0&v=paper_preview&mkt=zh-cn |
| [17] |
张昕, 李钧, 董凤英, 等. 5种哺乳动物和人涎腺组织学及超微结构观察[J]. 北京口腔医学, 2006, 14(1): 30–33, 36.
ZHANG X, LI J, DONG F Y, et al. Histologic and ultrastructural study of five species of mammalian and human salivary glands[J]. Beijing Journal of Stomatology, 2006, 14(1): 30–33, 36. DOI: 10.3969/j.issn.1006-673X.2006.01.009 (in Chinese) |
| [18] | MCDOUGALL E I. Studies on ruminant saliva. 1. The composition and output of sheep's saliva[J]. Biochem J, 1948, 43(1): 99–109. DOI: 10.1042/bj0430099 |
| [19] |
杨耀琴, 陆璐, 谷华运, 等. 颌下腺神经内分泌细胞的初步探讨[J]. 解剖学杂志, 1990, 13(1): 15–18.
YANG Y Q, LU L, GU H Y, et al. The neuroendocrine cells in submandibular glands—a preliminary observation[J]. Chinese Journal of Anatomy, 1990, 13(1): 15–18. (in Chinese) |
| [20] |
白娟, 李庆伟, 王继红. 唾液富组氨酸蛋白[J]. 中国生物化学与分子生物学报, 2015, 31(11): 1146–1151.
BAI J, LI Q W, WANG J H. Saliva rich-histidine protein—histatins[J]. Chinese Journal of Biochemistry and Molecular Biology, 2015, 31(11): 1146–1151. (in Chinese) |
| [21] | BATTACHARYA R D, SAKAMOTO F, SHRESTHA P, et al. Chronotoxicological effect of methyl mercury in rat submandilular gland. Immunohistochemical changes of r-EGF, S-100 protein and keratin[J]. Acta Histochem, 1993, 95(2): 1993–201. |
| [22] | GRESIK E W, WENK-SALAMONE K, ONETTI-MUDA A, et al. Effect of advanced age on the induction by androgen or thyroid hormone of epidermal growth factor and epidermal growth factor mRNA in the submandibular glands of C57BL/6 male mice[J]. Mech Ageing Dev, 1986, 34(2): 175–189. DOI: 10.1016/0047-6374(86)90033-3 |
| [23] | LIU B C, HAN D M, ZHANG T T, et al. Hypoxia-induced autophagy promotes EGFR loss in specific cell contexts, which leads to cell death and enhanced radiosensitivity[J]. Int J Biochem Cell Biol, 2019, 111: 12–18. DOI: 10.1016/j.biocel.2018.09.013 |
| [24] | LANTINI M S, PILUDU M, COSSU M. Subcellular localization of epidermal growth factor in human parotid gland[J]. Histochem J, 2001, 33(7): 427–431. DOI: 10.1023/A:1013780028887 |
| [25] |
王旭萍. 低氧性肺动脉高压大鼠肺内表皮生长因子受体的表达[J]. 高原医学杂志, 2013, 22(1): 20.
WANG X P. Expression of epidermal growth factor receptor in lung of rats with hypoxic pulmonary hypertension[J]. Journal of High Altitude Medicine, 2013, 22(1): 20. (in Chinese) |
| [26] | KIM W J, YUN Y S, KIM M S, et al. Immunohistochemical study of nitric oxide synthase in salivary glands[J]. Korean J Anat, 2000, 33(4): 487–495. |
| [27] |
张浩, 吴常信, 强巴央宗, 等. 藏鸡高海拔适应与肺组织NOS活力的研究[J]. 中国农业大学学报, 2006, 11(1): 35–38.
ZHANG H, WU C X, CHAMBA Y, et al. Adaptability to high altitude and NOS activity of lung in Tibetan chicken[J]. Journal of China Agricultural University, 2006, 11(1): 35–38. DOI: 10.3321/j.issn:1007-4333.2006.01.007 (in Chinese) |
| [28] |
宋笑, 袁莉刚, 李聪. 高原地区成年藏绵羊和小尾寒羊睾丸组织eNOS的差异表达[J]. 甘肃农业大学学报, 2018, 53(3): 1–6.
SONG X, YUAN L G, LI C. Comparison of distribution characteristics of eNOS in the testicular tissue of adult plateau Tibetan sheep and Small-Tail Han sheep[J]. Journal of Gansu Agricultural University, 2018, 53(3): 1–6. (in Chinese) |
| [29] |
金肆, 叶仕桥, 汪涛, 等. 急性低氧时Wistar大鼠与高原鼠兔肺组织内皮型一氧化氮合酶基因表达的变化[J]. 中国组织化学与细胞化学杂志, 2005, 14(5): 572–576.
JIN S, YE S Q, WANG T, et al. Effect of acute hypoxia on endothelial nitric oxide synthase gene expression in the lungs of Wistar Rats and Qingzang Plateau Pikas[J]. Chinese Journal of Histochemistry and Cytochemistry, 2005, 14(5): 572–576. DOI: 10.3870/j.issn.1004-1850.2005.05.022 (in Chinese) |



