干扰素(interferon,IFN)是人和其他动物机体内非常重要的一种细胞因子,在特定诱导剂的作用下,由效应细胞产生并分泌,具有广谱抗病毒、抗肿瘤活性和调节免疫等功能[1-3],也是机体反应最快,作用最广泛的抗病毒防线[4]。近年来,随着养犬业的迅速发展,犬的各种病毒性疾病问题也接踵而至,如犬瘟热、犬细小病毒等。高琳等[5]、张考等[6]已通过临床试验分别证明了适量的干扰素α在犬瘟热、犬细小病毒病的治疗中具有重要意义,除此之外,犬干扰素α(CaIFN-α)还具有免疫调节功能, 并能有效治疗一些特定疾病[7]。因此,犬干扰素α具有良好的临床应用前景。
目前,犬干扰素的生产多以原核表达为主,初步产物多以包涵体形式出现,其恢复干扰素活性的过程中,繁琐的变、复性过程成为了干扰素原核表达走向生产的一大难点,探索真核系统对干扰素的表达成为当前的热点问题。杆状病毒/昆虫细胞表达系统因安全性好、具有糖基化修饰等诸多优点成为表达具有生物活性蛋白的优选系统[8-11],Ruttanapumma等[12]利用昆虫表达系统表达了具有较高抗病毒活性的犬干扰素α4。本试验应用杆状病毒/昆虫细胞表达系统,并引入蜂素信号肽以期实现犬血清白蛋白-干扰素α2的分泌表达。
干扰素在抗病毒治疗和一些疾病的辅助治疗中具有明显效果[13-14],但因其半衰期短,给药频率高,使用周期长等缺陷使其在临床应用中受到一定限制。研究表明,在基因表达时引入较大分子量的其他蛋白可延缓目的蛋白在体内的降解速度从而延长其作用时间[15]。而白蛋白对生物体无害,且白蛋白融合方法目前正被广泛应用于其他重要的具有半衰期短的生物活性肽表达中。有研究表明,重组白蛋白多肽和人干扰素基因融合,可有效延长半衰期且耐受性良好[16-17]。
本试验利用昆虫细胞-杆状病毒表达系统进行犬血清白蛋白与干扰素融合蛋白的表达研究,犬血清白蛋白与干扰素融合基因针对昆虫细胞密码子进行优化,并在基因前引入蜂素信号肽,实现了分泌表达,为犬长效干扰素在临床应用提供了依据。
1 材料与方法 1.1 菌株、载体、病毒及细胞E. coli DH5α、E. coli DH10Bac、昆虫杆状病毒表达载体pFastBac1、水疱性口炎病毒(VSV)、犬瘟热病毒(CDV)、犬细小病毒(CPV)、草地贪夜蛾卵巢细胞(Sf9细胞)和犬肾细胞(MDCK)均为本实验室保存。
1.2 主要试剂Lipofectamine 2000转染试剂购自Invitrogen公司;Grace′s昆虫细胞培养基、DMEM培养基和优级澳洲胎牛血清购自GIBCO公司;HRP-DAB底物显色试剂盒购自天根生化科技有限公司;硝酸纤维素(NC)膜购自北京鼎国昌盛生物技术有限责任公司;鼠抗His单克隆抗体和FITC标记的羊抗鼠IgG(荧光二抗)购自碧云天生物技术公司;犬干扰素α(兔源)一抗购自北京四正柏生物科技有限公司,辣根过氧化物酶(HRP)标记的羊抗兔IgG购自南京迅贝生物科技有限公司。
1.3 albumin-CaIFN-α2融合基因的设计与合成根据GenBank中已公布的albumin序列(GenBank:NM_001003026)和CaIFN-α2序列(GenBank:M28625.1),将两个基因利用linker串联[18],去除原有信号肽,针对昆虫细胞密码子偏好性进行优化,并在基因前端加入蜂素信号肽的序列(GenBank:AY598466),后端加入his标签,人工合成编码albumin-CaIFN-α2(Alb-CaIFN-α2)的基因,并直接连入转移载体pFastBac1中,命名为pFastBac1-Alb-CaIFN-α2。然后根据合成的基因序列,设计鉴定alb-CaIFN-α2基因的特异引物。上游引物的序列:5′-GGATCCGCCACCATGAAGTTCCT-3′(下划线处为BamHⅠ酶切位点),下游引物的序列:5′-AAGCTTTTAGTGATGGTGGTGGTGGT-3′(下划线处为Hind Ⅲ酶切位点)。以上目的基因和引物均由通用生物工程有限公司合成。
1.4 重组穿梭质粒Bacmid-Alb-CaIFN-α2的构建将重组转移载体pFastBac1-Alb-CaIFN-α2转化E. coli DH10Bac感受态细胞,同时将未插入外源基因的质粒pFastBac1转化E. coli DH10Bac感受态作为阴性对照。具体杆状病毒的构建和纯化方法参照Bac-to-Bac Baculovirus Expression System说明书,利用BAC/PAC DNA Isolation Kit试剂盒提取重组穿梭质粒Bacmid-Alb-CaIFN-α2和未发生重组的野生型穿梭质粒Bacmid,并用Alb-CaIFN-α2特异引物进行PCR鉴定,将鉴定正确的重组穿梭质粒命名为rBacmid-Alb-CaIFN-α2。
1.5 重组穿梭质粒转染Sf9细胞用于转染的实验组质粒为重组穿梭质粒rBacmid-Alb-CaIFN-α2,不含外源基因的杆状病毒质粒Bacmid作为阴性对照,正常Sf9细胞为空白对照,具体操作方法和收毒时间参照Bac-to-Bac Baculovirus Expression System说明书,待Sf9细胞出现病变后,收集上清液12 000 r·min-1离心5 min,即为第一代(P1)重组杆状病毒rBac-Alb-CaIFN-α2和野毒,于4 ℃保存,并将重组杆状病毒和野毒在Sf9细胞中传代至第3代。
1.6 重组Alb-CaIFN-α2蛋白表达的检测 1.6.1 间接免疫荧光(IFA)检测将重组杆状病毒rBac-Alb-CaIFN-α2(P3)和野毒株接种于铺有Sf9细胞的24孔板中,28 ℃细胞培养箱中培养72 h。待细胞病变后,去掉培养液,进行间接免疫荧光试验,其中一抗为鼠抗His单克隆抗体(1:1 000),二抗为FITC标记的山羊抗鼠IgG(1:500),最后在荧光显微镜下观察重组蛋白Alb-CaIFN-α2的间接免疫荧光结果。
1.6.2 Western blot检测用重组杆状病毒rBac-Alb-CaIFN-α2(P3)和野毒感染Sf9细胞,28 ℃培养72 h。分别取试验组和阴性对照组的细胞培养上清,4 000 r·min-1离心5 min,取上清,样品加入上样缓冲液,煮沸10 min后,进行Western blot试验,用1:400倍稀释的犬IFNα抗体(兔源)为一抗,辣根酶标记的羊抗兔IgG为二抗(1:500),最后DAB溶液显色。
1.7 重组Alb-CaIFN-α2表达量检测分别用P1、P2、P3的重组杆状病毒rBac-Alb-CaIFN-α2感染Sf9细胞,72 h收集细胞培养上清,采用BCA试剂盒测定细胞培养上清中的蛋白浓度,经SDS-PAGE分析,电泳结果用BandScan 5.0软件分析目的蛋白占细胞培养上清中蛋白的比例及目的蛋白的表达量。将重组杆状病毒rBac-Alb-CaIFN-α2(P2)感染的Sf9细胞培养上清经HisTrap HP蛋白纯化柱纯化,纯化后的目的蛋白Alb-CaIFN-α2的浓度用BCA法检测。
1.8 重组Alb-CaIFN-α2的活性测定采用微量细胞病变抑制法测定重组Alb-CaIFN-α2的抗病毒活性,应用的病毒是2010年版《中华人民共和国药典》第三部中常用检测干扰素活性的VSV、CDV和CPV,细胞为MDCK,试验组待测样品为10倍倍比稀释的纯化后的重组Alb-CaIFN-α2。三种病毒为三个平行试验,将MDCK接种于96孔板,5% CO2、37 ℃培养成单层,弃液,加入含5%血清的DMEM培养基10倍倍比稀释的重组Alb-CaIFN-α2作用24 h,弃液,每板中的试验孔再分别加入含100TCID50的VSV、CDV、CPV,同时设病毒对照(只加病毒不加检测样品)和空白对照(不加病毒和检测样品);当病毒对照孔出现75%~100%的细胞病变,而细胞对照组中的细胞生长良好,直接判断。
在倒置显微镜下观察细胞病变,以抑制50%细胞病变(CPE)的最高Alb-CaIFN-α2稀释度作为一个活性单位,根据Reed-Muench法计算重组Alb-CaIFN-α2的抗病毒活性。
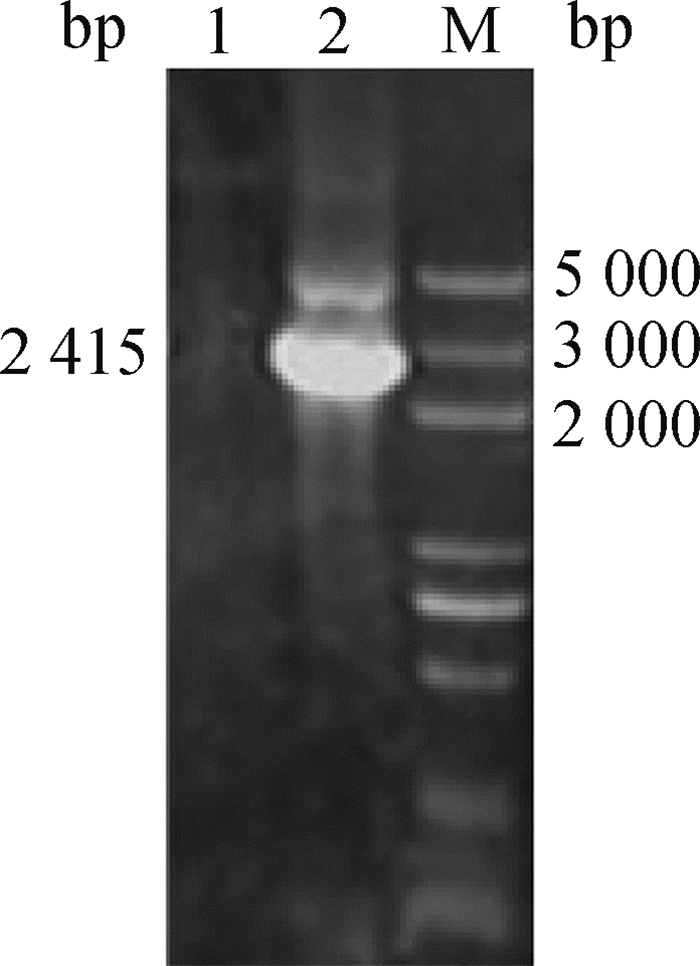
2 结果 2.1 重组杆状病毒质粒rBacmid-Alb-CaIFN-α2的构建及鉴定以重组穿梭质粒rBacmid-Alb-CaIFN-α2为模板,用特异性引物扩增,得到2 415 bp的条带;而以未转入载体片段的杆状病毒质粒Bacmid为模板,用特异性引物未扩增出条带(图 1)。结果表明,重组穿梭质粒rBacmid-Alb-CaIFN-α2构建成功。
|
M. DNA相对分子质量标准; 1.杆状病毒质粒Bacmid的扩增; 2.重组杆状病毒质粒rBacmid-Alb-CaIFN-α2 M. DNA marker; 1. PCR amplification of Bacmid; 2. PCR amplification of rBacmid-Alb-CaIFN-α2 图 1 重组穿梭质粒rBacmid-Alb-CaIFN-α2的PCR鉴定 Fig. 1 Identification of recombinant Bacmid-Alb-CaIFN-α2 by PCR |
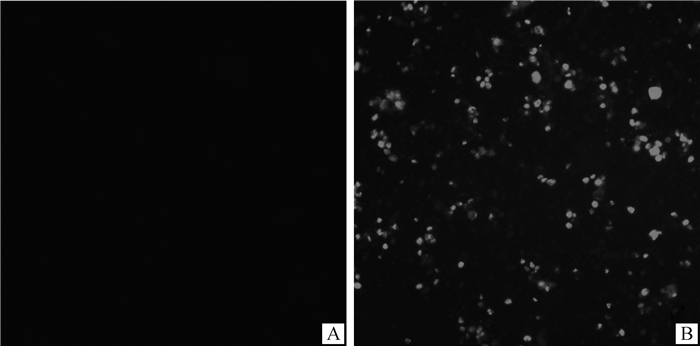
在荧光显微镜下,感染重组杆状病毒rBac-Alb-CaIFN-α2的细胞能够观察到绿色荧光,而野毒感染的细胞则没有检测到绿色荧光(图 2),说明重组目的蛋白Alb-CaIFN-α2在昆虫细胞中成功表达。
|
A.感染野生型杆状病毒的Sf9细胞;B.感染P3代重组杆状病毒的Sf9细胞 A. Sf9 cells infected with wild baculovirus; B. Sf9 cells infected with recombinant baculovirus rBac-Alb-CaIFN-α2 图 2 重组Alb-CaIFN-α2的IFA检测(100×) Fig. 2 Detection of the expression of recombinant Alb-CaIFN-α2 by IFA(100×) |
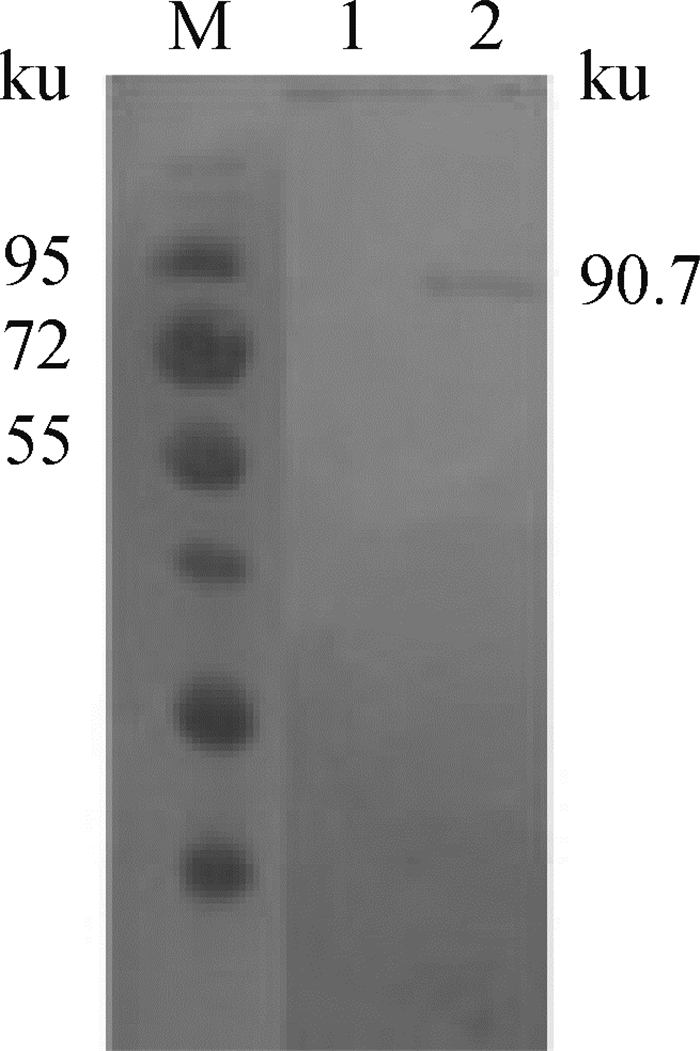
重组Alb-CaIFN-α2大小为90.7 ku,Western blot结果显示,感染重组杆状病毒的Sf9细胞上清显示大小约为90 ku的条带,与目的蛋白大小相符,感染野生杆状病毒的Sf9细胞上清未检测到蛋白条带(图 3),说明重组Alb-CaIFN-α2在Sf9细胞中获得分泌表达。
|
M.蛋白质相对分子质量标准; 1.野毒感染Sf9细胞培养上清;2.重组杆状病毒感染Sf9细胞培养上清; M. Protein molecular weight marker; 1. Sf9 cells supernatant infected with wild baculovirus; 2. Sf9 cells supernatant infected with recombinant baculovirus rBac-Alb-CaIFN-α2 图 3 重组Alb-CaIFN-α2的Western blot检测 Fig. 3 Detection of the expression of recombinant Alb-CaIFN-α2 by Western blot |
P1、P2、P3重组杆状病毒rBac-Alb-CaIFN-α2感染的Sf9细胞培养上清的蛋白浓度分别为10.16、11.90、8.25 mg·mL-1,经SDS-PAGE检测后,用BandScan 5.0软件分析,重组Alb-CaIFN-α2占细胞上清总蛋白的7.1%,P2重组杆状病毒rBac-Alb-CaIFN-α2感染Sf9细胞后收获的重组Alb-CaIFN-α2表达量最高,表达量为0.84 mg·mL-1。纯化后的重组Alb-CaIFN-α2蛋白浓度为1.14 mg·mL-1。
2.4 重组Alb-CaIFN-α2的抗病毒活性分析当病毒对照孔出现75%~100%的细胞病变时判断结果。此时,正常细胞对照组的MDCK细胞生长状态良好;病毒对照组的MDCK细胞变圆、拉丝、死亡、脱落,根据Reed-Muench法计算,重组Alb-CaIFN-α2在MDCK上抗VSV的活性为10(5+0.23) U·0.1 mL-1=1.70×106 U·mL-1;在MDCK上抗CDV的活性为10(4+0.55) U·0.1 mL-1=3.52×105 U·mL-1;在MDCK上抗CPV的活性为10(4+0.34) U·0.1 mL-1=2.19×105 U·mL-1。
3 讨论CaIFN-α2属于Ⅰ型干扰素,在Ⅰ型干扰素的分类中,由于与CaIFN-α1和CaIFN-α7同源性较高被分为同一组[19],其中CaIFN-α1和CaIFN-α7均已通过试验表明具有较高的抗病毒活性[20-21],而CaIFN-α2在本研究室姚凌云等[22]的原核表达一文中具有良好的生物活性。本研究在此基础上进一步研究CaIFN-α2在杆状病毒/昆虫细胞表达系统中的表达效果和生物学活性。
应用杆状病毒/昆虫细胞表达系统表达外源基因的过程中,多数哺乳动物基因的信号肽不能被昆虫细胞识别。Sisk等[23]研究表明,蜂素信号肽能引导外源蛋白进入内质网进行糖基化、酰基化修饰,介导重组蛋白以分泌表达的形式存在于培养上清中,并能增加外源蛋白的表达量;而Kozak序列在基因翻译转录的启动过程中起重要作用[24]。为了提高目的蛋白在昆虫细胞中的表达量,并促进其分泌表达,本试验在设计基因时多方面优化,首先,将融合基因针对昆虫细胞的偏好性进行了优化,利用基因对昆虫细胞的偏好性来提高外源蛋白的表达水平,然后,将原有犬白蛋白信号肽换成蜂素信号肽并引入了Kozak序列,最终实现了重组Alb-CaIFN-α2在昆虫细胞中的分泌表达,上清中的目的蛋白表达量达0.84 mg·mL-1。总体来说,昆虫细胞本身的蛋白种类很多,而在昆虫细胞进行分泌表达外源蛋白时,培养上清中的杂蛋白较少,易于纯化回收。
血清白蛋白是动物机体内天然存在的一种大分子化合物,性质稳定,在运输物质、调节渗透压、清除自由基等方面具有很好的作用,在体内的半衰期达19 d之久,可作为药物运输载体制备生物制剂[25-26],非常适合用于与干扰素结合延长其半衰期的研究。本试验以昆虫细胞杆状病毒表达系统进行犬血清白蛋白与干扰素融合蛋白的表达研究,经Western blot和IFA检测,重组Alb-CaIFN-α2在昆虫细胞中获得稳定表达,并且通过微量病变抑制法测得该融合蛋白在MDCK对VSV的抗病毒活性为1.70×106 U·mL-1,比王晶宇等[27]在CHO中表达的CaIFN-α4-GFP的活性(1.39×105 U·mL-1)高近10倍,并通过与姚凌云等[22]在大肠杆菌中表达的CaIFN-α2活性(3.16×106 U·mL-1)比较,说明白蛋白虽然对干扰素存在一定空间位阻效应,但在体外试验中的抗病毒活性影响不大。重组Alb-CaIFN-α2在MDCK上对CDV和CPV的抗病毒能力,证明重组Alb-CaIFN-α2有一定的广谱抗病毒活性。
4 结论成功构建重组穿梭质粒rBacmid-Alb-CaIFN-α2,并收获了重组杆状病毒rBac-Alb-CaIFN-α2,实现了重组Alb-CaIFN-α2在昆虫细胞中的高效表达,利用MDCK/VSV法检测Alb-CaIFN-α2的抗病毒活性可达1.70×106 U·mL-1,为进一步研究长效干扰素生物学活性和临床研究奠定了基础。
| [1] | GONZÁLEZ-NAVAJAS J M, LEE J, DAVID M, et al. Immunomodulatory functions of type Ⅰ interferons[J]. Nat Rev Immunol, 2012, 12(2): 125–135. |
| [2] | MALMGAARD L. Induction and regulation of IFNs during viral infections[J]. J Interferon Cytokine Res, 2004, 24(8): 439–454. DOI: 10.1089/1079990041689665 |
| [3] | ZHAO N, YAO H P, LAN L P, et al. Efficient production of canine interferon-alpha in silkworm Bombyx mori by use of a BmNPV/Bac-to-Bac expression system[J]. Appl Microbiol Biotechnol, 2008, 78(2): 221–226. DOI: 10.1007/s00253-007-1296-y |
| [4] | SIEGAL P F, KADOWAKI N, SHODELL M, et al. The nature of the principal type 1 interferon- producing cells in human blood[J]. Science, 1999, 284(5421): 1835–1837. DOI: 10.1126/science.284.5421.1835 |
| [5] |
高琳, 汪崇, 杨文亮. 中药疗法和干扰素对犬瘟热治疗效果的比较研究[J]. 现代畜牧兽医, 2012(5): 44–47.
GAO L, WANG C, YANG W L. Comparative study on the therapeutic effect of traditional Chinese medicine therapy and interferon on canine distemper[J]. Modern Journal of Animal Husbandry and Veterinary Medicine, 2012(5): 44–47. DOI: 10.3969/j.issn.1672-9692.2012.05.025 (in Chinese) |
| [6] |
张考, 靳慧君, 仲飞, 等. 腺病毒介导犬干扰素-γ基因的表达及其体外抗犬细小病毒的作用[J]. 微生物学报, 2012, 52(11): 1400–1407.
ZHANG K, JIN H J, ZHONG F, et al. Adenovirus-mediated canine interferon-γ expression and its antiviral activity against canine parvovirus[J]. Acta Microbiologica Sinica, 2012, 52(11): 1400–1407. (in Chinese) |
| [7] | ITO A, ISOGAI E, YOSHIOKA K, et al. Ability of orally administered IFN-α4 to inhibit naturally occurring gingival inflammation in dogs[J]. J Vet Med Sci, 2010, 72(9): 1145–1151. DOI: 10.1292/jvms.09-0201 |
| [8] | CHAI H, VAN VASUDE S G, PORTER A G, et al. Glycosylation and high-level secretion of human tumour necrosis factor-beta in recombinant baculovirus-infected insect cells[J]. Biotechnol Appl Biochem, 1993, 18(3): 259–273. |
| [9] | DRUGMAND J C, SCHNEIDER Y J, AGATHOS S N. Insect cells as factories for biomanufacturing[J]. Biotechnol Adv, 2012, 30(5): 1140–1157. DOI: 10.1016/j.biotechadv.2011.09.014 |
| [10] | DAI X J, HAJÓS J P, JOOSTEN N N, et al. Isolation of a Spodoptera exigua baculovirus recombinant with a 10. 6 kbp genome deletion that retains biological activity[J]. J Gen Virol, 2000, 81(10): 2545–2554. DOI: 10.1099/0022-1317-81-10-2545 |
| [11] | AILOR E, BETENBAUGH M J. Modifying secretion and post-translational processing in insect cells[J]. Curr Opin Biotechnol, 1999, 10(2): 142–145. |
| [12] | RUTTANAPUMMA R, ANZAI M, TAKEGAWA M, et al. High level expression of biologically active canine interferon-α subtype 4 using a baculovirus[J]. J Vet Med Sci, 2006, 68(12): 1347–1349. DOI: 10.1292/jvms.68.1347 |
| [13] | VEZALI E, AGHEMO A, COLOMBO M. Interferon in the treatment of chronic hepatitis C:a drug caught between past and future[J]. Expert Opin Biol Ther, 2011, 11(3): 301–310. DOI: 10.1517/14712598.2011.552906 |
| [14] | KWON H, LOK A S. Hepatitis B therapy[J]. Nat Rev Gastroenterol Hepatol, 2011, 8(5): 275–284. DOI: 10.1038/nrgastro.2011.33 |
| [15] | SUBRAMANIAN G M, FISCELLA M, LAMOUSÉ-SMITH A, et al. Albinterferon α-2b:a genetic fusion protein for the treatment of chronic hepatitis C[J]. Nat Biotechnol, 2007, 25(12): 1411–1419. DOI: 10.1038/nbt1364 |
| [16] | ZHAO H L, XUE C, WANG Y, et al. Circumventing the heterogeneity and instability of human serum albumin-interferon-α2b fusion protein by altering its orientation[J]. J Biotechnol, 2007, 131(3): 245–252. |
| [17] | ZHAO H L, YAO X Q, XUE C, et al. Increasing the homogeneity, stability and activity of human serum albumin and interferon-α2b fusion protein by linker engineering[J]. Protein Expr Purif, 2008, 61(1): 73–77. DOI: 10.1016/j.pep.2008.04.013 |
| [18] | KLEMENT M, LIU C C, LOO B L W, et al. Effect of linker flexibility and length on the functionality of a cytotoxic engineered antibody fragment[J]. J Biotechnol, 2015, 199: 90–97. DOI: 10.1016/j.jbiotec.2015.02.008 |
| [19] | TAIRA O, WATANUGI I, HAGIWARA Y, et al. Cloning and expression of canine interferon-α genes in Escherichia coli[J]. J Vet Med Sci, 2005, 67(10): 1059–1062. DOI: 10.1292/jvms.67.1059 |
| [20] |
徐晓娟, 王怡飞, 王玉, 等. 犬干扰素α1基因在大肠埃希菌中的表达及其抗病毒活性的测定[J]. 中国生物制品学杂志, 2013, 26(8): 1084–1087, 1093.
XU X J, WANG Y F, WANG Y, et al. Expression of canine interferon α1 gene in E. coli and antiviral activity of expressed product[J]. Chinese Journal of Biologicals, 2013, 26(8): 1084–1087, 1093. (in Chinese) |
| [21] |
潘福星, 朱梅胜, 冯培祥, 等. 比格犬α7干扰素成熟肽基因的原核表达及表达产物活性的分析[J]. 中国兽医科学, 2014, 44(3): 298–302.
PAN F X, ZHU M S, FENG P X, et al. Prokaryotic expression of Beagle IFN-α7 gene and analysis of its antiviral activities[J]. Chinese Veterinary Science, 2014, 44(3): 298–302. (in Chinese) |
| [22] |
姚凌云, 王晶宇, 欧阳伟, 等. 犬干扰素α2的原核表达及抗病毒活性分析[J]. 中国动物传染病学报, 2018, 26(2): 59–63.
YAO L Y, WANG J Y, OUYANG W, et al. Prokaryotic expression and antiviral analysis of canine interferon α2[J]. Chinese Journal of Animal Infectious Diseases, 2018, 26(2): 59–63. (in Chinese) |
| [23] | SISK W P, BRADLEY J D, LEIPOLD R J, et al. High-level expression and purification of secreted forms of herpes simplex virus type 1 glycoprotein gD synthesized by baculovirus-infected insect cells[J]. J Virol, 1994, 68(2): 766–775. |
| [24] |
杜明梅, 叶玲, 刘建伟, 等. Kozak序列+4G提高绿色荧光蛋白在HEK293细胞中的表达[J]. 生物工程学报, 2008, 24(3): 491–494.
DU M M, YE L, LIU J W, et al. Enhancement of GFP expression by Kozak sequence +4G in HEK293 cells[J]. Chinese Journal of Biotechnology, 2008, 24(3): 491–494. DOI: 10.3321/j.issn:1000-3061.2008.03.023 (in Chinese) |
| [25] | HUANG Y S, CHEN Z, YANG Z Y, et al. Preparation and characterization of a potent, long-lasting recombinant human serum albumin-interferon-α2b fusion protein expressed in Pichia pastoris[J]. Eur J Pharm Biopharm, 2007, 67(2): 301–308. DOI: 10.1016/j.ejpb.2007.02.015 |
| [26] | OSBORN B L, OLSEN H S, NARDELLI B, et al. Pharmacokinetic and pharmacodynamic studies of a human serum albumin-interferon-α fusion protein in cynomolgus monkeys[J]. J Pharmacol Exp Ther, 2002, 303(2): 540–548. DOI: 10.1124/jpet.102.037002 |
| [27] |
王晶宇, 欧阳伟, 王永山, 等. 犬干扰素α4在CHO细胞中的稳定表达[J]. 中国兽医科学, 2017, 47(4): 448–454.
WANG J Y, OUYANG W, WANG Y S, et al. Stable expression of canine interferon α4 in CHO cell[J]. Chinese Veterinary Science, 2017, 47(4): 448–454. (in Chinese) |



