2. 洛阳师范学院生命科学学院, 洛阳 471934;
3. 西北农林科技大学 国家干细胞工程技术研究中心陕西分中心, 杨凌 712100
2. College of Life Science, Luoyang Normal University, Luoyang 471934, China;
3. Shaanxi Branch of National Stem Cell Engineering Center, Northwest A & F University, Yangling 712100, China
世界卫生组织WTO统计,全世界每年约有600万皮肤烧伤患者,其中由于烧伤造成的死亡人数高达30万[1-2]。目前,临床上烧伤治疗的主要方法有自体皮肤移植、同种异体皮肤移植、异种皮肤移植和构建人工皮肤等。由于存在皮源供应不足、免疫排斥反应等缺陷,自体皮肤移植、同种异体和异种皮肤移植在临床上的使用受到限制[3]。随着组织工程皮肤构建技术的迅速发展,烧伤患者的治愈率得到了显著提高。但目前临床上应用的这些组织工程皮肤缺乏毛囊、汗腺、皮脂腺等皮肤附属器官,只具备皮肤的屏障功能,不具备正常皮肤的生理功能,临床表现为创面干燥、皴裂、缺乏韧性和弹性等,严重影响了患者的生活质量[4]。因此,构建具有毛囊、汗腺等皮肤附属器官,具有正常生理功能的组织工程皮肤是未来组织工程发展的方向。
毛囊干细胞(hair follicle stem cells, HFSCS)具有多向分化潜能,不仅可以分化为毛囊上皮细胞,而且可以分化为皮脂腺细胞和表皮角质形成细胞等[5-6];而毛囊真皮成分细胞是控制毛发生长的基础,在毛发形成、生长以及皮肤创伤愈合过程中发挥重要作用。以毛囊成分细胞为种子细胞构建毛囊化的组织工程皮肤成为当前研究的热点。目前,体外诱导毛囊形成一般采用小鼠或人胚胎来源细胞[7],利用动物成体毛囊干细胞体外构建具有毛囊结构的组织工程皮肤研究目前还未取得成功。山羊是季节性换毛比较明显的动物之一,毛囊周期性活动明显,利用山羊毛囊干细胞构建组织工程皮肤研究还处于空白状态。而且,体外构建毛囊器官,有助于羊毛发周期的调控机制研究,对于促进羊毛的生产、优化畜牧生产具有较大的应用价值。本试验从山羊耳部组织分离毛囊干细胞和毛囊真皮组织细胞作为种子细胞,以人羊膜和Ⅰ型胶原为支架材料,探讨组织工程皮肤毛囊等附属器官重建问题,以期为毛发的移植和受损皮肤修复的临床应用提供新的思路。
1 材料与方法 1.1 试验材料 1.1.1 试验动物健康雌性布尔山羊6只(2~3.5岁),饲养于西北农林科技大学试验动物养殖场。
1.1.2 主要试剂DMEM/F12、胰蛋白酶、新生牛血清(NBS)为Gibco公司产品;牛血清白蛋白(BSA)为Equitec bio公司产品;表皮生长因子(EGF)为R & D公司产品;双抗为Hyclone公司产品;胰岛素、牛Ⅰ型胶原蛋白为Sigma公司产品。
1.2 方法 1.2.1 山羊毛囊干细胞、毛囊真皮细胞分离培养在参照前人研究[8-10]的基础上,经改进,取山羊耳部组织,经双抗、酒精消毒后,Dispase酶37 ℃水浴消化6~8 h,显微镜下收集完整毛囊,胰酶消化后,采用差速贴壁法分离培养毛囊干细胞和毛囊真皮细胞,具体分离培养方法参照相关报道[11-12]。
1.2.2 人羊膜及羊膜支架的处理 1.2.2.1 人羊膜的处理将健康剖腹产产妇的胎盘带回实验室,徒手(带手套)剥落羊膜,去除羊膜海绵层,用0.25%的胰酶消化移除羊膜上皮细胞。
1.2.2.2 支架制作将硝酸纤维素膜(NC膜)剪成中空的正方形于塑料袋内封口后高压,将高压后的NC膜贴于羊膜基底层面,翻转,使羊膜上皮面向上,恒温箱干燥备用。具体试验过程参照文献[13]。
1.2.3 组织工程皮肤构建及检测 1.2.3.1 真皮等同物制备取浓度为4.5 mg·mL-1的牛Ⅰ型胶原蛋白溶液、5×DMEM溶液、毛囊真皮细胞浓度为1×105·mL-1的DMEM溶液,三者以7:2:1的体积比混合,前两者混合后,用1 mol·L-1的NaOH调节pH值到7.2,然后将1 mL含毛囊真皮细胞的DMEM溶液加入混匀,三者混合物称之为胶原凝胶混合物,然后,将3~5 mL胶原凝胶混合物均匀滴加在直径4 cm×4 cm的处理过的羊膜支架材料上,凝固后称之为真皮等同物。
1.2.3.2 全层皮肤制备真皮等同物培养4~6 d后,以1.5×106·cm-2接种密度在其表面接种毛囊干细胞,用自制无血清培养基培养,每2~4 d换液一次。7 d后,采用气液界面培养,促进表皮层角化。
1.2.3.3全层皮肤培养25 d后,用2.5%戊二醛固定,扫描电镜观察。
1.2.4 移植将试验动物分为两组,试验组3只,对照组3只。手术前禁食1 d,侧卧保定,铺手术洞巾,肌内注射846合剂2.4~2.6 mL全麻。
试验组:首先,在试验动物背部制作全层皮肤缺损,面积为4 cm×4 cm;然后将体外培养的组织工程皮肤缝合上去,敷料压背,保护伤口。
对照组:同移植组一样,在相同位置制作全层皮肤缺损,将4 cm×4 cm的羊膜缝合上去。
25~30 d后去掉敷料层,观察伤口愈合情况。
1.2.5 效果检测移植后30、60、90 d,采用坐标纸读数法测量疤痕面积。将薄膜覆盖在坐标纸上,读取正方形及待测瘢痕所占的格子数量[14-15]。以记号笔描绘的外缘为界线,取格子的原则为满1/2视为1个,不满1/2视为没有,记录每次读取的数据[16],每只羊一次由同一实验人员测量3次,取平均值。
1.2.6 数据分析利用Excel进行数据统计,数据采用SPSS18.0统计软件进行单因素方差分析和多重比较,结果以“x±s”表示。
2 结果 2.1 山羊原代毛囊干细胞和真皮细胞的鉴定将消化获得的原代细胞接种于多聚赖氨酸包被的培养皿中,20 min后,一部分毛囊干细胞开始贴壁,刚贴壁的细胞体积小,胞体透亮,折光性强(图 1A);无血清培养液继续培养3~5 d后,细胞融合呈铺路石状(图 1B),细胞70%融合后可消化传代,用于后续研究。将消化法获得的毛囊真皮成纤维细胞接种于细胞培养皿中,12~24 h后贴壁(图 1C),培养5~7 d后,细胞呈旋涡状生长(图 1D)。细胞生长状态表明,本试验分离的山羊毛囊干细胞和毛囊真皮细胞符合各自细胞生长特征,可用于后期试验。
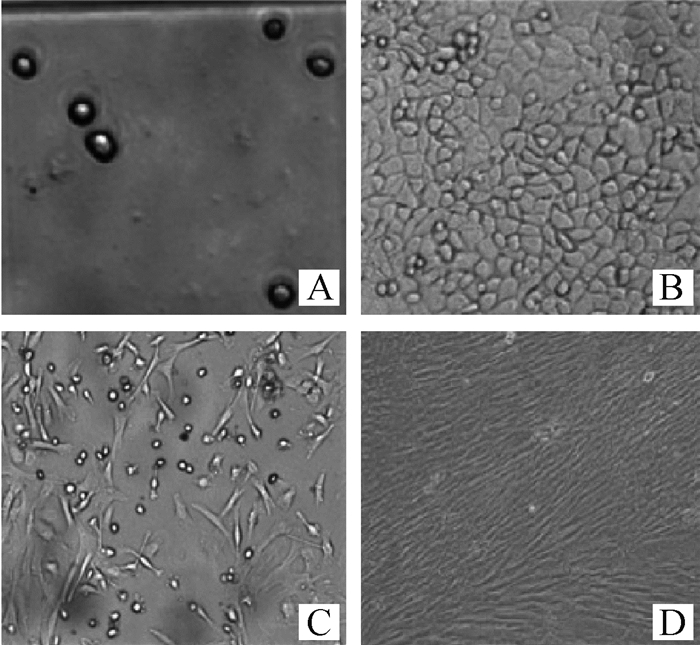
|
A.单个山羊毛囊干细胞(200×);B.融合后的山羊毛囊干细胞(100×);C.贴壁的毛囊真皮细胞(100×);D.融合生长的毛囊真皮细胞(50×) A. Single goat hair follicle stem cells (200×); B. Fused goat hair follicle stem cells (100×); C. Adherent hair follicle dermal cells (100×); D. Fused hair follicle dermal cells (50×) 图 1 山羊毛囊干细胞、毛囊真皮细胞形态特征 Fig. 1 The morphology of goat hair follicle stem cells and dermal cells |
取3~5 mL细胞胶原凝胶混合物分别滴加在铺有羊膜和未铺羊膜的六孔板中,待细胞胶原凝胶混合物凝固后,加入2~3 mL血清浓度为20%的DMEM培养液,测定胶原凝胶的直径,记作第1天,然后放入培养箱中培养,每间隔24 h测定直径,直至凝胶不再收缩。试验重复3组,每组3个重复。试验结果显示,从第2天开始到第7天,两组凝胶直径持续收缩,第7天后,直径稳定在一个数值,不再收缩。未铺羊膜组7 d后直径由原来的(30.1±0.9) mm收缩为(8.1±0.5) mm,收缩率为73.0%,而铺羊膜组7 d后,收缩率为30.0%。差异显著性检验表明,第2~7天,两组间直径大小差异极显著(P<0.01),试验结果表明,羊膜能有效地阻止胶原凝胶的收缩,结果见表 1。
|
|
表 1 铺羊膜组和未铺羊膜组直径收缩比较(x±sx) Table 1 Diameter contraction between amniotic membrane group and unpaved amniotic membrane group(x±sx) |
真皮等同物培养4~6 d后,显微镜镜下显示,毛囊真皮细胞在胶原凝胶中交错生长(图 2A),细胞生长状态良好。然后,以1.5×106·cm-2密度在真皮等同物上接种毛囊干细胞,接种毛囊干细胞15 min后,细胞成圆形,均匀铺在真皮等同物表面(图 2B)。毛囊干细胞接种真皮等同物15 d后,全层皮肤表层细胞致密化生长,局部出现细胞聚集生长(图 2C);全层皮肤继续培养至20~25 d时,见毛囊结构形成(图 2D、E)。真皮细胞生长状态良好、全层皮肤表皮细胞致密化、毛囊结构形成,说明体外组织皮肤构建成功。
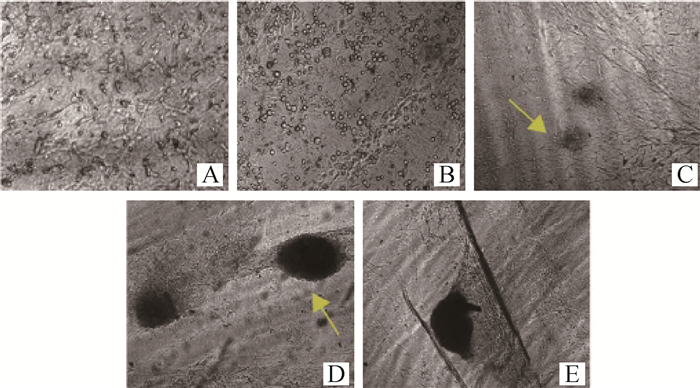
|
A.真皮等同物中成纤维细胞生长状况(100×);B.毛囊干细胞接种真皮等同物15 min(100×);C.毛囊干细胞接种真皮等同物15 d(100×);D.毛囊结构形成(50×);E.毛发长出(50×) A. The cells grew in a network in the collagen gel (100×); B. Hair follicle stem cells were inoculated with dermal equivalents after 15 min (100×); C. Hair follicle stem cells were inoculated with dermal equivalents after 15 d (100×); D. Hair follicle formed (50×); E. Hair growth in full skin (50×) 图 2 组织工程皮肤中毛囊形成过程 Fig. 2 Hair follicle formed in the tissue engineered skin |
培养25 d的全层组织工程皮肤用2.5%戊二醛固定后,电镜扫描观察显示,表皮层角质形成细胞分化良好(图 3红色箭头所示),一部分角质分化细胞开始脱落(图 3蓝色箭头所示),接近于正常皮肤。
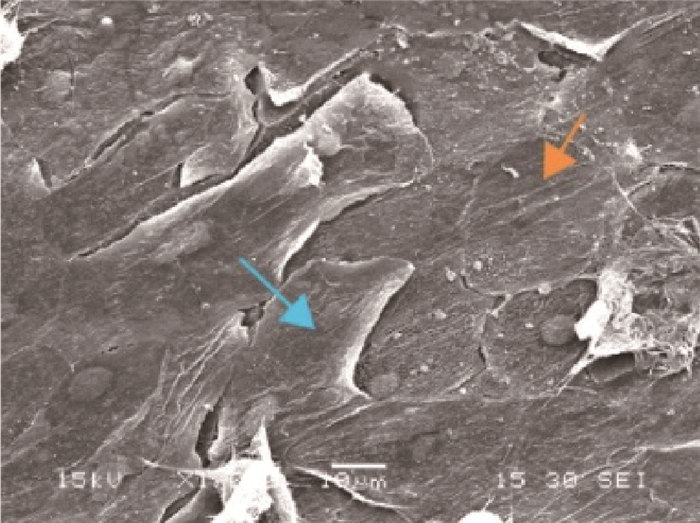
|
图 3 培养25 d的组织工程皮肤扫描电镜图(1 000×) Fig. 3 Scanning electron microscopy of tissue-engineered skin cultured for 25 days (1 000×) |
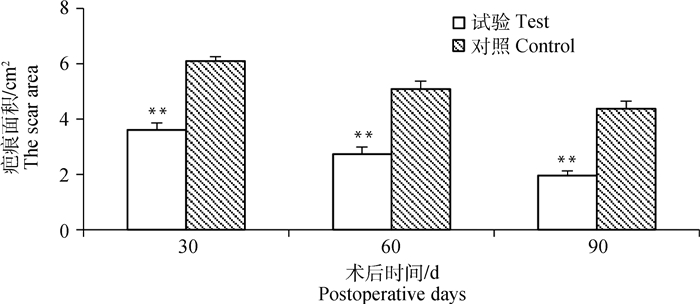
试验组和对照组山羊,制作全层皮肤组织缺损,分别移植全层组织工程皮肤和空白羊膜。移植后观察,发现6只异体细胞移植羊均未发生炎症和移植排斥反应。图 4为移植和疤痕修复过程。移植25 d后去掉敷料层,发现移植组伤口表面光滑,色泽红润,而对照组伤口表面结瘢。移植后30、60、90 d疤痕面积测量分析表明,试验组疤痕面积极显著小于对照组(P<0.01)(图 5)。
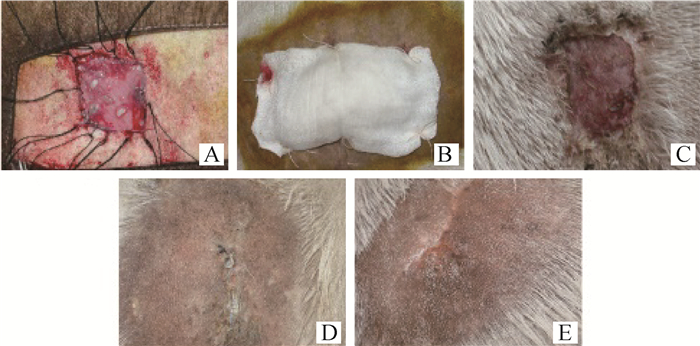
|
A.组织工程皮肤移植及缝合;B.敷料压背;C.移植25 d后愈合状况(×100);D.移植60 d后疤痕状况;E.移植90 d后疤痕状况 A. Transplantation and suture of tissue engineered skin; B. Wound dressing; C. Scar condition on the 25th day after transplantation; D. Scar condition on the 60th day after transplantation; E. Scar condition on the 90th day after transplantation 图 4 移植及疤痕修复过程 Fig. 4 Transplantation and scar repaired |
|
**.P<0.01 图 5 试验组和对照组疤痕面积对比 Fig. 5 Comparison of the scar area between the test and control group |
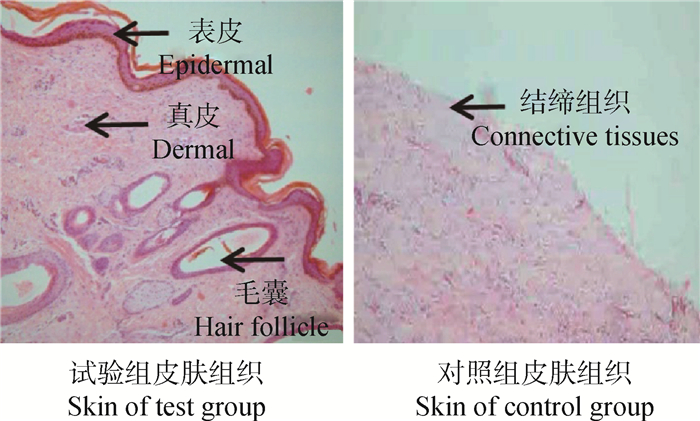
移植270 d后,所有移植羊创伤部位彻底恢复,从移植羊愈合部位取皮肤样本,制作组织切片观察皮肤重建情况。结果(图 6)显示,试验组真、表皮结构发生重建,并出现毛囊结构;而对照组为致密的结缔组织。试验说明毛囊干细胞和毛囊真皮细胞在移植羊体内能够促进皮肤组织结构重建。
|
图 6 移植后皮肤样本组织学检测(HE染色,4×) Fig. 6 Histological section of skin after transplantation (HE staining, 4×) |
自1975年上皮培养技术发明以来[17-18],组织工程皮肤的发展取得了长足进步。Integra、Apligraft、Dermagraft和AlloDerm等四种组织工程皮肤已相继问世,为皮肤烧伤患者解决了一些临床实际问题。但截至目前,还没有任何一款组织工程皮肤可以实现皮肤完整的生理功能,主要问题是缺乏毛囊、汗腺等皮肤附属器官。因此,研发构建具有皮肤附属器官的组织工程皮肤意义重大。
种子细胞和生物支架材料是组织工程皮肤研究的两个重要环节。可用作组织工程皮肤研制的种子细胞有表皮来源细胞(角质形成细胞)、真皮来源细胞(真皮成纤维细胞)和干细胞(表皮干细胞、间充质干细胞等)[19]。角质形成细胞、真皮成纤维细胞属于终末分化细胞,在体外培养过程中因细胞增殖、分裂,端粒DNA丢失等原因,克隆形成能力下降,不能满足临床大量扩增需求。胚胎干细胞具有无限增殖能力和全能分化性,但是由于涉及伦理、道德甚至法律问题,应用研究受到限制。成体干细胞(表皮干细胞、间充质干细胞等)既能满足扩增需求,又不受伦理限制,成为最理想的种子细胞。Rodgers等[20]2018年最新报道,间充质干细胞可有效治疗热烧伤和辐射烧伤。
毛囊干细胞存在于毛囊隆突部位,是皮肤来源细胞的前体细胞,具有多向分化潜能[21-22]。研究表明,毛囊干细胞在毛囊各种细胞发出的信号诱导下,可以向上迁移参与皮脂腺、表皮的形成,向下迁移参与毛囊的形成[23],在哺乳动物的毛发生长和皮肤修复过程中发挥着重要作用。毛囊真皮成分细胞包括毛乳头细胞和真皮鞘成纤维细胞。毛乳头细胞的重要功能是诱导毛囊形成,将毛乳头细胞重新植入已切除了下部组织结构的毛囊底部时,可诱导毛囊形成和毛发生长[24-25]。毛囊真皮鞘细胞又被称为是毛乳头细胞储备库,在毛乳头细胞缺失时,毛囊真皮鞘细胞可以再生毛乳头细胞。经典切除试验表明,在切除老鼠触须下段1/3时,真皮鞘成纤维细胞可转化为毛乳头,毛囊能够再生;切除下段1/2时,毛囊不能再生[26-27]。在胚胎形态发生学中,毛囊形成的过程是先出现间质细胞(真皮鞘细胞)的凝集,然后,凝集的真皮鞘细胞转化为毛乳头细胞,从而诱导毛囊的形成与再生。国内相关学者研究发现,体外培养的真皮鞘细胞也具有凝集生长的特性[27-28]。本研究中,在毛囊形成之前,也出现细胞凝集生长现象(图 3C),与前者研究相印证。
鉴于毛囊干细胞、毛囊真皮细胞在毛囊形成过程中的互作机制,本研究以毛囊干细胞、毛囊真皮成分细胞为种子细胞制作组织工程皮肤。目前,国内外利用毛囊干细胞和毛囊真皮细胞构建组织工程皮肤研究的最新进展是Leiros等[29]报道的采用成年人头皮毛囊干细胞与毛乳头细胞,接种到无细胞真皮基质中,构建出双层组织工程皮肤,移植到裸鼠的全层皮肤缺损处,2周后出现毛囊胚胎发育不同阶段的结构特征,但未见成熟毛囊形成。本研究组织工程皮肤体外培养至25 d时发现有毛囊形成。这一试验结果填补了成体干细胞体外诱导毛囊形成的空白。此外,体外培养的组织工程皮肤移植后均未出现红肿、渗出、积脓和坏死等现象。移植一个月后去掉敷料层,观察发现移植组表面光滑,色泽红润,而对照组后表面结瘢。分别于移植后30、60、90 d测量疤痕面积,试验组表面光滑,疤痕面积极显著小于对照组(P<0.01)。由于对照组为空白羊膜,说明试验组组织工程皮肤中的细胞在毛囊形成以及减少瘢痕形成方面起重要作用。本研究所用的种子细胞为毛囊干细胞和毛囊真皮成分细胞,没有进一步筛选毛乳头细胞和毛囊真皮鞘成纤维细胞,也没有对种子细胞进行标记,不能充分说明每种细胞在毛囊构成中的作用,这有待于进一步研究。
3.2 组织工程皮肤真皮支架的制作支架材料是组织工程皮肤研究的重要内容,一般分为天然类和合成类两类。天然类支架材料中,胶原因具有良好的生物相容性和黏合性而广泛应用于皮肤替换和烧伤治疗[12]。而胶原和成纤维细胞以一定的比例混合,然后将角朊细胞接种于凝胶表面即为组织工程皮肤。国外以猪真皮Ⅰ型胶原和牛Ⅰ型胶原为支架材料合成的组织工程皮肤已经应用于临床[30-31]。国内金岩等[32]以胎儿皮肤细胞和牛Ⅰ型胶原混合,研制出全层组织工程皮肤;显微观察显示该皮肤具备皮肤表皮层和真皮层,其结构接近于正常皮肤。刘钰等[33]用牛尾胶原和鼠尾胶原体外构建3D人工皮肤,结果表明牛尾胶原更适合作为支架材料构建人工皮肤。
胶原作为真皮支架材料虽然具有黏附性好、抗原性弱、可降解且没有毒性等优点,但胶原作为真皮支架也有突出的缺点,即胶原凝胶的收缩性,研究发现胶原凝胶最大可收缩80%[34]。胶原凝胶的收缩程度与胶原的浓度以及成纤维细胞的比例有关。胶原凝胶的收缩程度和胶原浓度成反比,和成纤维细胞浓度成正比;但如果胶原浓度太高,则不利于成纤维细胞的生长[35]。因此,探索胶原浓度、细胞浓度及收缩率三者之间的关系,找到三者的最佳配比是解决胶原凝胶收缩的关键环节。本研究在参照前人工作的基础上,采用正交试验设计筛选出最佳的胶原浓度和细胞浓度,胶原浓度为4.5 mg·mL-1,细胞密度为1×105·mL-1,细胞生长状态和胶原凝胶收缩为最佳。把胶原凝胶混合物滴加在羊膜上,培养7 d后真皮等同物的最大收缩率为30.0%,而对照组7 d后的收缩率为73.0%。此外,羊膜作为一种生物材料,具有很好的组织相容性,在移植初期可为种子细胞提供营养,还可以有效降低烧伤后瘢痕形成[36-37]。
4 结论首次以山羊成体干细胞——毛囊干细胞和毛囊真皮细胞为种子细胞,以羊膜、牛Ⅰ型胶原为支架材料,体外构了具有毛囊结构的组织工程皮肤,并将组织工程皮肤移植到山羊体内,通过观察和检测受损皮肤的修复效果发现,毛囊干细胞和毛囊真皮细胞作为种子细胞可促进皮肤基底层、毛囊结构的重建,该研究为具有完整生理功能的组织工程皮肤研制奠定了坚实基础。
| [1] | PILEHVAR-SOLTANAHMADI Y, AKBARZADEH A, MOAZZEZ-LALAKLO N, et al. An update on clinical applications of electrospun nanofibers for skin bioengineering[J]. Artif Cells Nanomed Biotechnol, 2016, 44(6): 1350–1364. |
| [2] |
黄博鑫.组织工程皮肤支架制备及其全层皮肤构建研究[D].广州: 广东工业大学, 2018: 1-67.
HUANG B X. Preparation of tissue-engineered skin scaffolds and study of full-thickness skin construction[D]. Guangzhou: Guangdong University of Technology, 2018: 1-67. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-11845-1018866987.htm |
| [3] |
殷璐.人胚胎干细胞定向诱导为成纤维细胞并构建组织工程皮肤的研究[D].西安: 西北大学, 2016: 1-64.
YIN L. Inducing human embryonic stem cells into fibroblasts for the construction of tissue-engineered skin[D]. Xi'an: Northwest University, 2016: 1-64. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10697-1017038569.htm |
| [4] |
来国莉, 付丽红. 胶原在组织工程人工皮肤中的应用[J]. 陕西科技大学学报, 2004, 22(3): 113–117.
LAI G L, FU L H. Application of collagen in tissue engineering for artificial skin[J]. Journal of Shaanxi University of Science & Technology, 2004, 22(3): 113–117. DOI: 10.3969/j.issn.1000-5811.2004.03.027 (in Chinese) |
| [5] | OSHIMA H, ROCHAT A, KEDZIA C, et al. Morphogenesis and Renewal of hair follicles from adult multipotent stem cells[J]. Cell, 2001, 104(2): 233–245. DOI: 10.1016/S0092-8674(01)00208-2 |
| [6] | TAYLOR G, LEHRER M S, JENSEN P J, et al. Involvement of follicular stem cells in forming not only the follicle but also the epidermis[J]. Cell, 2000, 102(4): 451–461. DOI: 10.1016/S0092-8674(00)00050-7 |
| [7] | ASAKAWA K, TOYOSHIMA K E, ISHIBASHI N, et al. Hair organ regeneration via the bioengineered hair follicular unit transplantation[J]. Sci Rep, 2012, 2: 424. DOI: 10.1038/srep00424 |
| [8] | GHO C G, BRAUN J E F, TILLI C M L J, et al. Human follicular stem cells:their presence in plucked hair and follicular cell culture[J]. Br J Dermatol, 2004, 150(5): 860–868. DOI: 10.1111/j.1365-2133.2004.05862.x |
| [9] | ZHANG Y, XIANG M M, WANG Y, et al. Bulge cells of human hair follicles:segregation, cultivation and properties[J]. Colloids Surf. B, 2006, 47(1): 50–56. DOI: 10.1016/j.colsurfb.2005.11.017 |
| [10] | NIEMANN C, WATT F M. Designer skin:lineage commitment in postnatal epidermis[J]. Trends Cell Biol, 2002, 12(4): 185–192. DOI: 10.1016/S0962-8924(02)02263-8 |
| [11] |
史明艳, 杨学义, 窦忠英. 山羊毛囊干细胞分离培养方法研究[J]. 畜牧兽医学报, 2006, 37(5): 436–440.
SHI M Y, YANG X Y, DOU Z Y. Study on the isolation and culture of goat hair follicle stem cells[J]. Acta Veterinaria et Zootechnica Sinica, 2006, 37(5): 436–440. DOI: 10.3321/j.issn:0366-6964.2006.05.004 (in Chinese) |
| [12] |
史明艳.山羊毛囊干细胞及组织工程皮肤构建研究[D].杨凌: 西北农林科技大学, 2006: 1-96.
SHI M Y. Study on goat hair follicle stem cells and construction of tissue engineered skin[D]. Yangling: Northwest A&F University, 2006: 1-96. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10712-2006179925.htm |
| [13] |
王馨.羊膜生物支架与组织工程化角膜上皮的构建[D].杨凌: 西北农林科技大学, 2004: 1-78.
WANG X. Human amniotic membrane bioscaffold and construction of tissue-engineering corneal epithelium[D]. Yangling: Northwest A&F University, 2004: 1-78. (in Chinese) http://cdmd.cnki.com.cn/article/cdmd-10712-2004124424.htm |
| [14] |
李荟元, 刘仲荣, 屠军波, 等. 国外美容医学最新动态[J]. 中国美容医学, 2005, 14(4): 518–520.
LI H Y, LIU Z R, TU J B, et al. The latest trend of cosmetic medicine abroad[J]. Chinese Journal of Aesthetic Medicine, 2005, 14(4): 518–520. DOI: 10.3969/j.issn.1008-6455.2005.04.069 (in Chinese) |
| [15] |
于东宁, 张国安, 李健宁. 瘢痕面积及其不规则程度的定量测量方法研究[J]. 中国美容医学, 2006, 15(5): 486–489.
YU D N, ZHANG G A, LI J N. Study on measurements of scar areas and irregularity degree[J]. Chinese Journal of Aesthetic Medicine, 2006, 15(5): 486–489. DOI: 10.3969/j.issn.1008-6455.2006.05.002 (in Chinese) |
| [16] |
冉聃, 李婉娟, 孙全刚, 等. 不同方法测量不规则瘢痕面积的比较[J]. 法医学杂志, 2016, 32(5): 338–341.
RAN D, LI W J, SUN Q G, et al. Comparision of different methods of area measurement in irregular scar[J]. Journal of Forensic Medicine, 2016, 32(5): 338–341. DOI: 10.3969/j.issn.1004-5619.2016.05.005 (in Chinese) |
| [17] | RHEINWATD J G, GREEN H. Seria cultivation of strains of human epidemal keratinocytes:the formation keratinizin colonies from single cell is[J]. Cell, 1975, 6(3): 331–343. DOI: 10.1016/S0092-8674(75)80001-8 |
| [18] | GREEN H, KEHINDE O, THOMAS J. Growth of cultured human epidermal cells into multiple epithelia suitable for grafting[J]. Proc Natl Acad Sci USA, 1979, 76(11): 5665–5668. DOI: 10.1073/pnas.76.11.5665 |
| [19] |
张广静, 王正想, 冯世军, 等. 组织工程皮肤种子细胞的研究进展[J]. 中国当代医药, 2018, 25(19): 28–31.
ZHANG G Z, WANG Z X, FENG S J, et al. Research progress on tissue engineered skin seed cells[J]. China Modern Medicine, 2018, 25(19): 28–31. DOI: 10.3969/j.issn.1674-4721.2018.19.008 (in Chinese) |
| [20] | RODGERS K, JADHAV S S. The application of mesenchymal stem cells to treat thermal and radiation burns[J]. Adv Drug Deliv Rev, 2018, 123: 75–81. DOI: 10.1016/j.addr.2017.10.003 |
| [21] | ZHANG H S, ZHANG S B, ZHAO H S, et al. Ovine hair follicle stem cells derived from single vibrissae reconstitute haired skin[J]. Int J Mol Sci, 2015, 16(8): 17779–17797. DOI: 10.3390/ijms160817779 |
| [22] |
丁毓威, 辛国华, 曾元临, 等. 干细胞诱导分化为毛囊及再生的研究进展[J]. 中国组织工程研究, 2016, 20(50): 7579–7585.
DING Y W, XIN G H, ZENG Y L, et al. Research progress of stem cells in hair follicle regeneration[J]. Chinese Journal of Tissue Engineering Research, 2016, 20(50): 7579–7585. DOI: 10.3969/j.issn.2095-4344.2016.50.019 (in Chinese) |
| [23] | BROUARD M, BARRANDON Y. Controlling skin morphogenesis:hope and despair[J]. Curr Opin Biotechnol, 2003, 14(5): 520–525. DOI: 10.1016/j.copbio.2003.09.005 |
| [24] |
伍津津, 朱堂友.
皮肤组织工程学[M]. 北京: 人民军医出版社, 2009: 122-123.
WU J J, ZHU T Y. Tissue engineering of skin[M]. Beijing: People's Military Medical Press, 2009: 122-123. (in Chinese) |
| [25] |
伍津津. 毛囊干细胞与组织工程研究进展[J]. 中国医学文摘·皮肤科学, 2016, 33(4): 415–423.
WU J J. Research progress of hair follicle stem cells and tissue Engineering[J]. China Medical Abstracts of Dermatology, 2016, 33(4): 415–423. (in Chinese) |
| [26] | PISANSARAKIT P, MOORE G P. Induction of hair follicles in mouse skin by rat vibrissa dermal papillae[J]. J Embryol Exp Morphol, 1986, 94: 113–119. |
| [27] | WU J J, ZHU T Y, LU Y G, et al. Hair follicle reformation induced by dermal papilla cells from human scalp skin[J]. Arch Dermatol Res, 2006, 298(4): 183–190. DOI: 10.1007/s00403-006-0686-9 |
| [28] |
位争伟.毛囊真皮成分细胞生物学特性及其诱导毛囊形成的初步研究[D].重庆: 第三军医大学, 2003: 1-84.
WEI Z W. Primary study on the biological properties of the hair follicular dermal cells to induce the hair follicle reformation[D]. Chongqing: The Third Military Medical University, 2003: 1-84. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-90025-2003122684.htm |
| [29] | LEIRÍS G J, KUSINSKY A G, DRAGO H, et al. Dermal papilla cells improve the wound healing process and generate hair bud-like structures in grafted skin substitutes using hair follicle stem cells[J]. Stem Cells Transl Med, 2014, 3(10): 1209–1219. DOI: 10.5966/sctm.2013-0217 |
| [30] | HANSBROUGH J F, MOZINGO D W, KEALEY G P, et al. Clinical trials of a biosynthetic temporary skin replacement, dermagraft-transitional covering, compared with cryopreserved human cadaver skin for temporary coverage of excised burn wounds[J]. J Burn Care Rehabil, 1997, 18(1): 43–51. DOI: 10.1097/00004630-199701000-00008 |
| [31] | HANSBROUGH J F, DORÉ C, HANSBROUGH W B. Clinical trials of a living dermal tissue replacement placed beneath meshed, split-thickness skin grafts on excised burn wounds[J]. J Burn Casre Rehabil, 1992, 13(5): 519–529. DOI: 10.1097/00004630-199209000-00004 |
| [32] |
金岩, 吕红兵, 刘源, 等. 人全层组织工程皮肤的研制[J]. 实用口腔医学杂志, 2002, 18(2): 163–166.
JIN Y, LÜ H B, LIU Y, et al. Development of human tissue-engineered skin with full thickness[J]. Journal of Practical Stomatology, 2002, 18(2): 163–166. DOI: 10.3969/j.issn.1001-3733.2002.02.023 (in Chinese) |
| [33] |
刘钰, 沈冲, 孟琴. 体外构建3D人工皮肤[J]. 中国组织工程研究, 2016, 20(46): 6915–6921.
LIU Y, SHEN C, MENG Q. Artificial skin preparation using three-dimensional printing in vitro[J]. Chinese Journal of Tissue Engineering Research, 2016, 20(46): 6915–6921. DOI: 10.3969/j.issn.2095-4344.2016.46.010 (in Chinese) |
| [34] | CHRISTOPHERS E. Cellular architecture of the stratum corneum[J]. J Invest Dermatol, 1971, 56(3): 165–169. |
| [35] | POTTEN C S. The epidermal proliferative unit:the possible role of the central basal cell[J]. Cell Tissue Kinet, 1974, 7(1): 77–88. |
| [36] | GHOLIPOURMALEKABADI M, SAMADIKUCH-AKSARAEI A, SEIFALIAN A M, et al. Silk fibroin/amniotic membrane 3D bi-layered artificial skin[J]. Biomed Mater, 2018, 13(3): 035003. DOI: 10.1088/1748-605X/aa999b |
| [37] | HE P, ZHAO J N, ZHANG J M, et al. Bioprinting of skin constructs for wound healing[J]. Burns Trauma, 2018, 6: 5. DOI: 10.1186/s41038-017-0104-x |



