2. 河北北方学院生命科学研究中心, 张家口 075000;
3. 河北北方学院基础医学院, 张家口 075000
2. Life Science Research Center, Hebei North University, Zhangjiakou 075000, China;
3. Basic Medical College, Hebei North University, Zhangjiakou 075000, China
自1997年以来不断出现新亚型动物源性流感病毒感染人、甚至导致公共卫生事件,如H5N1和H7N9亚型流感病毒[1-2]。此外,我国近年来陆续报道H9N2流感病毒感染人病例,尽管感染者一般表现为轻微的呼吸道症状[3-4],但是也有危重临床病例出现,表现为严重的肺炎[5-6],而且目前研究显示H9N2流感病毒具有更直接有效地与人类细胞表面SAα2-6Gal受体结合的能力,因此H9N2流感病毒具有潜在突破种间屏障而导致人类流感流行的能力[7]。
H9N2流感病毒能有效地在人及实验动物肺组织内增殖,其肺病理组织学损伤变化特征为弥漫性肺泡损伤,因此,肺微血管内皮细胞(PMVEC)损伤可能是流感病毒引起急性肺损伤的重要环节之一[8-9]。其致病机制主要与诱导产生大量的炎性细胞因子及活性氧类自由基有关[10]。徐彤等[11]研究发现氧化应激作用在H9N2流感病毒诱导肺损伤过程中发挥重要作用。作为氧化应激敏感性传感器,TRPM2瞬时受体电位(transient receptor potential,TRP)通道是多种细胞中参与构成Ca2+信号通路的一个重要结构域,借助氧化应激引起细胞内Ca2+浓度升高,参与多种细胞的生理、病理过程。因此,TRPM2可作为氧化应激相关性疾病一个潜在的治疗靶点[12]。Hecquet和Malik[13]研究表明TRPM2通道在H2O2作用下导致细胞质内Ca2+浓度增加,同时,通过不同方法抑制内源性TRPM2的表达和功能,有效地缓解了氧化应激导致的血管内皮细胞损伤。此外,Hecquet等[14]证实氧化应激过程中抑制TRPM2介导的Ca2+内流可以减缓内皮细胞凋亡,进而缓解血管损伤和炎症反应。在正常情况下,细胞内总钙量的70%~80%存在线粒体中,线粒体对Ca2+的摄取和释放以及细胞质内钙离子浓度的调节中起重要作用。在感染、内毒素等损伤因素作用下引起细胞膜破坏和膜上Ca2+-ATPase受抑制,线粒体代偿性摄入Ca2+,最终导致细胞凋亡或者坏死[15]。因此,TRPM2介导Ca2+内流与内皮细胞线粒体功能异常密切相关。
鉴于氧化应激作用在流感病毒诱导肺损伤的重要作用以及TRPM2诱导Ca2+内流与内皮细胞线粒体功能异常的相关性,为了探讨TRPM2离子通道在H9N2流感病毒感染PMVEC线粒体损伤作用,本研究在建立TRPM2 shRNA PMVEC基础上,研究TRPM2通道对H9N2流感病毒感染PMVEC线粒体损伤以及相关的特异性酶、线粒体膜电位以及细胞凋亡的影响,为进一步阐明流感病毒诱导肺损伤的机制及今后开展有效防控提供理论依据。
1 材料与方法 1.1 材料SIA/swine/hebei/012/2008/(H9N2)病毒(本实验室分离),经中国农业科学院哈尔滨兽医研究所动物流感重点开放实验室鉴定,其部分基因序列号为Y063662、CY063663、CY063664、Y063665。将该病毒经10日龄SPF鸡胚(北京实验动物中心提供)盲传3代,收集死亡的鸡胚感染性尿囊液,分装后于-70 ℃冰箱保存,待用。
小鼠PMVEC购自武汉普诺赛生命科技有限公司;培养基DMEM-高糖、L-谷氨酰胺、丙铜酸钠、青链霉素双抗购自Gibco公司;胎牛血清(FBS)购自康宁公司。
TRPM2 shRNA慢病毒载体质粒购自圣克鲁兹;胰蛋白酶-EDTA消化液(0.25%)、JC-1检测试剂盒、Annexin V-FITC/PI双染细胞凋亡检测试剂盒、谷胱甘肽(GSH)检测试剂盒、线粒体提取试剂盒、超氧化物歧化酶(SOD)测试盒、一氧化氮合成酶(NOS)测试盒、线粒体呼吸链复合物Ⅳ检测试剂盒、总ATP酶定量试剂盒、总蛋白定量测试盒均购自江苏凯基公司。
1.2 方法 1.2.1 细胞培养用含10%小牛血清的DMEM-H培养液在CO2培养箱中培养PMVEC,定期更换培养液,定期传代细胞保持指数生长发育。
1.2.2 TRPM2 shRNA PMVEC活力检测TRPM2 shRNA慢病毒颗粒转染及阳性细胞筛选、鉴定具体方法见梁亭等[16]的报道。将未经慢病毒转染以及慢病毒转染shRNA阴性和TRPM2 shRNA阳性PMVEC培养至对数生长期,0.25%胰酶消化细胞,4 ℃ 800×g离心5 min,PBS洗涤,计数5×107个细胞,加入100 μL含0.5 mg·mL-1 MTT的培养液置于5% CO2 37 ℃细胞培养箱中进行培养3 h,离心吸弃上清,每孔加入100 μL二甲亚砜,振荡混匀后于490 nm测定OD值。
1.2.3 TRPM2基因沉默对H9N2流感病毒感染导致PMVEC线粒体损伤的电镜观察将各组细胞解冻、复苏,培养至对数生长期,在细胞达到70%融合时,加入5 MOI的H9N2病毒进行感染,在感染后24和48 h,PBS缓冲液洗板,用细胞铲将细胞刮下、4 ℃ 800×g离心5 min,细胞沉淀经固定、脱水、包埋等处理后使用Leica EM UC7超薄切片机切片,切片经醋酸铀、枸橼酸铅染色,JEM 1230透射电镜观察线粒体损伤情况。
1.2.4 PMVEC线粒体提取及氧化应激相关指标(NOS、SOD活性和GSH含量)测定将细胞培养至对数生长期,用0.25%胰酶消化细胞,4 ℃ 800×g离心5 min,PBS洗涤,计数5×107个细胞,加0.8 mL缓冲液重悬,细胞悬液冰浴、匀浆;加0.2 mL Medium Buffer混匀,4 ℃、1 200×g离心5 min,弃沉淀;转移上清,4 ℃、7 000×g离心10 min所得沉淀即为线粒体;重悬线粒体沉淀,4 ℃、9 500×g离心5 min,再次沉淀线粒体,用反应缓冲液重悬线粒体沉淀(100 μL,5×107个细胞)。立即使用,进行蛋白定量,按照检测试剂盒说明书操作步骤测定并计算、测定不同试验组线粒体中SOD、NOS活性和GSH含量。
1.2.5 线粒体功能相关ATP酶及线粒体呼吸链复合物Ⅳ活性检测6孔板接种细胞,病毒处理结束后,弃上清液,每孔加入200 μL裂解液,充分裂解后,4 ℃、12 000×g离心5 min,取上清,转移至96孔板,每孔60 μL,3个复孔,每孔加100 μL ATP检测工作液,并根据试剂盒说明绘制标准曲线,酶标仪检测。按上述线粒体提取方法提取线粒体后,按照说明书指导方法测定线粒体呼吸链复合物Ⅳ活性。
1.2.6 线粒体跨膜电位(△ψm)定性观察将培养于6孔板中的各组PMVEC细胞,计数5.0×104个·孔-1,PBS洗2次,加入1 mL培养基,然后加入JC-1染色工作液,充分混匀。培养箱中37 ℃孵育20 min,2 000 r·min-1离心5 min,吸除上清,在冰水混合物条件下用JC-1染色缓冲液洗涤2次、重悬,置于载玻片上,激光共聚焦显微镜下观察、拍照分析。
1.2.7 细胞凋亡的AnnexinV-FITC/PI双染检测将培养于6孔板中细胞吸去悬浮培养液,以预冷PBS润洗3次后,弃PBS液体,收集细胞。将收集的各组PMVEC悬浮于1×Annexin V-FITC/PI结合缓冲液中,细胞密度约为5×104个·孔-1,加入5 μL的Annexin V-FITC染色液,避光室温孵育15 min后,加入10 μL PI染色液,轻轻混匀避光室温孵育5 min,立即在激光共聚焦显微镜下观察细胞凋亡情况。
1.3 统计学分析数据以均数±标准差(x±s)表示,采用Spss20.0软件进行统计分析,多组间差异比较采用方差分析,组间两两差异比较采用LSD法分析,以P<0.05为差异有统计学意义。
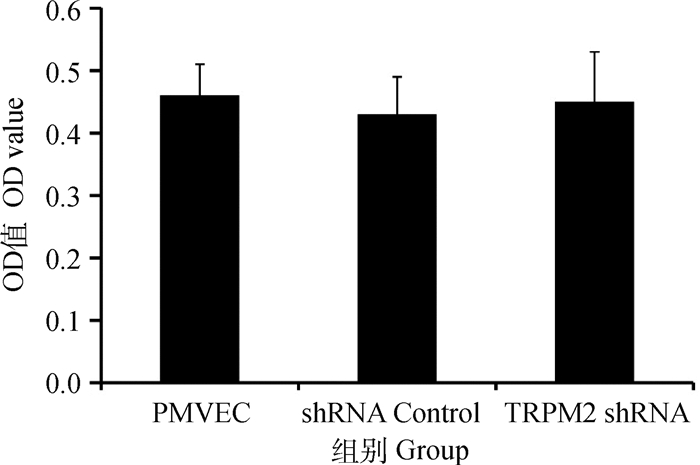
2 结果 2.1 TRPM2基因沉默对PMVEC活力的影响由图 1可知,未经慢病毒转染的PMVEC OD值与慢病毒转染shRNA阴性对照及TRPM2 shRNA阳性PMVEC的OD值基本一致(P>0.05),TRPM2基因沉默对PMVEC活力没有影响。
|
图 1 沉默TRPM2基因对PMVEC活力的影响 Fig. 1 The effect of TRPM2 gene silencing on cell viability of PMVEC |
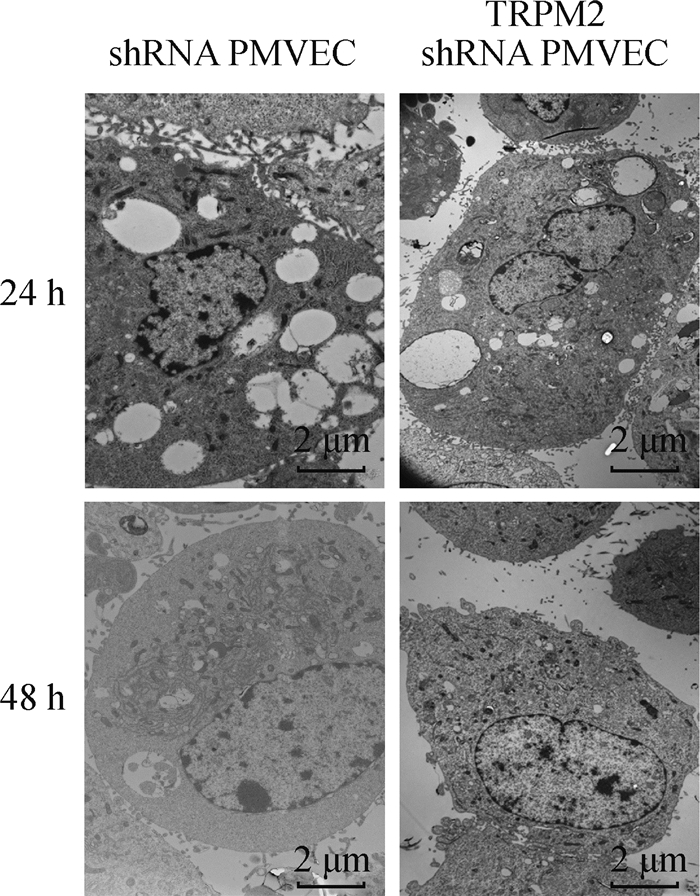
电镜观察结果(图 2)显示,shRNA PMVEC在H9N2-SIV感染后24 h,PMVEC细胞质中细胞器数量减少,可见大量的空泡结构,挤压细胞核至变形;至病毒感染后48 h,细胞质中细胞器数量减少,细胞核染色质边集,内质网明显增多; 然而在TRPM2 shRNA PMVEC内,在病毒感染后24 h,虽然呈现与未基因沉默PMVEC相似的变化,但是损伤程度明显减轻;至感染后48 h,与对照组相比没有观察到明显的细胞损伤。
|
图 2 沉默TRPM2基因对PMVEC超微结构损伤的影响 Fig. 2 The effect of TRPM2 gene silencing on ultrastructural damage of PMVEC |
与对照shRNA PMVEC线粒体提取物相比在H9N2流感病毒作用24 h后,TRPM2 shRNA PMVEC线粒体的SOD活性和GSH水平明显高于对照组(P<0.05或P<0.01);至病毒作用后48 h时,TRPM2基因沉默的TRPM2 shRNA PMVEC线粒体的SOD活性和GSH水平仍然极显著高于未进行TRPM2基因沉默的shRNA PMVEC(P<0.01),表明TRPM2基因沉默减少了H9N2-SIV感染PMEVC SOD和GSH的消耗。
与SOD和GSH的变化趋势相反,TRPM2基因沉默的TRPM2 shRNA PMVEC线粒体提取物中mtNOS活性值则在病毒作用24 h开始即极显著低于对照的shRNA PMVEC(P<0.01);至病毒作用后48 h,基因沉默组的线粒体提取物中mtNOS极显著低于TRPM2 shRNA PMVEC(P<0.01)。
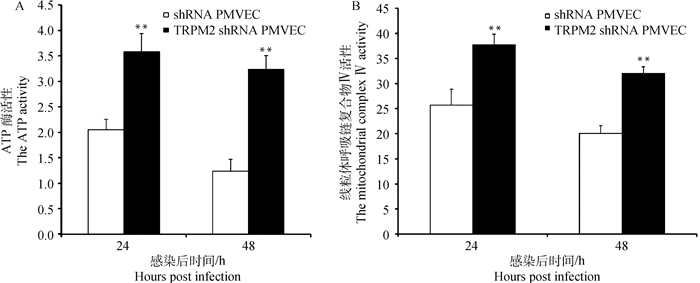
2.4 TRPM2基因沉默对PMVEC线粒体呼吸链复合物Ⅳ活性、Na+-K+-ATP酶活性的影响图 3结果显示,Na+-K+-ATP酶与细胞活力密切相关,与TRPM2 shRNA PMVEC相比,shRNA PMVEC在H9N2-SIV作用24 h后,Na+-K+-ATP酶活性明显降低(P<0.01);至病毒作用48 h,Na+-K+-ATP酶活性极显著低于TRPM2 shRNA PMVEC(P<0.01)。
|
与shRNA PMVEC比较,**. P<0.01 Compared with shRNA PMVEC, **. P < 0.01 图 3 TRPM2基因沉默对H9N2-SIV感染PMVEC的线粒体呼吸链复合物Ⅳ和Na+-K+-ATP酶活性的影响 Fig. 3 The effect of TRPM2 gene silencing on mitochondrial complex Ⅳ and Na+-K+-ATP activity in mitochondria of H9N2-SIV infected PMVEC |
|
|
表 1 TRPM2基因沉默对H9N2-SIV感染PMVEC线粒体中SOD活性、GSH水平、mtNOS活性的影响(x±s,n=6) Table 1 The effect of TRPM2 gene silencing on SOD activity, GSH level and mtNOS activity in PMVEC mitochondrial with H9N2-SIV infection (x±s, n=6) |
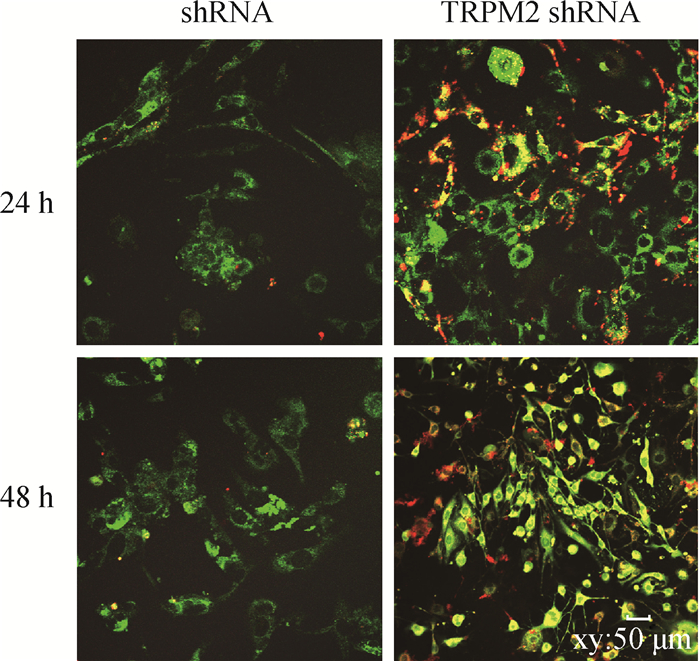
激光共聚焦显微镜观察(图 4)显示,shRNA PMEVC主要呈现绿色荧光,随着病毒作用时间延长至48 h,更多的shRNA PMEVC呈现明显的绿色荧光。与此相反,TRPM2 shRNA PMVEC呈现明显红色以及黄绿色荧光,至病毒作用48 h,与shRNA PMEVC对照相比,视野中仍然有较多细胞呈现红色以及黄绿色荧光。
|
图 4 TRPM2基因沉默对H9N2感染的PMVEC线粒体膜电位的影响(JC-1染色,40×) Fig. 4 The effect of TRPM2 gene silencing on mitochondrial membrane potential in H9N2 infected PMVEC (JC-1 stain, 40×) |
TRPM2基因沉默对感染H9N2流感病毒PMVEC凋亡的影响结果(图 5)显示,在shRNA PMEVC对照组,病毒作用24 h大量PMVEC细胞膜呈现绿色荧光,部分细胞核出现红色荧光;至病毒作用48 h,PMVEC细胞核呈现红色荧光比例明显高于病毒作用24 h;然而,在TRPM2 shRNA PMVEC病毒作用24 h,与shRNA PMVEC相比呈现绿色荧光的细胞明显减少,几乎没有见到红色荧光的细胞核;至病毒作用48 h显示被染色的PMVEC仍然明显少于对照组,提示TRPM2基因沉默显著降低H9N2-SIV感染导致的PMVEC凋亡。
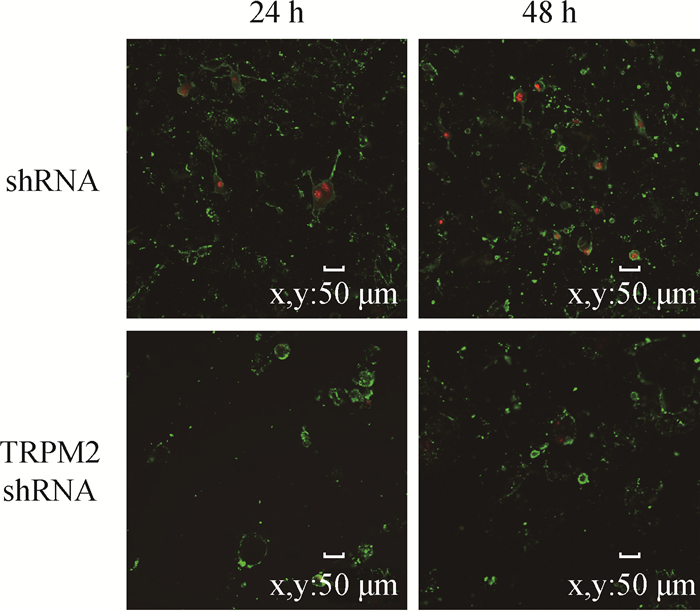
|
图 5 TRPM2基因沉默对H9N2感染的PMVEC凋亡的影响(AnnexinV-FITC/PI双染,40×) Fig. 5 The effect of TRPM2 gene silencing on apoptosis in H9N2 infected PMVEC (AnnexinV-FITC/PI double stain, 40×) |
线粒体是高度特化的真核细胞的动力站,处于细胞呼吸链和氧化磷酸化的中心。在细胞病理条件下,线粒体Ca2+转运发生紊乱,通过改变线粒体膜的通透性导致线粒体内相关物质释放入细胞质,从而引起细胞坏死或凋亡,因此线粒体可能在细胞凋亡中起到“主开关”作用。作为位于细胞膜上的一种多功能非选择性钙离子通道和氧化应激敏感性传感器,TRPM2通过调节胞内钙离子浓度从而调节氧化应激引起的细胞损伤[12],因此,TRPM2可能在氧化应激引起Ca2+内流与细胞线粒体损伤之间存在密切相关性。
目前研究认为氧化应激作用在流感病毒感染导致肺损伤过程中发挥重要作用[17-19]。在研究H9N2-SIV感染小鼠PMVEC过程中,本课题组前期研究发现TRPM2表达明显增加,参与了H9N2-SIV导致小鼠PMVEC损伤过程。本研究为了进一步探讨TRPM2是否参与细胞线粒体损伤,利用H9N2-SIV感染TRPM2 shRNA PMVEC,结果发现TRPM2基因沉默明显减少了病毒感染导致的SOD以及GSH的消耗,而NOS则显著低于shRNA PMVEC,表明TRPM2作为氧化应激活化的信号通路沉默后反馈减少活性氧类/氮类自由基产生,进而减少细胞损伤程度。Hecquet和Malik[13]发现通过不同方法抑制内源性TRPM2的表达和功能,有效地缓解了氧化应激导致的血管内皮细胞损伤。此外,在没有影响对照小鼠的情况下,Lu等[20]报道利用TRPM2离子通道抑制剂(2-APB、FA)显著降低了糖尿病大鼠肺毛细血管滤过系数和过氧化物水平。为了检测TRPM2基因沉默是否影响PMVEC生存能力,试验中本研究检测TRPM2 shRNA和shRNA对照PMVEC活力,结果显示TRPM2基因沉默对PMVEC生存能力没有影响。在病毒感染后超微结构观察显示在shRNA对照PMVEC中细胞器显著减少、线粒体基质减少、甚至出现空泡化及凋亡趋势;同时Annexin V-FITC/PI染色激光共聚焦观察显示大量细胞出现凋亡现象。然而,在TRPM2 shRNA PMVEC内细胞损伤明显减轻、凋亡细胞数量明显降低。这种现象表明通过shRNA技术使TRPM2基因沉默保护了H9N2-SIV导致PMVEC损伤以及细胞凋亡。
细胞凋亡的主要途径之一是细胞内线粒体途径。线粒体是细胞内产生活性氧类的主要场所,参与细胞内氧化还原反应过程以及清除侵入的病原微生物。然而在病理状态下,线粒体损伤导致呼吸链复合物Ⅰ~Ⅳ酶活性降低,致使呼吸链电子传递过程中产生的大量活性氧类将线粒体自身作为首要靶标,造成线粒体结构与功能的异常,进而加速活性氧类的生成,导致细胞严重的氧化损伤和细胞凋亡[21-22]。本研究结果显示TRPM2基因沉默后,PMVEC内Na+-K+-ATP酶活性和线粒体呼吸链复合物Ⅳ活性显著高于H9N2病毒感染对照shRNA PMVEC。线粒体膜电位对于维护线粒体功能十分重要。目前研究证实线粒体在细胞凋亡过程中起着中心地位作用,是细胞凋亡的执行者[23-24]。线粒体膜电位的下降早于电镜下线粒体形态的改变,也早于DNA裂解和细胞膜表面丝氨酸磷脂的暴露[25]。本研究线粒体膜电位JC-1染色显示TRPM2基因沉默显著减少H9N2病毒感染导致PMVEC线粒体膜电位的下降。此外,TRPM2基因沉默也明显减少H9N2病毒感染导致的细胞凋亡,其变化趋势与线粒体膜电位变化相关一致。Çakir等[26]报道应用TRPM2离子通道阻断剂N-(p-amylcinnamoyl) anthranilic acid (ACA)有效保护大鼠肾缺血-再灌注损伤。此外,Li等[27-28]报道通过基因沉默等不同方法抑制TRPN2离子通道有效阻止了游离脂肪酸诱导的线粒体破裂以及β-细胞死亡。以上研究证实TRPM2离子通道在线粒体损伤中发挥着重要作用。
4 结论TRPM2 shRNA通过影响线粒体相关特异性酶、膜电位变化、活性氧类/氮类自由基可以有效减缓PMVEC线粒体损伤及诱导的细胞凋亡,提示TRPM2离子通道与H9N2-SIV致PMVEC线粒体损伤具有密切相关性,为进一步以TRPM2为靶点研究干预流感病毒诱导肺损伤提供借鉴。
| [1] | POOVORAWAN Y, PYUNGPORN S, PRACHAYANGPRECHA S, et al. Global alert to avian influenza virus infection:from H5N1 to H7N9[J]. Pathog Glob Health, 2013, 107(5): 217–223. DOI: 10.1179/2047773213Y.0000000103 |
| [2] | GAO R B, CAO B, HU Y W, et al. Human infection with a novel avian-origin influenza A (H7N9) virus[J]. N Engl J Med, 2013, 368(20): 1888–1897. DOI: 10.1056/NEJMoa1304459 |
| [3] |
何军, 刘丽萍, 侯赛, 等. 安徽省2株人感染H9N2流感病毒基因特征[J]. 中华流行病学杂志, 2016, 37(5): 708–713.
HE J, LIU L P, HOU S, et al. Genomic characteristics of 2 strains of influenza A (H9N2) virus isolated from human infection cases in Anhui province[J]. Chinese Journal of Epidemiology, 2016, 37(5): 708–713. DOI: 10.3760/cma.j.issn.0254-6450.2016.05.025 (in Chinese) |
| [4] |
游胜, 冯秀, 刘晓青, 等. 江西省首例人感染H9N2禽流感病例流行病学调查[J]. 现代预防医学, 2017, 44(5): 782–784.
YOU S, FENG X, LIU X Q, et al. Epidemiological investigation on the first case of human infection with H9N2 avian influenza in Jiangxi[J]. Modern Preventive Medicine, 2017, 44(5): 782–784. (in Chinese) |
| [5] |
王玥莲, 鲁丽莉, 冯琛, 等. 2016年四川省首例人感染禽流感H9N2危重症临床救治转运路径[J]. 世界最新医学信息文摘, 2016, 16(88): 152–153.
WANG Y L, LU L L, FENG C, et al. Discussion on clinical pathway of the first human avian influenza H9N2 critical disease in Sichuan province, 2016[J]. World Latest Medicine Information (Electronic Version), 2016, 16(88): 152–153. (in Chinese) |
| [6] | World Health Organization. Influenza at the human-animal interface Summary and assessment, 13 February to 9 April 2019[EB/OL]. (2019-04-09). https://www.who.int/influenza/human_animal_interface/Influenza_Summary_IRA_HA_interface_09_04_2019.pdf?ua=1. |
| [7] | WAN H Q, PEREZ D R. Amino acid 226 in the hemagglutinin of H9N2 influenza viruses determines cell tropism and replication in human airway epithelial cells[J]. J Virol, 2007, 81(10): 5181–5191. DOI: 10.1128/JVI.02827-06 |
| [8] |
张增峰, 樊晓晖, 陈晓燕, 等. 禽流感病毒H9N2在人肺组织的复制[J]. 病毒学报, 2013, 29(2): 206–210.
ZHANG Z F, FAN X H, CHEN X Y, et al. Avian influenza virus subtype H9N2 replicates in human lung tissues[J]. Chinese Journal of Virology, 2013, 29(2): 206–210. (in Chinese) |
| [9] | ZENG H, PAPPAS C, BELSER J A, et al. Human pulmonary microvascular endothelial cells support productive replication of highly pathogenic avian influenza viruses:possible involvement in the pathogenesis of human H5N1 virus infection[J]. J Virol, 2012, 86(2): 667–678. DOI: 10.1128/JVI.06348-11 |
| [10] | IMAI Y, KUBA K, NEELY G G, et al. Identification of oxidative stress and toll-like receptor 4 signaling as a key pathway of acute lung injury[J]. Cell, 2008, 133(2): 235–249. DOI: 10.1016/j.cell.2008.02.043 |
| [11] | XU T, WANG C L, ZHANG R H, et al. Carnosine markedly ameliorates H9N2 swine influenza virus-induced acute lung injury[J]. J Gen Virol, 2015, 96(10): 2939–2950. DOI: 10.1099/jgv.0.000238 |
| [12] | RU X C, YAO X Q. TRPM2:a multifunctional ion channel for oxidative stress sensing[J]. Acta Physiol Sin, 2014, 66(1): 7–15. |
| [13] | HECQUET C M, MALIK A B. Role of H2O2-activated TRPM2 calcium channel in oxidant-induced endothelial injury[J]. Thromb Haemost, 2009, 101(4): 619–625. DOI: 10.1160/TH08-10-0641 |
| [14] | HECQUET C M, AHMMED G U, VOGEL S M, et al. Role of TRPM2 channel in mediating H2O2-induced Ca2+ entry and endothelial hyperpermeability[J]. Circ Res, 2008, 102(3): 347–355. DOI: 10.1161/CIRCRESAHA.107.160176 |
| [15] | HANSFORD R G. Physiological role of mitochondrial Ca2+ transport[J]. J Bioenerg Biomembr, 1994, 26(5): 495–508. DOI: 10.1007/BF00762734 |
| [16] |
梁亭, 李珮瑶, 罗强, 等. 稳定抑制TRPM2基因表达肺微血管内皮细胞系的构建与鉴定[J]. 中国细胞生物学学报, 2019, 41(3): 439–445.
LIANG T, LI P Y, LUO Q, et al. Construction and verification of a mouse pulmonary microvascular endothelial cell lines to inhabit TRPM2 gene expression with shRNA lentivirus system[J]. Chinese Journal of Cell Biology, 2019, 41(3): 439–445. (in Chinese) |
| [17] | HE G M, DONG C G, LUAN Z H, et al. Oxygen free radical involvement in acute lung injury induced by H5N1 virus in mice[J]. Influenza Other Respir Viruses, 2013, 7(6): 945–953. DOI: 10.1111/irv.12067 |
| [18] | XU M J, LIU B J, WANG C L, et al. Epigallocatechin-3-gallate inhibits TLR4 signaling through the 67-kDa laminin receptor and effectively alleviates acute lung injury induced by H9N2 swine influenza virus[J]. Int Immunopharmacol, 2017, 52: 24–33. DOI: 10.1016/j.intimp.2017.08.023 |
| [19] | WANG Q W, SU Y, SHENG J T, et al. Anti-influenza A virus activity of rhein through regulating oxidative stress, TLR4, Akt, MAPK, and NF-κB signal pathways[J]. Plos One, 2018, 13(1): e0191793. DOI: 10.1371/journal.pone.0191793 |
| [20] | LU S L, XIANG L S, CLEMMER J S, et al. Oxidative stress increases pulmonary vascular permeability in diabetic rats through activation of transient receptor potential melastatin 2(TRPM2) channels[J]. Microcirculation, 2014, 21(8): 754–760. DOI: 10.1111/micc.12158 |
| [21] | AVERY S V. Molecular targets of oxidative stress[J]. Biochem J, 2011, 434(2): 201–210. DOI: 10.1042/BJ20101695 |
| [22] | KOWALTOWSKI A J, DE SOUZA-PINTO N C, CASTILHO R F, et al. Mitochondria and reactive oxygen species[J]. Free Radical Biol Med, 2009, 47(4): 333–343. DOI: 10.1016/j.freeradbiomed.2009.05.004 |
| [23] | ARMSTRONG J S, STEINAUER K K, HORNUNG B, et al. Role of glutathione depletion and reactive oxygen species generation in apoptotic signaling in a human B lymphoma cell line[J]. Cell Death Differ, 2002, 9(3): 252–263. DOI: 10.1038/sj.cdd.4400959 |
| [24] | GRAZZINI E, PUMA C, ROY M O, et al. Sensory neuron-specific receptor activation elicits central and peripheral nociceptive effects in rats[J]. Proc Natl Acad Sci U S A, 2004, 101(18): 7175–7180. DOI: 10.1073/pnas.0307185101 |
| [25] |
杨慧玲, 潘景轩, 吴伟康.
高级病理生理学[M]. 北京: 科学出版社, 1998: 10.
YANG H L, PAN J X, WU W K. Advanced pathophysiology[M]. Beijing: Science Press, 1998: 10. (in Chinese) |
| [26] | ÇAKIR M, TEKIN S, TAŞLIDERE A, et al. Protective effect of N-(p-amylcinnamoyl) anthranilic acid, phospholipase A2 enzyme inhibitor, and transient receptor potential melastatin-2 channel blocker against renal ischemia-reperfusion injury[J]. J Cell Biochem, 2019, 120(3): 3822–3832. DOI: 10.1002/jcb.27664 |
| [27] | LI F F, MUNSEY T S, SIVAPRASADARAO A. TRPM2-mediated rise in mitochondrial Zn2+ promotes palmitate-induced mitochondrial fission and pancreatic β-cell death in rodents[J]. Cell Death Differ, 2017, 24(12): 1999–2012. DOI: 10.1038/cdd.2017.118 |
| [28] | LI F F, ABUARAB N, SIVAPRASADARAO A. TRPM2:shredding the mitochondrial network[J]. Channels, 2017, 11(6): 507–509. DOI: 10.1080/19336950.2017.1376982 |



