梅花鹿位居动物药之首,而梅花鹿茸角作为一种名贵的中药材,以其重要的药用价值和保健功能在中医药领域发挥着不可替代的作用。茸角具有免疫调节、抗癌、抗疲劳、抗骨质疏松、抗炎、抗氧化、促进伤口愈合等功能[1],查阅对茸角进行研究的相关资料发现,现在对茸角药理作用的研究主要停留在了胶原蛋白、氨基酸、脂质、微量元素、激素、生长因子、多糖类、灰分及其他的化学组分,而且研究发现茸角组织从上到下(腊片、粉片、血片、骨片)蛋白质和脂质含量逐渐降低,灰分则逐渐升高,并且随着茸角的生长过程,蛋白质、脂质和灰分含量也发生着很大的变化[2]。由于对茸角中生物大分子的分析、分离与样品制备的限制,临床数据和分子机制仍然空缺,这就严重制约了茸角药理作用的研究与系列产品的开发[3]。
但茸角作为一种动物类中药,在人类疾病上的应用是否绝对安全尚无定论。有研究发现,水溶性茸角蛋白质经过口服、皮下、腹腔注射等给药途径,可导致小鼠组织器官一定的病理性损伤[4],但对于其原因仍不清楚,为了能够使茸角在安全的前提之下发挥其强大的药理作用,茸角蛋白质组分的研究也显得尤其重要。
本研究以不同生长时期梅花鹿茸角为试验材料,应用label-free蛋白质组学技术揭示鹿茸生长过程中蛋白质表达特征,为进一步探究与茸角药理活性相关蛋白质组分及茸角相关产品的开发提供数据支撑。
1 材料与方法 1.1 试验材料梅花鹿茸角6支,取自中国农业科学院特产研究所中心鹿场,生长期分别为10、20、40、60、130与360天。其中10天为茸角再生的初期;20天为眉支分生期;40天为二杠茸末期;60天为三杈茸末期;130天为茸角骨化期;360天为茸角脱落期。
1.2 试剂与仪器主要试剂:尿素、硫脲、CHAPS、DTT、两性电解质(Bio-Lyte pH3-10)、Clean-up Kit蛋白纯化试剂盒、TEMED、碘乙酰胺、甲醇、碳酸氢铵、胰蛋白酶、三氟乙酸、乙腈、甲酸。
主要仪器:Agilent Q-TOF-MS/MS G6530、Hielscher UP400S超声波处理器、Sigma离心机、ZIEGRA制冰机、MILLIPORE纯水仪、Speed-Vac system真空干燥器。
1.3 鹿茸角蛋白质提取新鲜茸角组织切成1 mm×1 mm小块,PBS洗去茸角组织表面的血液及杂质,液氮研磨机研磨成细粉。取2 g细粉加入10 mL蛋白质裂解液(7 mol·L-1尿素、2 mol·L-1硫脲、4% CHAPS、65 mmol·L-1 DTT、0.2% Bio-Lyte、1% PMSF),超声3 min,冰上裂解2 h,每隔30 min振荡器震荡1 min。20 000 r·min-1、4℃离心15 min,收集上清液,2D-clean up蛋白纯化试剂盒处理蛋白质原液。
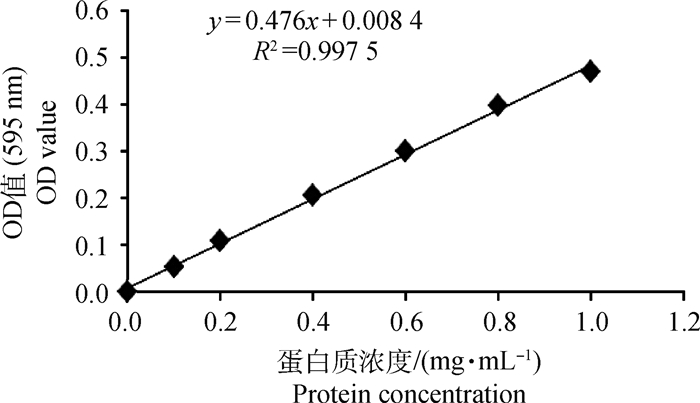
1.4 鹿茸角蛋白质含量测定采用Bradford法测定蛋白质含量。首先配制考马斯亮蓝G-250工作液:0.01 g G-250溶解到5 mL 95%乙醇中,溶解后加入10 mL 85%磷酸,去离子水定容到100 mL,4℃避光保存。用BSA(1 mg·mL-1)作为标准蛋白,测定595 nm处吸光度,绘制标准曲线(图 1)。将待测蛋白溶液用上样缓冲液(7 mol·L-1尿素、2 mol·L-1硫脲、4% CHAPS)稀释20倍,确保待测蛋白质溶液浓度在标准曲线内。取待测蛋白质溶液50 μL溶于1 mL考马斯亮蓝G-250工作液中,测定吸光度,根据标准曲线计算蛋白质溶液浓度。
|
图 1 蛋白质浓度标准曲线 Fig. 1 Standard curve of protein concentration |
蛋白质溶液中加入终浓度为10 mmol·L-1的DTT,37℃保温1 h,室温冷却后迅速加入终浓度为50 mmol·L-1的碘乙酰胺,避光37℃反应1 h。按1:50(酶:蛋白质)的比例在蛋白质溶液中加入胰蛋白酶,37℃反应14 h或过夜。最后加2% ACN与0.5%TFA终止酶解反应,真空干燥。
1.6 鹿茸角蛋白质酶解肽段分析蛋白质肽段的分离与质谱鉴定在Agilent QTOF G6530上进行,流动相A液为0.1%甲酸水溶液,B液为0.1%甲酸乙腈溶液。前1 min,B液线性梯度从3%到8%;79 min,B液线性梯度从8%到40%;30 min,B液线性梯度从40%到85%;最后2 min,B液维持在85%。质谱采用正离子模式,喷雾电压为1.85 kV,扫描范围:300~2000 m·z-1。
1.7 鹿茸角蛋白质鉴定利用Peaks(version 7.0)软件对所得质谱数据进行分析,先对质谱数据进行从头测序(de novo)计算,然后再进行数据库搜索。参数设置:固定修饰为Carbamidomethylation;可变修饰为Oxidation;酶切蛋白为胰蛋白酶;肽段末端不允许有非特异性断裂;母离子质量数最大容许误差范围为±20.0 ppm,碎片离子最大容许误差范围为0.5 Da;数据库为反刍动物蛋白质库;FDR值< 1%,并至少含有1个以上肽段的蛋白质为成功鉴定蛋白质。
1.8 不同时期鹿茸角差异蛋白质筛选及功能分析利用Peaks软件中非标签蛋白质定量功能(label free quantification)对6个生长时期茸角的差异蛋白质进行筛选。显著性差异用P值来衡量,P < 0.05,且差异在2倍以上才认定为显著差异蛋白质。蛋白质GO功能注释与KEGG通路富集分别使用Blast2GO [5]与KOBAS 3.0在线软件[6]。
2 结果 2.1 鹿茸角蛋白质含量测定梅花鹿茸角蛋白质含量丰富,即使是完全骨化的鹿角也含有一定比例的蛋白质成分。在梅花鹿茸角的6个不同生长时期中,生长60天的梅花鹿茸角蛋白质含量最高,为82.25 mg·g-1,其次是40天(74.00 mg·g-1)、20天(70.90 mg·g-1)、10天(65.35 mg·g-1),生长至130天时梅花鹿茸角骨化完全,蛋白质含量明显下降,为56.00 mg·g-1,蛋白质含量最低的是360天鹿角28.02 mg·g-1,仅为60天茸角蛋白质浓度的34%。
2.2 鹿茸角蛋白质鉴定6个不同生长时期的茸角组织共成功鉴定出了636种蛋白质,其中10天的茸角鉴定出328种蛋白质,分子量范围为8.63~514.73 ku;20天的茸角鉴定出430种蛋白质,分子量范围为8.32~848.80 ku;40天的茸角鉴定出328种蛋白质,分子量范围为8.22~909.61 ku;60天的茸角鉴定出338种蛋白质,分子量范围为8.22~514.73 ku;130天的茸角鉴定出154种蛋白质,分子量范围为7.78~579.02 ku;360天鹿角鉴定出142种蛋白质,分子量范围为8.63~521.31 ku。
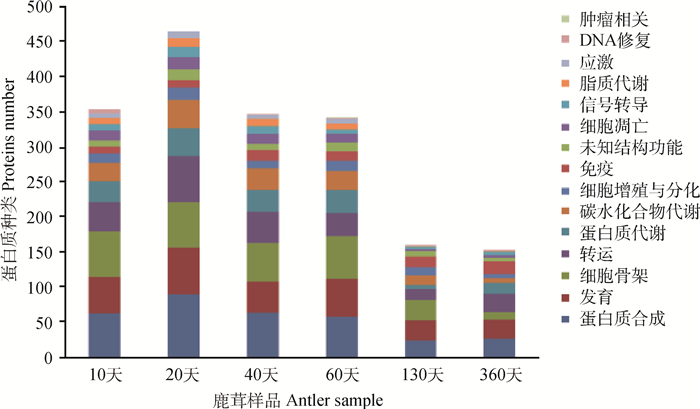
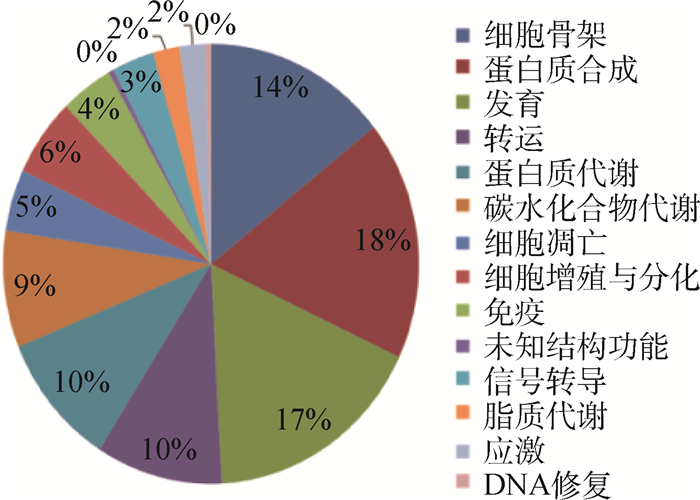
2.3 鹿茸角蛋白质生物信息学分析为进一步了解不同生长时期梅花鹿茸角蛋白质组分,利用Blast2GO软件对成功鉴定的636种蛋白质进行GO功能注释,按其参与的生物过程可主要分为14类,包括蛋白质合成130种、发育102种、细胞骨架97种、转运87种、蛋白质代谢64种、碳水化合物代谢47种、细胞增殖与分化34种、免疫31种、细胞凋亡21种、信号转导17种、脂质代谢17种、应激12种、DNA修复6种,未知结构24种。为了比较不同生长时期梅花鹿茸角蛋白质表达的差异,分别将各个时期表达的蛋白质进行GO功能注释(图 2)。结果显示,不同生长时期梅花鹿茸角蛋白质分类基本一致,其中20天茸角组织各类别的蛋白质种类均高于其他时期茸角蛋白质,但40天茸角免疫蛋白质种类高于20天茸角。
|
图 2 蛋白质的生物过程分类 Fig. 2 Classification of proteins based on their associated biological processes |
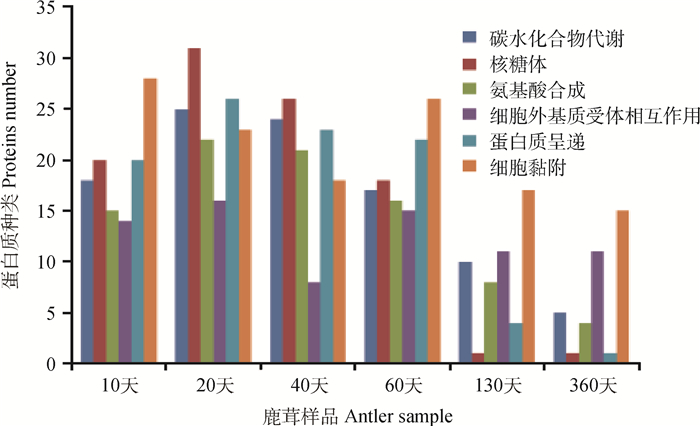
为了更进一步了解茸角蛋白质的功能,对6个时间点样品中所鉴定的蛋白质进行KEGG通路富集分析,富集到了碳水化合物代谢、核糖体、氨基酸合成、糖酵解、蛋白质加工通路等(图 3)。KEGG通路富集分析显示,茸角生长初期(10天)主要为细胞粘附通路,二杠茸生长阶段(20天、40天)主要为碳水化合物代谢、核糖体、氨基酸合成通路,三杈茸时期(60天)主要为细胞粘附通路,骨化期(130、360天)主要为细胞外基质受体相互作用和细胞黏附通路。
|
图 3 KEGG代谢通路富集分析 Fig. 3 KEGG pathways significantly enriched |
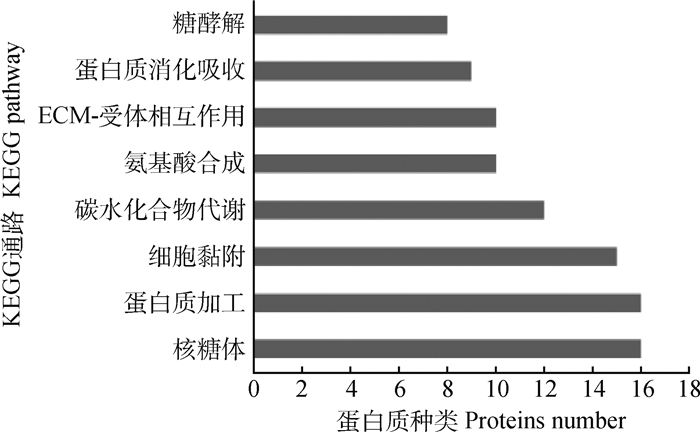
通过Peaks软件共筛选到了218种显著差异表达蛋白质,分子量范围为10.2 ~527.5 ku。主要包括蛋白质合成相关43种、发育蛋白41种、细胞骨架蛋白35种、转运蛋白24种、蛋白质代谢24种、碳水化合物代谢21种、细胞增殖与分化蛋白13种、免疫蛋白10种、细胞凋亡蛋白12种、信号转导8种、脂质代谢5种、应激5种、DNA修复1种、未知结构蛋白1种(图 4)。KEGG代谢通路主要富集到了蛋白质加工、碳水化合物代谢、氨基酸合成、细胞外基质受体相互作用通路、黏着斑及糖酵解通路等(图 5)。
|
图 4 差异蛋白质生物过程分类 Fig. 4 Classification of significant differentially exprssed proteins based on their associated biological processes |
|
图 5 KEGG代谢通路富集分析 Fig. 5 Enrichment analysis of KEGG pathways |
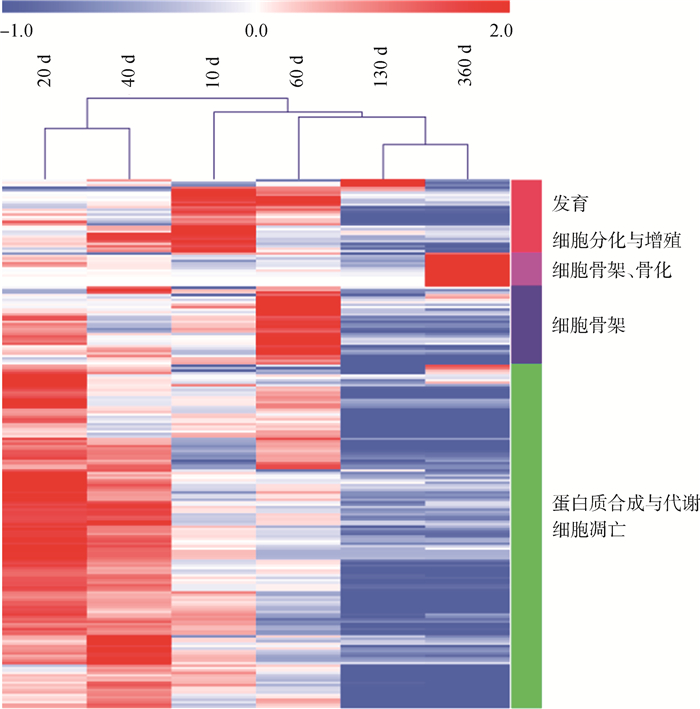
对已筛选的218种差异蛋白质进行聚类分析(图 6),在10天茸角组织中上调的蛋白质有27种,其中主要包括蛋白质合成相关蛋白8种、发育相关蛋白5种、细胞骨架蛋白5种、细胞增殖与分化蛋白3种等。在20天茸角组织中上调的蛋白质有141种,主要包括蛋白质合成相关蛋白21种、蛋白质代谢7种、发育相关蛋白20种、细胞骨架蛋白16种、转运蛋白9种、碳水化合物代谢蛋白5种等。在40天茸角组织中上调的蛋白质有41种,主要包括蛋白质合成相关蛋白7种、发育相关蛋白4种、碳水化合物代谢蛋白8种、细胞骨架蛋白5种、信号转导5种等。在60天茸角组织中上调的蛋白质有37种,蛋白质合成相关蛋白7种、发育相关蛋白5种、细胞凋亡相关蛋白3种、细胞骨架蛋白6种、转运蛋白5种等。在130天茸角组织中上调的蛋白质有3种,发育蛋白2种、蛋白质合成相关蛋白1种。在360天茸角组织中上调的蛋白质有16种,免疫相关蛋白6种、细胞骨架蛋白3种、转运蛋白5种等。
|
图 6 差异蛋白质表达量聚类 Fig. 6 Clustering for differential protein expression |
梅花鹿茸角中的有机物质绝大部分为蛋白质,即使在完全骨化的茸角组织中仍含有相当比例的蛋白质,蛋白质含量的高低可作为评价茸角价值的一个指标。本研究发现,在60天的茸角组织中蛋白质含量最高,且该时期茸角嫩度适中、产量较高,推测60天可能为茸角的最佳收茸期,张恒等[7]将塔里木马鹿的最佳收茸时间定在了生长速度最快的阶段,但梅花鹿的最佳收茸期的确定还需对其他有效成分做进一步检测分析。
3.1 鹿茸角10天高表达蛋白分析梅花鹿茸角在每年的4月份左右脱盘,茸角的脱盘过程标志着茸角周期性再生的开始。在茸角脱盘后,角柄末端会形成凹面,充满血液,并在几小时内迅速形成疤痕,阻止血液流动。直至10天左右,疤痕被上皮组织代替,伤口愈合,同时间充质细胞不断增殖分化为前成软骨细胞、成软骨细胞、软骨细胞、骨细胞,进而形成完整的茸角结构,也可称为芽基。10天梅花鹿茸角组织表达上调蛋白质主要参与了发育、细胞分化与增殖等过程,如ZEB1、desmoplakin、SH3BGRL、tropomyosin alpha-4、ribosome-binding protein 1等。ZEB1属于锌指蛋白类的转录抑制因子[8-9],可抑制钙粘着蛋白表达,诱导上皮细胞间质转型的发生,使细胞失去粘性,促进细胞转移。desmoplakin是桥粒的重要组成蛋白,在器官发育过程中发挥重要作用[10]。tropomyosin alpha-4与ribosome-binding protein 1能促进人类间充质干细胞的成骨分化过程[11]。在梅花鹿茸角生长至10天左右时,形成了完整的神经系统,nucleoside diphosphate kinase A、citron Rho-interacting kinase、serine/threonine-protein kinase DCLK等神经再生相关蛋白质在10天茸角组织中表达上调可能对促进茸角组织内部神经系统的发育起重要的调节作用[12-13]。
3.2 鹿茸角20、40天高表达蛋白分析随着茸角伤口愈合,生长速度也逐渐加快,20与40天的梅花鹿茸角组织的表达上调蛋白质主要参与了蛋白质合成与代谢等生物过程,其中包括了大量的核糖体蛋白质。核糖体蛋白质主要分布在蛋白质合成旺盛的区域,其数量和蛋白质合成的强度有关,并在生物体的生长中起着关键性作用。另外,有研究显示,一些核糖体蛋白质除了作为核糖体的一部分参与蛋白质合成外,还有着其它的重要功能,如RPL13A可作为转录抑制因子参与多种免疫相关蛋白质转录调控过程[14]。大部分蛋白质在合成之后,必须经过正确的折叠才能发挥其正常功能。Hsp70、Hsp90等高表达蛋白可协助蛋白质正确折叠,以满足茸角快速生长的需要[15]。茸角旺盛的代谢过程势必会产生较多的活性氧,如氧离子、过氧化氢、羟基自由基等,这些物质的大量积累会导致细胞结构、基因结构、生物大分子的破坏,严重时可导致细胞和组织的死亡[16],为了保证机体功能的正常运行,过氧化物酶的存在是必须的,如peroxiredoxin 2、peroxiredoxin 4。另外,在茸角的快速生长过程中也伴随着神经的生长,失去神经支配的茸角组织生长缓慢,且形成畸形茸。Tenascin-C与tenascin-N两种神经生长相关蛋白质在20天的茸角组织中表达上调,对茸角组织中神经系统的生长可能具有重要的作用[17-18]。多种细胞凋亡相关蛋白质在20与40天梅花鹿茸角组织中表达上调,如14-3-3s家族蛋白可抑制细胞凋亡,促进细胞分裂,影响细胞周期[19]。
3.3 鹿茸角60天高表达蛋白分析生长60天的茸角组织为三杈茸的末期,在三杈茸的生长过程中(40~60天),茸角的生长速度呈指数增长,在60天左右时达到了茸角生长速度的顶点。在此时期发现多种细胞骨架蛋白表达上调,F-actin-capping protein、fascin、ezrin与stathmin 1等,细胞骨架蛋白不仅能维持正常的细胞结构,在细胞运动、细胞分裂、信号转导过程中也发挥着重要作用。ezrin介导F-actin-capping protein、fascin与actin微丝结合连接,促进茸角组织细胞迁移[20]。stathmin 1被认为是细胞增殖的标志物,可调节微管系统的动态平衡,该蛋白质一旦功能紊乱会导致微管系统的持续性组装以及无法控制的细胞周期,最终可导致肿瘤的形成[21]。这几种蛋白的异常表达都将会导致细胞正常生物行为的改变,而且近些年越来越多的研究发现,这几种蛋白质在肿瘤组织中表达都明显上调,如乳腺癌、甲状腺肿瘤[22]、黑色素瘤、神经母细胞瘤[23]等。
3.4 鹿茸角骨化期(130、360天)高表达蛋白分析随着茸角组织的不断骨化,茸皮开始皱缩、枯死,血管堵塞、退化,有机物质的含量也显著下降,但仍还有一定比例的蛋白质。蛋白质定量结果显示,tropomyosin 1、tropomyosin 2、myosin regulatory light chain、myosin regulatory light polypeptide 9等蛋白质表达在骨化后的茸角组织中表达上调(130、360天),说明这几种骨架蛋白质可能是维持茸角细胞结构的基本组分。同时,osteomodulin也表现出上调,研究显示,osteomodulin可通过αVβ3整合蛋白与成骨细胞结合,介导骨矿化过程[24],该蛋白质表达的上调可能与茸角的快速骨化过程相关。而对于参与蛋白质合成的核糖体蛋白、转录起始因子、转录延伸因子等蛋白质表达水平显著下调,标志着茸角组织代谢下降,有效活性物质较少,药理作用下降。
4 结论本研究采用label-free蛋白质组学技术,比较全面的分析了不同生长时期梅花鹿茸角蛋白质组分。结果发现,不同生长阶段茸角的蛋白质表达有各自的特点,生长初期(10天),细胞增殖、分化相关蛋白表达上调;二杠茸生长阶段(20、40天),蛋白质合成、蛋白质代谢、氧化还原、能量代谢及神经发育等相关蛋白表达上调;三杈茸时期(60天)细胞骨架、骨化相关蛋白表达上调;骨化期(130、360天)茸角组织骨化完全,蛋白质合成、碳水化合物代谢、发育相关蛋白表达显著下调。该研究为进一步探究与茸角药理活性相关蛋白质组分以及茸角相关产品的开发提供数据支撑。
| [1] | SUI Z G, ZHANG L H, HUO Y S, et al. Bioactive components of velvet antlers and their pharmacological properties[J]. J Pharm Biomed Anal, 2014, 87: 229–240. DOI: 10.1016/j.jpba.2013.07.044 |
| [2] | TSENG S H, SUNG C H, CHEN L G, et al. Comparison of chemical compositions and osteoprotective effects of different sections of velvet antler[J]. J Ethnopharmacol, 2014, 151(1): 352–360. DOI: 10.1016/j.jep.2013.10.060 |
| [3] | HUO Y S, HUO H, ZHANG J. The contribution of deer velvet antler research to the modern biological medicine[J]. Chin J Integr Med, 2014, 20(10): 723–728. DOI: 10.1007/s11655-014-1827-1 |
| [4] |
赵大玮, 李丹, 陈智嘉, 等. 吉林省双阳梅花鹿鹿茸水溶性蛋白组分的提取及对小鼠主要脏器病理形态学的影响[J]. 吉林大学学报:医学版, 2011, 37(3): 448–451.
ZHAO D W, LI D, CHEN Z J, et al. Extraction of protein components from Jilin Shuangyang sika deer pilose antler and their effects on pathomorphology of major organs in mice[J]. Journal of Jilin University:Medicine Edition, 2011, 37(3): 448–451. (in Chinese) |
| [5] | CONESA A, GOTZ S. Blast2GO:A comprehensive suite for functional analysis in plant genomics[J]. Int J Plant Genomics, 2008, 2008: 619832. |
| [6] | XIE C, MAO X Z, HUANG J J, et al. .KOBAS 2.0:a web server for annotation and identification of enriched pathways and diseases[J]. Nucleic Acids Res, 2011, 39(Web Server issue): W316–W322. |
| [7] |
张恒, 矫继峰, 黄金彪, 等. 塔里木马鹿最佳收茸期探究[J]. 畜牧与兽医, 2014, 46(12): 52–55.
ZHANG H, JIAO J F, HUANG J B, et al. Study on the best harvest period of tarim red deer[J]. Animal Husbandry & Veterinary Medicine, 2014, 46(12): 52–55. (in Chinese) |
| [8] | HAIDER M, ZHANG X T, COLEMAN I, et al. Epithelial mesenchymal-like transition occurs in a subset of cells in castration resistant prostate cancer bone metastases[J]. Clin Exp Metastas, 2016, 33(3): 239–248. DOI: 10.1007/s10585-015-9773-7 |
| [9] | TAN Y F, TANG L, OUYANG W X, et al. β-catenin-coordinated lncRNA MALAT1 up-regulation of ZEB-1 could enhance the telomerase activity in HGF-mediated differentiation of bone marrow mesenchymal stem cells into hepatocytes[J]. Pathol Res Pract, 2019, 215(3): 546–554. DOI: 10.1016/j.prp.2019.01.002 |
| [10] |
肖春, 刘虓, 胡火珍. desmoplakin基因在斑马鱼早期胚胎表达的研究[J]. 四川动物, 2010, 29(6): 965–967.
XIAO C, LIU X, HU H Z. Spatiotemporal expression pattern research of desmoplakin in the early embryos of zebrafish[J]. Sichuan Journal of Zoology, 2010, 29(6): 965–967. (in Chinese) |
| [11] | FOSTER L J, ZEEMANN P A, LI C, et al. Differential expression profiling of membrane proteins by quantitative proteomics in a human mesenchymal stem cell line undergoing osteoblast differentiation[J]. Stem Cells, 2005, 23(9): 1367–1377. DOI: 10.1634/stemcells.2004-0372 |
| [12] | OIKE Y, YASUNAGA K, SUDA T. Angiopoietin-related/angiopoietin-like proteins regulate angiogenesis[J]. Int J Hematol, 2004, 80(1): 21–28. DOI: 10.1532/IJH97.04034 |
| [13] | SAXENA A, CHUA T C, CHU F C, et al. Improved outcomes after aggressive surgical resection of hilar cholangiocarcinoma:a critical analysis of recurrence and survival[J]. Am J Surg, 2011, 202(3): 310–320. DOI: 10.1016/j.amjsurg.2010.08.041 |
| [14] | LEE J, HARRIS A N, HOLLEY C L, et al. Rpl13a small nucleolar RNAs regulate systemic glucose metabolism[J]. J Clin Invest, 2016, 126(12): 4616–4625. DOI: 10.1172/JCI88069 |
| [15] | LI C Y, HARPER A, PUDDICK J, et al. Proteomes and signalling pathways of antler stem cells[J]. PLoS One, 2012, 7(1): e30026. DOI: 10.1371/journal.pone.0030026 |
| [16] | GIUSTARINI D, DALLE-DONNE I, TSIKAS D, et al. Oxidative stress and human diseases:origin, link, measurement, mechanisms, and biomarkers[J]. Crit Rev Clin Lab Sci, 2009, 46(5-6): 241–281. DOI: 10.3109/10408360903142326 |
| [17] | SEVER M, GUNAY G, GULER M O, et al. Tenascin-C derived signaling induces neuronal differentiation in a three-dimensional peptide nanofiber gel[J]. Biomater Sci, 2018, 6(7): 1859–1868. DOI: 10.1039/C7BM00850C |
| [18] | NAKAMURA A, MORISE J, YABUNO-NAKAGAWA K, et al. Site-specific HNK-1 epitope on alternatively spliced fibronectin type-Ⅲ repeats in tenascin-C promotes neurite outgrowth of hippocampal neurons through contactin-1[J]. PLoS One, 2019, 14(1): e0210193. DOI: 10.1371/journal.pone.0210193 |
| [19] | AGARWAL P, DEINNOCENTES P, BIRD R C. Evaluation of 14-3-3 sigma as a potential partner of p16 in quiescence and differentiation[J]. In Vitro Cell Dev Biol-An, 2018, 54(9): 658–665. DOI: 10.1007/s11626-018-0291-1 |
| [20] | VEGA I E, UMSTEAD A, WYGANT C M, et al. Ezrin expression is increased during disease progression in a Tauopathy mouse model and Alzheimer's disease[J]. Curr Alzheimer Res, 2018, 15(12): 1086–1095. DOI: 10.2174/1567205015666180813152043 |
| [21] | LIU T, LIU L M, LIU M N, et al. MicroRNA-493 targets STMN-1 and promotes hypoxia-induced epithelial cell cycle arrest in G2/M and renal fibrosis[J]. FASEB J, 2019, 33(2): 1565–1577. DOI: 10.1096/fj.201701355RR |
| [22] | CHEN G, ZHANG F R, REN J, et al. Expression of fascin in thyroid neoplasms:a novel diagnostic marker[J]. J Cancer Res Clin Oncol, 2008, 134(9): 947–951. DOI: 10.1007/s00432-008-0374-6 |
| [23] | YU F, ZHU X D, FENG C, et al. Proteomics-based identification of spontaneous regression-associated proteins in neuroblastoma[J]. J Pediatr Surg, 2011, 46(10): 1948–1955. DOI: 10.1016/j.jpedsurg.2011.06.024 |
| [24] | CHIQUET-EHRISMANN R, OREND G, CHIQUET M, et al. Tenascins in stem cell niches[J]. Matrix Biol, 2014, 37: 112–123. DOI: 10.1016/j.matbio.2014.01.007 |



