2. 青藏高原动物遗传资源保护与利用教育部/四川省重点实验室, 成都 610041
2. Key Laboratory of Qinghai-Tibetan Plateau Animal Genetic Resource Reservation and Utilization of Ministry of Education/Sichuan Province, Chengdu 610041, China
皮下脂肪组织(subcutaneous adipose tissue,SAT)、肌内脂肪(intramuscular fat,IMF)和内脏脂肪组织(visceral adipose tissue,VAT)同属于白色脂肪组织(white adipose tissue,WAT),与糖尿病、肥胖、心血管疾病和代谢综合征等密切相关[1-2]。研究表明,SAT中含有较高的饱和脂肪酸(saturated fatty acid,SFA),人体摄入过多的SFA可能会导致动脉硬化和冠心病等疾病的发生[3]。脂肪生成是前体脂肪细胞向成熟脂肪细胞的分化过程,脂肪酸作为必需营养素的主要来源积聚在脂肪组织,并且可以作为信号传导分子调节脂肪细胞分化[4]。因此,从脂肪细胞分化入手探讨皮下脂肪沉积的机制对畜禽和人类健康、肉质利用和育种目标等具有重要的意义。
成纤维细胞生长因子10(fibroblast growth factor 10,FGF10)是成纤维细胞生长因子家族(fibroblast growth factors,FGFs)的成员之一[5],在器官发育、成熟[6]以及细胞分化[7-8]等多种生物过程中发挥重要的调控作用。Sakaue等[9]发现,在3T3-L1脂肪细胞中添加FGF10抗体,会影响分化过程中CCTTA增强子结合蛋α(CCTTA-enhancer binding protein α,C/EBPα)、过氧化物酶体增殖物激活受体(peroxisome proliferator activated receptor γ,PPARγ)、降脂素(nafenopin)和脂肪酸结合蛋白4(fatty acid binding protein 4,aP2或FABP4)的分泌。Zhang等[10]指出,FGF10可以促进脂肪干细胞(adipose-derived stem cell,ADSC)分化,并通过载体移植使细胞不断分泌FGF10以增加皮下脂肪组织含量。进一步研究表明,FGF10除了通过自分泌或旁分泌的方式促进脂肪细胞的分化外[10],在fgf10-/-小鼠胚胎WAT中还通过Ras/MAPK通路促进脂肪细胞增殖和分化[11]。Ohta和Itoh[12]利用基因敲除技术研究发现,fgf10-/-小鼠白色脂肪组织的增殖和分化活动与野生型小鼠相比明显减弱。作者前期研究发现,FGF10可通过调控C/EBPα和脂蛋白脂酶(lipoprotein lipase,LPL)的表达促进山羊肌内前体脂肪细胞分化[13]。研究表明,动物肌内脂肪组织和皮下脂肪组织的沉积机制不同[14],在这两种细胞分化过程中存在大量差异表达基因[15-16]。那么,FGF10是否也促进山羊皮下脂肪细胞分化,并且其作用机制是否与在肌内脂肪细胞中一致?
因此,本研究在构建山羊FGF10过表达腺病毒载体的基础上,用重组腺病毒感染山羊皮下前体脂肪细胞并诱导其分化,利用形态学方法检测其对脂滴聚集的影响,利用qPCR技术检测分化标志基因、脂代谢相关基因、FGFRs和KLF家族(Kruppel like factors,KLFs)的表达变化,明确FGF10在山羊前体脂肪细胞分化中的表达模式,探究其对分化的影响及可能的作用机制,并与本实验室前期获得的关于其在不同部位脂肪细胞(肌内脂肪细胞)分化的数据进行比较分析,进而为阐明FGF10调控山羊脂肪沉积的分子机制提供重要的基础。
1 材料与方法 1.1 试验材料 1.1.1 样品采集试验动物来自于四川省简阳大哥大牧业有限公司的7日龄简州大耳山羊。
1.1.2 主要试剂TRIzol试剂和SYBR® Premix Ex Taq TM (2×)购自TaKaRa(大连)公司;感受态细胞DH5α、质粒小提试剂盒(离心柱型)和pGM-T连接试剂盒均购自TIANGEN公司;限制性内切酶Bgl Ⅱ、Hind Ⅲ、反转录试剂盒购自Thermo公司;胎牛血清购自Gemini公司;Ⅰ型胶原酶和油酸购自Sigma公司;DMEM/F12、PBS、Opti-MEM、胰蛋白酶和双抗购自Hyclone公司;转染试剂(Lipofectamine® RNAIMAX Reagent)购自Invitrogen公司;HEK 293A细胞系和穿梭质粒pAdTrack-CMV分别由四川大学生物治疗国家重点实验室和西北农林科技大学陕西省农业分子生物学重点实验室赠予。
1.2 试验方法 1.2.1 山羊FGF10基因腺病毒过表达载体的构建根据NCBI上山羊FGF10基因(KT899958)的mRNA序列,利用SnapGene软件设计亚克隆引物,FGF10-S:AGATCTGCCACCATGGATTACAAG-GATGACGACGATAAGTGGAAATGGATTCTG-ACACATTGT(AGATCTG为Bgl Ⅱ的酶切位点,CCACC为Kozak,ATG为起始密码子,GATTA-CAAGGATGACGACGATAAG为flag),FGF10-A:A-AGCTTTTAGTGGTGGTGGTGGTGGTGTGAG-TGTACCACCATTGGAAGAAA(AAGCTT为Hind Ⅲ的酶切位点,TTA为终止密码子,GTGGTGGTGGTGGTGGTGTG为his)。利用实验室保存的山羊FGF10菌液为模板[17],以亚克隆引物扩增,将目的基因片段连接到pGM-T载体后测序。质粒提取纯化后通过Bgl Ⅱ和Hind Ⅲ双酶切,胶回收酶切产物并将其连接到pAdTrack/CMV上,构建重组穿梭质粒pAdTrack/CMV-FGF10。将穿梭质粒利用Pme Ⅰ酶切线性化,之后转化到感受态细胞BJ5183中进行同源重组,构建重组腺病毒质粒pAD-FGF10,用Pac Ⅰ酶切线鉴定,提取鉴定正确的质粒转化DH5α感受态细胞进行扩繁,最后转染HEK 293A细胞进行病毒包装,完成病毒的扩繁。
1.2.2 山羊原代皮下脂肪细胞的分离培养、传代及诱导分化根据实验室前期建立的山羊脂肪细胞培养方法进行皮下前体脂肪细胞原代培养[18]。试验动物饥饿24 h后,使用新吉尔灭及75%酒精清洗体表。颈动脉放血后,在无菌细胞间分离腹部皮下脂肪组织,PBS清洗2~3次,修剪后加入Ⅱ型胶原酶消化,37℃消化1.5 h,期间不断轻轻震荡。以等体积的完全培养基终止消化,经400目滤网过滤后离心(2 000 r·min-1 5 min)。弃上清后加入红细胞裂解液裂解5 min,随后离心去除上清液,加入适量完全培养基使细胞沉淀悬浮,并接种于25 cm2培养瓶中,即获得原代皮下脂肪细胞。当细胞融合度大约为80%时开始传代,利用胰蛋白酶消化使细胞脱落,1 000 r·min-1离心5 min,弃去上清,加入适量完全培养基并重悬浮,接种于25 cm2培养瓶,每2 d换一次液。细胞传至F3代且融合度达80%时,使用50 μmol·L-1油酸诱导液进行诱导分化,每2 d换一次液,分别在分化第0、1、3、5和7天收集细胞用于FGF10及FGFRs时序表达的检测。
1.2.3 细胞感染重组腺病毒向融合度达80%的F3代山羊皮下前体脂肪细胞加入适量重组腺病毒,阴性对照组(Negative Control)以Ad-GFP感染细胞,试验组(OEFGF10)以pAdEasy-FGF10感染细胞,24 h后更换为终浓度50 μmol·L-1油酸的完全培养基,诱导分化2 d后收集细胞。
1.2.4 油红O染色利用油红O染色法观察FGF10被过表达后山羊皮下前体脂肪细胞分化过程中脂滴积聚的变化。用于染色的皮下脂肪细胞接种于24孔板,过表达FGF10基因2 d后弃去培养基,用PBS缓慢清洗3次,10%甲醛固定30 min,弃去甲醛,PBS清洗3次后加入适量油红O工作液,染色20 min,弃去油红O工作液后用PBS清洗多次,显微镜下观察并拍照。
1.2.5 细胞总RNA提取及实时荧光定量PCR用TRIzol法提取所收集细胞的总RNA,利用紫外分光光度计检测样品总RNA浓度及OD260 nm/OD280 nm,取1 μg总RNA按照反转录试剂盒说明书反转录cDNA,置于-20℃备用。将cDNA原液稀释5倍用于qPCR检测转染效率以及分化相关基因、FGFRs以及KLFs的表达水平。利用Primer 5.0软件设计定量引物,见表 1。qPCR反应体系:5倍cDNA稀释液1 μL,10 μmol·L-1上下游引物各1 μL,荧光染料(SYBR® Premix Ex Taq TM(2×))10 μL,补充ddH2O至20 μL。
|
|
表 1 qPCR引物信息 Table 1 Primer information for qPCR |
结果以“平均值±标准差”表示,以UXT为内参基因矫正目的基因的表达[19],采用2-△△Ct法对qPCR数据进行分析。显著性检验由SPSS 18.0软件中One-way ANOVA分析(P < 0.05时, 认为差异显著,P < 0.01时, 认为差异极显著)。
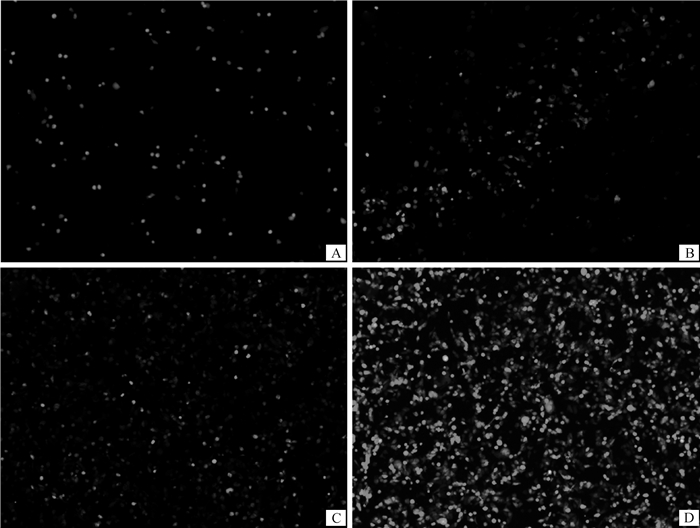
2 结果 2.1 成功构建腺病毒过表达载体pAD-FGF10使用Bgl Ⅱ和Hind Ⅲ限制性内切酶对pAdTrack-CMV-FGF10质粒进行双酶切,琼脂糖凝胶电泳分别得到长度约为9.2 kb的pAdTrack载体片段和750 bp的目的基因片段(图 1),测序结果显示,插入序列与预期目的基因序列完全一致,证明穿梭载体pAdTrack-CMV-FGF10构建成功。提取pAD-FGF10质粒经Pac Ⅰ酶切鉴定,结果显示, 在4.5 kb处出现目的条带(图 2),表明腺病毒重组成功。pAD-FGF10重组腺病毒载体经Pac Ⅰ酶切线性化后转染293A细胞。转染72 h后荧光倒置显微镜观察到少量绿色荧光蛋白(green fluorescent protein,GFP)的表达(图 3A),转染7 d后GFP的表达增多并出现彗星状荧光聚集(图 3B),转染8 d后GFP的表达铺满整个视野(图 3C),待细胞大部分病变并从底部脱落进行收毒,通过重复“侵染-冻融-扩增”最终得到高滴度病毒(图 3D)。

|
1. DNA Marker; 2. pAdTrack-CMV-FGF10 图 1 pAdTrack-CMV-FGF10双酶切鉴定 Fig. 1 Digestion identification of pAdTrack-CMV-FGF10 |

|
1.DNA Marker; 2. pAdEasy-FGF10 图 2 pAdEasy-FGF10的Pac Ⅰ酶切鉴定 Fig. 2 Digestion identification of Pac Ⅰ for pAdEasy-FGF10 |
|
A.转染72 h;B.转染7 d;C.转染8 d;D.反复感染后细胞荧光表达情况 A. 72 h after being transfected; B. 7 d after being transfected; C. 8 d after being transfected; D. GFP expression after repeated infection 图 3 pAdEasy-FGF10转染293A细胞后GFP表达情况(200×) Fig. 3 GFP expression after 293A cell transfected by pAdEasy-FGF10(200×) |
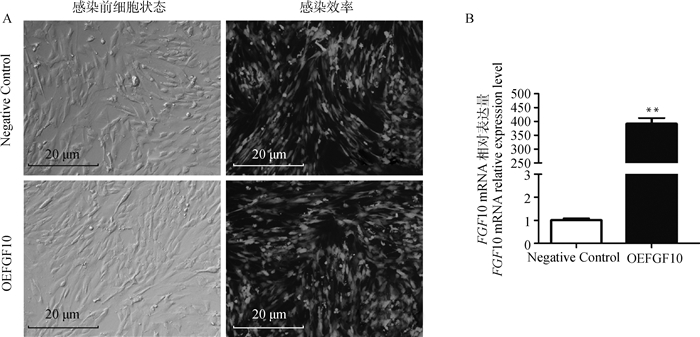
感染前细胞形态正常呈椭圆或梭形(图 4A),感染48 h后显微镜观察GFP的表达情况,Negative Control组和OEFGF10组的绿色荧光铺满整个视野,感染效率相似(图 4A)。
|
A. pAdEasy-FGF10在山羊皮下前体脂肪细胞中的感染效率;B. FGF10基因过表达效率。**. P < 0.01;*. P < 0.05;UXT作为内参基因;下同 A. The infection efficiency of pAdEasy-FGF10 in goats subcutaneous preadipocytes; B. The overexpression efficiency of FGF10 gene. **. P < 0.01; *. P < 0.05; UXT as reference gene; The same as below 图 4 在山羊皮下前体脂肪细胞中过表达FGF10的效率 Fig. 4 The overexpression efficiency of FGF10 in goats subcutaneous preadipocytes |
收集用山羊FGF10腺病毒感染前体脂肪细胞并诱导分化48 h后的细胞,利用qPCR检测FGF10过表达效率,结果显示,与Negative Control组相比OEFGF10组的FGF10基因表达水平上升387.19倍(P < 0.01,图 4B)。
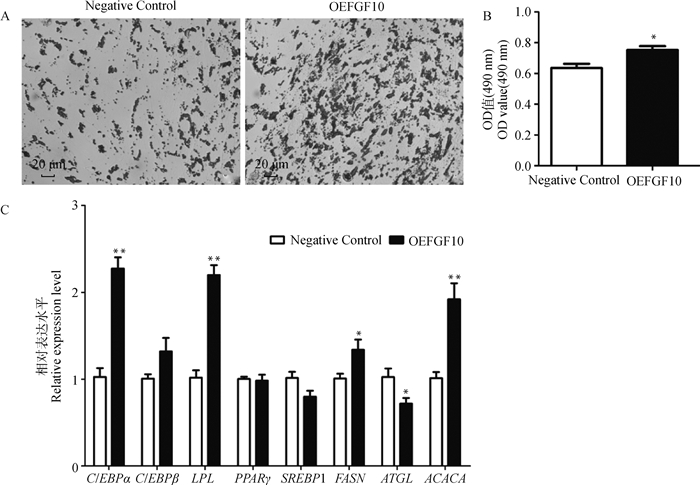
2.3 过表达FGF10对山羊皮下前体脂肪细胞分化的影响 2.3.1 过表达FGF10后山羊皮下前体脂肪细胞的形态学观察结果油红O染色结果显示,OEFGF10组脂滴积聚增加(图 5A),利用异丙醇提取并检测,发现OEFGF10组OD490 nm值显著高于Negative Control组(图 5B, P < 0.05)。
|
A.油红O染色分析;B.油红O染色提取法检测OD490 nm值;C.过表达FGF10对脂肪细胞分化标志基因及脂代谢基因表达的影响 A. Oil red O staining analysis; B. The OD490 nm value was detected by Oil red O staining; C. The effect of FGF10 overexpression on expression of adipocytes differentiation marker genes and lipid metabolism genes 图 5 过表达FGF10对山羊皮下脂肪细胞分化的影响 Fig. 5 The effect of FGF10 overexpression on differentiation of subcutaneous adipocyte in goats |
为进一步探究FGF10调控山羊前体皮下脂肪细胞分化的作用机制,利用qPCR技术检测脂肪细胞分化标志基因C/EBPα、CCTTA增强子结合蛋β(CCTTA-enhancer binding protein β,C/EBPβ)、PPARγ和脂代谢相关基因LPL、固醇调节元件结合蛋白1(sterol regulatory element binding protein 1,SREBP1)、脂肪酸合成酶(fatty acid synthase,FASN)、乙酰辅酶A羧化酶A(acetyl-CoA carboxylases alpha, ACACA)和脂肪甘油三酯脂肪酶(adipose triglyceride lipase,ATGL)的相对表达水平。结果显示(图 5C),过表达FGF10基因后,C/EBPα、ACACA和LPL基因的相对表达水平极显著升高(P < 0.01),分别上调2.22、1.90和2.16倍,FASN的相对表达水平显著升高(P < 0.05),ATGL的表达量显著降低(P < 0.05),而C/EBPβ、PPARγ和SREBP1的相对表达水平变化不显著(P>0.05)。
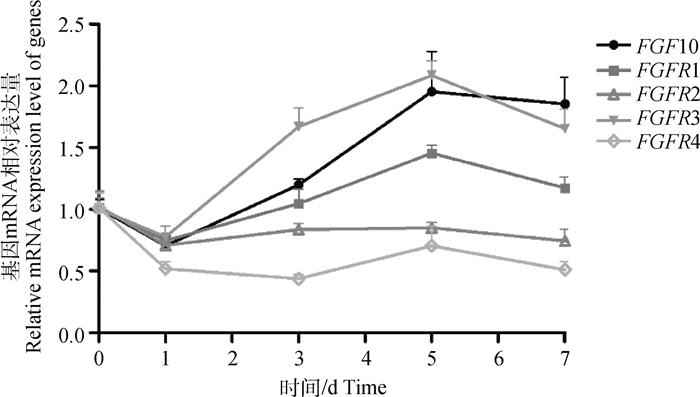
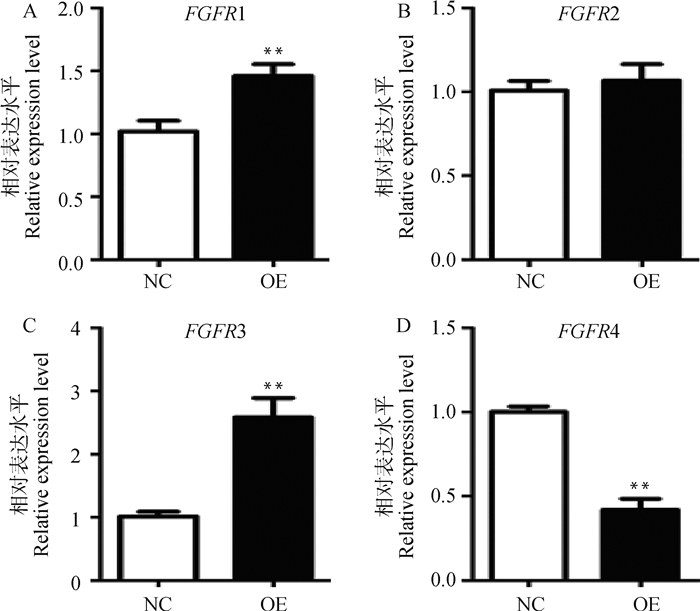
2.4 过表达FGF10对山羊皮下前体脂肪细胞成脂分化影响的可能作用机制 2.4.1 过表达FGF10对FGFRs表达水平的影响为探讨FGF10对山羊皮下前体脂肪细胞分化作用可能与哪些受体有关,本研究首先检测了FGF10与受体(FGFR1、FGFR2、FGFR3、FGFR4)在山羊前体脂肪细胞分化过程中的表达趋势。结果可见(图 6),在山羊脂肪细胞分化的0-7 d,FGF10与FGFR1和FGFR3表达趋势相似,相关系数分别为0.752(P < 0.01)和0.806(P < 0.01,表 2),推测其可能通过这两个受体发挥作用。为进一步探讨其可能性,本试验利用qPCR技术检测过表达FGF10后4个受体的表达水平变化。结果显示(图 7),FGFR1和FGFR3的相对表达水平分别上调1.43和2.55倍(P < 0.01),而FGFR4的相对表达水平下调58.11%(P < 0.01),FGFR2的相对表达水平与Negative Control组相比差异不显著(P>0.05)。根据以上结果推测FGF10可能通过FGFR1和FGFR3受体发挥作用。
|
图 6 FGF10及FGFRs基因在山羊皮下前体脂肪细胞分化过程中的相对表达 Fig. 6 The relative expression levels of FGF10 and FGFRs genes during differentiation of subcutaneous preadipocyte in goats |
|
|
表 2 FGF10与FGFRs在山羊皮下前体脂肪细胞分化过程中的表达相关性分析 Table 2 Correlation analysis of expression of FGF10 and FGFRs during differentiation of subcutaneous preadipocyte in goats |
|
NC. Negative control; OE. OEFGF10 图 7 过表达FGF10对山羊皮下前体脂肪细胞FGFRs表达的影响 Fig. 7 The effect of FGF10 overexpression on expression of FGFRs in subcutaneous preadipocytes in goats |
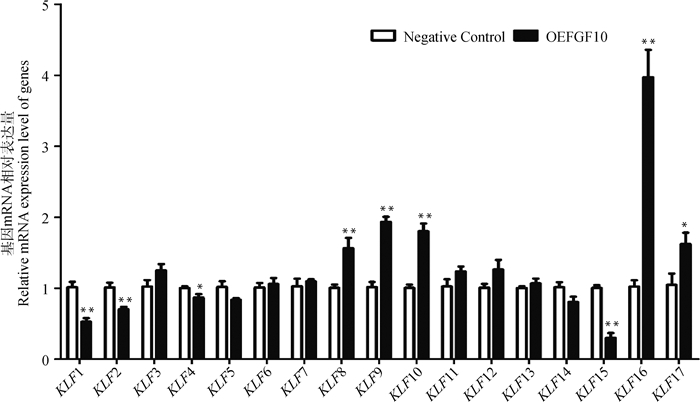
在山羊皮下前体脂肪细胞中过表达FGF10后,KLFs多数成员的mRNA表达水平发生了显著变化,其中5个成员表达水平显著上调,4个成员表达水平显著下调。即利用腺病毒超表达载体介导FGF10基因过表达后,KLF1、KLF2、KLF4和KLF15的相对表达水平分别下调了48.52%(P < 0.01)、30.76%(P < 0.01)、13.37%(P < 0.05)和70.33%(P < 0.01),而KLF8、KLF9、KLF10、KLF16和KLF17分别上调1.55(P < 0.01)、1.90(P < 0.01)、1.79(P < 0.01)、3.89(P < 0.01)和1.55(P < 0.05)倍,其他KLFs成员的相对表达水平变化不显著(P>0.05,图 8)。
|
图 8 过表达FGF10对KLFs表达的影响 Fig. 8 The effect of FGF10 overexpression on expression of KLFs |
WAT以脂质形式储存能量,在能量稳态中起关键作用。同时WAT还是一个动态的器官,通过产生脂肪细胞分泌的蛋白质和脂肪因子,并以自分泌/旁分泌或内分泌方式发挥着重要的代谢功能[20-21]。成纤维细胞生长因子(FGF)是在发育、代谢和神经功能中具有不同功能的信号蛋白。作为家族成员之一,FGF10在脂肪形成中发挥着重要作用[22],且本实验室前期的转录组测序结果发现,FGF10是山羊皮下脂肪细胞分化前后的主要差异表达基因之一,因此本研究利用腺病毒介导的FGF10基因处理前体脂肪细胞,以期解释其对山羊皮下前体脂肪细胞分化的调控作用。
本研究发现,山羊皮下前体脂肪细胞分化过程中FGF10基因的表达水平呈先下降后上升的趋势,这与该基因在鸡前体脂肪细胞分化过程中的表达模式相似[23],但Sakaue等[9]发现,3T3-L1细胞诱导分化过程中FGF10基因的表达在2 d达到最高水平,并在6 d恢复到基础值。与本实验室前期研究结果比较[13],FGF10基因在山羊肌内和皮下前体脂肪细胞分化过程中的表达趋势相似,均为分化后表达水平相对更高,但其表达峰值出现的时间不同,在分化2 d的肌内脂肪细胞中表达水平最高,在分化5 d的皮下脂肪细胞中表达水平最高,推测产生这种表达差异可能与不同部位的脂肪细胞有关。
为研究FGF10基因在山羊皮下脂肪细胞中的作用,本试验成功构建了FGF10过表达载体(pAdEasy-FGF10)。在体外培养的皮下前体脂肪细胞中过表达FGF10基因,发现其过表达显著促进脂滴积聚。与本研究结果一致的是,FGF10基因促进脂肪干细胞分化为成熟的脂肪细胞[9],并在小鼠胚胎敲除FGF10后抑制WAT增殖和分化活动[8]。为进一步揭示FGF10基因促进山羊皮下前体脂肪细胞分化的分子调控机制,本研究首先利用qPCR技术检测分化标志基因在过表达FGF10基因前后的表达变化,发现过表达FGF10促进C/EBPα和LPL的表达,与在肌内脂肪细胞分化中的相似[13]。其中,C/EBPα是脂肪细胞分化的正调控因子,促进脂肪细胞进入终末分化[24],LPL是甘油三酯水解的限速酶,在脂肪细胞分化过程中表达水平逐渐升高,促进脂肪细胞分化以及机体脂肪贮存[25-26]。Asaki等[22]发现,FGF10和C/EBPα的表达滞后于C/EBPβ和PPARγ,并且在脂肪生成过程中FGF10和C/EBPα发挥协同作用。因此,FGF10基因可能通过上调C/EBPα和LPL的表达促进山羊皮下前体脂肪细胞分化表达。此外,FGF10还促进FASN和ACACA的表达,同时抑制ATGL的表达。ATGL是一种催化脂肪水解起始步骤的限速酶[27],而FASN和ACACA均为脂肪酸合成的关键酶[28-29]。推测过表达FGF10后脂质积聚增多是由于脂肪酸合成增强,同时抑制脂肪水解所造成。
由于FGFs与FGFRs结合以介导FGFs发挥作用,因此,本研究在山羊皮下脂肪细胞过表达FGF10后检测FGFR1、FGFR2、FGFR3和FGFR4的表达变化。qPCR结果显示,过表达FGF10后FGFR1和FGFR3相对表达水平升高,同时三者在皮下脂肪细胞的时序表达趋势相似,推测FGF10可能通过与FGFR1或FGFR3结合进而发挥其生物学功能。FGFR1介导脂肪细胞-肝细胞通讯网络并抑制肝的脂肪生成和脂肪细胞的脂解作用[30],然而Kähkönen等[31]指出,干扰FGFR1的表达可抑制脂肪细胞分化。FGFR3是骨生长的重要调节因子[32],同时也是肉仔鸡腹部脂肪组织早期发育过程中的潜在调节基因[33],并通过FGFR3/MAPK轴促进成脂分化[34]。上述研究表明,FGFR1和FGFR3均与脂肪细胞分化有关,但FGF10是如何与FGFR1或FGFR3结合来促进脂肪细胞分化还需利用CO-IP等试验进一步验证。
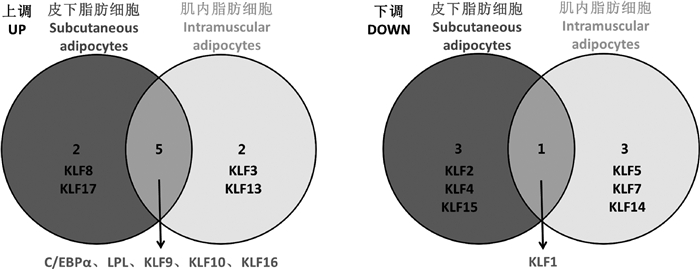
KLFs是与脂肪细胞生长发育密切相关的转录因子家族,自2005年KLF15被发现在3T3-L1前体脂肪细胞分化中具有重要的调控作用后[35],该家族的其他成员在脂肪中的研究也受到了广泛重视。近年来研究发现,在脂肪细胞分化过程中KLFs与FGFs之间存在关联。例如,FGF2通过调控KLF14的表达促进脂质生成[36],干扰和过表达FGF21基因可以调节KLF3、KLF7、KLF9、KLF11、KLF14和KLF16的表达,进而抑制山羊肌内前体脂肪细胞分化(数据未发表),但在山羊皮下脂肪细胞分化过程中FGF10与KLFs之间是否存在联系尚未见报道。因此为了进一步阐明FGF10促进山羊皮下前体脂肪细胞分化的分子机制,本研究检测了过表达FGF10后KLFs家族17个成员的变化,结果发现,过表达FGF10基因上调KLFs中KLF8、KLF9和KLF10等正调控因子的表达,下调KLF2和KLF4等负调控因子的表达,而KLF15作为促进脂肪细胞分化的转录因子[37]在过表达FGF10后其表达受到抑制,抑制分化的KLF16基因[38]表达上调,此外KLF1和KLF17在脂肪细胞分化中的作用尚不清楚。基于KLFs成员之间存在相互调控的关系[39-40],例如KLF4与KLF2、KLF5~7通过协同或拮抗作用抑制山羊肌内脂肪细胞的分化(数据未发表),推测KLF15和KLF16表达水平的变化可能是由二级调节所引起。与FGF10基因在肌内前体脂肪细胞分化过程的调控机制相比[13],该基因在皮下和肌内脂肪细胞中共同调控C/EBPα、LPL、KLF1、KLF9、KLF10、KLF16的表达,不同的是在皮下脂肪细胞中FGF10还调控KLF2、KLF4、KLF8、KLF15和KLF17基因的表达,而在肌内脂肪细胞中调控KLF3、KLF5、KLF7、KLF13和KLF14的表达(图 9),提示FGF10调控山羊肌内和皮下前体脂肪细胞分化的机制有其独特的地方。这种同一基因在不同部位脂肪细胞的差异调控将是本实验室后续研究关注的重点。
|
图 9 过表达FGF10基因对山羊肌内和前体脂肪细胞分化影响的差异比较 Fig. 9 The effect of FGF10 overexpression on the differentiation of subcutaneous adipocytes and intramuscular adipocytes |
本研究发现,过表达FGF10基因明显促进山羊皮下前体脂肪细胞分化,并上调C/EBPα、LPL、FASN和ACACA的表达水平,下调ATGL的表达水平,并且这个过程中KLFs某些成员相应的上调和下调,FGFR1和FGFR3发生了相似的变化;这些结果与该基因在山羊肌内前体脂肪细胞分化中的结果相比,发挥促进分化作用的分子机制存在差异。研究结果为阐明FGF10调控山羊不同部位脂肪细胞分化的分子机理提供重要数据。
| [1] | LUO L P, LIU M L. Adipose tissue in control of metabolism[J]. J Endocrinol, 2016, 231(3): R77–R99. DOI: 10.1530/JOE-16-0211 |
| [2] | FUJISAWA T, KAGAWA K, HISATOMI K, et al. Obesity with abundant subcutaneous adipose tissue increases the risk of post- ERCP pancreatitis[J]. J Gastroenterol, 2016, 51(9): 931–938. DOI: 10.1007/s00535-016-1160-x |
| [3] |
黄业传, 贺稚非, 李洪军, 等. 皮下脂肪和肌内脂肪对猪肉风味的作用[J]. 中国农业科学, 2011, 44(10): 2118–2130.
HUANG Y C, HE Z F, LI H J, et al. The flavor contribution of subcutaneous and intramuscular fat to pork[J]. Scientia Agricultura Sinica, 2011, 44(10): 2118–2130. (in Chinese) |
| [4] | DE QUEIROZ J C F, ALONSO-VALE M I C, CURI R, et al. Control of adipogenesis by fatty acids[J]. Arq Bras Endocrinol Metab, 2009, 53(5): 582–594. DOI: 10.1590/S0004-27302009000500011 |
| [5] | YAMASAKI M, MIYAKE A, TAGASHIRA S, et al. Structure and expression of the rat mRNA encoding a novel member of the fibroblast growth factor family[J]. J Biol Chem, 1996, 271(27): 15918–15921. DOI: 10.1074/jbc.271.27.15918 |
| [6] | JIN L B, WU J, BELLUSCI S, et al. Fibroblast growth factor 10 and vertebrate limb development[J]. Front Genet, 2019, 9: 705. DOI: 10.3389/fgene.2018.00705 |
| [7] | WU J, CHU X, CHEN C, et al. Role of fibroblast growth factor 10 in mesenchymal cell differentiation during lung development and disease[J]. Front Genet, 2018, 9: 545. DOI: 10.3389/fgene.2018.00545 |
| [8] | SUZUKI K, YAMANISHI K, MORI O, et al. Defective terminal differentiation and hypoplasia of the epidermis in mice lacking the Fgf10 gene[J]. FEBS Lett, 2000, 481(1): 53–56. DOI: 10.1016/S0014-5793(00)01968-2 |
| [9] | SAKAUE H, KONISHI M, OGAWA W, et al. Requirement of fibroblast growth factor 10 in development of white adipose tissue[J]. Genes Dev, 2002, 16(8): 908–912. DOI: 10.1101/gad.983202 |
| [10] | ZHANG X Y, WU M J, ZHANG W W, et al. Differentiation of human adipose-derived stem cells induced by recombinantly expressed fibroblast growth factor 10 in vitro and in vivo[J]. In Vitro Cell Dev Biol Anim, 2010, 46(1): 60–71. DOI: 10.1007/s11626-009-9240-3 |
| [11] | KONISHI M, ASAKI T, KOIKE N, et al. Role of Fgf10 in cell proliferation in white adipose tissue[J]. Mol Cell Endocrinol, 2006, 249(1-2): 71–77. DOI: 10.1016/j.mce.2006.01.010 |
| [12] | OHTA H, ITOH N. Roles of FGFs as adipokines in adipose tissue development, remodeling, and metabolism[J]. Front Endocrinol (Lausanne), 2014, 5: 18. |
| [13] | XU Q, LIN S, WANG Y, et al. Fibroblast growth factor 10 (FGF10) promotes the adipogenesis of intramuscular preadipocytes in goat[J]. Mol Biol Rep, 2018, 45(6): 1881–1888. DOI: 10.1007/s11033-018-4334-1 |
| [14] | ZHANG G H, LU J X, CHEN Y, et al. Comparison of the adipogenesis in intramuscular and subcutaneous adipocytes from Bamei and Landrace pigs[J]. Biochem Cell Biol, 2014, 92(4): 259–267. DOI: 10.1139/bcb-2014-0019 |
| [15] | SUN W X, WANG H H, JIANG B C, et al. Global comparison of gene expression between subcutaneous and intramuscular adipose tissue of mature Erhualian pig[J]. Genet Mol Res, 2013, 12(4): 5085–5101. DOI: 10.4238/2013.October.29.3 |
| [16] | SHENG X H, NI H M, LIU Y H, et al. RNA-seq analysis of bovine intramuscular, subcutaneous and perirenal adipose tissues[J]. Mol Biol Rep, 2014, 41(3): 1631–1637. DOI: 10.1007/s11033-013-3010-8 |
| [17] |
李倩, 林亚秋, 朱江江, 等. 山羊FGF10基因的克隆及其表达分析[J]. 农业生物技术学报, 2016, 24(11): 1726–1733.
LI Q, LIN Y Q, ZHU J J, et al. Cloning and expression analysis of Capra hircus FGF10 gene[J]. Journal of Agricultural Biotechnology, 2016, 24(11): 1726–1733. (in Chinese) |
| [18] |
林森, 林亚秋, 朱江江, 等. Wnt10b对山羊前体脂肪细胞分化相关基因表达的影响[J]. 畜牧兽医学报, 2018, 49(4): 685–692.
LIN S, LIN Y Q, ZHU J J, et al. Effect of Wnt10b on the expression of precursor adipocytes differentiation related genes in goat[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(4): 685–692. (in Chinese) |
| [19] |
许晴, 林森, 朱江江, 等. 山羊肌内前体脂肪细胞诱导分化过程中内参基因的表达稳定性分析[J]. 畜牧兽医学报, 2018, 49(5): 907–918.
XU Q, LIN S, ZHU J J, et al. The expression stability analysis of reference genes in the process of goat intramuscular preadipocytes differentiation[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(5): 907–918. (in Chinese) |
| [20] | FASSHAUER M, BLUHER M. Adipokines in health and disease[J]. Trends Pharmacol Sci, 2015, 36(7): 461–470. DOI: 10.1016/j.tips.2015.04.014 |
| [21] | MAURY E, BRICHARD S M. Adipokine dysregulation, adipose tissue inflammation and metabolic syndrome[J]. Mol Cell Endocrinol, 2010, 314(1): 1–16. DOI: 10.1016/j.mce.2009.07.031 |
| [22] | ASAKI T, KONISHI M, MIYAKE A, et al. Roles of fibroblast growth factor 10 (Fgf10) in adipogenesis in vivo[J]. Mol Cell Endocrinol, 2004, 218(1-2): 119–128. DOI: 10.1016/j.mce.2003.12.017 |
| [23] | MATSUBARA Y, AOKI M, ENDO T, et al. Characterization of the expression profiles of adipogenesis-related factors, ZNF423, KLFs and FGF10, during preadipocyte differentiation and abdominal adipose tissue development in chickens[J]. Comp Biochem Physiol B, 2013, 165(3): 189–195. DOI: 10.1016/j.cbpb.2013.04.002 |
| [24] | MOTA DE SÁ P, RICHARD A J, HANG H, et al. Transcriptional regulation of adipogenesis[J]. Compr Physiol, 2017, 7(2): 635–674. |
| [25] | HU X, TANG J, HU X, et al. MiR-27b impairs adipocyte differentiation of human adipose tissue-derived mesenchymal stem cells by targeting LPL[J]. Cell Physiol Biochem, 2018, 47(2): 545–555. DOI: 10.1159/000489988 |
| [26] | ZHANG Y Y, WANG Y N, WANG H B, et al. MicroRNA-224 impairs adipogenic differentiation of bovine preadipocytes by targeting LPL[J]. Mol Cell Probes, 2019, 44: 29–36. DOI: 10.1016/j.mcp.2019.01.005 |
| [27] | ROY D, FARABAUGH K T, WU J, et al. Coordinated transcriptional control of adipocyte triglyceride lipase (Atgl) by transcription factors Sp1 and peroxisome proliferator-activated receptor γ (PPARγ) during adipocyte differentiation[J]. J Biol Chem, 2017, 292(36): 14827–14835. DOI: 10.1074/jbc.M117.783043 |
| [28] | ZAPPATERRA M, LUISE D, ZAMBONELLI P, et al. Association study between backfat fatty acid composition and SNPs in candidate genes highlights the effect of FASN polymorphism in large white pigs[J]. Meat Sci, 2019, 156: 75–84. DOI: 10.1016/j.meatsci.2019.05.013 |
| [29] |
田卫华, 杨丽玉, 李红, 等. 蛋鸡脂肪代谢相关基因ACACA和FASN表达及调控特性[J]. 农业生物技术学报, 2019, 27(2): 280–288.
TIAN W H, YANG L Y, LI H, et al. Expression and regulation characteristics of lipid metabolism-related ACACA and FASN genes in laying hens (Gallus gallus)[J]. Journal of Agricultural Biotechnology, 2019, 27(2): 280–288. (in Chinese) |
| [30] | YANG C F, WANG C, YE M, et al. Control of lipid metabolism by adipocyte FGFR1-mediated adipohepatic communication during hepatic stress[J]. Nutr Metab (Lond), 2012, 9: 94. DOI: 10.1186/1743-7075-9-94 |
| [31] | KÄHKÖNEN T E, IVASKA K K, JIANG M, et al. Role of fibroblast growth factor receptors (FGFR) and FGFR like-1 (FGFRL1) in mesenchymal stromal cell differentiation to osteoblasts and adipocytes[J]. Mol Cell Endocrinol, 2018, 461: 194–204. DOI: 10.1016/j.mce.2017.09.015 |
| [32] | FOLDYNOVA-TRANTIRKOVA S, WILCOX W R, KREJCI P. Sixteen years and counting:the current understanding of fibroblast growth factor receptor 3 (FGFR3) signaling in skeletal dysplasias[J]. Hum Mutat, 2012, 33(1): 29–41. DOI: 10.1002/humu.21636 |
| [33] | BOHANNON-STEWART A, KELLEY G, KIMAT-HI B, et al. Expression of potential regulatory genes in abdominal adipose tissue of broiler chickens during early development[J]. Genet Res Int, 2014, 2014: 318304. |
| [34] | PARK J R, LEE H, KIM C H, et al. Functional characteristics of mesenchymal stem cells derived from the adipose tissue of a patient with achondroplasia[J]. In Vitro Cell Dev Biol Anim, 2016, 52(5): 545–554. DOI: 10.1007/s11626-016-0008-2 |
| [35] | MORI T, SAKAUE H, IGUCHI H, et al. Role of Krüppel-like factor 15 (KLF15) in transcriptional regulation of adipogenesis[J]. J Biol Chem, 2005, 280(13): 12867–12875. DOI: 10.1074/jbc.M410515200 |
| [36] | DE ASSUNCAO T M, LOMBERK G, CAO S, et al. New role for Kruppel-like factor 14 as a transcriptional activator involved in the generation of signaling lipids[J]. J Biol Chem, 2014, 289(22): 15798–15809. DOI: 10.1074/jbc.M113.544346 |
| [37] | GUO H F, KHAN R, RAZA S H A, et al. KLF15 promotes transcription of KLF3 gene in bovine adipocytes[J]. Gene, 2018, 659: 77–83. DOI: 10.1016/j.gene.2018.03.049 |
| [38] | JANG M K, LEE S, JUNG M H. RNA-Seq analysis reveals a negative role of KLF16 in Adipogenesis[J]. PLoS One, 2016, 11(9): e0162238. DOI: 10.1371/journal.pone.0162238 |
| [39] | FUNNELL A P W, MALONEY C A, THOMPSON L J, et al. Erythroid Krüppel-like factor directly activates the basic Krüppel- like factor gene in erythroid cells[J]. Mol Cell Biol, 2007, 27(7): 2777–2790. DOI: 10.1128/MCB.01658-06 |
| [40] | EATON S A, FUNNELL A P, SUE N, et al. A network of Krüppel-like Factors (Klfs):Klf8 is repressed by Klf3 and activated by Klf1 in vivo[J]. J Biol Chem, 2008, 283(40): 26937–26947. DOI: 10.1074/jbc.M804831200 |



