2. 山西农业大学文理学院, 太谷 030801
2. College of Arts and Sciences, Shanxi Agricultural University, Taigu 030801, China
氟中毒是全世界广泛存在的一种人畜共患的全身性地方病,其主要临床症状为氟骨症和氟斑牙[1]。地方性氟中毒在我国广泛流行,危害极其严重,受害人群高达1.2亿,分布于1 306个地区10万多个村庄。1991—2012年的调查统计报道显示,截至2012年底,中国28个省份1 135个区县流行饮水型氟中毒,12个省份173个区县流行燃煤型氟中毒,其中燃煤型氟骨症患病率由3.61%增加到13.10%[2]。氟中毒引起的骨骼和牙齿的病变依然是地方病防控的重点。
成骨细胞作为骨骼生长发育中最为重要的细胞,对骨骼基质的沉积、骨骼重建、钙动态平衡、胶原蛋白合成以及类骨质的矿化等都具有重要的意义。在氟中毒时,由于氟在骨骼中浓度较高而使得成骨细胞成为其危害的主要靶点,在低浓度氟作用时可刺激成骨细胞增殖加快,骨骼矿化增加;而高浓度氟明显抑制成骨细胞增殖,诱发细胞凋亡和自噬,分泌骨基质降低、骨形成显著减慢[3]。
细胞自噬和凋亡之间关系非常复杂,细胞自噬是通过吞噬、降解或消化细胞内受损或多余的老化蛋白和细胞器来修复细胞损伤,使细胞更利于生存[4];而细胞凋亡是程序性死亡,细胞的所有成分均被其它活细胞降解和消化[5]。自噬可抑制氧化应激对机体的损伤,从而对细胞起到一定保护作用,但过度的细胞自噬可激活调亡[6]。那么氟刺激下的细胞自噬是拮抗其诱导的凋亡还是促进其凋亡发生,目前还未见相关报道。
谷胱甘肽S转移酶(GST)是广泛存在于各种生物体内的各种组织细胞中的一类酶,其主要功能是清除体内自由基和解毒,在抗氧化系统和毒物解毒代谢中起着十分重要的作用。Omega家族(GSTO)是近年来发现GST的一个新的超家族,广泛存在于多种生物体内[7]。近来发现谷胱甘肽S转移酶Omega 1(GSTO1)存在于大量的哺乳动物体内, 在正常组织细胞中GSTO1含量丰富。转基因动物体内GSTO1的过表达可提高动物抗氧化应激能力[7]。小鼠抗辐射细胞内GSTO1过表达对细胞氧化应激的应答有重要的作用[8]。此外GSTO1所具有谷胱甘肽依赖的脱氢抗坏血酸还原酶的活性,对坏血酸再循环所引起的氧化应激可能起到一定的保护作用。然而,在众多的氟中毒研究中发现,高浓度氟可使成骨细胞氧化应激增强和细胞增殖受阻,而低浓度的氟作用正好相反。本试验通过沉默成骨细胞中GSTO1基因表达研究其在氟致成骨细胞自噬与凋亡中的作用,进一步探讨氟与成骨细胞自噬与凋亡之间的关系。
1 材料与方法 1.1 主要材料及实验仪器出生24 h内的清洁级昆明小鼠;氟化钠(NaF,AR)购自天津市化学试剂三厂;标准胎牛血清FBS和胰蛋白酶购自美国Gibco公司;青链霉素混合液购自美国Hyclone公司;Ⅱ型胶原酶购自美国Invitrogen公司;siRNA和siRNA mate由上海吉玛制药技术有限公司合成;RT-PCR试剂盒、RNA提取试剂盒、反转录试剂盒均购自美国Promega公司;PCR引物由上海Invitrogen贸易有限公司设计合成。β-actin、LC3、p62、Beclin1、Atg5和Atg3蛋白抗体以及辣根过氧化物酶标记的IgG均购自北京博奥森生物技术有限公司;Mx3000实时荧光定量PCR仪(美国Stratagene公司);D-3752高速冷冻离心机(Sigma公司);BX51型生物显微镜(日本OLYMPUS)。
1.2 方法 1.2.1 si-GSTO1的设计、合成按照NCBI基因数据库中小鼠GSTO1的mRNA序列(GenBank No.: NM_010362.3),针对小鼠GSTO1 mRNA 257、354、545位点设计、合成3对21核苷酸siRNA(siRNA1、siRNA2、siRNA3)序列,分别如下,siRNA1正义链:5′-CCGGCACGAAGUCAUCAAUTT-3′,反义链:5′-AUUGAUGACUUCGUGCCGGTT-3′;siRNA2正义链:5′-GGUCACUUGGUCACCGAAU-TT-3′,反义链:5′-AUUCGGUGACCAAGUGACCTT-3′;siRNA3正义链:5′-GGAAGCGUUGGAGA-ACGAATT-3′,反义链:5′-UUCGUUCUCCAACGCUUCCTT-3′。以上si-GSTO1和带有FAM荧光标记的siRNA(FAM-siRNA)、阴性对照siRNA(Negative Control-siRNA,NC-siRNA)均由上海吉玛制药技术有限公司合成。
1.2.2 成骨细胞原代与传代培养取出生24 h内的昆明小鼠15只,用75%的医用酒精浸泡15 min消毒致小鼠窒息后移至无菌超净台剥离小鼠头盖骨,刮除骨膜及骨缝处软组织,用PBS漂洗多次至无血细胞,用0.25%胰蛋白酶在37 ℃水浴中消化3次,每次30 min,然后再用0.1%Ⅱ型胶原酶振荡消化1 h,间隔15 min晃动一次,保证能充分消化骨片,收集成骨细胞于含15%胎牛血清和100 U·mL-1青链霉素的F12/DMEM培养液中,用5%的CO2在37 ℃培养箱中培养,定时观察细胞生长状况并换液,待细胞铺满培养瓶底壁后将细胞进行消化传代,培养到第三代的细胞进行鉴定和后续试验。
1.2.3 成骨细胞的鉴定取第三代生长良好的细胞接种于两个预置盖玻片的6孔培养板中,在倒置显微镜下观察细胞形态,取出盖玻片用PBS洗涤3次,甲醇固定10 min,待吹干后吉姆萨染液染色15 min,用BX51型生物显微镜拍照。用4%多聚甲醛固定后进行HE染色,同时进行ALP染色和茜素红染色。ALP染色按照南京建成生物科技有限公司生产的ALP染色试剂盒说明书进行。茜素红染色将PBS清洗3次的成骨细胞用95%乙醇固定10 min,再用蒸馏水洗涤3次,每次5 min,加入0.1%茜素红(pH 7.4),在室温放置10 min后用BX51型生物显微镜拍照。
1.2.4 成骨细胞染氟化钠浓度筛选用F12/DMEM将NaF配制成104 mg·L-1的溶液,从中吸出200 μL加入装有1 800 μL培养基中,稀释为103 mg·L-1的NaF溶液。以此类推一直稀释到1 mg·L-1,分别将不同浓度NaF的完全培养基2 mL滴加到接种好成骨细胞的6孔板中。染氟24 h后提取成骨细胞总RNA,用RT-PCR检测GSTO1基因的转录量,确定氟化钠最佳浓度。
1.2.5 成骨细胞siRNA转染与自噬和凋亡相关基因检测 1.2.5.1成骨细胞siRNA转染浓度与转染成分的筛选与试验分组:分别将不同浓度(20、30、50、100 nmol ·L-1)荧光标记的FAM-siRNA试剂(0.6、0.9、1.5、3 μL)加入F12/DMEM各自形成混合物A 50 μL,在超净台放置5 min。由说明书推荐用量将3 μL转染试剂siRNA mate加入到F12/DMEM中形成50 μL混合物B,同样静置5 min,然后将不同浓度的A和B混合孵育20 min,分别滴加到24孔板的各个对应的孔中,转染6 h后在倒置显微镜下观察各个浓度绿色荧光的信号,选定siRNA的最佳转染浓度。将试剂盒中的siRNA1、siRNA2和siRNA3按上述方法配制成100 μL AB混合物加入到接种好成骨细胞的培养板中,转染48 h提取总RNA,通过qRT-PCR法检测GSTO1的mRNA转录量确定沉默效果,选取siRNA序列。
试验分组:空白对照组(control)、阴性对照组(NC-siRNA)、氟化钠组(1 mg·L-1)、沉默目的基因组(siRNA-GSTO1)、氟化钠加沉默目的基因组(NaF/siRNA-GSTO1)。
1.2.5.2RNA提取及RT-PCR检测自噬和凋亡相关基因转录:严格按照RNA提取试剂盒操作步骤提取成骨细胞总RNA,逆转录后取1 μL进行RT-PCR,PCR体系为10 μL。应用Primier5.0软件设计引物,引物序列及大小见表 1。实时荧光定量PCR反应体系如下:2×Go Taq qPCR Master Mix 5 μL,CXR Reference Dye 0.1 μL,上下游引物各0.4 μL,DEPC水3.1 μL,cDNA 1 μL,总反应体系为10 μL。退火温度60 ℃,扩增条件:95 ℃预变性2 min,95 ℃变性15 s,60 ℃ 30 s,72 ℃ 30 s,设定45个循环。所有样本均为4个重复,最后通过2- ΔΔCt方法对数据进行处理分析。
|
|
表 1 本试验中所用到的引物序列 Table 1 Primer sequences used in the present study |
将成骨细胞中加入蛋白裂解液进行裂解,然后测定蛋白浓度,并将蛋白浓度调整为相同水平。将分离的蛋白加入适量上样缓冲液,高温变性后加入到SDS-PAGE中在冰浴条件下进行电泳,浓缩胶电压80 V,分离胶电压100 V。用聚偏二氟乙烯(PVDF)膜恒压35 V转膜2 h,封闭2 h后,用β-actin、LC3、p62、Beclin1、Atg5和Atg3抗体4 ℃孵育过夜,加入辣根过氧化物酶标记的IgG孵育2 h,用ECL检测蛋白表达。
1.2.7 试验数据统计与分析采用GraphPad Prism5.0统计软件中One-way analysis of variance(ANOVA)和T-test方法进行数据分析,*P < 0.05表示差异显著, **P < 0.01和*** P < 0.001均表示差异极显著。
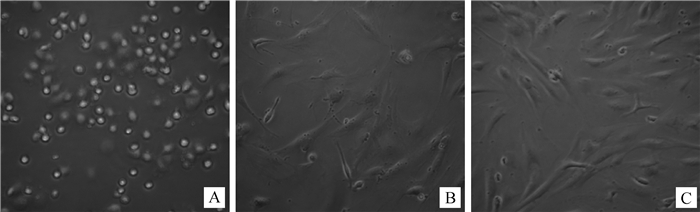
2 结果 2.1 成骨细胞培养取原代培养的成骨细胞置于倒置相差显微镜下观察,细胞体呈球形,悬浮于培养液中(如图 1A)。接种24 h时,大部分细胞开始贴壁生长,呈圆形、梭形等,形态不规则(图 1B)。将成骨细胞传代培养48 h后在显微镜下观察,细胞贴壁展开,呈梭形或三角形(图 1C)。
|
A.分离的成骨细胞0 h;B.原代成骨细胞培养24 h;C.传代成骨细胞培养48 h A. Newly isolated osteoblasts; B. Primary osteoblasts cultured for 24 h; C. Passaged osteoblasts cultured for 48 h 图 1 成骨细胞原代培养与传代培养(200×) Figure 1 The culture of primary and passage osteoblasts(200×) |
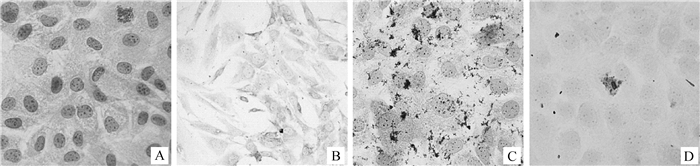
成骨细胞经HE染色后,细胞质被染成粉红色,细胞核被染成紫蓝色,细胞突起相互交联,细胞核较大,并且轮廓清晰,呈卵圆形,核内有黑色颗粒(图 2A)。细胞经Giemsa染色后,细胞质呈浅蓝色,染色均匀,细胞核被染为蓝色或蓝紫色(图 2B)。细胞经ALP染色后,细胞质和细胞突起内有大量的黑色颗粒或絮状沉淀,表明该细胞的细胞质和突起含有丰富的碱性磷酸酶,符合成骨细胞所具有的性质(图 2C)。细胞培养7 d后,经茜素红染色可见橘红色钙化结节,边界清晰,表现出钙盐沉积能力,符合成骨细胞钙结节的染色特性(图 2D)。综合四种染色特点,该细胞具有成骨细胞的各种特征,可确定为成骨细胞。
|
A. HE染色;B. Giemsa染色;C.碱性磷酸酶染色;D.茜素红染色 A. HE staining; B. Giemsa staining; C. ALP staining; D. Alizarin red staining 图 2 小鼠成骨细胞的鉴定 Figure 2 The identification of osteoblasts in mice |
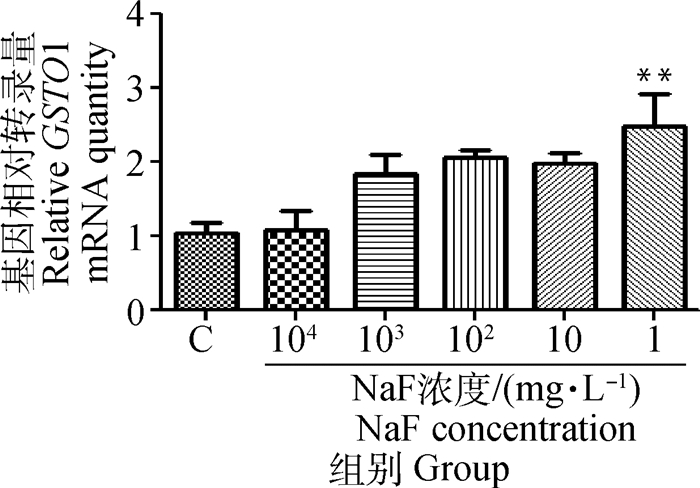
将含有不同氟化钠浓度(104、103、102、101、1 mg·L-1)培养液培养的成骨细胞进行总RNA提取,用RT-PCR检测GSTO1基因的转录情况,由图 3可看出GSTO1在染氟成骨细胞中整体呈上升趋势,其中1 mg·L-1的NaF可使成骨细胞中GSTO1基因的转录极显著升高,故在后续试验中使用NaF浓度为1 mg·L-1。
|
与C组相比较,**. P < 0.01 Compared with group C, **. P < 0.01 图 3 不同氟化钠浓度下GSTO1在成骨细胞中的转录 Figure 3 Transcription of GSTO1 in osteoblasts at different concentrations of sodium fluoride |
用不同浓度的FAM-siRNA转染成骨细胞,转染24 h后荧光显微镜观察绿色荧光(图 4),通过荧光强弱筛选siRNA的最佳转染浓度。结果显示,20 nmol·L-1的FAM-siRNA转染成骨细胞6 h后可见微弱的FAM绿色荧光。随着转染浓度的增加,荧光亮度逐渐增强,带有绿色荧光的成骨细胞逐渐增多,其中以50和100 nmol·L-1最为显著。根据FAM-siRNA转染浓度筛选50 nmol·L-1为后续siRNA的转染浓度。

|
图 4 不同浓度的FAM-siRNA转染成骨细胞后的荧光照片(200×) Figure 4 Fluorescent photos of osteoblasts transfected with different concentrations of FAM-siRNA (200×) |
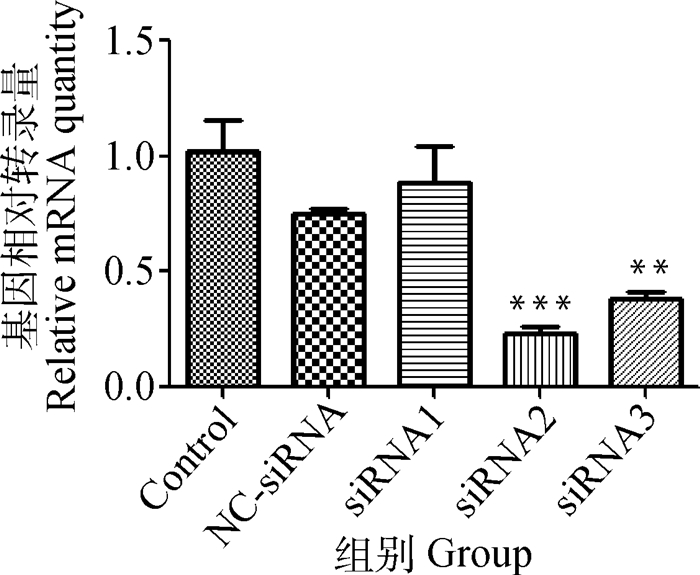
以空白对照组(Control)为参照,3对GSTO1的siRNA采用50 nmol·L-1的浓度转染成骨细胞,转染48 h后,各组GSTO1基因的转录情况如图 5所示。结果表明,siRNA2和siRNA3对小鼠成骨细胞GSTO1基因的转录较对照组极显著降低,且以si-RNA2干扰成骨细胞GSTO1基因转录下降极显著(P < 0.001),而阴性对照组(NC-siRAN)和siRNA1组GSTO1基因的转录则无显著变化。进一步试验选用si-RNA2序列作为干扰GSTO1基因的干扰序列,即siRNA-GSTO1组。
|
与control进行比较,**.P < 0.01; ***.P < 0.001 Compared with group control, **. P < 0.01; ***. P < 0.001 图 5 50 nmol·L-1的si-GSTO1转染成骨细胞48 h后GSTO1基因转录 Figure 5 GSTO1 transcription after 50 nmol·L-1 si-GSTO1 transfection in osteoblasts cultured for 48 h |
从图 6可以看出,在试验48 h时,成骨细胞中与自噬相关的LC3、Beclin1和Atg5基因转录水平在NaF和siRNA-GSTO1组较空白对照组显著升高(P < 0.001或P < 0.05),而NaF/siRNA-GSTO1组差异不显著(LC3基因除外);与NaF组相比较,NaF/siRNA-GSTO1组中LC3、Beclin1和Atg5基因转录水平显著下降(P < 0.05);而p62基因转录与LC3、Beclin1和Atg5正好相反,与空白对照组相比较,NaF、siRNA-GSTO1和NaF/siRNA-GSTO1组转录水平均极显著降低(P < 0.001或P < 0.01),但与NaF组相比较,NaF/siRNA-GSTO1组p62基因转录水平显著升高(P < 0.05)。结果表明1 mg·L-1的NaF和GSTO1基因的沉默均可使成骨细胞自噬发生增强,沉默GSTO1基因的转录具有拮抗NaF刺激自噬发生的作用。
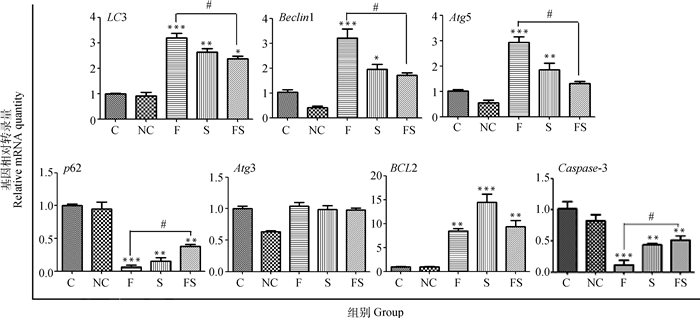
|
C.空白对照组;NC.阴性对照组;F.氟化钠组(1 mg·L-1);S.沉默目的基因组(siRNA-GSTO1);FS.氟化钠加沉默目的基因组(NaF/siRNA-GSTO1);与C组相比,*.P < 0.05, **.P < 0.01, ***.P < 0.001;F组和FS组比较,#.P < 0.05 C. Control group; NC. NC-siRNA group; F. NaF (1 mg·L-1) group; S. siRNA-GSTO1 group; FS. NaF/siRNA-GSTO1 group; Compared with the control group, *.P < 0.05, **.P < 0.01, ***.P < 0.001; Comparison between group F and FS, #.P < 0.05 图 6 沉默GSTO1基因对氟对成骨细胞自噬与凋亡相关基因的转录 Figure 6 The transcription of autophagy and apoptotic genes in fluoride-mediated osteoblasts inhibited silencing of GSTO1 gene |
成骨细胞抑凋亡基因BCL2在NaF、siRNA-GSTO1和NaF/siRNA-GSTO1组中较空白对照组转录水平均极显著升高(P < 0.01或P < 0.001),与NaF组相比较,NaF/siRNA-GSTO1组转录水平无显著变化。成骨细胞促凋亡基因Caspase-3在NaF、siRNA-GSTO1和NaF/siRNA-GSTO1组中较空白对照组转录水平均极显著降低(P < 0.01或P < 0.001),但与NaF组相比较,NaF/siRNA-GSTO1组转录水平显著升高(P < 0.05)。提示1 mg·L-1的NaF和GSTO1基因的沉默均可使成骨细胞凋亡减少,沉默GSTO1基因对低剂量NaF抑制凋亡的发生有一定的拮抗作用。
2.5 GSTO1基因沉默对氟致成骨细胞自噬相关蛋白表达的影响Western blot检测了成骨细胞中自噬相关蛋白LC3、p62、Beclin1、Atg5和Atg3的表达水平,见图 7,可以看出LC3、p62、Beclin1、Atg5和Atg3蛋白的表达与基因转录趋势一致,与空白对照组相比,LC3、Beclin1和Atg5蛋白在NaF组显著升高(P < 0.01和P < 0.05),而Beclin1蛋白在NaF/siRNA-GSTO1组极显著下降(P < 0.01),与NaF组相比较,NaF/siRNA-GSTO1组中LC3、Beclin1和Atg5蛋白表达显著下降(P < 0.05);p62蛋白表达在NaF、siRNA-GSTO1和NaF/siRNA-GSTO1组中较空白对照组相比均显著降低(P < 0.01或P < 0.05),但与NaF组相比较,NaF/siRNA-GSTO1组p62蛋白表达显著升高(P < 0.05);而Atg3的mRNA表达水平和蛋白表达水平在各试验组中均无显著性差异。表明1 mg·L-1的NaF可以使成骨细胞中自噬相关蛋白表达增加,抑制GSTO1基因表达可拮抗NaF对成骨细胞自噬发生的作用。
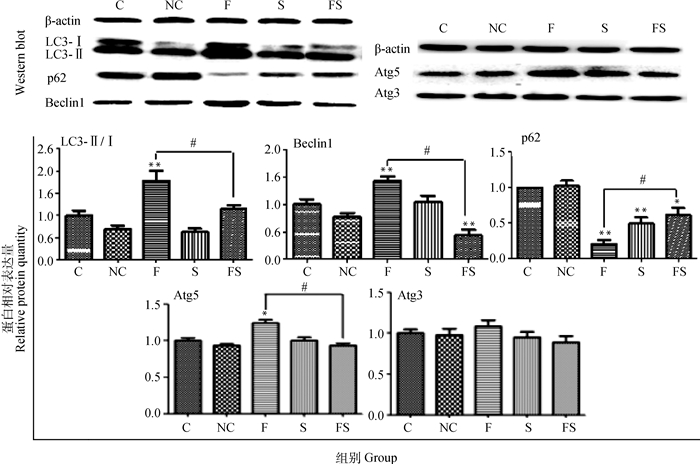
|
C.空白对照组;NC.阴性对照组;F.氟化钠组(1 mg·L-1);S.沉默目的基因组(siRNA-GSTO1);FS.氟化钠加沉默目的基因组(NaF/siRNA-GSTO1);与C组相比,*.P < 0.05, **.P < 0.01, ***.P < 0.001;F组和FS组比较,#.P < 0.05 C. Control group; NC. NC-siRNA group; F. NaF (1 mg·L-1) group; S. siRNA-GSTO1 group; FS. NaF/siRNA-GSTO1 group; Compared with the control group, *.P < 0.05, **.P < 0.01, ***.P < 0.001; Comparison between group F and FS, #.P < 0.05 图 7 沉默GSTO1基因对氟对成骨细胞自噬相关蛋白表达的影响 Figure 7 The effect of silencing GSTO1 gene on the expression of autophagy in fluoride-mediated osteoblasts |
氟是一种重要的亲骨元素,在低剂量时可有效预防龋齿,并且能调节细胞增殖、分化和凋亡相关转化因子的活性来促进成骨细胞的增殖和分化。但高剂量的氟化物能抑制成骨细胞的增殖促进细胞凋亡[9]。有研究表明成骨细胞在染氟(0.5、5、10和20 mg·L-1 NaF)后观察到其凋亡率随剂量增加显著增加[10]。郭晓东等[11]用5 mmol·L-1的NaF刺激成骨细胞MC3T3-E1诱导自噬与凋亡24和48 h中发现,氟能显著抑制成骨细胞MC3T3-E1的增殖,诱发细胞凋亡,同时也促进自噬产生。Xu等[12]用1.0和10.0 mg·L-1氟化物处理OS732细胞(人类成骨细胞样细胞系)24、96和240 h,发现低剂量的氟化物可以通过激活内质网应激通路和PERK信号通路来改变骨转换基因的表达,提示氟对成骨细胞通过PERK信号通路起非常重要的作用。在小鼠成骨细胞中氟可诱导成骨细胞的自噬,其中,Beclin-1、LC3和p62在自噬通路中发挥重要作用[13]。
有大量研究表明高氟可引起动物发生氧化应激导致各组织发生损伤,故有不同研究人员分别应用VC、VE、硒等抗氧化物质减轻氟的氧化应激取得了一定的效果[14-16]。在高氟诱导的氧化应激研究中,谷胱甘肽还原酶(GSH)和谷胱甘肽S转移酶(GST)是标志性的检测指标,GST是多基因家族蛋白,是氧化剂和环境危害的主要细胞防御系统[17],而GSTO1是GST中一类具有清除体内自由基、解毒和抗氧化能力的蛋白,GSTO1参与抗氧化防御[18]。本研究中将不同浓度的氟化钠加入培养24 h的成骨细胞中,表现出GSTO1基因转录有整体升高趋势,表明氟可刺激细胞中GSTO1转录的升高。其中1.0 mg·L-1的NaF刺激GSTO1基因转录极显著增加(P < 0.01),作为后续研究氟化钠的选择浓度。
使用GSTO1-1 siRNA技术对GSTs的研究表明,它们可以通过与其他主要蛋白质相互作用干扰细胞增殖和细胞死亡途径[19]。GSTO1是保持细胞凋亡和自噬,即死亡与生存相互平衡之间的决定因素,可通过抑制JNK信号来减少AFB1诱导的巨噬细胞的凋亡并通过UPR诱导细胞存活的自噬[20]。在细胞自噬中LC3被认为是自噬体的标志分子, LC3-Ⅰ和LC3-Ⅱ分别是LC3的两种形式,在共价连接酶Atg3的作用下LC3由可溶形式(LC3-Ⅰ)转变为脂溶形式(LC3-Ⅱ),LC3-Ⅱ能够与新形成的自噬体膜相结合,因此, 它也经常被用作细胞内自噬的标记物[21]。p62是一种泛素结合蛋白,参与泛素蛋白酶体系统(ubiquitin-proteasome system,UPS)和自噬-溶酶体系统两种蛋白降解过程。当自噬发生时,细胞质中的p62首先与泛素化的蛋白质结合,再与定位于自噬小体内膜上的LC3-Ⅱ蛋白结合形成复合物,并在自噬溶酶体中降解[22]。自噬发生时,p62水平显著下降。Beclin1是一种哺乳动物中首个被发现的具有调节细胞自吞噬作用的自噬蛋白,在自噬的早期阶段,在其他自噬相关蛋白(auto-phagy-related genes, ATG)的补充中发挥重要作用。此外,Beclin1可以与许多结合伴侣相互作用,诱导和抑制自噬途径[23]。自噬相关蛋白是在酵母和其他真核生物中鉴定了许多参与自噬的蛋白,调控这些蛋白的基因被命名为自噬相关基因[21]。其中Atg3和Atg5是自噬通路上的关键因子,Atg3是LC3-Ⅰ和LC3-Ⅱ相互转换中的共价连接酶,使得LC3-Ⅱ与新的自噬体膜结合,而Atg5是形成自噬体结构的直接产物,它与Atg12共价连接并与Atg16L1形成前自噬体结构[21],当自噬增强时其表达会显著升高[5]。
在本研究中GSTO1基因siRNA技术和添加1 mg·L-1的NaF均可使自噬相关基因LC3、Beclin1和Atg5基因mRNA转录水平显著升高,p62基因转录显著下降;抗凋亡基因BCL2转录显著升高,凋亡基因Caspase-3转录显著下降。这一结果分别与Zhang等[19]用氟对睾丸细胞自噬与凋亡的影响及Paul等[20]用GSTO1-1基因沉默检测黄曲霉毒素诱导的巨噬细胞凋亡与自噬的研究结果相一致。同时本试验结果显示氟能够显著上调LC3、Beclin1和Atg5蛋白的表达,而使p62蛋白表达显著下降,表明低剂量的氟作用于成骨细胞后自噬被激活。但在本试验中,Atg3基因及蛋白表达未见显著变化推测在自噬形成过程中,不是通过Atg3介导LC3的形态改变连接到新的自噬体膜上导致自噬形成,而是介导于Atg5、Beclin1及LC3导致自噬体的形成。
但与NaF组相比较,NaF/siRNA-GSTO1组LC3、Beclin1和Atg5基因mRNA转录水平显著降低(P < 0.05),而p62和Caspase-3基因转录显著升高(P < 0.05)。表明沉默GSTO1表达对低剂量氟致成骨细胞自噬增强与抑制凋亡有一定的拮抗作用。用Western blot技术检测了LC3、Beclin1、p62、Atg5和Atg3蛋白的表达,结果与基因转录趋势完全一致,也证明了GSTO1基因与低剂量氟对成骨细胞自噬之间的作用为协同效应。Piaggi等[17]研究表明GSTO1对中毒引起的细胞凋亡有拮抗作用,与本研究的结果相一致,同时也表明GSTO1在氟致成骨细胞自噬和凋亡的发生发展中起着重要的作用。
4 结论低剂量氟与沉默GSTO1表达均可致成骨细胞自噬增强的同时凋亡减弱,GSTO1对低剂量氟致成骨细胞自噬增强与抑制凋亡有一定的协同效应。GSTO1具有缓解氟中毒造成骨骼损失引发氟骨症的作用。
| [1] | LI M Y, CAO J L, CHEN J J, et al. Waterborne fluoride exposure changed the structure and the expressions of steroidogenic-related genes in gonads of adult zebrafish (Danio rerio)[J]. Chemosphere, 2016, 145: 365–375. DOI: 10.1016/j.chemosphere.2015.11.041 |
| [2] |
刘永林, 马培, 雒昆利, 等. 1991-2012年中国地方性氟中毒病情动态变化[J]. 重庆师范大学学报:自然科学版, 2016, 33(2): 142–151.
LIU Y L, MA P, LUO K L, et al. The state and trend of endemic fluorosis from 1991 to 2012 in China[J]. Journal of Chongqing Normal University: Natural Science Edition, 2016, 33(2): 142–151. (in Chinese) |
| [3] |
李彤, 张秀云, 徐辉, 等. 氟对体外培养成骨细胞氧化应激和增殖活性的影响[J]. 中国实验诊断学, 2007, 11(2): 194–197.
LI T, ZHANG X Y, XU H, et al. The effects of fluoride on oxidative stress and proliferative activity of osteoblasts[J]. Chinese Journal of Laboratory Diagnosis, 2007, 11(2): 194–197. DOI: 10.3969/j.issn.1007-4287.2007.02.018 (in Chinese) |
| [4] | LEVINE B, KROEMER G. Autophagy in the pathogenesis of disease[J]. Cell, 2008, 132(1): 27–42. DOI: 10.1016/j.cell.2007.12.018 |
| [5] | GANESAN S, PEARCE S C, GABLER N K, et al. Short-term heat stress results in increased apoptotic signaling and autophagy in oxidative skeletal muscle in Sus scrofa[J]. J Therm Biol, 2018, 72: 73–80. DOI: 10.1016/j.jtherbio.2018.01.003 |
| [6] | YANG H L, MEI J, CHANG K K, et al. Autophagy in endometriosis[J]. Am J Transl Res, 2017, 9(11): 4707–4725. |
| [7] | MONTICOLO F, COLANTUONO C, CHIUSANO M L. Shaping the evolutionary tree of green plants:evidence from the GST family[J]. Sci Rep, 2017, 7: 14363. DOI: 10.1038/s41598-017-14316-w |
| [8] | BOARD P G, MENON D. Structure, function and disease relevance of Omega-class glutathione transferases[J]. Arch Toxicol, 2016, 90(5): 1049–1067. DOI: 10.1007/s00204-016-1691-1 |
| [9] | SIMON M J K, BEIL F T, RVTHER W, et al. High fluoride and low calcium levels in drinking water is associated with low bone mass reduced bone quality and fragility fractures in sheep[J]. Osteop Int, 2014, 25(7): 1891–1903. DOI: 10.1007/s00198-014-2707-4 |
| [10] | YAN X Y, YAN X T, MORRISON A, et al. Fluoride induces apoptosis and alters collagen Ⅰ expression in rat osteoblasts[J]. Toxicol Lett, 2011, 200(3): 133–138. DOI: 10.1016/j.toxlet.2010.11.005 |
| [11] |
郭晓东, 杨茂伟, 梁单, 等. 氟诱导成骨细胞MC3T3-E1自噬与凋亡及其相互作用分析[J]. 中国地方病防治杂志, 2012, 27(3): 165–168.
GUO X D, YANG M W, LIANG D, et al. An analysis on fluorine-induced autophagy and apoptosis of MC3T3-E1 and their interaction[J]. Chinese Journal of Control of Endemic Diseases, 2012, 27(3): 165–168. (in Chinese) |
| [12] | XU H, ZHOU Y L, ZHANG X Y, et al. Activation of PERK signaling through fluoride-mediated endoplasmic reticulum stress in OS732 cells[J]. Toxicology, 2010, 277(1-3): 1–5. DOI: 10.1016/j.tox.2010.08.006 |
| [13] | ZHAO Y F, LI Y Y, GAO Y F, et al. TGF-β1 acts as mediator in fluoride-induced autophagy in the mouse osteoblast cells[J]. Food Chem Toxicol, 2018, 115: 26–33. DOI: 10.1016/j.fct.2018.02.065 |
| [14] |
张颖, 孙贵范, 金亚平, 等. 氟对成骨细胞增殖分化的影响及维生素C的拮抗作用[J]. 中华劳动卫生职业病杂志, 2003, 21(4): 250–252.
ZHANG Y, SUN G F, JIN Y P, et al. Effects of fluoride on proliferation and differentiation of rat osteoblasts in vitro and the antagonistic action of vitamin C[J]. Chinese Journal of Industrial Hygiene and Occupational Diseases, 2003, 21(4): 250–252. DOI: 10.3760/cma.j.issn.1001-9391.2003.04.004 (in Chinese) |
| [15] | GUNEY M, ORAL B, TAKE G, et al. Effect of fluoride intoxication on endometrial apoptosis and lipid peroxidation in rats:role of vitamins E and C[J]. Toxicology, 2007, 231(2-3): 215–223. DOI: 10.1016/j.tox.2006.12.020 |
| [16] |
于倩, 左楠, 贾海燕, 等. 硒对氟中毒雏鸡肝脏细胞色素P450酶系主要亚型的影响[J]. 畜牧兽医学报, 2009, 40(6): 922–927.
YU Q, ZUO N, JIA H Y, et al. The effect of selenium on main subtypes of hepatic microsomal-cytochrome P450s in chickens with exposure of fluoride[J]. Acta Veterinaria et Zootechnica Sinica, 2009, 40(6): 922–927. DOI: 10.3321/j.issn:0366-6964.2009.06.023 (in Chinese) |
| [17] | PIAGGI S, RAGGI C, CORTI A, et al. Glutathione transferase omega 1-1 (GSTO1-1) plays an anti-apoptotic role in cell resistance to cisplatin toxicity[J]. Carcinogenesis, 2010, 31(5): 804–811. DOI: 10.1093/carcin/bgq031 |
| [18] | MENG F, ZHANG Y Y, LIU F, et al. Characterization and mutational analysis of omega-class GST (GSTO1) from Apis cerana cerana, a gene involved in response to oxidative stress[J]. PLoS One, 2014, 9(3): e93100. DOI: 10.1371/journal.pone.0093100 |
| [19] | ZHANG S, NIU Q, GAO H, et al. Excessive apoptosis and defective autophagy contribute to developmental testicular toxicity induced by fluoride[J]. Environ Poll, 2016, 212: 97–104. DOI: 10.1016/j.envpol.2016.01.059 |
| [20] | PAUL S, JAKHAR R, BHARDWAJ M, et al. Glutathione-S-transferase omega 1 (GSTO1-1) acts as mediator of signaling pathways involved in aflatoxin B1-induced apoptosis-autophagy crosstalk in macrophages[J]. Free Rad Biol Med, 2015, 89: 1218–1230. DOI: 10.1016/j.freeradbiomed.2015.11.006 |
| [21] |
陈科, 程汉华, 周荣家. 自噬与泛素化蛋白降解途径的分子机制及其功能[J]. 遗传, 2012, 34(1): 5–18.
CHEN K, CHENG H H, ZHOU R J. Molecular mechanisms and functions of autophagy and the ubiquitin-proteasome pathway[J]. Hereditas, 2012, 34(1): 5–18. DOI: 10.3760/cma.j.issn.1003-9406.2012.01.002 (in Chinese) |
| [22] |
陈金东. 细胞自噬与细胞凋亡在细胞中的作用[J]. 遵义医学院学报, 2016, 39(3): 217–222.
CHEN J D. The role of autophagy and apoptosis in cells[J]. Journal of Zunyi Medical University, 2016, 39(3): 217–222. (in Chinese) |
| [23] | PANKIV S, CLAUSEN T H, LAMARK T, et al. p62/SQSTM1 binds directly to Atg8/LC3 to facilitate degradation of ubiquitinated protein aggregates by autophagy[J]. J Biol Chem, 2007, 282(33): 24131–24145. DOI: 10.1074/jbc.M702824200 |



