2. 农业部肉羊遗传育种重点实验室, 呼和浩特 010018;
3. 内蒙古自治区山羊遗传育种工程技术研究中心, 呼和浩特 010018
2. Key Laboratory of Mutton Sheep Genetics and Breeding of Ministry of Agriculture, Hohhot 010018, China;
3. Engineering Research Center for Goat Genetics and Breeding of Inner Mongolia Autonomous Region, Hohhot 010018, China
家畜精液冷冻保存技术是一项重要的动物繁殖技术,近10多年,精液冷冻保存技术已得到长足的发展。随着精液冷冻技术的不断优化[1-4],牛、山羊和绵羊的冷冻精液在生产中也得到广泛的应用。精子在冷冻-解冻过程中受到冷冻应激,使精子活力降低、质膜损伤以及DNA结构破坏。DNA损伤主要由冷冻过程中氧化应激导致的[5-6]。精子的生存和运动依赖糖酵解和线粒体氧化磷酸化(oxidative phosphorylation, OXPHOS)提供能量,在此过程中会产生大量的活性氧(ROS),这些多余的ROS会在精子或精清中抗氧化酶的作用下被去除,如果缺乏抗氧化酶或抗氧化体系被破坏,就会引发氧化应激反应[7]。
山羊精子能够利用葡萄糖、果糖、乳糖和其它糖进行代谢,而且可利用的浓度(6~375 mmol·L-1)范围较大[8]。其中小分子糖(葡萄糖和果糖)研究较多。葡萄糖是比较适合山羊精子代谢的底物,给精子提供能量以维持正常的生理活动和功能[8-9]。在冷冻过程中因处理方式不同,添加葡萄糖浓度也不同。然而,在绒山羊精液冷冻保存过程中,关于葡萄糖对精子代谢影响的报道较少。
葡萄糖通过精子的质膜,利用糖酵解或三羧酸循环(TCA)为精子提供能量[10]。哺乳动物精子获取能量的方式受诸多因素的影响,例如稀释液的成分、温度等。在液态保存山羊精液的研究中发现,低温条件下精子主要依赖葡萄糖通过糖酵解为精子提供能量[11],但是糖酵解产物乳酸的积累会导致精子周围环境的改变,进而影响精子的生存[12-13]。
在本研究中,从冷冻-解冻后的精子活力、运动速率、细胞结构以及代谢等方面,比较了不同浓度葡萄糖对内蒙古绒山羊精液冷冻保存的影响,为提高绒山羊精液冷冻保存效果及阐明绒山羊精子抗冻机制提供一些实践与理论依据。
1 材料与方法 1.1 主要试剂Tris、柠檬酸-水合物、葡萄糖、乳酸和甘油均购于Sigma公司,双抗购于Gibco公司,Annaxin V/PI试剂盒购于BD生物技术公司,PNA-FITC购于上海哈灵生物技术公司, ATP检测试剂盒(S0026)、DCFH-DA(S0033)购于碧云天生物技术公司,吖啶橙(A8120)、丙酮酸(PA)含量检测试剂盒(BC2205)、乳酸(LA)含量检测试剂盒(BC2230)均购于索莱宝生物技术公司。
1.2 精液采集精液采自6只(2~4岁)健康的、具有正常繁殖能力的公绒山羊。用假阴道法采集精液后,立即进行品质检测和处理。将鲜精密度达到200×107·mL-1,活力≥85%的精液在35 ℃下进行混合。冷冻稀释液成分[1]为300 mmol·L-1 tris、95 mmol·L-1柠檬酸-水合物、1%双抗、10%卵黄(v/v)和5%甘油(v/v)。根据试验设计在此基础上添加不同浓度葡萄糖0、28、56、84和112 mmol·L-1。
1.3 精液冷冻混合后的精液用等温的冷冻液按体积比为1:5在试管中进行一步稀释,之后水浴,置于5 ℃冰箱2 h,取平衡后的精液立刻分装于0.25 mL冷冻细管中,封管。置于5 ℃冰箱平衡30 min。在距离液氮液面上4 cm处熏蒸7 min,投入液氮中冷冻保存。冷冻精液保存3 d,解冻:将冻精细管置于38 ℃水浴中30 s[14]。
1.4 精子质量检测 1.4.1 精子运动检测冷冻精液解冻后,将精子悬浮液滴于专用精子计数板中,放置在37 ℃恒温台上,利用计算机辅助精子分析系统(computer-assisted sperm analysis system——CASA,Minitube德国),分别检测冷冻-解冻后精子的活力、运动速率包括曲线速率(VCL)、直线速率(VSL)和平均路径速率(VAP)。
1.4.2 精子结构检测将解冻后的精液,加入适量PBS洗涤,1 000 r·min-1离心3 min,弃上清。调整精子密度为120×105 ·mL-1,按照PNA-FITC试剂盒说明操作染色20 min后,洗涤,之后加入10 μL PI染色5 min,洗涤,然后进行精子顶体完整率检测;在上述精子密度下,参考赵娜等[15]检测方法,利用Annaxin V/PI检测精子膜的完整性;在同样精子密度下,用10 μmol·L-1吖啶橙染液避光染色15 min,检测精子DNA的完整性。流式细胞仪(ACEA NovoCyteTM)检测时,采集2万个精子细胞。PNA-FITC/PI染色后,统计Q2-1(PI+-PNA-)和Q2-3(PI--PNA-),为完整顶体的精子比率;Annaxin V/PI染色后,统计Q2-3(PI--Annexin V-)为完整质膜的精子比率;吖啶橙染色后,统计绿色荧光的精子比率。
1.5 精子中ROS和Ca2+的检测将解冻后的精液加入适量PBS洗涤,1 000 r·min-1离心3 min,弃上清,调整精子密度为120×105·mL-1。用ROS检测试剂盒,检测ROS水平,洗涤后的精子加入1 mL不加卵黄和甘油的稀释液,加入10 μmol·L-1 DCFH-DA,37 ℃,5% CO2培养箱避光孵育30 min,每隔5 min轻轻颠倒混匀,之后PBS洗涤3次,PBS重悬,取200 μL进行流式细胞仪检测其荧光值,其中, 荧光强度=荧光值A(DCFH-DA)-荧光值B(细胞自发光),剩余部分用PI染色后荧光显微镜观察。
检测精子细胞中游离Ca2+水平,洗涤后的精子加入PBS悬浮调整浓度为120×105·mL-1,加入5 μmol·L-1 Fluo-3 AM,37 ℃,5%CO2培养箱避光孵育60 min,离心去上清,加入PBS悬浮继续孵育30 min,洗涤两次,PBS重悬,取200 μL用流式细胞仪检测其荧光值,其中,荧光强度=荧光值A(Fluo-3 AM)-荧光值B(细胞自发光),剩余部分用PI染色后荧光显微镜观察。
1.6 ATP、丙酮酸(PA)和乳酸(LA)的检测将解冻后的精子细胞加入PBS进行洗涤,1 000 r·min-1离心3 min,去除上清,收集细胞,加入500 μL ATP提取液,超声破碎后,4 ℃ 12 000 r·min-1离心15 min,取上清液。按照ATP检测试剂盒操作说明,多功能酶标仪检测发光值;解冻的悬浮液离心后收集,按照丙酮酸和乳酸检测试剂盒操作说明,多功能酶标仪检测吸光值;BCA法检测各个样品的总蛋白浓度。
1.7 数据分析采用SAS9.0软件中的ANOVA进行单因素方差分析和显著性检验。数据用“平均值±标准差”表示。用P < 0.05表示差异显著,P < 0.01表示差异极显著。
2 结果 2.1 葡萄糖对绒山羊精子冷冻-解冻后活力和速率的影响稀释液中添加不同浓度的葡萄糖,绒山羊精液冷冻-解冻后精子活力和速率如图 1。在添加56 mmol·L-1浓度条件下,精子活力显著高于其他浓度(P<0.05),0(对照组)、28和84 mmol·L-1组之间没有差异,112 mmol·L-1组活力显著下降(P<0.05)(图 1A);在速率检测中,28、56和84 mmol·L-1组的VCL和VAP都显著高于对照组(P<0.05),VSL无显著差异;而112 mmol·L-1组的精子各项运动速率都显著降低(P<0.05)(图 1B)。
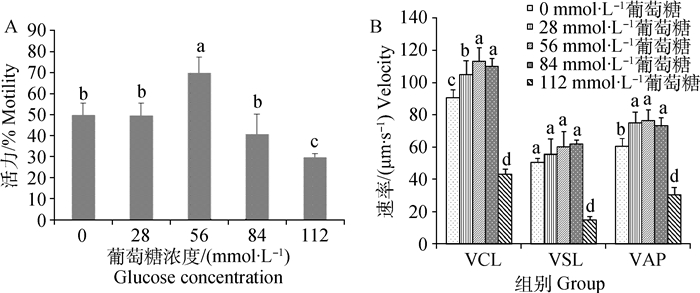
|
上标不同小写字母表示不同浓度组间差异显著,P<0.05。下同 Different superscripts (a, b, c, d) indicated the significant difference among different concentration groups, P < 0.05.The same as below 图 1 绒山羊精子解冻后活力(A)和速率(B) Figure 1 The motility (A) and velocity (B) in frozen-thawed sperm of cashmere goat |
绒山羊精子冷冻-解冻后细胞结构及检测结果见图 2。添加不同浓度葡萄糖检测精子顶体、质膜和DNA完整性(图 2B~D),统计结果如图 2E~G,冷冻-解冻后精子DNA完整性各组无显著性差异(图 2E),而且DNA完整率均达到83%以上。在28、56和84 mmol·L-1组中顶体和质膜完整性均显著高于对照组(P<0.05);112 mmol·L-1组与对照组之间无显著差异(图 2F~G)。
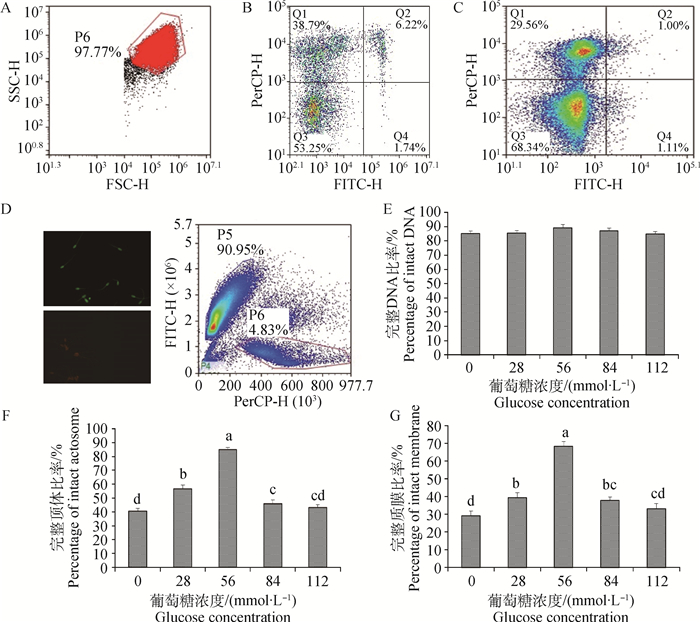
|
A.精子细胞群。B.PNA-FITC/PI荧光染色:Q1.完整顶体、质膜损伤的精子细胞;Q2.顶体损坏、质膜损伤的精子细胞;Q3.完整顶体、质膜完整的精子细胞;Q4.顶体损坏、质膜完整的精子细胞。C.PI/Annexin V-FITC荧光染色:Q1.膜损伤的死亡精子细胞;Q2.膜损坏的死亡精子细胞;Q3.完整膜的活精子细胞;Q4.膜完整的凋亡精子细胞。D.Acridine Orange荧光染色,右图靠近纵轴的是DNA完整的精子细胞群,靠近横轴是DNA断链或解旋的精子细胞;左图是在荧光显微镜下观察,绿色荧光(左上图)为DNA完整,橘色荧光(左下图)是DNA断链或解旋(400×)。E.精子DNA完整性分析;F.顶体完整性分析;G.质膜完整性分析 A. Spermatozoa. B. PNA-FITC/PI fluorescent staining:Q1. Sperm with damaged plasma membrane and intact acrosome; Q2. Sperm damaged plasma membrane and damaged acrosome; Q3. Sperm with intact plasma membrane and intact acrosome; Q4. Sperm with intact plasma membrane and damaged acrosome. C. PI/Annexin V-FITC fluorescent staining: Q1. Dead sperm with a damaged plasma membrane; Q2. Apoptotic sperm with a damaged plasma membrane; Q3. Viable sperm with a intact plasma membrane; Q4. Apoptotic sperm with a intact plasma membrane. D. Acridine Orange fluorescent staining. The right panel shows sperm with a intact DNA close to the vertical axis, sperm with damaged DNA close the horizontal axis. The left panel is observed under a fluorescence microscope, Green fluorescence (upper left) is intact DNA, orange fluorescence (below left) is DNA damaged(400×). E. Statistics of DNA integrity; F.Statistics of acrosome integrity; G. Statistics of membrane integrity. Different superscript indicate the significant difference among different concentration groups, P < 0.05. The same as below 图 2 冷冻解冻后精子的顶体完整性、质膜完整性和DNA完整性分析 Figure 2 Acrosomal integrity, integrity of plasma membrane and DNA integrity of frozen-thawed sperm |
DCFH-DA对冷冻解冻后绒山羊精子中ROS进行特异性染色(图 3a1、b1、c1),PI对死精子进行特异性染色,死精子和活精子均会产生ROS,在活精子的线粒体鞘和头部均检测到强烈的荧光信号。由图 3C可知,在56 mmol·L-1葡萄糖浓度下,精子细胞中ROS水平极显著高于其他组(P<0.01)。Fluo 3-AM对冷冻-解冻后精子Ca2+特异性染色(图 3a2、b2、c2),在精子线粒体鞘和部分精子的顶体检测到强烈的荧光信号。由图 3D可知,在28和56 mmol·L-1葡萄糖浓度下,精子细胞中Ca2+水平极显著低于其他组(P<0.01)。
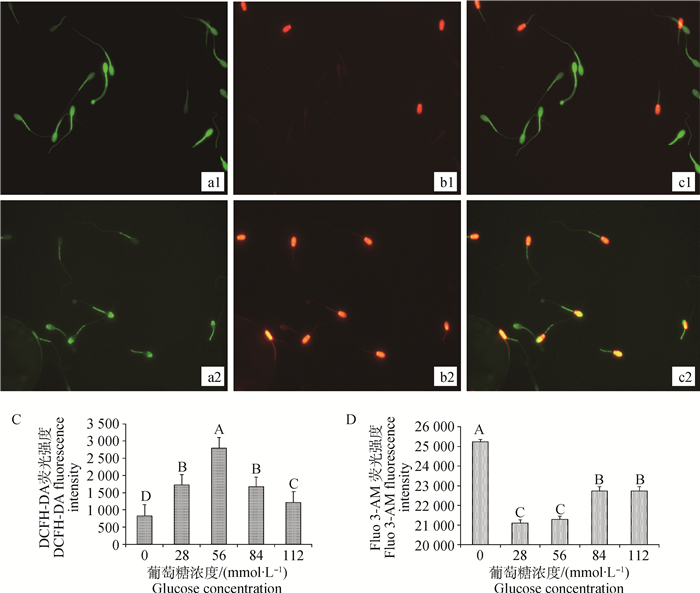
|
a1.DCFH-DA染色;b1.PI荧光染色;c1.a1和b1合并;a2.Fluo 3-AM染色;b2.PI荧光染色;c2.a2和b2合并。a1~c2 400×。C.DCFH-DA荧光信号的检测;D.Fluo 3-AM荧光信号的检测。上标不同大写字母表示不同浓度组间差异极显著,P<0.01。下同 a1. DCFH-DA fluorescent staining; b1. PI fluorescent staining; c1. a1 and b1 merge; a2. Fluo 3-AM fluorescent staining; b2. PI fluorescent staining; c2. a2 and b2 merge. a1-c2 400×. C. The DCFH-DA fluorescence intensity; D.The Fluo 3-AM fluorescence intensity. Different superscript A, B, C, D indicate the extremely significant difference among different concentration groups, P < 0.01.The same as below 图 3 DCFH-DA和Fluo 3-AM荧光染色及荧光强度分析 Figure 3 DCFH-DA and Fluo 3-AM fluorescent staining and fluorescent intensity |
冷冻-解冻后精子细胞中ATP浓度如图 4A所示,与对照组相比,添加葡萄糖后,精子中ATP浓度极显著升高,其中56和84 mmol·L-1组的ATP极显著高于其他组(P<0.01)。精液冷冻-解冻后,精子悬浮液中的丙酮酸浓度见图 4B,结果表明,丙酮酸浓度随着葡萄糖浓度的增加而升高,但112 mmol·L-1组与84 mmol·L-1组相比却显著下降(P<0.05)。
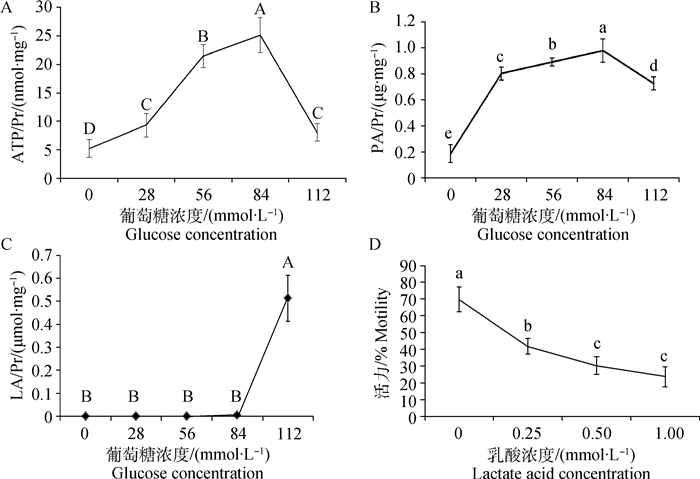
|
Pr.总蛋白 Pr.The total protein 图 4 不同浓度葡萄糖处理后冷冻-解冻精子中ATP(A)和精子悬浮液中丙酮酸(PA)(B)和乳酸(LA)(C)浓度以及乳酸对精子冷冻保存的影响(D) Figure 4 The ATP in sperm, pyruvic acid (PA) and lactic acid (LA) in sperm suspension with different concentrations glucose treatment and effect of lactic acid with different concentrations on the motility of cryopreservated sperm |
精子悬浮液中的乳酸浓度见图 4C,在低浓度葡萄糖组(28和56 mmol·L-1)中未检测到乳酸,而84 mmol·L-1组检测到微量乳酸((0.003±0.001)μmol·mg-1总蛋白),112 mmol·L-1组检测到大量乳酸((0.513±0.102)μmol·mg-1总蛋白)。为了进一步分析乳酸对精液冷冻保存的影响,在含有56 mmol·L-1葡萄糖的稀释液中添加不同浓度的乳酸,精液冷冻-解冻后精子活力结果见图 4D。与对照组相比,添加不同浓度的乳酸后,精子活力均显著下降(P<0.05)。
3 讨论在精子发生过程中,大部分胞质从精子上分离,因此成熟精子缺乏细胞质成分,只能利用精清或环境中的物质进行分解代谢,必要时也可以分解自身的能量物质来获取能量。精子代谢产生的能量,大部分维持其运动能力,剩余部分用于维持正常的生理特性,如维持质膜完整性。当环境中缺乏能量物质时,若不能及时得到补充,精子将会因能量的耗竭而丧失生存能力[16]。
葡萄糖是精子代谢过程可利用的主要底物之一,也是比较适合山羊精子代谢的底物[8-9],本研究中,在冷冻稀释液中添加不同浓度的葡萄糖(0、28、56、84、112 mmol·L-1),发现添加56 mmol·L-1葡萄糖更有利于绒山羊精子的冷冻保存,冷冻-解冻后的精子活力可达到69.79 %。但添加高浓度的葡萄糖(112 mmol·L-1)则不利于绒山羊精子的冷冻保存,冷冻-解冻后的精子活力显著下降。Salamon和Ritar[17]在山羊精子的研究中也表明,精液冷冻效果随着葡萄糖浓度的升高而降低。在Naing等[9]的研究中,在去除精清的条件下,将精子冷冻保存于含有69.38 mmol·L-1葡萄糖的冷冻液中,冷冻-解冻后总活力为60.5 %;而Küçük等[1]的研究中,将精液直接稀释于含有28 mmol·L-1葡萄糖的冷冻液中,解冻后活力为47.50%。说明在不同处理条件下,冷冻稀释液中添加合适浓度葡萄糖对山羊精液的冷冻保存具有重要作用。在速率检测中发现,添加一定浓度的葡萄糖(28~84 mmol·L-1)能够显著提高精子冷冻-解冻后的运动速率,这与人精子的研究结果一致[18]。另外,在冷冻-解冻后精子形态检测中发现,添加葡萄糖能够显著提高精子顶体和膜的完整性。说明葡萄糖在维持冷冻-解冻后山羊精子的活力、速率和细胞结构的完整性具有重要的作用。
对于哺乳动物精子三磷酸腺苷(ATP)的主要来源是糖酵解和线粒体氧化磷酸化(OXPHOS)[19-20]。在糖酵解过程中,葡萄糖进入细胞中经过一系列反应最终生成丙酮酸。丙酮酸可以被转移到细胞外,在乳酸脱氢酶的作用下生成乳酸,也可以进入线粒体进行TCA循环产生大量能量[9, 21]。在本试验中,精液冷冻-解冻后,在一定的葡萄糖浓度(28~84 mmol·L-1),精子悬浮液中丙酮酸随着冷冻稀释液中添加葡萄糖量的增加而增加。但是冷冻稀释液中添加低浓度葡萄糖(0~56 mmol·L-1)的精子悬浮液中未检测到乳酸,而高浓度葡萄糖组(112 mmol·L-1)的精子悬浮液中却存在大量乳酸。这种大量乳酸的存在可能是两方面的原因所致,首先随着葡萄糖浓度的增加,由于糖酵解的作用而使乳酸浓度增加,而且低温环境下,精子代谢主要以糖酵解为主[11];其次,精液解冻后,随着温度的升高,精子运动增强,糖酵解产生的能量不足以维持精子的运动和功能,精子代谢方式逐渐转变为氧化磷酸化为主[22],使糖酵解产物乳酸在乳酸脱氢酶的作用转化为丙酮酸,进入细胞线粒体发生OXPHOS产生更多ATP,以维持精子的正常功能。但是高浓度的葡萄糖使线粒体中Ca2+增加,而Ca2+参与调节线粒体形态和功能,当线粒体中Ca2+过载,将损伤线粒体膜,进而损坏线粒体功能[23]。本研究发现,高浓度葡萄糖组(84~112 mmol·L-1)与低浓度组(28~56 mmol·L-1)相比,精子中游离Ca2+水平显著增加,而且Ca2+主要分布在线粒体鞘和部分精子顶体中。因此,冷冻稀释液中添加高浓度葡萄糖可能通过破坏精子线粒体功能,降低有氧代谢能力,造成精子悬浮液中乳酸的大量积累。在大量乳酸的作用下,使精子周围环境pH改变[24],影响了精子的生存和活力。这一假设也在笔者进一步的试验中得到证实,以含有适合浓度葡萄糖(56 mmol·L-1)的稀释液为基础液,添加不同含量的乳酸,发现冷冻-解冻的精子活力均显著下降。
精子通过糖酵解和OXPHOS提供能量,维持精子的功能[25-26],在此过程中会产生活性氧(ROS)。以及在精子冷冻-解冻过程中,由于环境的改变、抗氧化物酶的缺乏,破坏ROS产生/清除之间的平衡,从而导致氧化应激发生[27]。精子中高水平的ROS会破坏核的结构[28-30],促进细胞凋亡[21]。
本研究,添加葡萄糖能够显著提高ATP的产生,而且在一定剂量范围内,随着浓度的升高,精子细胞产生ATP量逐渐增加。但更高浓度的葡萄糖(112 mmol·L-1)却减少了ATP的产生。另外,添加葡萄糖后,冷冻-解冻精子中ROS水平明显升高,其中添加56 mmol·L-1葡萄糖后,ROS水平极显著升高(P<0.01),特别是在活精子细胞中检测到高水平的ROS(图 3a1~c1)。这也表明适量葡萄糖可以增强精子线粒体的氧化磷酸化过程,在马精子研究中也表明,精子细胞中ROS水平反映了精子线粒体活性的强度[31]。而且本研究,添加56 mmol·L-1葡萄糖后,虽然精子中的ROS水平显著升高,但并没有影响到精子细胞DNA结构的完整性。这可能是由于精清中含有一些抗氧化物酶,能够消除部分活性氧,从而起到保护精子的作用[32]。因此在精液冷冻稀释液中添加适量葡萄糖可以增强线粒体活性,提高精子的代谢能力和抗冻能力。
4 结论本研究结果表明,在绒山羊精液冷冻保存过程中,在精液稀释液中添加一定浓度的葡萄糖能够促进绒山羊精子冷冻-解冻过程中的代谢,提高冷冻保存效果。但过高浓度的葡萄糖会抑制精子代谢,降低冷冻保存效果,这可能是由于大量乳酸积累导致的。
| [1] | KÜÇÜK N, AKSOY M, UÇAN U, et al. Comparison of two different cryopreservation protocols for freezing goat semen[J]. Cryobiology, 2014, 68(3): 327–331. DOI: 10.1016/j.cryobiol.2014.04.009 |
| [2] | MARTIN G, SABIDO O, DURAND P, et al. Cryopreservation induces an apoptosis-like mechanism in bull sperm[J]. Biol Reprod, 2004, 71(1): 28–37. DOI: 10.1095/biolreprod.103.024281 |
| [3] | KONYALI C, TOMÁS C, BLANCH E, et al. Optimizing conditions for treating goat semen with cholesterol-loaded cyclodextrins prior to freezing to improve cryosurvival[J]. Cryobiology, 2013, 67(2): 124–131. DOI: 10.1016/j.cryobiol.2013.06.001 |
| [4] | AISEN E G, MEDINA V H, VENTURINO A. Cryopreservation and post-thawed fertility of ram semen frozen in different trehalose concentrations[J]. Theriogenology, 2002, 57(7): 1801–1808. DOI: 10.1016/S0093-691X(02)00653-2 |
| [5] | SIEME H, OLDENHOF H, WOLKERS W F. Sperm membrane behaviour during cooling and cryopreservation[J]. Reprod Domest Anim, 2015, 50(S3): 20–26. |
| [6] | SHAFIEI M, FOROUZANFAR M, HOSSEINI S M, et al. The effect of superoxide dismutase mimetic and catalase on the quality of postthawed goat semen[J]. Theriogenology, 2015, 83(8): 1321–1327. DOI: 10.1016/j.theriogenology.2015.01.018 |
| [7] | AMIDI F, PAZHOHAN A, SHABANI N M, et al. The role of antioxidants in sperm freezing:a review[J]. Cell Tissue Bank, 2016, 17(4): 745–756. DOI: 10.1007/s10561-016-9566-5 |
| [8] | PURDY P H. A review on goat sperm cryopreservation[J]. Small Rumin Res, 2006, 63(3): 215–225. DOI: 10.1016/j.smallrumres.2005.02.015 |
| [9] | NAING S W, WAHID H, AZAM K M, et al. Effect of sugars on characteristics of Boer goat semen after cryopreservation[J]. Anim Reprod Sci, 2010, 122(1-2): 23–28. DOI: 10.1016/j.anireprosci.2010.06.006 |
| [10] | RODRIGUEZ-GIL J E. Mammalian sperm energy resources management and survival during conservation in refrigeration[J]. Reprod Domest Anim, 2006, 41(S2): 11–20. DOI: 10.1111/rda.2006.41.issue-s2 |
| [11] |
邱建华.山羊精液液态保存过程中精子葡萄糖代谢的研究[D].泰安: 山东农业大学, 2011.
QIU J H.Investigation of goat sperm metabolism during long term liquid storage of goat semen[D]. Taian: Shandong Agricultural University, 2011.(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10434-1011098260.htm |
| [12] | KAMP G, BÜSSELMANN G, LAUTERWEIN J. Spermatozoa:models for studying regulatory aspects of energy metabolism[J]. Experientia, 1996, 52(5): 487–494. DOI: 10.1007/BF01919321 |
| [13] | SCOTT T W, WHITE I G, ANNISON E F. Glucose and acetate metabolism by ram, bull, dog and fowl spermatozoa[J]. Biochem J, 1962, 83(2): 398–404. DOI: 10.1042/bj0830398 |
| [14] | BARBAS J P, MASCARENHAS R D. Cryopreservation of domestic animal sperm cells[J]. Cell Tissue Bank, 2009, 10(1): 49–62. DOI: 10.1007/s10561-008-9081-4 |
| [15] |
赵娜, 甄林青, 胡启蒙, 等. 超低温冷冻过程引起猪精子产生"似凋亡"变化[J]. 畜牧兽医学报, 2013, 44(11): 1766–1774.
ZHAO N, ZHEN L Q, HU Q M, et al. Cryopreservation procedure induces the alterations of "apoptosis-like" of boar sperm[J]. Acta Veterinaria et Zootechnica Sinica, 2013, 44(11): 1766–1774. (in Chinese) |
| [16] |
朱士恩.
家畜繁殖学[M]. 5版. 北京: 中国农业出版社, 2011.
ZHU S E. Reproduction in farm animals[M]. 5th ed. Beijing: China Agriculture Press, 2011. (in Chinese) |
| [17] | SALAMON S, RITAR A J. Deep freezing of Angora goat semen:effects of diluent composition and method and rate of dilution on survival of spermatozoa[J]. Aust J Biol Sci, 1982, 35(3): 295–303. |
| [18] | WILLIAMS A C, FORD W C L. The role of glucose in supporting motility and capacitation in human spermatozoa[J]. J Androl, 2011, 22(4): 680–695. |
| [19] | DU PLESSIS S S, AGARWAL A, MOHANTY G, et al. Oxidative phosphorylation versus glycolysis:what fuel do spermatozoa use?[J]. Asian J Androl, 2015, 17(2): 230–235. DOI: 10.4103/1008-682X.135123 |
| [20] | FERRAMOSCA A, ZARA V. Bioenergetics of mammalian sperm capacitation[J]. Biomed Res Int, 2014, 2014: 902953. |
| [21] | RAMIÓ-LLUCH L, YESTE M, FERNÁNDEZ-NOVELL J M, et al. Oligomycin A-induced inhibition of mitochondrial ATP-synthase activity suppresses boar sperm motility and in vitro capacitation achievement without modifying overall sperm energy levels[J]. Reprod Fertil Dev, 2014, 26(6): 883–897. |
| [22] | LOSANO J D A, ANGRIMANI D S R, DALMAZZO A, et al. Effect of mitochondrial uncoupling and glycolysis inhibition on ram sperm functionality[J]. Reprod Domest Anim, 2017, 52(2): 289–297. DOI: 10.1111/rda.12901 |
| [23] | GALLOWAY C A, YOON Y. Perspectives on:SGP symposium on mitochondrial physiology and medicine:what comes first, misshape or dysfunction?The view from metabolic excess[J]. J Gen Physiol, 2012, 139(6): 455–463. DOI: 10.1085/jgp.201210771 |
| [24] | MATSUZAKI M, MIZUSHIMA S, HIYAMA G, et al. Lactic acid is a sperm motility inactivation factor in the sperm storage tubules[J]. Sci Rep, 2015, 5: 17643. DOI: 10.1038/srep17643 |
| [25] | ST JOHN J C, BOWLES E J, AMARAL A. Sperm mitochondria and fertilisation[J]. Soc Reprod Fertil Suppl, 2007, 65: 399–416. |
| [26] | NASCIMENTO J M, SHI L Z, TAM J, et al. Comparison of glycolysis and oxidative phosphorylation as energy sources for mammalian sperm motility, using the combination of fluorescence imaging, laser tweezers, and real-time automated tracking and trapping[J]. J Cell Physiol, 2008, 217(3): 745–751. DOI: 10.1002/jcp.v217:3 |
| [27] | GIBB Z, AITKEN R J. The impact of sperm metabolism during in vitro storage:the stallion as a model[J]. Biomed Res Int, 2016, 2016: 9380609. |
| [28] | THOMSON L K, FLEMING S D, AITKEN R J, et al. Cryopreservation-induced human sperm DNA damage is predominantly mediated by oxidative stress rather than apoptosis[J]. Hum Reprod, 2009, 24(9): 2061–2070. DOI: 10.1093/humrep/dep214 |
| [29] | AITKEN R J. Reactive oxygen species as mediators of sperm capacitation and pathological damage[J]. Mol Reprod Dev, 2017, 84(10): 1039–1052. DOI: 10.1002/mrd.22871 |
| [30] | ZHU Z D, FAN X T, LV Y H, et al. Vitamin E analogue improves rabbit sperm quality during the process of cryopreservation through its antioxidative action[J]. PLoS One, 2015, 10(12): e0145383. DOI: 10.1371/journal.pone.0145383 |
| [31] | DAVILA M P, MUÑOZ P M, TAPIA J A, et al. Inhibition of mitochondrial complex I leads to decreased motility and membrane integrity related to increased hydrogen peroxide and reduced ATP production, while the inhibition of glycolysis has less impact on sperm motility[J]. PLoS One, 2015, 10(9): e0138777. DOI: 10.1371/journal.pone.0138777 |
| [32] | POTTS R J, NOTARIANNI L J, JEFFERIES T M, et al. Seminal plasma reduces exogenous oxidative damage to human sperm, determined by the measurement of DNA strand breaks and lipid peroxidation[J]. Mutat Res, 2000, 447(2): 249–256. DOI: 10.1016/S0027-5107(99)00215-8 |



