2. 中国农业科学院上海兽医研究所农业部动物寄生虫学重点开放实验室,上海 200241;
3. 上海师范大学生命与环境科学学院,上海 200233
2. Key Laboratory of Animal Parasitology of Ministry of Agriculture, Shanghai Veterinary Research Institute, Chinese Academy of Agricultural Sciences, Shanghai 200241, China;
3. College of Life and Environmental Sciences, Shanghai Normal University, Shanghai 200233, China
ELAV-like(embryonic lethal abnormal vision like)蛋白家族是一类mRNA结合蛋白,含有3个高度保守的RNA识别基序(RRM),存在于多种生物体中,对神经系统的发育和功能维持起重要作用,且多项研究表明,RRM RNA结合蛋白在细胞代谢过程中起重要作用,在人和其他多种生物中其表达量变化或突变会引起发育异常或导致神经性自身免疫病的发生[1-4]。ELAV在果蝇中首次克隆获得,因其表达改变致果蝇视神经发育异常并于胚胎期死亡而得名[5-6]。ELAV-like蛋白家族有ELAV-like 1、ELAV-like 2、ELAV-like 3和ELAV-like 4四个成员,其中ELAV-like 1在各组织广泛表达,ELAV-like 3和ELAV-like 4作为自身抗原在多系统神经障碍肿瘤性脑病中被发现[7-8],ELAV-like 2蛋白不仅在多种物种的神经系统表达,在小鼠的生殖腺及非洲爪蟾的睾丸、卵巢和早期胚胎中也有特异性表达[9-12],且研究表明,小鼠在卵母细胞生长期间,ELAV-like 2过早降低会导致成熟卵母细胞减数分裂效益低下[13-14]。
血吸虫雌雄异体,只有与雄虫合抱方能引发雌虫的性成熟和产卵,成熟雌虫所产虫卵沉积于肝,造成宿主的病理损害,排出体外造成疾病再传播。单性感染的雌虫生长缓慢,处于生殖系统发育阻遏状态,卵黄腺和卵巢不能发育成熟、不能正常产卵;而经两性感染达到性成熟的雌虫一旦与合抱雄虫分开,虫体也会逐渐变小,性器官退化,回到发育不完善的发育阻遏状态[15-17],这表明从控制雌虫的生殖发育入手控制血吸虫病传播与发生有着重要的理论意义。本实验室前期分析正常发育雌虫与发育阻遏雌虫转录组表达差异时发现一条在发育阻遏雌虫中高表达的基因,序列分析发现其编码的氨基酸序列与ELAV-like 2同源,是一种mRNA结合蛋白,与果蝇的Sex-lethal(Sxl)蛋白也有一定的同源性,同属于RRM RNA结合蛋白[18-20]。而Sxl是果蝇性别发育决定的调节开关,与果蝇的性别决定和维持有很大的关系[21]。且ELAV-like 2与Sxl基因表达转录后的调控机制及其相似[22],由此可推测,SjELAV-like 2在血吸虫的生长发育中应也有同样重要的功能。
本研究在前期基础上通过5′-RACE和3′-RACE获得了SjELAV-like 2基因的全长,克隆表达了该基因,分析了该基因在感染后不同时间、不同性别及不同状态血吸虫体内的表达情况,对该蛋白在血吸虫成虫雌虫体内的分布进行了定位,并利用RNA干扰(RNAi)技术对该基因功能进行了初步研究,为进一步研究该基因的生物学功能及其作用机制奠定了基础。
1 材料与方法 1.1 材料 1.1.1 虫株与实验动物日本血吸虫中国大陆株尾蚴由中国农业科学院上海兽医研究所血吸虫病研究室提供;BALB/c小鼠(6周龄,雄性),购于上海斯莱克实验动物有限责任公司。
1.1.2 主要试剂与仪器Ex Taq HS、dNTP (2.5 mmol·L-1)、PrimeScriptRT reagent Kit with gDNA Eraser、SYBR premix Ex TaqTM试剂盒、pGEM T-easy载体、SMARTer® RACE 5′/3′Kit、限制性内切酶BamHⅠ、HindⅢ、T4 DNA Ligase均购于TaKaRa公司;Trizol、弗氏完全佐剂、弗氏不完全佐剂购于Sigma公司;核酸回收试剂盒、质粒小量抽提试剂盒、增强型HRP-DAB底物显色液、HRP标记山羊抗小鼠IgG均购于北京天根生化科技有限公司;硝酸纤维素膜(Whatman)购于北京经科宏达生物技术有限公司;大肠杆菌感受态细胞BL21(DE3)、DH5α购于上海翊圣生物科技有限公司;pET28a、IPTG由本实验室保存;PCR引物合成及测序由上海英骏生物科技有限公司完成;dsRNA由上海吉玛制药技术公司合成。
PCR仪(DNA Thermal Cycler480,美国PERKIN ELMER);凝胶成像分析仪(ImageQuant 300,美国GE);超声波细胞破碎仪(VCX-130,美国SONICS);ABi 7500实时荧光定量PCR仪(美国ABi);高压蒸汽灭菌锅(MLS-3780,美国Thermo Scientific);扫描电镜(JSM-6380LV,日本);恒温振荡器(SYK-2012C,上海苏坤);光学显微镜(Eclipse80)。
1.2 方法 1.2.1 实验动物感染采用腹部贴片法感染6周龄雄性BALB/c小鼠,分别于感染7、14、18、21、25、28、35、42 d后剖杀,以肝门静脉灌注法收集虫体;并分别收集18、21、25、28、35、42 d曾合抱的雌虫和雄虫,同时收集单性感染而来的25 d发育阻遏雌虫与两性感染而来的曾与雄虫合抱的25 d正常发育雌虫,液氮冻存备用。所有动物实验遵循中国农业科学院上海兽医研究所动物保护和使用委员会批准的动物使用协议,批准号为SYXK(沪)2016-0010。
1.2.2 SjELAV-like 2基因的获得和序列分析根据前期发现的SjELAV-like 2基因的部分序列(GenBank登录号为FN330875.1),利用Primer 5.0设计5′-RACE和3′-RACE引物。5′-RACE引物:GSP1(5′-ATCCGTGACCGCAACAGTGGA-3′),GSP2(5′-CAACATCGATTACGGATGC-3′);3′-RACE引物:GSP3(5′-TGACAAAGTCGCCCTTGCAG-3′),GSP4(5′-CGCGTCCAAACTGTCCGAA-3′)。TRIzol®法抽提日本血吸虫总RNA,分光光度计进行浓度测定;采用Fermentas RevertAid TM First Strand cDNA Synthesis Kit反转录为cDNA,以其为模板,根据SMARTer® RACE 5′/3′Kit说明书进行5′和3′末端的扩增,将扩增产物回收连接到pGEM T-easy载体,转化至大肠杆菌DH5α中,挑选单克隆扩大培养,抽提质粒送上海英骏生物科技有限公司测序。通过BLAST搜索到ELAV-like 2基因在埃及血吸虫(Schistosoma haematobium,XP 012796928.1)、曼氏血吸虫(Schistosoma mansoni,XP 018649930.1)和人类(Humans,BAD92531.1)的同源基因序列,利用DNAMAN软件进行序列多重比对分析。
1.2.3 SjELAV-like 2基因的克隆和表达根据上面获得的基因序列设计引物,以日本血吸虫成虫cDNA为模板,进行PCR扩增。上游引物(5′-CGCGGATCCACTGCAGAAATGGTTGTATATC-3′,下划线处为BamHⅠ酶切位点),下游引物(5′-GGGAAGCTTTAACCTTGACATAGTTTGTACG-3′,下划线为HindⅢ酶切位点)。分别用BamHⅠ和HindⅢ对PCR产物及pET28a双酶切并用T4 DNA Ligase连接转化到大肠杆菌BL21(DE3)感受态细胞,阳性克隆采用菌液PCR鉴定和序列测序鉴定。将测序正确的重组克隆pET28-SjELAV-like 2接种于LB培养基,37 ℃、250 r·min-1振荡培养,OD600 nm达0.6~0.8 h,加入IPTG至终浓度1 mmol·L-1诱导表达,并用质谱鉴定所表达特异条带(质谱鉴定由上海厚基生物科技有限公司完成)。为确定最佳诱导时间,在IPTG诱导0、1、2、3、4、6和8 h时收集菌液。同时以SDS-PAGE凝胶电泳分析经超声波裂解后的菌体蛋白,判定其表达状况。将以包涵体形式存在的重组蛋白(rSjELAV-like 2)溶解于8 mol·L-1尿素。
1.2.4 感染后不同时间血吸虫体内SjELAV-like 2基因的扩增以18、25、28、35、42 d血吸虫虫体cDNA为模板,扩增SjELAV-like 2全长ORF的上、下游引物进行PCR,PCR反应条件为95 ℃预变性3 min;然后94 ℃ 30 s+59 ℃ 55 s+72 ℃ 45 s,共30个循环;循环结束后72 ℃延伸10 min。将PCR产物连接到T-克隆载体中,转化DH5α菌株,阳性克隆进行测序分析。
1.2.5 rSjELAV-like 2的纯化取500 μL上文中“1.2.3”制备的溶解于8 mol·L-1尿素的重组蛋白,不插样品梳直接上样,按照常规方法进行SDS-PAGE。电泳毕,将卸下的胶放入一干净平皿中,用适量的0.3 mol·L-1 KCl溶液染色5 min后,切下染成银白色的目的条带,加入液氮研磨,将碾碎的粉末置于2 mL EP管中加入适量6 mol·L-1尿素37 ℃水浴1~2 h,然后12 000 r·min-1离心1 h,取上清。SDS-PAGE凝胶电泳验证纯化的重组蛋白。
1.2.6 rSjELAV-like 2重组蛋白多克隆抗体的制备及Western blotting检测在纯化的重组蛋白中加入佐剂(首免采用弗氏完全佐剂,加强免疫采用弗氏不完全佐剂),采用皮下注射方法每只小鼠注射50 μg rSjELAV-like 2,每隔两周免疫一次,共免疫三次。在第三次免疫后一周,对小鼠眼眶静脉采血,制备抗rSjELAV-like 2的特异性血清。提取全虫蛋白经SDS-PAGE凝胶电泳,转移到硝酸纤维素(NC)膜上,用抗rSjELAV-like 2血清作一抗,辣根过氧化物酶标记的山羊抗小鼠IgG为二抗,以沉淀性DAB显色液作为底物进行显色。
1.2.7 间接免疫组化间接免疫组化步骤[23]简述如下:将石蜡切片(8 μm)脱蜡水化,切片置于枸橼酸中加热煮沸修复,冷却至室温后加3% H2O2室温封闭15 min去除内源性过氧化物酶,以小鼠抗rSjELAV-like 2特异性血清为一抗,未处理正常小鼠血清作对照(抗体1:100稀释),4 ℃过夜,37 ℃复温45 min,滴加HRP标记的山羊抗鼠IgG二抗(1:1 000稀释)37 ℃孵育20 min,DAB显色,Harris苏木素,封片,镜检。
1.2.8 荧光实时定量RT-PCR检测分别提取感染后不同时间、不同性别及不同状态血吸虫虫体总RNA,按照PrimeScriptTM RT reagent Kit说明书反转录为cDNA;按照SYBR® Premix Ex TaqTMⅡ说明书,采用荧光染料法进行RT-qPCR。扩增SjELAV-like 2的引物:上游引物(5′-CATCAGTCGGCACCATC-3′),下游引物(5′-TCGCCCTTGCAGTTTAG-3′),扩增基因片段长度为182 bp,引物使用浓度为10 pmol。扩增Tublin引物:上游引物(5′-ACCTCAACAACCACCACC-3′),下游引物(5′-TTGCGGCTTCTGCTCTTC-3′),扩增基因片段长度为234 bp,引物使用浓度为10 pmol,每个反应均做3孔重复。应用Applied Biosystems 7500软件进行计算分析,以日本血吸虫Tublin基因作为内参,得出相对于每百万持家基因的目的基因含量。
1.2.9 RNAi试验 1.2.9.1 siRNA的筛选根据SjELAV-like 2基因序列,设计三对siRNA及一对无关对照siRNA(NC),由上海吉玛制药技术有限公司合成(表 1)。15只BALB/c小鼠,分为5组,S1、S2、S3、PBS和NC组,按“1.2.1 ”的方法感染小鼠,于感染后22 d尾静脉注射1 OD S1、S2、S3、NC或等体积的PBS。48 h后剖杀小鼠,肝门静脉灌注法收集虫体,提取各组虫体总RNA,反转录为cDNA,以此为模板,利用RT-qPCR检测受干扰虫体SjELAV-like 2基因的表达情况,并据此判断干扰效果[24]。
|
|
表 1 小干扰RNA序列 Table 1 The sequences of small interfering RNA |
12只BALB/c小鼠,分为3组,每组4只小鼠。于感染后第4天,选择干扰效果最佳的siRNA,小鼠尾静脉注射siRNA、PBS或NC, 每4 d干扰一次,共干扰10次,42 d时收集虫体并计数,RT-qPCR检测干扰效果。
1.2.9.3 肝虫卵计数收集肝并称重,加入PBS匀浆机混匀后,定容至20 mL,取1 mL肝匀浆液,加入等体积10% NaOH,56 ℃水浴锅中消化2 h,消化完全后混匀取50 μL样品,镜检计数虫卵,重复三次,计算减卵率。
减卵率=(1-试验组卵胚数目/对照组卵胚数目)×100%。
1.2.9.4 毛蚴计数取4 mL肝匀浆液于细颈平底烧瓶中,加入去氯水,并用一薄层棉花覆盖在液面下5 cm处,28 ℃孵化6 h后收集棉花上层清液,转移至15 mL离心管中,加入50 μL碘酊染液固定毛蚴,4 000×g离心5 min,吸去上清,定容至2 mL,混匀后取100 μL样品,镜检计数毛蚴,重复三次,计算减孵化率。
减孵化率=(对照组平均孵化率-处理组平均孵化率)/对照组平均孵化率×100%。
1.2.9.5 扫描电镜(SEM)观察将长期干扰试验中收集的虫体用PBS洗涤后,4 ℃置于4%戊二醛中固定24 h。固定好的样品经0.1 mol·L-1 PBS漂洗6次(5 min·次-1),0.5%锇酸室温固定1 h,30%、50%、70%、80%、90%、95%乙醇分别脱水20 min,100%乙醇脱水2次(20 min·次-1),真空干燥,离子溅射仪喷金后,使用JEOJ ISM-6380LV扫描电镜观察并拍照[25]。
1.2.10 统计学分析利用GraphPad Prism 5 software(GraphPad software Inc,CA)进行数据分析,试验组与对照组的差异性分析用t-test进行检验;P-values小于等于0.01或0.001分别视为差异显著和极显著。
2 结果 2.1 SjELAV-like 2基因序列全长的获得及序列分析利用RACE技术对已知的部分血吸虫SjELAV-like 2基因片段进行5′和3′末端扩增,将产物测序后拼接获得序列全长并提交到GenBank,登录号为MG515726。该基因长度为1 894 bp,其开放阅读框长度为1 635 bp,共编码544个氨基酸,所编码蛋白分子量大小为60.3 ku。将其与埃及血吸虫、曼氏血吸虫和人的ELAV-like 2基因进行对比(图 1),其氨基酸序列的同源性分别为82%、88%和37%。

|
SjELAV-like 2与埃及血吸虫、曼氏血吸虫和人类ELAV-like 2氨基酸序列比对,ELAV-like 2序列之间的相似性以颜色显示 DANMAN alignment of the derived amino acid sequences of ShELAV-like 2, SmELAV-like and HsELAV-like 2, the regions with high identity and similarity between ELAV-like 2 sequences are shown in colors 图 1 SjELAV-like 2蛋白序列比对分析 Figure 1 The comparision analysis of the protein sequence of SjELAV-like 2 |
以日本血吸虫成虫cDNA为模板,PCR扩增获得含完整开放阅读框的编码区,构建重组表达质粒pET28-SjELAV-like 2,并在大肠杆菌BL21(DE3)中成功表达融合蛋白rSjELAV-like 2(融合蛋白经质谱鉴定无误),其相对分子质量大小与预期结果相符,合并His-tag后相对分子质量为64.2 ku(图 2);IPTG诱导4 h时表达量达最高,且以包涵体形式存在(图 2)。经纯化后,得到条带单一的rSjELAV-like 2目的蛋白(图 3)。
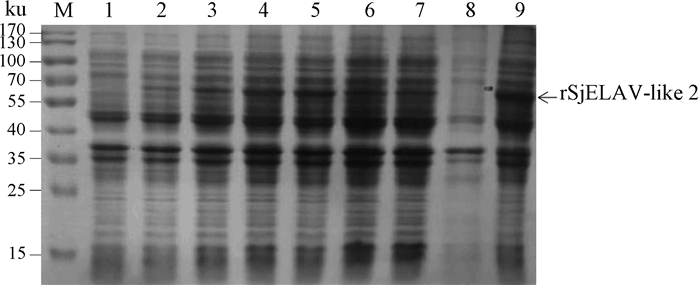
|
M.蛋白质相对分子质量标准;1~7.IPTG分别诱导时间0、1、2、3、4、6、8 h;8. pET28-SjELAV-like 2诱导上清;9. pET28-SjELAV-like 2诱导包涵体 M. Protein molecular marker; 1-7.Recombinant protein induced by IPTG with time 0, 1, 2, 3, 4, 6, 8 h; 8. Supernatant of induced pET28-SjELAV-like 2;9. Inclusion bobies of induced pET28-SjELAV-like 2 图 2 重组蛋白rSjELAV-like 2的SDS-PAGE检测 Figure 2 Detection of recombinant protein rSjELAV-like 2 by SDS-PAGE |
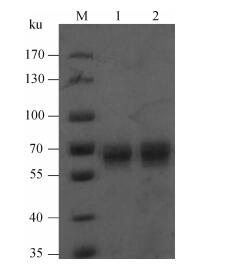
|
M.蛋白质相对分子质量标准;1. 10 μL纯化产物;2. 20 μL纯化产物 M. Protein molecular marker; 1. 10 μL purified rSjELAV-like 2 protein; 2. 20 μL purified rSjELAV-like 2 protein 图 3 rSjELAV-like 2重组蛋白的纯化产物 Figure 3 SDS-PAGE analysis of purified rSjELAV-like 2 |
以感染后18、25、28、35、42 d日本血吸虫cDNA为模板,PCR扩增SjELAV-like 2基因,电泳结果显示不同时间段cDNA扩增产物大小相同(图 4),将PCR产物连接到T-克隆载体,对阳性克隆的测序分析也说明不同时间段cDNA扩增的SjELAV-like 2基因产物相同,表明该基因在血吸虫体内转录时剪切方式一致。

|
M. DNA相对分子质量标准;1~5.分别以18、25、28、35、42 d血吸虫虫体cDNA为模板的SjELAV-like 2基因扩增产物 M. DL2000 DNA marker; 1-5. Products of SjELAV-like 2 gene amplification with 18, 25, 28, 35, 42 d Schistosoma japonicum cDNA as template 图 4 感染后不同时间血吸虫SjELAV-like 2基因的PCR扩增 Figure 4 Amplification of SjELAV-like 2 gene by PCR in Schistosoma japonicum at different days after infection |
用纯化后的rSjELAV-like 2重组蛋白免疫小鼠获得小鼠抗rSjELAV-like 2的特异性血清。将日本血吸虫全虫可溶性抗原经SDS-PAGE凝胶电泳分离,经电转移至NC膜上,用小鼠抗rSjELAV-like 2蛋白的特异性血清作为一抗进行Western blotting检测,结果有三条条带,条带a、c在Marker和空白孔均存在,特异性条带b仅存在于样品孔(图 5)。将三条条带对应位置的蛋白胶条进行LC-MSMS(Q-excative Orbitraq, Thermo)质谱检测,结果表明仅特异性条带b对应位置胶条可以检测到目的蛋白(质谱检测mascot查库得分23.24),在Marker孔、样品孔和空白孔出现非特异性条带a、c可能是由于制备特异性血清的rSjELAV-like 2蛋白抗原由切胶法纯化而来,其中可能含有某些可刺激产生抗体的物质。Western blotting结果表明SjELAV-like 2具有良好的反应原性。
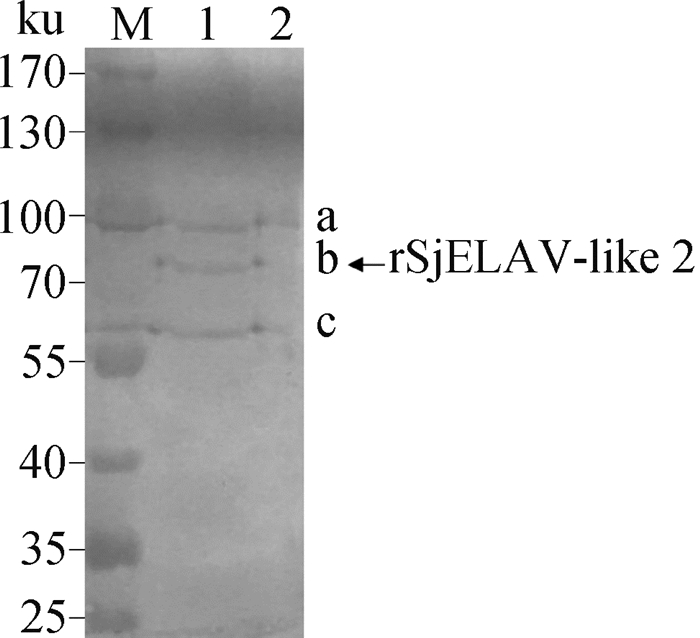
|
M.蛋白质相对分子质量标准;1.日本血吸虫全虫蛋白;2.空白对照 M. Molecular mass marker; 1. Soluble protein of Schistosoma japonicum; 2. Blank control 图 5 小鼠抗rSjELAV-like 2多抗与全虫蛋白的Western blotting分析 Figure 5 Western blotting analysis of anti-rSjELAV-like 2 polyclonal antibody |
利用免疫组化的方法,以小鼠抗rSjELAV-like 2特异性血清为一抗,未感染血吸虫的小鼠阴性血清作为对照,定位SjELAV-like 2在血吸虫成虫雌虫体内的表达,光学显微镜检测显示其在日本血吸成虫雌虫体被成簇状排列,体内结构中散在分布(图 6)。
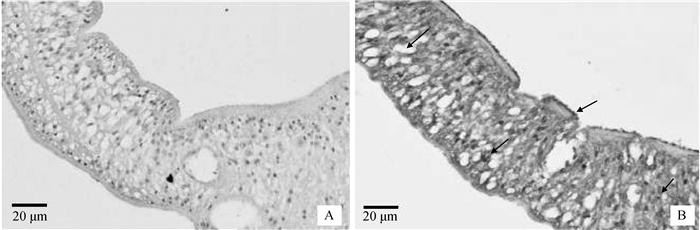
|
A.阴性血清为一抗;B.抗rSjELAV-like 2血清为一抗 A. Negative serum as primary antibody; B.Anti-rSjELAV-like 2 serum as primary antibody 图 6 免疫组化分析SjELAV-like 2蛋白在日本血吸虫成虫雌虫体内分布情况400× Figure 6 Immunohistochemical analysis of SjELAV-like 2 protein in vivo in adult females distribution of Schistosoma japonicum 400× |
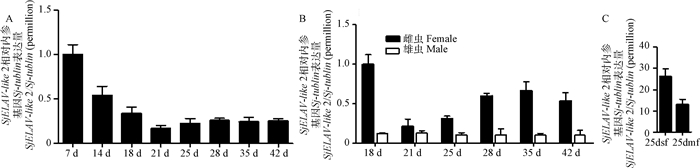
RT-qPCR分析结果表明,SjELAV-like 2基因在日本血吸虫童虫中表达较高,其中以7 d童虫表达量最高,之后逐渐下降,虫体成熟后表达量趋于平稳(图 7A);通过分析其在合抱雌、雄虫中的表达情况发现,SjELAV-like 2在合抱雌虫的表达量均显著高于同时期合抱雄虫,其在检测的不同时期的合抱雄虫中的表达量基本一致(图 7B),说明其期别表达差异(图 7A)应主要来自雌虫。我们也分析了SjELAV-like 2在单性感染而来的25 d发育阻遏雌虫与两性感染而来的曾与雄虫合抱的25 d正常发育雌虫中表达差异(图 7C),结果表明其在单性感染而来的雌虫中高表达,这验证了本实验室前期转录组研究结果。
|
A. SjELAV-like 2在血吸虫感染后不同时间虫体的表达情况;B. SjELAV-like 2在血吸虫不同性别虫体的表达情况;C. SjELAV-like 2在血吸虫不同状态雌虫的表达情况;7 d、14 d、18 d、21 d、25 d、28 d、35 d、42 d表示在感染不同时期收集的虫体;25 dsf.单性感染而来的25 d发育阻遏雌虫;25 dmf.两性感染而来的曾与雄虫合抱的25 d正常发育雌虫 A. Expression of SjELAV-like 2 at different days after infection of schistosoma japonicum; B. Expression of SjELAV-like 2 in different genders of Schistosoma japonicum; C. Expression of SjELAV-like 2 in different states of schistosoma females; 7 d, 14 d, 18 d, 21 d, 25 d, 28 d, 35 d, 42 d mean the parasites collected at different periods after infection; 25 dsf. 25 days under develop female worms from single-sex cercariae infected; 25 dmf. 25 days normal developed female worms from double-sex cercariae infected 图 7 Real-time PCR分析SjELAV-like 2在血吸虫表达情况 Figure 7 Real-time PCR analysis the expression of SjELAV-like 2 in schistosoma japonicum |
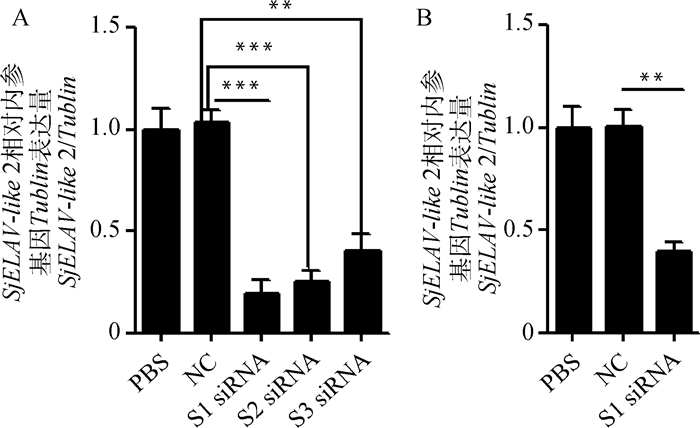
收集SjELAV-like 2 siRNA S1、S2、S3干扰组,NC无关对照组及PBS空白对照组虫体,提取RNA,并反转录为cDNA,利用RT-qPCR检测分析siRNA S1、S2、S3对SjELAV-like 2基因表达水平的干扰效果。结果显示S1、S2、S3 siRNA均在一定程度上干扰了SjELAV-like 2的表达,其中S1 siRNA的干扰效果最好,达79.1%(P=0.000 8)(图 8A)。选取S1 siRNA进行体内长期干扰试验,从感染后第4天开始,每4 d干扰一次,共干扰10次,42 d时收集虫体,利用RT-qPCR检测干扰效果发现,干扰组与NC组相比,SjELAV-like 2基因的表达下降达60%(P=0.006)(图 8B)。与NC组相比,干扰组减虫率达28.57%(P=0.005),小鼠肝减卵率达39.67%(P=0.006),每只雌虫肝虫卵负荷的贡献率下降17.74%(P=0.008),虫卵减孵化率达75.56%(P=0.004)(表 2)。
|
A.最佳干扰效果siRNA筛选;B. S1siRNA体内长期干扰;**. P < 0.01,***. P < 0.001 A. Selection of siRNA with the best interference effect; B. Long-term interference by S1si RNA in vivo; **. P < 0.01, ***. P < 0.001 图 8 RT-qPCR检测干扰效果 Figure 8 Interference effects were detected by RT-qPCR |
|
|
表 2 siRNA干扰效果评估(x±s) Table 2 Value of siRNA interference effect (x±s) |
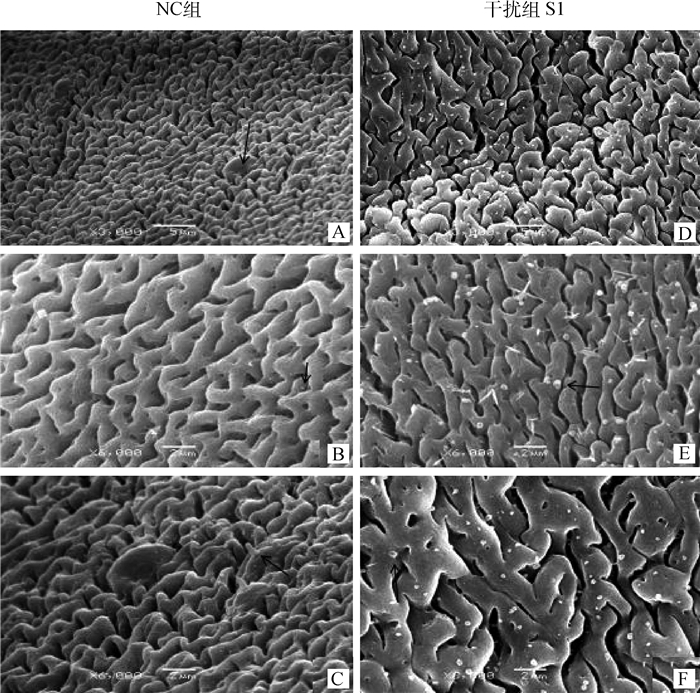
利用扫描电镜观察S1 siRNA干扰组虫体和NC组虫体的体被形态变化情况,结果发现,与NC组相比,SjELAV-like 2干扰组虫体体被不同部位出现大量泡状突出物(图 9)。
|
A~C.日本血吸虫正常状态下体被表膜形态(箭头所示:A.光面乳突;B.泡状突出物;C.有蒂乳突);D~F. SjELAV-like 2 siRNA干扰组虫体表膜形态(箭头所示:E、F.泡状突出物);放大倍数:A、D 3 000×,B、C、E、F 6 000× A-C. Morphology of Schistosoma japonicum in the control group (arrows indicate: A. Smooth mastoid; B. Vesicular protrusions; C. Pedicle mastoid process); D-F. Morphology of Schistosoma japonicum treated with SjELAV-like 2 siRNA (arrows indicate: E, F. Vesicular protrusions); Magnification: A, D 3 000×, B, C, E, F 6 000× 图 9 扫描电镜观察RNA干扰后虫体体被 Figure 9 SEM analysis of worms tegument after RNAi |
血吸虫病是由血吸虫感染引起的,严重危害人畜健康和经济发展的重大寄生虫病,至今仍是一个需要重视的公共卫生问题[26]。目前对于血吸虫病的治疗主要应用化学药物,如吡喹酮,虽然药物对感染血吸虫的个体有治疗效果,但是药物治疗不能解决重复感染问题,也不能起到预防的目的[27]。血吸虫成熟雌虫所产虫卵是造成宿主主要病理损害和疾病再传播的根源,针对虫卵在病理损害和疾病再传播方面的关键作用,从控制血吸虫生殖发育,防止血吸虫产卵入手,将为研制高效抗血吸虫生长发育疫苗和药物提供新思路。
本研究通过5′-RACE和3′-RACE获得了在发育阻遏雌虫高表达的SjELAV-like 2基因序列全长,并在原核系统中克隆和表达了该基因。反应原性分析时发现该天然蛋白的相对分子质量大于理论相对分子质量,根据对感染后不同时间血吸虫SjELAV-like 2基因的扩增及测序分析,我们认为其不存在转录时外显子的不同剪接模式,因此,出现这种情况可能是翻译后修饰的结果。
日本血吸虫在生长发育到第15、16天时开始合抱,第18天时合抱基本完成,合抱对雌虫发育是非常重要的阶段,合抱后雌虫进入正常生殖发育。本研究发现,SjELAV-like 2在日本血吸虫各个阶段均有表达,在7 d时表达量最高,之后逐渐降低,虫体成熟后表达量达到稳定状态;分析该基因在雌、雄虫体中的表达情况时发现,SjELAV-like 2在不同时间合抱雌虫体内的表达量均显著高于同时期合抱雄虫,且在18 d时表达量最高,18~21 d表达量明显降低,之后其在雌虫体内的表达保持在相对稳定的水平。分析其在感染后25 d正常发育雌虫与发育阻遏雌虫表达情况时发现其在发育阻遏雌虫的表达高于正常发育雌虫,这也验证了我们转录组分析的结果(未发表资料)。通过以上分析我们有理由认为SjELAV-like 2在期别分析中7和14 d时的高表达也主要来源于雌虫。鉴于SjELAV-like 2在血吸虫感染后不同时间、不同状态及不同性别的表达情况,我们认为该基因及其产物对血吸虫雌虫的生殖发育有重要的影响,它的存在可能会抑制雌虫的发育进程。令人遗憾的是,免疫组化试验并未鉴定到该蛋白在血吸虫生殖系统的特异表达,这可能与采用的切片来自于成熟时期虫体有关,也可能该基因及其产物是血吸虫雌虫生殖发育的调控因子,而不是血吸虫雌虫生殖发育调控的结果。
RNAi是利用与靶基因序列同源的双链RNA引发生物体内的序列特异性基因转录后沉默,从而引起靶基因表达抑制的现象,因其特异性和高效性,被广泛应用于基因功能的分析[28]。本研究利用RNAi技术对SjELAV-like 2基因功能进行了初步研究,筛选出了干扰效果良好的S1 siRNA,进行了体内长期RNAi试验。RT-qPCR检测发现,干扰后SjELAV-like 2的表达显著降低,且干扰后肝减卵率和卵胚孵化率均显著降低,初步说明该基因对日本血吸虫的生殖发育有重要影响。
通过扫描电镜观察发现,与NC组相比,SjELAV-like 2干扰组虫体体被不同部位出现大量泡状突出物。血吸虫体被由一层合胞体细胞组成,血吸虫不仅可通过体被吸收葡萄糖、脂类、氨基酸等营养物质,体被外质膜的更新还可以影响免疫细胞或宿主抗体的黏附,翻转则有利于血吸虫利用宿主抗原进行伪装,这与血吸虫逃避免疫攻击,在宿主体内存活数十年有非常重要的关系。由此可见,血吸虫的体被除摄取营养外,还起着重要的防御机能[29]。基因功能研究发现,与NC组相比,SjELAV-like 2干扰组减虫率达28.57%,这可能与其体壁结构变化导致的营养摄取和防御功能的改变有关。
4 结论成功克隆、表达SjELAV-like 2基因。RT-qPCR分析发现SjELAV-like 2在日本血吸虫童虫中表达较高,且在合抱雌虫的表达量均高于同时期合抱雄虫。RNAi功能研究结果表明,长期持续干扰SjELAV-like 2基因的表达,受干扰虫体产卵能力和所产卵胚孵化能力都受到显著的影响,说明该基因与血吸虫生长发育有重要关系,为今后进一步研究该基因对日本血吸虫生长发育的影响奠定了基础。
| [1] | BURD C G, DREYFUSS G. Conserved structures and diversity of functions of RNA-binding proteins[J]. Science, 1994, 265(5172): 615–621. DOI: 10.1126/science.8036511 |
| [2] | ANTIC D, KEENE J D. Embryonic lethal abnormal visual RNA-binding proteins involved in growth, differentiation, and posttranscriptional gene expression[J]. Am J Hum Genet, 1997, 61: 273–278. DOI: 10.1086/514866 |
| [3] | MANLEY G T, SMITT P S, DALMAN J, et al. Hu antigens:Reactivity with hu antibodies, tumor expression, and major immunogenic sites[J]. Ann Neurol, 1995, 38(1): 102–110. DOI: 10.1002/(ISSN)1531-8249 |
| [4] | ROBINOW S, WHITE K. Characterization and spatial distribution of the ELAV protein during Drosophila melanogaster development[J]. J Neurobiol, 1991, 22(5): 443–461. DOI: 10.1002/(ISSN)1097-4695 |
| [5] | YAO K M, SAMSON M L, REEVES R, et al. Gene elav of Drosophila melanogaster:a prototype for neuronal-specific RNA binding protein gene family that is conserved in flies and humans[J]. J Neurobiol, 1993, 24(6): 723–739. DOI: 10.1002/(ISSN)1097-4695 |
| [6] | SIMIONATO E, BARRIOS N, DULOQUIN L, et al. The Drosophila RNA-binding protein ELAV is required for commissural axon midline crossing via control of commissureless mRNA expression in neurons[J]. Dev Biol, 2007, 301(1): 166–177. DOI: 10.1016/j.ydbio.2006.09.028 |
| [7] | MA W J, CHENG S, CAMPBELL C, et al. Cloning and characterization of HuR, a ubiquitously expressed Elav-like protein[J]. J Biol Chem, 1996, 271(14): 8144–8151. DOI: 10.1074/jbc.271.14.8144 |
| [8] | SCHECKEL C, DRAPEAU E, FRIAS M A, et al. Regulatory consequences of neuronal ELAV-like protein binding to coding and non-coding RNAs in human brain[J]. eLife, 2016, 5: e10421. DOI: 10.7554/eLife.10421 |
| [9] | SAMSON M L. Rapid functional diversification in the structurally conserved ELAV family of neuronal RNA binding proteins[J]. BMC Genomics, 2008, 9: 392. DOI: 10.1186/1471-2164-9-392 |
| [10] | GOOD P J. A conserved family of elav-like genes in vertebrates[J]. Proc Natl Acad Sci U S A, 1995, 92(10): 4557–4561. DOI: 10.1073/pnas.92.10.4557 |
| [11] | INCE-DUNN G, OKANO H J, JENSEN K B, et al. Neuronal Elav-like (Hu) proteins regulate RNA splicing and abundance to control glutamate levels and neuronal excitability[J]. Neuron, 2012, 75(6): 1067–1080. DOI: 10.1016/j.neuron.2012.07.009 |
| [12] | WISZNIAK S E, DREDGE B K, JENSEN K B. HuB (elavl2) mRNA is restricted to the germ cells by post-transcriptional mechanisms including stabilisation of the message by DAZL[J]. PLoS One, 2011, 6(6): e20773. DOI: 10.1371/journal.pone.0020773 |
| [13] | GU L, WANG Q, SUN Q Y. Histone modifications during mammalian oocyte maturation:dynamics, regulation and functions[J]. Cell Cycle, 2010, 9(10): 1942–1950. DOI: 10.4161/cc.9.10.11599 |
| [14] | CHALUPNIKOVA K, SOLC P, SULIMENKO V, et al. An oocyte-specific ELAVL2 isoform is a translational repressor ablated from meiotically competent antral oocytes[J]. Cell Cycle, 2014, 13(7): 1187–1200. DOI: 10.4161/cc.28107 |
| [15] |
乔洪宾, 曹宇凡, 韩愉, 等. 单性血吸虫带虫免疫对继发血吸虫病的影响[J]. 中国动物传染病学报, 2014, 22(3): 41–47.
QIAO H B, CAO Y F, HAN Y, et al. Effect of infection of single-sex schistosoma on secondary schistosomiasis[J]. Chinese Journal of Animal Infecious Diseases, 2014, 22(3): 41–47. (in Chinese) |
| [16] |
韩愉.日本血吸虫正常发育与发育阻遏雌虫形态结构观察和差异miRNAs研究[D].上海: 中国农业科学院上海兽医研究所, 2015.
HAN Y. Morphological structure observed and differentially expressed miRNAs analysis of normal developed and underdevelop female schistosoma japonicum[D]. Shanghai: Shanghai Veterinary Research Institute, Chinese Academy of Agricultural Sciences, 2015. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-82101-1015378830.htm |
| [17] |
乔洪宾.正常发育和发育阻遏日本血吸虫雌虫差异蛋白质组学分析及雄性尾蚴免疫效果评估[D].上海: 中国农业科学院上海兽医研究所, 2014.
QIAO H B.Analysis of different proteomic between normally developed and underdeveloped female Schistosoma japonicum and the evaluation of male cercariae immune effect[D]. Shanghai: Shanghai Veterinary Research Institute, Chinese Academy of Agricultural Sciences, 2014. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-82101-1014326883.htm |
| [18] | COLOMBRITA C, SILANI V, RATTIA A. ELAV proteins along evolution: back to the nucleus?[J]. Mol Cell Neurosci, 2013, 56(4): 447–455. |
| [19] | SAMSON M L, CHALVET F. Found in neurons, a third member of the Drosophila elav gene family, encodes a neuronal protein and interacts with elav[J]. Mech Dev, 2003, 120(3): 373–383. DOI: 10.1016/S0925-4773(02)00444-6 |
| [20] | MANSFIELD K D, KEENE J D. Neuron-specific ELAV/Hu proteins suppress HuR mRNA during neuronal differentiation by alternative polyadenylation[J]. Nucleic Acids Res, 2012, 40(6): 2734–2746. DOI: 10.1093/nar/gkr1114 |
| [21] | SUN X, YANG H, STURGILL D, et al. Sxl-dependent, tra/tra2-independent alternative splicing of the Drosophila melanogaster X-linked gene found in neurons[J]. G3 (Bethesda), 2015, 5(12): 2865–2874. DOI: 10.1534/g3.115.023721 |
| [22] | MOSCHALL R, GAIK M, MEDENBACH J. Promiscuity in post-transcriptional control of gene expression:Drosophila sex-lethal and its regulatory partnerships[J]. FEBS Lett, 2017, 591(11): 1471–1488. DOI: 10.1002/1873-3468.12652 |
| [23] |
倪灿荣, 马大烈, 戴益民.
免疫组织化学实验技术及应用[M]. 北京: 化学工业出版社, 2006.
NI C R, MA D L, DAI Y M. Immunohistochemical experiment technology and application[M]. Beijing: Chemical Industry Press, 2006. (in Chinese) |
| [24] | CAO Y F, SHI Y L, QIAO H B, et al. Distribution of lethal giant larvae (Lgl) protein in the tegument and negative impact of siRNA-based gene silencing on worm surface structure and egg hatching in Schistosoma japonicum[J]. Parasitol Res, 2014, 113(1): 1–9. DOI: 10.1007/s00436-013-3620-z |
| [25] | MICHAEL E, HODGES R D. Scanning electron microscopy of the duodenal mucosa of chickens infected withEimeria acervulina[J]. Parasitology, 1975, 71(2): 229–237. DOI: 10.1017/S0031182000046679 |
| [26] |
龚震宇, 杨小平. 全球血吸虫病流行概况[J]. 疾病监测, 2011, 26(6): 504.
GONG Z Y, YANG X P. The global epidemic of schistosomiasis[J]. Disease Surveillance, 2011, 26(6): 504. DOI: 10.3784/j.issn.1003-9961.2011.06.023 (in Chinese) |
| [27] |
郭家钢. 中国血吸虫病综合治理的历史与现状[J]. 中华预防医学杂志, 2006, 40(4): 225–228.
GUO J G. The history and present situation of the comprehensive control of schistosomiasis in China[J]. Chinese Journal of Preventive Medicine, 2006, 40(4): 225–228. DOI: 10.3760/j:issn:0253-9624.2006.04.004 (in Chinese) |
| [28] | NDEGWA D, KRAUTZ-PETERSON G, SKELLY P J. Protocols for gene silencing in schistosomes[J]. Exp Parasitol, 2007, 117(3): 284–291. DOI: 10.1016/j.exppara.2007.07.012 |
| [29] |
钱门宝, 胡薇. 血吸虫体被的结构功能及其蛋白质组研究[J]. 中国寄生虫学及寄生虫病杂志, 2008, 26(6): 466–471.
QIAN M B, HU W. The structure and function of Schistosome tegument and related proteomic study[J]. Chinese Journal of Parasitology and Parasitic Diseases, 2008, 26(6): 466–471. (in Chinese) |



