2. 吉林农业大学, 长春 130118
2. Jilin Agricultural University, Changchun 130118, China
布鲁菌病(Brucellosis,简称布病)是由布鲁菌(Brucella)引起的人畜共患传染病,造成多种动物和人感染,危害日益加重[1]。当前布病的防控主要是采取血清监测和疫苗免疫为主的措施,现有的弱毒疫苗免疫由于存在安全隐患以及目前的检测方法的灵敏性和特异性等问题严重阻碍了人畜布鲁菌病的净化和防控工作。为此,筛选和鉴定有效的毒力因子、疫苗候选抗原和诊断标识对于研制安全有效的疫苗和建立灵敏特异的诊断方法具有重要的意义。“体内诱导表达抗原技术”(in vivo-induced antigen technology, IVIAT)被广泛用于一些病原菌毒力分子和候选抗原筛选鉴定的研究中,“体内诱导基因”是致病菌在宿主体内表达而在体外不表达的功能基因[2-4]。大量研究证实,这些仅体内表达的基因常常对病原菌在体内的致病和生存有重要意义。通过收集病原菌在不同感染途径,不同感染阶段的康复血清可以获得病原菌在不同感染阶段可能产生的不同抗原物质,这些抗原物质有的是病原菌重要的毒力成分,有的是病原菌诊断标识以及药物靶点,对研究病原菌的致病、疫苗和诊断具有重要意义。为此,本研究构建了羊布鲁菌基因表达文库,收集临床上羊布鲁菌感染阳性血清,利用IVIAT筛选鉴定羊布鲁菌特异的体内诱导抗原。对筛选得到的基因进行RT-PCR验证,为筛选和鉴定布鲁菌新的毒力分子、诊断靶标、疫苗候选抗原和药物靶点提供科学依据。
1 材料与方法 1.1 材料 1.1.1 菌株、质粒和培养基布鲁菌16M标准菌株为军事医学院军事兽医研究所王兴龙研究员惠赠;大肠杆菌DH5α和BL21(DE3)购自TaKaRa生物;质粒pET-30abc(+)购自Thermo Scientific, TSB培养基购自Sigma,用于培养布鲁菌16M菌株;LB培养基(OXOID)用于培养大肠杆菌;卡那霉素(购自Merk)终质量浓度为50 μg·mL-1。所有菌株均用20%甘油保存于-70 ℃冰箱中;试验用血清采自感染羊布鲁菌的羊,虎红平板凝集试验检测为阳性。
1.1.2 主要试剂DNA限制性内切酶、Taq DNA聚合酶、CIAP、DNA连接试剂盒、细菌DNA提取试剂盒、RNA提取试剂盒、胶回收及质粒提取试剂盒均购自TaKaRa公司。氯霉素、X-gal、IPTG等购自上海生物工程有限公司。混合蛋白酶抑制剂购自ROCH公司,辣根过氧化物酶标记的兔抗鹿IgG购自上海生工。
1.2 方法 1.2.1 文库构建布鲁菌16M标准菌株在TSB培养基中37 ℃培养48 h,然后提取基因组DNA,用限制性内切酶Sau3AⅠ 37 ℃酶切2 h。然后回收大小在0.5~2 kb的片段,用T4连接酶连接到pET-30abc(先用BamHⅠ酶切载体,然后再用CIAP去磷酸化)载体中,4 ℃过夜。将基因组连接产物转化至大肠杆菌DH5α感受态细胞中,涂布于含卡那霉素(50 μg·mL-1)的LB平板上,37 ℃过夜培养,随机挑取100个单菌落在LB液体培养基中37 ℃过夜培养,分别提取质粒,用KpnⅠ和HindⅢ双酶切鉴定构建的文库是否合格(空质粒少于20%),将平皿上的菌落用PBS全部洗下,提取质粒即为构建好的布鲁菌基因组文库。将基因组文库质粒转化至大肠杆菌BL21(DE3)感受态细胞中进行表达。
1.2.2 血清探针的制备从布鲁菌感染梅花鹿的阳性血清中随机选取7份混合在一起(阳性血清来自于吉林省动物疫病防控中心),这些血清样本分别用虎红平板凝集试验、试管凝集试验和ELISA进行检测,均确定为布鲁菌阳性血清。将血清用0.22 μm的滤膜过滤,用膜吸附法先与布鲁菌16M全菌进行作用,37 ℃ 30 min,去除布鲁菌菌体表面蛋白的抗体,吸附过程重复3~5次,用ELISA检测抗体下降的程度,然后再将上述血清分别与布鲁菌菌体裂解产物和大肠杆菌BL21的裂解产物进行吸附,分别去除布鲁菌裂解产物的抗体及宿主菌的抗体。吸附后所得血清即为制备的布鲁菌血清探针。
1.2.3 表达文库的免疫筛选将转化获得的表达文库菌液以适宜浓度涂布于含有卡那霉素(50 μg·mL-1)的LB平板上,37 ℃培养5 h,将灭菌的PVDF膜小心放入长好的平板上,充分接触复印15 min,做好标记,将标记好的PVDF膜放入含卡那霉素(50 μg·mL-1)和IPTG(1 mmol·L-1)的LB平板上,菌落面朝上,37 ℃培养4 h,取出PVDF膜,在氯仿蒸汽中熏蒸15 min,部分裂解菌落。立即加入10%脱脂奶粉室温封闭1 h,用PBS-T (含0.5%吐温-20的磷酸盐缓冲液)洗涤5 min后,加入PBS稀释(1:200)的吸附后血清4 ℃过夜孵育,PBS-T洗涤,加入辣根过氧化物酶(HRP)标记的兔抗鹿IgG(1:20 000),室温孵育1 h,PBS-T洗涤,TMB显色,将结果与母板对比,标记出阳性菌落。挑取阳性菌落划线于含卡那霉素(50 μg·mL-1)的LB平板上,37 ℃过夜培养,挑取阳性菌落于含卡那霉素(50 μg·mL-1)LB液体培养基中37 ℃过夜培养,20%甘油保存于-70 ℃冰箱中。
1.2.4 基因鉴定以仅含有pET-30a/b/c空载体的大肠杆菌BL21(DE3)为阴性对照,剔除假阳性克隆,对上一步确定的阳性克隆再次进行菌落免疫印迹筛选,步骤相同,筛选出与对照比较仍呈阳性反应的克隆。提取最终确定的阳性克隆的质粒,对插入序列进行基因测序鉴定。测序结果在NCBI entrez database′s B. melitensis和 B. abortus genomes数据库中进行检索,用PSORTb 2.0软件进行细胞定位。
1.2.5 RT-PCR验证提取培养48 h的布鲁菌16M总RNA,用DNaseⅠ消化RNA中的基因组DNA,用核酸定量仪检测RNA的纯度和浓度,琼脂糖凝胶电泳检测RNA的完整性,-80 ℃冻存备用。参照PrimeScriptTM RT-PCR Kit使用说明书进行RNA逆转录,根据上述IVIAT鉴定的阳性产物测序结果所得序列设计引物(表 1),按照RT-PCR试剂盒的反应体系,优化反应条件进行PCR扩增,琼脂糖凝胶检测扩增结果。
|
|
表 1 14个体内诱导表达基因的PCR引物 Table 1 Fourteen PCR primers that induced expression of the gene in vivo |
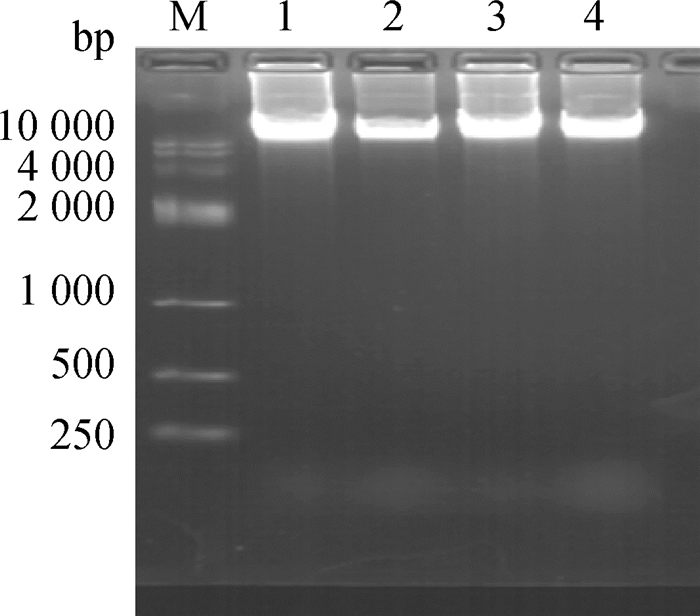
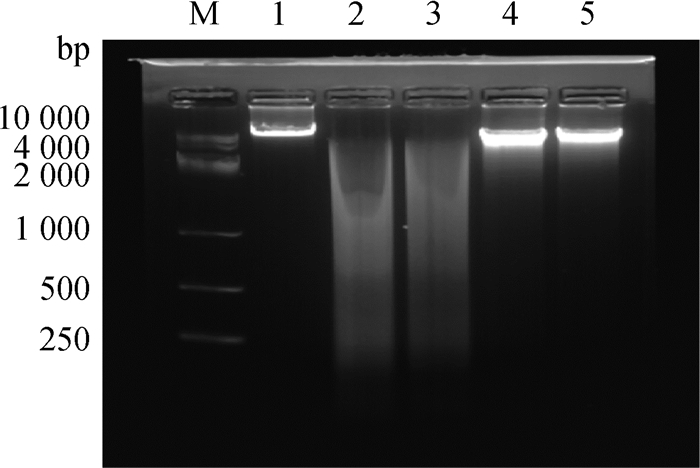
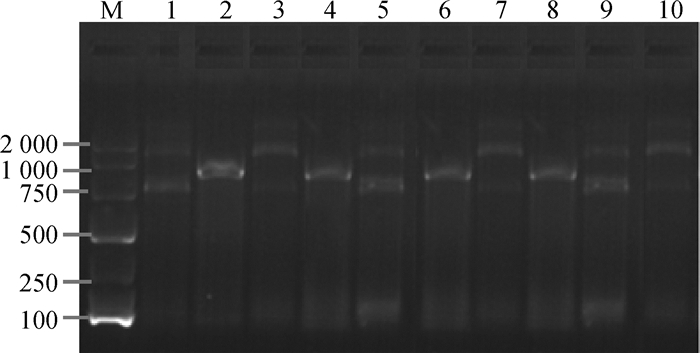
提取羊布鲁菌16M基因组,如图 1所示。用16倍倍比稀释的Sau3AⅠ酶切基因组,基因组片段大小均在0.5~2 kb之间,如图 2所示。酶切片段纯化后与线性去磷酸化的表达载体pET-30a/b/c连接,转化到DH5α中,构建羊布鲁菌16M基因组文库,大小为4×104。将构建好的重组质粒文库全部转入BL21感受态细胞中,随机抽取转化子,利用KpnⅠ和HindⅢ双酶切的方法,检测插入效率,插入效率约为90%,空质粒低于20%,证明构建的文库合格,如图 3所示。
|
M.DNA相对分子质量标准;泳道1~4均为布鲁菌16M基因组 M. DNA marker; Lanes 1-4 are Brucella 16M genomes 图 1 羊布鲁菌16M基因组电泳图 Figure 1 Electrophoresis map of Brucella 16M genome |
|
M.DNA相对分子质量标准;泳道1~5分别为内切酶稀释4、8、16、32、64倍的酶切结果 M. DNA marker; Lanes 1-5 were the results of digestion by endonuclease diluted 4, 8, 16, 32 and 64 times 图 2 布鲁菌16M基因组Sau3AⅠ部分酶切 Figure 2 Brucella 16M genome partially digested by Sau3AⅠ |
|
M.DNA相对分子质量标准;泳道1~10为用KpnⅠ和HindⅢ双酶切鉴定挑取的10个转化菌 M. DNA marker; Lanes 1-10 were double-digested with KpnⅠ and HindⅢ to identify the 10 transformed bacteria 图 3 双酶切鉴定电泳图 Figure 3 Double enzyme digestion identification by electrophoresis |
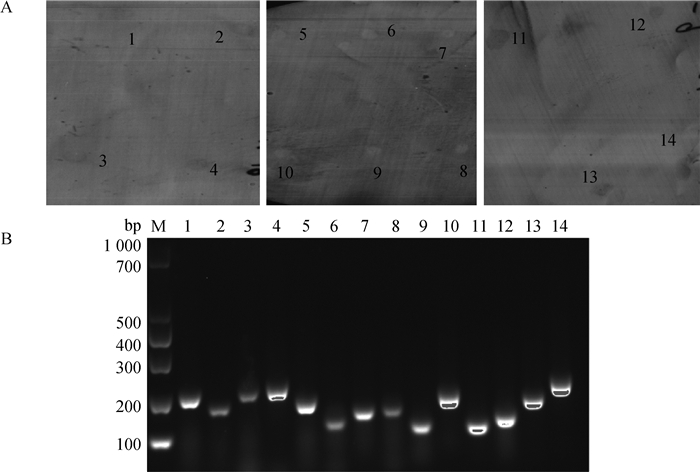
利用临床上采集的7份羊布鲁菌阳性血清经过充分吸附后制成的免疫探针,筛选阳性克隆,菌落能够与血清探针进行特异性反应,结果有14个特异性菌落发生了特异性反应。如图 4A所示。对这14个特异性插入序列进行测序,测序结果在NCBI GenBank上B. melitensis 和B. abortus基因组序列中进行检索,14个产物均属于B. melitesis和B. abortus 两株布鲁菌的基因产物,它们分别是:glucose-6-pho-sphate dehydrogenase(葡萄糖-6磷酸脱氢酶);copper-binding periplasmic protein precursor(周质铜结合蛋白前体);NAD(P)H quinone oxidoreductase, PIG3 family protein [NAD(P)H醌氧化还原酶PIG3家族蛋白];tRNA uridine 5-carboxy methylaminomethyl modification enzyme GidA(mnmG) (tRNA尿苷5-羧基甲基氨甲基修饰酶GidA);cyclic nucleotide-binding domain protein(环核苷酸结合域蛋白);aldehyde dehydrogenase family protein(乙醛脱氢酶家族蛋白);betaine-aldehyde dehydrogenase(三甲基甘氨醛脱氢酶);hypothetical protein DK61_1527(未知蛋白);cobalamin synthesis protein P47K(钴氨素合成蛋白P47K);acetate-CoA ligase(乙酸CoA连接酶);cobW/HypB/UreG, nucleotide-binding domain protein(核苷酸结合域蛋白);tellurite resistance TerB family protein(亚碲酸抑制TerB家族蛋白);nitrous oxide reductase maturation NosD family protein(一氧化二氮成熟体NosD家族蛋白);propionate-CoA ligase(丙酸CoA连接酶)。通过PSORTb 2.0软件分析,这些蛋白主要与布鲁菌的糖代谢、RNA修饰、离子转运和跨膜运输等功能相关,分别位于布鲁菌细胞质和细胞膜内(详见表 2)。
|
1.葡萄糖6-磷酸脱氢酶;2.铜离子结合周质蛋白前体;3. NAD(P)H醌氧化还原酶,PIG3家族蛋白;4. tRNA尿苷5-羧基甲氨基甲基修饰酶GidA(mnmG);5.环核苷酸结合域蛋白;6.乙醛脱氢酶家族蛋白;7.三甲基甘氨醛脱氢酶;8.假定蛋白DK61_1527;9.钴氨素合成蛋白p47K;10.乙酸辅酶A连接酶;11. cobW/HypB/UreG核苷酸结合域蛋白;12.亚碲酸抑制TerB家族蛋白;13.一氧化二氮还原酶NosD家族蛋白;14丙酸辅酶A连接酶;M.核酸相对分子质量标准 1. Glucose-6-phosphate dehydrogenase; 2. Copper-binding periplasmic protein precursor; 3. NAD(P)H quinone oxidoreductase, PIG3 family protein; 4. tRNA uridine 5-carboxy methylaminomethyl modification enzyme GidA(mnmG); 5. Cyclic nucleotide-binding domain protein; 6. Aldehyde dehydrogenase family protein; 7. Betaine-aldehyde dehydrogenase; 8. Hypothetical protein DK61_1527;9. Cobalamin synthesis protein P47K;10. Acetate-CoA ligase; 11. CobW/HypB/UreG, nucleotide-binding domain protein; 12. Tellurite resistance TerB family protein; 13. Nitrous oxide reductase maturation NosD family protein; 14. Propionate-CoA ligase; M. DNA marker 图 4 IVIAT筛选抗原与阴性对照血清的菌落免疫印迹反应(A)及阳性克隆RT-PCR验证(B) Figure 4 Colony-immunoblotting of IVIAT screening antigens with negative control sera(A) and positive clones RT-PCR verification electrophoresis(B) |
|
|
表 2 NCBI比对鉴定得到的蛋白信息表 Table 2 NCBI identification of the resulting protein information table |
根据获得的14个体内诱导基因设计特异性引物,对布鲁菌16M反转录得到的cDNA进行RT-PCR扩增,RT-PCR结果显示有14个基因得到了特异性扩增,验证了这些基因均属于布鲁菌基因组基因。结果如图 4B所示。
3 讨论体内诱导抗原鉴定技术(IVIAT)是一种新型的鉴定病原微生物体内表达基因的方法,该方法是利用感染并康复的动物血清,用体外培养的病菌全细胞、细胞裂解液及热变性细胞裂解液吸附处理收集的动物血清,再用吸附后的血清为探针来筛选已构建于大肠杆菌宿主菌的病菌基因组表达文库,阳性反应克隆则含有病菌DNA序列所编码的体内抗原。大量的研究表明,这些独特的在体内表达而在体外不表达的基因往往对病原菌在体内的生存和致病有重要意义,这些基因多半是病原菌的毒力因子、免疫候选抗原、药物靶点和分子诊断标识。因此,近年来有关病原菌的体内诱导基因的研究越来越受到重视。该方法不需要动物模型,无需直接对病原微生物进行操作,可以检测瞬时表达以及不同感染途径、不同感染阶段的基因等优点,因此在较为复杂以及具有毒性的病原微生物中有着广泛的应用前景[5-7]。
本研究利用IVIAT技术,从大概40 000个含有布鲁菌16M基因组片段的大肠杆菌克隆中筛选得到了14个体内诱导表达基因。经RT-PCR验证,这些基因均是布鲁菌16M体内诱导表达的基因。它们主要是布鲁菌糖代谢,离子物质运输,细胞膜组成以及RNA修饰等过程中重要的基因表达产物。在先前的研究中利用IVIAT方法也鉴定了一些布鲁菌体内诱导表达的基因,Lowry等[8]运用麋鹿血清从B. abortus RB51的基因组表达文库中成功筛选得到了10个布鲁菌体内诱导基因,验证了MDH、AfuA、D15等基因。孙晓庆[9]运用牛血清从牛布鲁菌疫苗株A19基因组中成功筛选得到33个体内诱导表达基因,并对Fumly、SDR、MDH、Nirase、Fumhy、EnvZ、AfuA和D15等8个体内诱导抗原进行原核表达和免疫原性分析。然而在本试验中,利用IVIAT筛选到的14个体内诱导表达基因与他们的研究获得的体内诱导基因完全不一致,这些基因全部是未曾被报道过的基因,这主要有二个原因,其一是采用的宿主血清和布鲁菌菌株不同,本研究的研究对象是羊的血清和平滑型菌株羊布鲁菌16M,而其他学者开展研究所使用的血清分别是牛、麋鹿等动物血清,菌株分别是粗糙型牛布鲁菌疫苗株RB51[8]和平滑型牛布鲁菌疫苗株A19[9]。布鲁菌的种型之间,疫苗株和强毒株之间,平滑型菌株和粗糙型菌株之间在致病和免疫过程中诱导产生的基因存在较大差异,这就是本试验所得到的诱导基因与其他研究不一致的根本原因。其二是细菌培养时间不同,在本研究中细菌培养时间为48 h,而其他研究中细菌培养时间为24 h,这也是导致所得到的诱导抗原不一致的主要原因之一。细菌在不同培养时间所诱导表达的基因也存在着较大的差异。因此,在我们的研究中可以真实客观地反映出羊布鲁菌强毒株感染过程中所诱导表达的重要基因,这些基因对于研究羊布鲁菌建立感染、识别免疫、参与细胞代谢起到了至关重要的作用。在鉴定的14个基因中,有的已经被验证了在布鲁菌中的作用,如环核苷酸结合蛋白(cyclic nucleotide-binding domain protein,CNB)已经被研究发现是布鲁菌潜在的药物靶点,CNB是环核苷单磷酸(cyclic nucleotide monophosphate,cNMP)结合蛋白的保守区,cNMP结合蛋白根据其在细胞内的功能已经被认为是潜在的药物作用靶点。CNB是关键的细胞装置组成部分,调节多个细胞内部过程。这些蛋白结构域已经在几个蛋白家族被发现,如cAMP受体蛋白(CRP), cAMP和cGMP依赖的蛋白激酶(PKA和PKG)以及ether-a-go-go(EAG)通道蛋白。CNB主要负责两个二级信使cAMP和cGMP的结合[10]。本研究中通过体内诱导抗原技术也鉴定到了该基因,这为研究布鲁菌治疗药物的筛选提供了科学依据。
tRNA尿苷5-羧基甲基氨甲基修饰酶GidA [tRNA uridine 5-carboxy methylaminomethyl modification enzyme GidA(mnmG)]是tRNA修饰过程中十分重要的酶,在真核生物和原核生物的翻译过程中,tRNA修饰酶GidA有助于tRNA的正确折叠和结构稳定以及在监督密码子和反密码子正确翻译中起到了重要作用[11]。在几个致病病原菌中,GidA在细菌生长、细胞分裂以及毒力调节等过程中均起到了关键的作用。在Ⅱ型链球菌中发现该基因不仅影响了细菌生长、细胞分裂、荚膜合成,也严重影响了Ⅱ型链球菌的毒力[12]。然而该基因在布鲁菌中的作用还没有被报道,有可能成为布鲁菌新的毒力分子。
亚碲酸盐抗性TerB家族蛋白(tellurite resistance TerB family protein)是细菌重要的毒力因子,在吞噬体抑制、毒素耐受以及细菌毒力等方面发挥着重要的作用。在很多细菌都有该基因,如大肠杆菌、肺炎克雷伯菌、金黄色葡萄球菌、单增李斯特菌等,帮助细菌在吞噬细胞内生存和复制[13]。本研究首次在布鲁菌中发现该基因,该分子也有可能成为布鲁菌在细胞内生存的重要毒力分子。
本研究中也筛选到NosD家族蛋白(nitrous oxide reductase maturation NosD family protein)。NosD是属于糖水化合物和糖水解域的蛋白,其具体生物学意义还不是很清楚[14]。NosY是六螺旋的转膜蛋白,其被认为是和NosF和NosD一起形成ABC转运体,有研究已经表明ABC转运体是布鲁菌与宿主相互作用过程中的重要毒力因子,具有致病作用,也是重要的免疫成分,可用于布鲁菌疫苗候选抗原[15]。在我们的研究中鉴定得到的NosD有可能成为布鲁菌重要的免疫识别抗原。
NAD(P)H醌氧化还原酶PIG3家族蛋白[NAD(P)H quinone oxidoreductase, PIG3 family protein]主要参与肿瘤凋亡,被用作长期的肿瘤促凋亡的标识[16],然而在本研究中鉴定得到了该蛋白,该分子也可能与布鲁菌细胞内生存有关,也可作为布鲁菌感染宿主细胞后细胞凋亡的诊断标识,布鲁菌可能通过抑制该基因的表达来抑制宿主细胞的凋亡,从而在宿主内得以生存。
虽然本研究所鉴定的14个布鲁菌体内诱导基因中有些基因的功能还未知,但是从上述已知的基因功能中我们不难发现这些基因在布鲁菌的胞内生存、毒力作用、细胞代谢、免疫识别等重要生物学过程中起着关键作用,有可能成为布鲁菌新的毒力分子,药物作用靶点和免疫识别标识,有待我们进一步通过试验研究来证实这些基因的重要功能,本研究结果对于研究布鲁菌的致病机制,筛选药物作用靶点和分子诊断标识提供了科学依据。
4 结论本研究将体内诱导抗原技术(IVIAT)成功地应用到布鲁菌候选抗原和诊断标识的筛选和鉴定研究中,利用该技术成功获得14个体内诱导基因,这些基因在布鲁菌的毒力和免疫中均具有重要意义,将为布鲁菌疫苗的研制和诊断产品的研发提供候选抗原和诊断标识。
| [1] | FRANC K A, KRECEK R C, HÄSLER B N, et al. Brucellosis remains a neglected disease in the developing world: a call for interdisciplinary action[J]. BMC Public Health, 2018, 18(1): 125. DOI: 10.1186/s12889-017-5016-y |
| [2] | CHIANG S L, MEKALANOS J J, HOLDEN D W. In vivo genetic analysis of bacterial virulence[J]. Annu Rev Microbiol, 1999, 53: 129–154. DOI: 10.1146/annurev.micro.53.1.129 |
| [3] | KLITGAARD K, JENSEN T K, ANGEN Ø, et al. Measurement of bacterial gene expression in vivo by laser capture microdissection and quantitative real-time RT-PCR[J]. J Microbiol Methods, 2007, 69(2): 414–416. DOI: 10.1016/j.mimet.2006.12.003 |
| [4] | WANG J, MUSHEGIAN A, LORY S, et al. Large-scale isolation of candidate virulence genes of Pseudomonas aeruginosa by in vivo selection[J]. Proc Natl Acad Sci U S A, 1996, 93(19): 10434–10439. DOI: 10.1073/pnas.93.19.10434 |
| [5] |
陈师勇, 莫照兰, 张振冬, 等. 细菌毒力基因体内表达检测技术研究进展[J]. 遗传, 2005, 27(3): 505–511.
CHEN S Y, MO Z L, ZHANG Z D, et al. Advances in detection technologies of in vivo expression of bacterial virulence gene[J]. Hereditas, 2005, 27(3): 505–511. DOI: 10.3321/j.issn:0253-9772.2005.03.031 (in Chinese) |
| [6] | CAO S L, PROGULSKE-FOX A, HILLMAN J D, et al. In vivo induced antigenic determinants of Actinobacillus actinomycetemcomitans[J]. FEMS Microbiol Lett, 2004, 237(1): 97–103. DOI: 10.1111/fml.2004.237.issue-1 |
| [7] | DEB D K, DAHIYA P, SRIVASTAVA K K, et al. Selective identification of new therapeutic targets of Mycobacterium tuberculosis by IVIAT approach[J]. Tuberculosis (Edinb), 2002, 82(4-5): 175–182. DOI: 10.1054/tube.2002.0337 |
| [8] | LOWRY J E, GOODRIDGE L, VERNATI G, et al. Identification of Brucella abortus genes in elk (Cervus elaphus) using in vivo-induced antigen technology (IVIAT) reveals novel markers of infection[J]. Vet Microbiol, 2010, 142(3-4): 367–372. DOI: 10.1016/j.vetmic.2009.10.010 |
| [9] |
孙晓庆.牛型布鲁氏菌体内诱导抗原的鉴定及其特性分析[D].上海: 中国农业科学院上海兽医研究所, 2012.
SUN X Q. Idetification and characterization of the antigerns intruced during infection of Brucella abortus A19[D]. Shanghai: Shanghai Veterinary Research Institute, Chinese Academy of Agricultural Sciences, 2012. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-82101-1012415699.htm |
| [10] | HE Z, GAO Y, DONG J, et al. Crystal structure of cyclic nucleotide-binding-like protein from Brucella abortus[J]. Biochem Biophys Res Commun, 2015, 468(4): 647–652. DOI: 10.1016/j.bbrc.2015.11.005 |
| [11] | IWASAKI W, MIYATAKE H, MIKI K. Crystal structure of the small form of glucose-inhibited division protein A from Thermus thermophilus HB8[J]. Proteins, 2005, 61(4): 1121–1126. |
| [12] | GAO T, TAN M, LIU W, et al. GidA, a tRNA modification enzyme, contributes to the growth, and virulence of Streptococcus suis serotype 2[J/OL]. Front Cell Infect Microbiol, 2016, 6(44): 1-11 (2016-04-19)[2018-06-25]. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4835480/. doi: 10.3389/fcimb.2016.00044. |
| [13] | TURKOVICOVA L, SMIDAK R, JUNG G, et al. Proteomic analysis of the TerC interactome: Novel links to tellurite resistance and pathogenicity[J]. J Proteomics, 2016, 136: 167–173. DOI: 10.1016/j.jprot.2016.01.003 |
| [14] | HONISCH U, ZUMFT W G. Operon structure and regulation of the nos gene region of Pseudomonas stutzeri, encoding an ABC-Type ATPase for maturation of nitrous oxide reductase[J]. J Bacteriol, 2003, 185(6): 1895–1902. DOI: 10.1128/JB.185.6.1895-1902.2003 |
| [15] | ROSINHA G M, FREITAS D A, MIYOSHI A, et al. Identification and characterization of a Brucella abortus ATP-binding cassette transporter homolog to Rhizobium meliloti ExsA and its role in virulence and protection in mice[J]. Infect Immun, 2002, 70(9): 5036–5044. DOI: 10.1128/IAI.70.9.5036-5044.2002 |
| [16] | PORTÉ S, VALENCIA E, YAKOVTSEVA E A, et al. Three-dimensional structure and enzymatic function of proapoptotic human p53-inducible quinone oxidoreductase PIG3[J]. J Biol Chem, 2009, 284(25): 17194–17205. DOI: 10.1074/jbc.M109.001800 |



