2. 广东省农业科学院农产品公共监测中心, 广州 510640
2. Public Monitoring Center for Agro-Product of Guangdong Academy of Agricultural Sciences, Guangzhou 510640, China
鸭疫里氏杆菌病是由鸭疫里氏杆菌(Riemerella anatipestifer)引起的急性、败血性、接触性的传染病,呈急性或败血症感染,主要引起各种炎症,如纤维素性心包炎、肝周炎、气囊炎及关节炎等[1-2]。发病没有季节性,多见于秋冬季节及潮湿天气[3]。潜伏期较短,一般为2~5 d,最长为一周,可感染2~8周龄的雏鸭、雏鹅、火鸡等,尤其以2~3周龄的雏鸭最易感染。该病可在世界范围内广泛传播,最早发现于欧洲国家;随后在前苏联、印度等国家都有发现[4-6];2004年,日本、韩国等东亚国家对其有所报道,亚洲已经成为鸭疫里氏杆菌病流行的主要地区[7-8]。自1982年在我国北京周边地区发现鸭疫里氏杆菌病以来,浙江、山东、广西等各个省、市、自治区都有该病的报道[9-11],已经严重影响了我国养鸭行业的发展,是造成水禽养殖行业重大经济损失的主要原因之一。
利用血清型对鸭疫里氏杆菌进行分型是早年间常用的方法之一。目前已报道的鸭疫里氏杆菌血清型有25种,其中1~21型为国际上早已报道的血清型,22~25型为我国程安春等[12]在进行血清型调查时新发现的血清型。由于鸭疫里氏杆菌血清型众多,各个血清型之间无明显交叉保护现象[13],且不同地区不同年间鸭疫里氏杆菌的优势血清型会随着时间的变化而变化,这给疾病的治疗带来了巨大的困难。除了传统的血清型分型方法外,多种分型方法也可用于鸭疫里氏杆菌分子分型[14],如限制性片段长度多态性(restriction fragment length polymorphism,RFLP)技术、随机扩增多态性DNA(random amplified polymorphic DNA,RAPD)技术、细菌基因组重复序列PCR(repetitive-element PCR,rep-PCR)技术及单链多态性(single strand conformation polymorphism,SSCP)技术等,其中脉冲场凝胶电泳(pulsed field gel electrophoresis,PFGE)技术被称为调查细菌分子流行病学相关性及溯源的“金标准”[15],具有重复性好、分辨率高、结果稳定、易于标准化等特点,已被运用于不同种属细菌的分子分型[16-18]。本实验室近年来已运用PFGE技术对鸭疫里氏杆菌菌株间遗传关系进行了初步研究,Sun等[19]、张亚楠等[20]已对广东地区鸭疫里氏杆菌部分菌株成功分型。为掌握广东地区Ⅰ型血清型鸭疫里氏杆菌菌株流行情况,分析菌株间遗传关系,本研究对2007至2017年间广东地区分离的220株鸭疫里氏杆菌进行Ⅰ型血清型鉴定,并对血清Ⅰ型菌株进行SmaⅠ-PFGE分子分型。旨在调查近年来广东地区鸭疫里氏杆菌优势血清型,并应用SmaⅠ-PFGE分子分型技术对优势血清型菌株之间进行遗传关系的研究,不但为本地区鸭疫里氏杆菌灭活疫苗的研制及临床治疗提供一定的指导,还从分子水平确定菌株同源性,进而确定传染源和流行范围。
1 材料与方法 1.1 实验材料 1.1.1 病料样本2007—2017年在广东省广州、清远、佛山、惠州、江门等地采集疑似传染性浆膜炎特征性症状的病死鸭、鹅的脑或肝组织,分离并鉴定得到鸭疫里氏杆菌220株。其中,在鹅源病料样本中分离得到86株菌,在鸭源病料样本中分离得到134株菌。2007—2013年和2013—2015年分离的35株和95株鸭疫里氏杆菌菌株分别为本实验室前期Sun等[19]和张亚楠等[20]分离。
1.1.2 培养基和试剂胰蛋白胨大豆琼脂培养基(tryptic soy agar,TSA)、胰蛋白胨大豆肉汤(tryptic soy broth,TSB)购自广州环凯微生物科技有限公司;酵母提取粉(yeast extract)购自英国OXOID公司;新生牛血清购自北京鼎国昌盛生物技术有限责任公司;rTaq DNA聚合酶、DL2000、dNTP Mixture(2.5 mmol·L-1)均购自宝生物工程(大连)有限公司。
其他试剂:氯化钠、冰醋酸、氢氧化钠、浓盐酸、甲醛均购自广州化学试剂厂;SmaⅠ内切酶、10×T buffer购自宝生物工程(大连)有限公司;低熔点琼脂糖(MegaBase琼脂糖)、PFGE琼脂糖购自美BIO-RAD公司;蛋白酶K、溶菌酶均购自美国Sigma公司。十二烷基磺酸钠(SDS)、Tris碱(Tris-base)、乙二胺四乙酸钠(Na2EDTA)均购自北京普博欣生物科技有限责任公司。
血清Ⅰ型鸭疫里氏杆菌参考菌株RA1由广东省农业科学院兽医研究所惠赠,分型血清由华南农业大学兽医学院药理教研室以参考菌株免疫家兔制得。
1.1.3 实验动物2~2.5 kg雄性新西兰兔,购自南方医科大学。
1.1.4 标准菌株沙门菌H9812作为标准菌株进行对比分析。
1.2 方法 1.2.1 菌株的分离鉴定用灭菌的无菌棉签蘸取病死鸭或鹅的脑、肝等组织,划线接种于含有0.5%酵母提取粉和5%新生牛血清的TSA平板上,在二氧化碳培养箱中(5%~10%CO2,37 ℃条件下)培养24 h。挑取TSA平板上呈圆形、微突起、表面光滑、奶油状、直径1~2 mm的菌落接种于3 mL含有0.5%酵母提取粉和5%新生牛血清的TSB肉汤中,37 ℃振荡培养过夜后进行纯化培养和鉴定,采用美国德灵公司Micro Scan Walk Away-40全自动微生物鉴定仪鉴定疑似菌株。
根据本实验室前期建立的方法[19],合成鸭疫里氏杆菌外膜蛋白引物序列,PCR鉴定引物序列分别如下,RA-F:5′-CTTGGTATCCAAGGGGATTAATGTTT -3′,RA-R:5′-TTTAACTGAGATGGGTTACCAACTTC -3′,目的基因长度为707 bp。扩增的PCR产物经1%琼脂糖凝胶电泳后,送北京华大基因有限公司进行测序。
1.2.2 凝集抗血清的制备按文献[5]报道方法,将Ⅰ型血清型菌株RA1蘸取少许用3 mL TSB肉汤溶解,37 ℃振荡培养12 h后,用接种环在TSA平板上划线,置于37 ℃二氧化碳培养箱中过夜培养,挑取单个菌落进一步纯化,将培养在TSA平板上的菌群用FPSS(0.3% formalinised physiological saline solution,即加入3%甲醛的生理盐水)溶液洗涤,离心两次后,将菌体以FPSS悬浮,调节OD值(optical density)至0.2(525 nm),作为制备抗血清的抗原。
将抗血清抗原经耳缘静脉多次注射雄性健康新西兰兔,每4 d注射一次,剂量分别如下:0.05、0.1、0.2、0.5、0.5、1.0、1.0、1.5、2.0 mL,最后1次注射抗原后7 d,进行心脏采血,制备血清。将收集到的血液室温下静置2 h,离心10 min,收集上清,获得血清。
1.2.3 血清型鉴定玻板凝集试验,取干净载玻片一张,滴加阳性血清少许,用粗接种环蘸取待检菌的纯培养物,将载玻片轻轻晃动或用接种环涂开,在几秒内出现明显白色絮状凝集块者,判定为阳性结果。
1.2.4 脉冲场凝胶电泳在仲崇岳[21]建立的快速脉冲场凝胶电泳技术和本试验前期研究的基础上改进,参照标准化PFGE流程进行。
1.2.4.1模块的制备:将冻干保存的鸭疫里氏杆菌及沙门菌H9812复苏,37 ℃振荡培养12 h后,用接种环在TSA平板上划线,置于37 ℃含5% CO2二氧化碳培养箱中过夜培养,将具有典型形态的菌落涂布于TSA平板上,过夜培养后,用一次性接种环刮取适量菌体于1 mL STE溶液(0.01 mol·L-1 Tris-HCl,pH8.0;0.001 mol·L-1 Na2EDTA,pH8.0;0.4%NaCl)中,重悬,使用分光光度计调整OD600 nm值至2.0左右,取100 μL细菌混悬液至1.5 mL Eppendorf管中,加入10 μL溶菌酶(20 mg·mL-1)和90 μL 1.2%STE溶解的低熔点琼脂糖,充分混匀后注入一端封口的模具中,4 ℃放置5~10 min使模块凝固。
1.2.4.2细菌原位裂解:小心取出模具的模块后,转入含有3 mL lysis buffer(含有2 mg·mL-1溶菌酶的STE)溶液,于42 ℃水浴2 h。弃去lysis buffer,加入5 mL CLP溶液(cell lysis/proteinase K Buffer,即0.05 mol·L-1 Tris-HCl,pH8.0;0.05 mol·L-1 Na2EDTA,pH8.0;1%十二烷基肌胺酸钠;1% SDS;0.2 mg·mL-1蛋白酶K),55 ℃水浴3 h。
1.2.4.3模块洗涤:小心取出模块,加入8~10 mL预热至50 ℃的灭菌双蒸水,于50 ℃水浴轻微振荡20 min,重复两次。然后用8~10 mL预热至50 ℃的TE缓冲液液(0.01 mol·L-1 Tris-HCl,pH8.0;0.001 mol·L-1 Na2EDTA,pH8.0)于50 ℃缓慢振荡洗涤20 min,重复两次。洗涤完毕后,在室温下于TE溶液中缓慢冷却。
1.2.4.4限制性内切酶消化:切下2 mm宽洗涤后的胶块,依次加入145 μL的灭菌双蒸水、25 μL的BSA、25 μL的10×T buffer、3.5 μL的SmaⅠ(5 U·μL-1),于30 ℃水浴酶切3~4 h。剩下的胶块置于TE溶液中于4 ℃保存。
1.2.4.5制备PFGE琼脂糖凝胶:按照1.0%的比例,用0.5×TBE电泳缓冲液制备PFGE凝胶。将酶切处理后的胶块置于梳齿位置,然后用低熔点琼脂糖对点样端封口,于冰板上静置待其凝固。
1.2.4.6电泳:加入约2.5 L 0.5×TBE电泳缓冲液于CHEF-DR®Ⅲ System(Bio-Rad Laboratories,USA)电泳槽中,依次打开电源开关-循环泵开关-冷却系统I/O开关。脉冲场凝胶电泳参数设置如下:起始缓冲时间2.16 s,结束缓冲时间54.17 s,电泳时间20 h,电压6 V·cm-1,温度14 ℃,角度120 °,斜率:线性。待电泳缓冲液冷却到14 ℃时开始电泳。
1.2.4.7染色与拍照:电泳结束后,将电泳胶块放入浓度为1 μg·mL-1的EB溶液中,染色30 min以上,然后用双蒸水漂洗凝胶块20 min后,放入凝胶成像系统,照像拍照,保存图像并记录结果。用BioNumerics(Version6.0 Applied Math,Inc)软件处理并分析PFGE分型图谱,比较鸭疫里氏杆菌DNA条带同源性,条带解释参考Tenover等[22]的报道。
2 结果 2.1 鸭疫里氏杆菌的分离鉴定在2007—2017年分离得到的220株鸭疫里氏杆菌中,130株菌株由本实验室前期Sun等[19]和张亚楠等[20]分离鉴定。因此,需将从2015年9月至2017年6月在广东广州、清远、佛山、惠州、江门五个城市采集的病料样品中分离的90株菌株进行16S RNA鉴定。提取菌株DNA作为模板,采用已发表的外膜蛋白基因OmpA特异性引物进行PCR扩增鉴定,结果如图 1所示。将鉴定扩增结果送北京华大基因有限公司进行测序,NCBI进行对比分析,结果显示这90株菌株均为鸭疫里氏杆菌,其中,77株鸭疫里氏杆菌菌株为鹅源,13株鸭疫里氏杆菌菌株为鸭源,对确定为鸭疫里氏杆菌的菌株编号命名,采用“菌株种属+编号+来源+时间”的方式进行命名,以RAGD211QYGoose2015为例,其为一株编号为211的鹅源鸭疫里氏杆菌,在2015年清远分离得到。
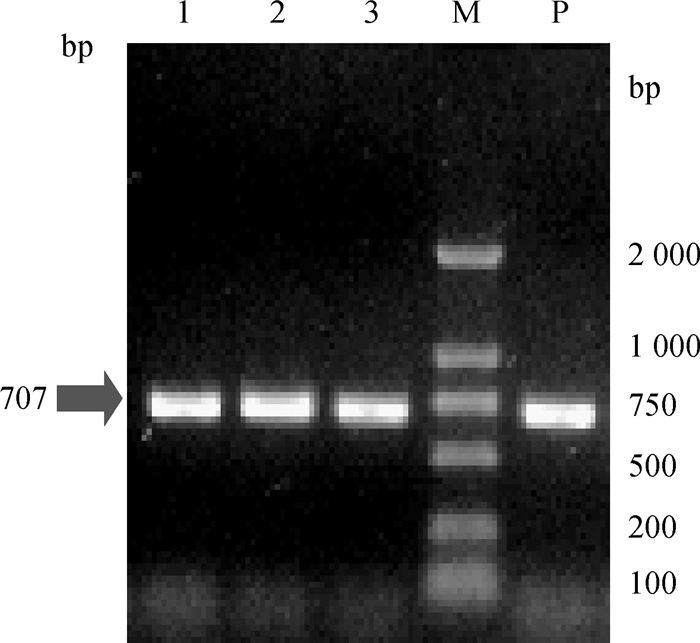
|
M.DL2000 DNA相对分子质量标准;1~3.样品PCR产物;P.阳性扩增结果 M. DL2000 marker; 1-3. PCR products; P. Positive result 图 1 鸭疫里氏杆菌OmpA基因的PCR扩增结果 Figure 1 PCR amplification of OmpA gene |
对本实验室现存的220株鸭疫里氏杆菌进行Ⅰ型血清型鉴定,其中,Ⅰ型血清型共119株,占总分离株54.09%,非Ⅰ型血清型为101株,占总分离株的45.91%。Ⅰ型血清型为2007—2017年间广东地区的主要流行血清型。不同年代间菌株分布结果、各个地区菌株分布结果、不同来源菌株分布结果分别见表 1~3。
|
|
表 1 各年份Ⅰ型血清型菌株比例 Table 1 Proportion of type Ⅰ serotype R. anatipestifer isolates in different period |
|
|
表 2 各地区Ⅰ型血清型菌株比例 Table 2 Proportion of type Ⅰ serotype R. anatipestifer isolates in each place |
|
|
表 3 各来源Ⅰ型血清型菌株比例 Table 3 Proportion of type Ⅰ serotype R. anatipestifer isolates in each source |
119株Ⅰ型血清型鸭疫里氏杆菌进行SmaⅠ-PFGE分型,有110株成功分型。部分代表性菌株的SmaⅠ-PFGE分型图谱如图 2所示。使用BioNumerics6.0聚类软件进行分析,110株鸭疫里氏杆菌的相似度为19.98%~100%,以相似度≥85%进行归类,共得到33种不同的类型,可分为19个簇和14个单一型。在这19个簇中,Cluster F和Cluster S为优势簇,都含有12个菌株,除优势簇以外,Cluster C、J、M、N、P中各有2个菌株;Cluster A、E、Q、R中各有3个菌株;Cluster D、K、L中各有6个菌株;Cluster G、H中各有8个菌株;Cluster B、I、O中分别含有4、5、7个菌株。除了图 2中各个簇代表菌株,其余每簇所包含具体菌株信息如表 4所示。结果表明Ⅰ型鸭疫里氏杆菌分子型别呈现多样化,不同的菌株之间的同源性差异较高,但存在小范围的克隆传播。

|
图 2 鸭疫里氏杆菌分离株PFGE代表性图谱 Figure 2 PFGE fingerprinting patterns of SmaⅠ-digested total DNA patterns from representative R. anatipestifer isolates |
|
|
表 4 各簇所含R. anatipestifer菌株情况 Table 4 The R. anatipestifer strains of each cluster |
鸭疫里氏杆菌血清型众多,各血清型之间交叉免疫保护弱,这给鸭疫里氏杆菌病的防控带来了巨大的困难,因此,掌握我国各个地方的鸭疫里氏杆菌的优势血清型,对于该地流行病学的调查、疫病的防控和疫苗株的选择具有重要的意义。广东省地处南方,天气潮湿,极易导致该病的发生,同时又是水禽养殖的大省,一旦发病,将造成严重的经济损失。本试验研究了2007—2017年广东地区近十年来分离的220株鸭疫里氏杆菌Ⅰ型血清型的流行特点,研究时间跨度长,涉及地方较多,为广东地区鸭疫里氏杆菌病的灭活疫苗的研制及使用提供了重要的数据参考。
目前,对广东地区鸭疫里氏杆菌优势血清型的报道虽然不少,但是研究涉及的菌株量较少,且时间跨度短。吴彩艳等[23]对2006—2008年广东地区86株鸭疫里氏杆菌血清型鉴定结果表明有81株为Ⅰ型血清型,Ⅰ型血清型为广东优势血清型。魏秀丽等[24]对广东地区20株鸭疫里氏杆菌的血清型鉴定结果显示有15株为10型,但仅有3株为Ⅰ型。张济培等[25]对珠三角地区100株鸭疫里氏杆菌进行血清型鉴定,发现有83株为Ⅰ型血清型。而本研究对近十年来广东省220株鸭疫里氏杆菌进行了血清型鉴定,发现Ⅰ型血清型菌株占总分离株的54.09%,虽然不同年间Ⅰ型血清型所占比例各不相同,但总体而言Ⅰ型血清型仍然是优势血清型。与之前该地区优势血清型流行情况相比,本试验调查结果与其基本保持一致,即:呈现出以Ⅰ型血清型为主要流行血清型,其他血清型同时存在的流行趋势。将本试验结果与吴彩燕等[23]、张济培等[25]所报道的广东地区鸭疫里氏杆菌Ⅰ型血清型所占比例进行对比,发现本研究得到的Ⅰ型血清型菌株所占比例严重下降,但与魏秀丽等[24]报道的对比,Ⅰ型血清型菌株所占比例明显升高,这可能与不同实验室分离的菌株来源不同有关,同时也与之前张大丙和郭玉璞[5]、程安春等[12]报道的鸭疫里氏杆菌血清型流行情况基本相符:即使是同一地方,不同时间内,鸭疫里氏杆菌主要流行血清型也会随着时间的改变而改变。
研究也发现,即使是在同一时间同一地区,不同鸭场的优势血清型不尽相同。例如同为2015年在广州采集到的病料,增城区分得的鸭疫里氏杆菌优势血清型为Ⅰ型,花都区分得的则非Ⅰ型,这可能是不同养殖场引进的种鸭或种鹅不同。同一鸭场不同时间也会存在不同的血清型,如同为在广东佛山三水一个养殖场采集到的鹅源病料,RAGD204FSGoose2015、RAGD205FSGoose2015、RAGD206FSGoose、RAGD318FSGoose2016为Ⅰ型血清型,而RAGD313FSGoose2016为非Ⅰ型,推测此鹅场可能引进新的雏鹅或在繁殖过程中发生血清型变化。
对鸭疫里氏杆菌分子学分型的方法有很多,各有优缺点[14]。Kiss等[26]首次运用PFGE技术和Eric-PCR技术对鸭疫里氏杆菌进行菌株间亲缘鉴定,两者分型的结果具有相似性,故认为两种方法都可以作为分子分型的方法。仲崇岳[21]运用快速脉冲场凝胶电泳技术对四川地区70多株鸭疫里氏杆菌进行分型得到了60种表型(以相似度80%为标准)。本研究室近年来对鸭疫里氏杆菌PFGE分型的方法进行研究,Sun等[19]对68株鸭疫里氏杆菌进行PFGE分型,有43株成功分型,并以85%的相似度作为标准将其分成了13种表型。张亚楠等[20]对广东地区115株鸭疫里氏杆菌进行SmaⅠ-PFGE分型,仅有58株分型成功,推测鸭疫里氏杆菌血清型可能会对脉冲场凝胶电泳产生影响。因此,本研究对Ⅰ型血清型鸭疫里氏杆菌进行了PFGE分型。根据之前的研究,对现有的实验室技术进行改进,增加了溶菌酶的含量以及裂解时间,使得菌体得到充分的裂解。119株Ⅰ型血清型鸭疫里氏杆菌中共有110株成功分型。但仍有9株未成功分型,这可能与菌株自身有关,也可能与PFGE实验操作过程中某些参数设置有关,因此需要进一步的研究与优化。
通过SmaⅠ酶对鸭疫里氏杆菌基因组不同位点进行酶切,并运用PFGE分型技术将同一血清型的菌株根据相似度≥85%分成不同的条带型别,110株菌可得到33种不同的表型。同一血清型经PFGE分型后得到不同表型说明PFGE分型法比血清学分型法分辨力更高。这33种不同的SmaⅠ-PFGE表型可分为19个簇和14个单一型。在这19个簇中,不同簇所含菌株数量不相同,优势簇Cluster F和S含有较多菌株(12株),而其他簇所含菌株量都较少,如仅含有2个菌株的Cluster C、J、M、N、P;含有3个菌株的Cluster A、E、Q、R等。另外不同簇之间相似度相差很大,例如,Cluster D和Cluster E之间相似度为84%,而Cluster E与Cluster S之间相似度仅为19%。
根据PFGE分型图谱发现,即使是同一养殖场Ⅰ型血清型的鸭疫里氏杆菌,也存在多样化的遗传背景,例如:RAGD201GZGoose2015和RAGD203GZGoose2015的SmaⅠ-PFGE遗传图谱同属于Cluster F,它们之间的相似度达到了99%,而与RAGD202GZGoose2015相比则相差甚远。鸭疫里氏杆菌在局部地区不仅具有多样化的遗传背景,同时还存在克隆传播。以优势簇Cluster F为例,RAGD201GZGoose2015、RAGD103GZDuck2010、RAGD147QYGoose2015及RAGDFSDuck2015,是分别来自广州、清远、佛山不同时间、不同来源的优势簇菌株,从PFGE关系图谱来看他们是属于同一进化群的,具有相似度很高的SmaⅠ-PFGE遗传图谱。此外还发现,同一进化群的鸭疫里氏杆菌对雏鸭、雏鹅的侵害是不分种属的,既可在种属之内、之间相互感染,也可在种属之间相互感染。
本文对2007—2017年广东地区分离的鸭里氏杆菌Ⅰ型血清型进行调查和鉴定,并运用脉冲场凝胶电泳技术对菌株进行分子分型,不仅从宏观的角度上为该地区鸭疫里氏杆菌病的疫苗的研发及使用提供参考指导,使得疾病的发生和治疗有了相应的依据。还在分子层次上将PFGE技术应用于监测所得的菌株,建立了近年来广东地区优势血清型鸭疫里氏杆菌遗传图谱,揭示了优势血清型鸭疫里氏杆菌的遗传多态性及传播特性,有助于实现该菌的主动监测和传染源溯源,对控制鸭疫里氏杆菌引起的动物源性疾病的流行有着重要的意义。
4 结论本研究通过对广东地区220株鸭疫里氏杆菌进行Ⅰ型血清型鉴定,并对血清Ⅰ型菌株进行SmaⅠ-PFGE分子分型,发现Ⅰ型血清型为近年来广东地区鸭疫里氏杆菌的优势血清型,且Ⅰ型血清型菌株之间分子型别呈现多样化,同源性差异较高,但存在小范围内的克隆传播。
| [1] | WANG X J, LIU W B, ZHU D K, et al. Comparative genomics of Riemerella anatipestifer reveals genetic diversity[J]. BMC Genomics, 2014, 17: 479. |
| [2] | CHEN Y P, LEE S H, CHOU C H, et al. Detection of florfenicol resistance genes in Riemerella anatipestifer isolated from ducks and geese[J]. Vet Microbiol, 2012, 154(3-4): 325–331. DOI: 10.1016/j.vetmic.2011.07.012 |
| [3] | WANG X L, DING C, WANG S H, et al. Whole-genome sequence analysis and genome-wide virulence gene identification of Riemerella anatipestifer Strain Yb2[J]. Appl Environ Microbiol, 2015, 81(15): 5093–5102. DOI: 10.1128/AEM.00828-15 |
| [4] |
王晓佳.不同血清型的鸭疫里默氏杆菌全基因组结构特点[D].雅安: 四川农业大学, 2013.
WANG X J. Genome structural characteristics of the different serotypes Riemerella anatipestifer[D]. Ya'an: Sichuan Agricultural University, 2013. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10626-1014103185.htm |
| [5] |
张大丙, 郭玉璞. 我国鸭疫里氏杆菌血清型的鉴定[J]. 畜牧兽医学报, 1999, 30(6): 536–542.
ZHANG D B, GUO Y P. Serotypes of Riemerella anatipestifer isolates from ducks in China[J]. Acta Veterinaria et Zootechnica Sinica, 1999, 30(6): 536–542. (in Chinese) |
| [6] |
吴彩艳, 程淑琴, 张建峰, 等. 我国鸭疫里氏杆菌病流行概述[J]. 动物医学进展, 2017, 38(6): 86–90.
WU C Y, CHENG S Q, ZHANG J F, et al. Introduction to epidemiology of Riemerellosis anatipestifer disease in China[J]. Progress in Veterinary Medicine, 2017, 38(6): 86–90. DOI: 10.3969/j.issn.1007-5038.2017.06.020 (in Chinese) |
| [7] | CHA S Y, SEO H S, WEI B, et al. Surveillance and characterization of Riemerella anatipestifer from wild birds in South Korea[J]. J Wildl Dis, 2015, 51(2): 341–347. DOI: 10.7589/2014-05-128 |
| [8] | CHIKUBA T, UEHARA H, FUMIKURA S, et al. Riemerella anatipestifer infection in domestic ducks in Japan, 2014[J]. J Vet Med Sci, 2016, 78(10): 1635–1638. DOI: 10.1292/jvms.16-0278 |
| [9] |
郑立森, 范光勤, 李舫, 等. 山东鸭疫里氏杆菌血清型鉴定及免疫防制[J]. 畜牧与兽医, 2005, 37(8): 46–47.
ZHENG L S, FAN G Q, LI F, et al. Serotype identification and immune control of Riemerella anatipestifer in Shandong[J]. Animal Husbandry & Veterinary Medicine, 2005, 37(8): 46–47. DOI: 10.3969/j.issn.0529-5130.2005.08.021 (in Chinese) |
| [10] |
蔡秀磊, 韦强, 崔言顺, 等. 浙江省22株鸭疫里默氏杆菌的血清型鉴定及耐药性研究[J]. 浙江农业学报, 2007, 19(1): 46–49.
CAI X L, WEI Q, CUI Y S, et al. Serotype identification and drug sensitivity test of 22 strains of Riemerella anatipestifersis isolated from ducks in Zhejiang province[J]. Acta Agriculturae Zhejiangensis, 2007, 19(1): 46–49. DOI: 10.3969/j.issn.1004-1524.2007.01.011 (in Chinese) |
| [11] |
吴礼洁, 陈泽祥. 鸭疫里氏杆菌不同血清型广西株的分离鉴定[J]. 中国兽医科技, 2001, 31(3): 13–14.
WU L J, CHEN Z X. Isolation and characterization of different serotype strains Guangxi of Riemerella anatipestifer[J]. Chinese Journal of Veterinary Science and Technology, 2001, 31(3): 13–14. DOI: 10.3969/j.issn.1673-4696.2001.03.005 (in Chinese) |
| [12] |
程安春, 汪铭书, 陈孝跃, 等. 我国鸭疫里默氏杆菌血清型调查及新血清型的发现和病原特性[J]. 中国兽医学报, 2003, 23(4): 320–323.
CHENG A C, WANG M S, CHEN X Y, et al. Epidemiology and new serotypes of Riemerella anatipestifer isolated from ducks in China and studies on their pathogenic characteristics[J]. Chinese Journal of Veterinary Science, 2003, 23(4): 320–323. DOI: 10.3969/j.issn.1005-4545.2003.04.004 (in Chinese) |
| [13] |
刘闯, 陈锋, 廖理克, 等. 鸭疫里默氏杆菌血清型的研究进展[J]. 湖北农业科学, 2008, 47(3): 355–357.
LIU C, CHEN F, LIAO L K, et al. Research progress on serotype of Riemerella anatipestifer[J]. Hubei Agricultural Sciences, 2008, 47(3): 355–357. DOI: 10.3969/j.issn.0439-8114.2008.03.038 (in Chinese) |
| [14] |
周迪, 朱必凤. 鸭疫里氏杆菌分子分型技术研究进展[J]. 畜牧与兽医, 2014, 46(4): 103–105.
ZHOU D, ZHU B F. Advances in molecular classification techniques of Riemerella anatipestifer[J]. Animal Husbandry & Veterinary Medicine, 2014, 46(4): 103–105. (in Chinese) |
| [15] |
张文通, 魏凤, 李峰, 等. 鸭疫里氏杆菌病的研究进展[J]. 水禽世界, 2016(2): 43–48.
ZHANG W T, WEI F, LI F, et al. Research progress of Riemerella anatipestifer disease[J]. Shuiqin Shijie, 2016(2): 43–48. (in Chinese) |
| [16] |
夏季. 分子生物学技术应用于病原微生物分子分型的研究进展[J]. 国际检验医学杂志, 2010, 31(11): 1278–1279.
XIA J. Molecular biology technology applied to molecular classification of pathogenic microorganisms[J]. International Journal of Laboratory Medicine, 2010, 31(11): 1278–1279. DOI: 10.3969/j.issn.1673-4130.2010.11.033 (in Chinese) |
| [17] |
叶蕊, 石丽媛, 王鹏, 等. 脉冲场凝胶电泳技术简介及其在细菌分子分型中的应用[J]. 中国媒介生物学及控制杂志, 2013, 24(2): 182–185.
YE R, SHI L Y, WANG P, et al. Brief introduction of pulsed-field gel electrophoresis and its application in bacterial molecular typing[J]. Chinese Journal of Vector Biology and Control, 2013, 24(2): 182–185. (in Chinese) |
| [18] |
丁水军. 脉冲场凝胶电泳技术及其在病原菌分子分型中的应用[J]. 中国卫生检验杂志, 2009, 19(4): 962–964.
DING S J. Pulsed-field gel electrophoresis and its application in molecular typing of pathogenic bacteria[J]. Chinese Journal of Health Laboratory Technology, 2009, 19(4): 962–964. (in Chinese) |
| [19] | SUN N, LIU J H, YANG F, et al. Molecular characterization of the antimicrobial resistance of Riemerella anatipestifer isolated from ducks[J]. Vet Microbiol, 2012, 158(3-4): 376–383. DOI: 10.1016/j.vetmic.2012.03.005 |
| [20] |
张亚楠, 蒋红霞, 李亚菲, 等. 115株鸭疫里氏杆菌的PFGE分型[J]. 中国兽医科学, 2016, 46(12): 1568–1574.
ZHANG Y N, JIANG H X, LI Y F, et al. PFGE analysis of 115 Riemerella anatipestifer strains[J]. Chinese Veterinary Science, 2016, 46(12): 1568–1574. (in Chinese) |
| [21] |
仲崇岳.鸭疫里默氏杆菌基因分型及耐药机理的研究[D].雅安: 四川农业大学, 2009.
ZHONG C Y. Study on multi-drug resistance mechanism and genotyping of R. anatipestifer[D]. Ya'an: Sichuan Agricultural University, 2009. (in Chinese) http://cdmd.cnki.com.cn/article/cdmd-10626-2009258877.htm |
| [22] | TENOVER F C, ARBEIT R D, GOERING R V, et al. Interpreting chromosomal DNA restriction patterns produced by pulsed-field gel electrophoresis:criteria for bacterial strain typing[J]. J Clin Microbiol, 1995, 33(9): 2233–2239. |
| [23] |
吴彩艳, 覃宗华, 袁建丰, 等. 广东地区鸭疫里氏杆菌的血清型及抗药性情况调查[J]. 畜牧与兽医, 2009, 41(5): 22–25.
WU C Y, QIN Z H, YUAN J F, et al. Serotypes and drug resistances of Rimerella anatipestifer isolates from Guangdong districts[J]. Animal Husbandry & Veterinary Medicine, 2009, 41(5): 22–25. (in Chinese) |
| [24] |
魏秀丽, 张兴晓, 姜世金, 等. 广东地区鸭疫里默氏杆菌的分离鉴定及双重PCR检测方法的建立[J]. 中国兽医学报, 2009, 29(6): 721–725.
WEI X L, ZHANG X X, JIANG S J, et al. Isolation, identification and development of duplex PCR method for detection of Riemerella anatipestifer from Guangdong province[J]. Chinese Journal of Veterinary Science, 2009, 29(6): 721–725. (in Chinese) |
| [25] |
张济培, 张小峰, 陈建红, 等. 珠三角及邻地鸭疫里默氏杆菌主要生物学特性的研究[J]. 中国预防兽医学报, 2012, 34(2): 100–103.
ZHANG J P, ZHANG X F, CHEN J H, et al. The main biological characterizations of Rimerella anatipester isolates derived from the Delta of Pearl River Areas[J]. Chinese Journal of Preventive Veterinary Medicine, 2012, 34(2): 100–103. DOI: 10.3969/j.issn.1008-0589.2012.02.05 (in Chinese) |
| [26] | KISS I, KARDOS G, NAGY J, et al. DNA fingerprinting of Riemerella anatipestifer isolates from ducks[J]. Vet Rec, 2007, 160(1): 26–28. DOI: 10.1136/vr.160.1.26 |



