流行性乙型脑炎(epidemic encephalitis B),又称日本乙型脑炎,简称乙脑,是由日本脑炎病毒(Japanese encephalitis virus, JEV)引起的一种自然疫源性人畜共患传染病[1]。该病是一种蚊媒传播的中枢神经系统性传染病,主要分布于亚洲地区和西太平洋沿岸[2-3]。
JEV是黄病毒科黄病毒属成员,基因组长约10 970 nt,编码一个多聚蛋白的开放阅读框(ORF),多聚蛋白裂解后形成3种结构蛋白(C、prM和E)和7种非结构蛋白(NS1、NS2A、NS2B、NS3、NS4A、NS4B和NS5)[4]。囊膜蛋白(envelope protein,E蛋白)是JEV最主要的结构蛋白和免疫原性蛋白,在介导病毒的吸附、融合,决定病毒的血凝活性、细胞嗜性、病毒毒力及诱导宿主保护性免疫反应方面起重要作用[5]。E蛋白膜外区含3个结构域,其中结构域Ⅲ (EDⅢ)呈免疫球蛋白样结构,是JEV结合受体的主要部位,具有良好的免疫原性[6]。
自然界中的多种动物和人类均可以感染JEV,其中猪是JEV最重要的扩增宿主,在JEV的流行中起到了重要的作用[7]。除此之外,畜禽以及野生动物也会对JEV的流行和传播产生一定的影响[8]。因此,对于JEV抗体水平的监测有利于及时掌控JEV的感染及流行情况,常用的JEV血清抗体检测方法主要有血清中和试验(SNT)、间接免疫荧光试验(IFA)、血凝抑制试验(HI)和酶联免疫吸附试验(ELISA)。比较而言[9],ELISA具有操作简便、快速、易批量化等优点,更适合于大规模JE流行病学调查以及临床推广应用,ELISA现已成为多种动物检测JEV抗体的首选方法[8]。到目前为止,国内外已建立多种关于不同动物及人类血清JEV抗体检测的ELISA,但是关于检测乙脑抗体的阻断ELISA却未有报道[10-11]。由于阻断ELISA具有特异性强、适用性广的特点,其在西尼罗河病毒(WNV)等黄病毒抗体的检测中已经得到了广泛的应用[12]。
临床上关于不同动物血清中JEV抗体的检测主要是以间接ELISA为主,市场上已经存在多种商品化间接ELISA试剂盒,但是尚无可以同时应用于检测不同动物JEV抗体的阻断ELISA试剂盒。为了开发可以应用于检测不同种类动物JEV抗体的阻断ELISA,本研究建立了以重组JEV EDⅢ蛋白作为包被抗原、HRP标记的JEV单抗作为检测抗体的阻断ELISA,并初步应用该方法对临床猪、牛和羊血清进行了流行病学调查。
1 材料与方法 1.1 细胞、质粒、血清及主要试剂分泌抗JEV EDⅢ蛋白单克隆抗体(1B10、1C4和6F10)的杂交瘤细胞株和pET-28a-JEV-EDⅢ原核表达质粒由本实验室制备及保存;JEV抗体标准阴、阳性血清由本实验室保存,猪圆环病毒2型(PCV2)抗体阳性血清、猪伪狂犬病病毒(PRV)抗体阳性血清、猪繁殖与呼吸综合征病毒(PRRSV)抗体阳性血清、猪瘟病毒(CSFV)抗体阳性血清和口蹄疫病毒(FMDV)抗体阳性血清均为商品化试剂盒中的阳性对照。
预染蛋白质Marker、RPMI 1640、Gibco胎牛血清均购自Invitrogen公司;HRP标记羊抗猪IgG购自Abcam公司;TMB显色液购自湖州英创公司;MAb TrapTM Kit购自GE Healthcare公司;其他化学试剂均为国产分析纯。
1.2 JEV EDⅢ蛋白和JEV单克隆抗体的制备 1.2.1 重组JEV EDⅢ蛋白的制备将pET-28a-JEV-EDⅢ质粒转化BL-21大肠杆菌,挑取单菌落,37 ℃培养,IPTG诱导表达6 h后,超声裂解菌体,以8 mol·L-1尿素溶解包涵体后经Ni柱纯化即为纯化后的EDⅢ蛋白。纯化好的EDⅢ蛋白经SDS-PAGE鉴定和蛋白定量仪测定浓度后,保存于-20 ℃备用。
1.2.2 JEV单克隆抗体的制备及标记应用本实验室制备并保存的3株分泌抗JEV EDⅢ蛋白单克隆抗体的杂交瘤细胞株(1B10、1C4和6F10)参照文献[13]制备腹水单抗。采用MAb TrapTM Kit纯化单抗,经间接ELISA测定其效价后进行Western blot鉴定,再将3株单抗送金斯瑞生物技术有限公司进行HRP标记。
1.3 阻断ELISA酶标单抗的筛选 1.3.1 酶标JEV单抗的ELISA相加试验参照文献[14]所述方法,先确定合适的JEV EDⅢ重组蛋白包被浓度,再以直接ELISA测定3株HRP标记的JEV EDⅢ蛋白单抗饱和时的最大稀释度。保持JEV EDⅢ蛋白包被浓度不变,然后将各株单抗两两以各自饱和时的最大稀释度加入同一个包被有EDⅢ蛋白抗原的检测孔内,从而测定抗体的结合水平。为了定量评定相加试验的测试结果,依据下列算式计算相加指数A.I.。
| $ \begin{array}{l} A.I. = \frac{{{A_{1 + 2}} - \frac{{{A_1} + {A_2}}}{2}}}{{{A_1}{\rm{ + }}{A_2} - \frac{{{A_1} + {A_2}}}{2}}} \times 100\% = \\ \;\;\;\;\;\;\;\;\;\left( {\frac{{2{A_{1 + 2}}}}{{{A_1} + {A_2}}} - 1} \right) \times 100\% \end{array} $ |
其中,A1、A2和A1+2分别表示单独的第一种单抗、单独的第二种单抗和两种抗体混合时的OD450 nm值。若两种单抗结合相同的表位,A1+2将会接近于平均值,A.I.将会接近于0。相反,若两种单抗结合不同的表位,A1+2将会接近于加和,A.I.将会接近于100%。A.I.≥50%表明2株单抗识别不同的表位。
1.3.2 酶标JEV单抗的阻断ELISA试验以商品化JEV抗体检测ELISA试剂盒从临床送检血清中随机筛选出15份JEV抗体阳性猪血清和15份JEV抗体阴性猪血清,以3株HRP标记的JEV单抗进行阻断ELISA对比检测,按照公式计算阻断率:阻断率(PI)=(1-被检血清OD450 nm值/阴性血清OD450 nm)×100%,根据阴、阳性猪血清的阻断率分析比较3株单抗的检测效果。
1.4 阻断ELISA反应条件的优化按棋盘法将JEV EDⅢ重组蛋白及选定的酶标单抗分别系列稀释后做方阵滴定,每个稀释度重复一次,取其平均值,计算各组阴、阳性血清的阻断率,选择阴性血清OD450 nm接近1且阳性血清阻断率最高的反应条件作为最佳反应条件;将JEV抗体阳性血清和JEV抗体阴性血清以1:1、1:4、1:50、1:100进行稀释,分别加入5%脱脂乳、2%BSA和5%BSA封闭的ELISA板中,根据阻断率选择合适的血清稀释度以及封闭液;将JEV抗体阳性血清和JEV抗体阴性血清按最佳稀释度在37 ℃分别作用0.5、1、1.5和2 h,根据阻断率选择合适的血清作用时间;将酶标单抗按确定好的稀释倍数加入ELISA板后,37 ℃分别作用0.5、1和1.5 h,根据阻断率结果选择合适的酶标单抗作用时间。
1.5 阻断ELISA临界值的确定取经实验室建立的检测JEV抗体间接ELISA及商品化ELISA试剂盒同时测定为JEV抗体阴性的猪血清样品100份,按已优化反应条件的JEV抗体阻断ELISA检测各血清样品的阻断率,计算出平均阻抑率(x)和标准差(s),分析结果并判定阻断率临界值。
1.6 阻断ELISA的交叉反应性试验以阻断ELISA对PCV2抗体阳性血清、PRV抗体阳性血清、CSFV抗体阳性血清、PRRSV抗体阳性血清以及FMDV抗体阳性血清进行检测,同时设置标准JEV抗体阴、阳性猪血清对照,根据检测结果判定本方法的交叉反应性。
1.7 阻断ELISA的重复性试验同一批次包被处理的阻断ELISA板中,随机取出1块,选取6份不同阻断率的血清样品,每个样品设置3个重复,在同一条件下进行阻断ELISA检测,计算各血清检测结果的批内变异系数。3个不同批次的阻断ELISA板中,各随机取出1块,在同一条件下对6份血清进行阻断ELISA检测,计算各血清检测结果的批间变异系数。
1.8 阻断ELISA与商品化ELISA试剂盒的对比用本试验建立的阻断ELISA与商品化猪乙型脑炎抗体ELISA检测试剂盒(武汉科前生物制品有限公司,批号171210)对比检测285份临床猪血清样品,依据检测结果计算本方法的敏感性、特异性以及与商品化试剂盒的检测符合率。
1.9 临床血清样品的检测以本试验建立的阻断ELISA对2017年8—11月来自安徽、江苏、山东等5省份猪场送检的共275份临床猪血清,以及本实验室收集的来自江苏省东台、溧水、姜堰等9地区共120份牛血清样品、120份羊血清样品进行阻断ELISA检测,根据阻断率临界值对检测结果进行阴阳性判定。
1.10 阻断ELISA与血清中和试验的比较从“1.9”中选取9份猪、牛和羊的血清样品,经56 ℃灭活30 min和0.22 μm无菌过滤后,按1:10、1:20、1:40、1:80、1:160和1:320做倍比稀释进行蚀斑减少血清中和试验(PRNT),同时设置病毒对照孔(100 PFU·mL-1)和正常细胞对照孔以及标准JEV抗体阴、阳性血清对照组。当对照组和对照孔均成立时,计算出相对病毒对照孔蚀斑数减少50%时对应的血清稀释度,作为该血清的中和抗体效价,以血清中和抗体效价≥1:10判定为JEV抗体阳性[15]。
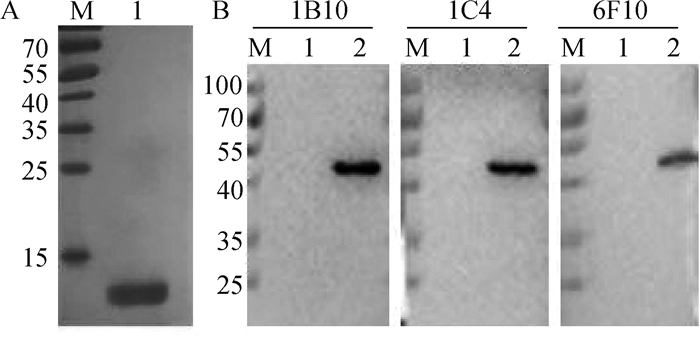
2 结果 2.1 JEV EDⅢ重组蛋白及JEV单克隆抗体的制备与鉴定将纯化的JEV EDⅢ蛋白进行SDS-PAGE电泳,结果显示有1条约14 ku的蛋白质带(图 1A),与EDⅢ蛋白理论大小一致。由JEV EDⅢ蛋白单抗1B10、1C4和6F10的Western blot结果显示(图 1B),3株单抗均可特异性识别JEV E蛋白(53 ku),且与C6/36细胞样品无反应。
|
M.蛋白质相对分子质量标准;A1.纯化的JEV EDⅢ蛋白;B1. C6/36细胞裂解物;B2. JEV感染的C6/36细胞裂解物 M. Protein marker; A1.Purified JEV EDⅢ protein; B1.C6/36 cell lysates; B2.C6/36 cell lysates infected with JEV 图 1 JEV EDⅢ重组蛋白的SDS-PAGE(A)及JEV单抗的Western blot(B)结果 Figure 1 SDS-PAGE of the recombinant JEV EDⅢ protein (A) and Western blot of JEV MAb(B) |
由直接ELISA测定3株HRP标记单抗的结果可知,当JEV EDⅢ蛋白的包被浓度为0.25 μg·mL-1时,HRP-1B10、HRP-1C4和HRP-6F10单抗饱和时的最大稀释度依次为1:6 400、1:6 400和1:3 200。进一步以3株单抗进行直接ELISA相加试验,结果如表 1所示,HRP-1B10单抗和HRP-1C4单抗的A.I.为83.0%,HRP-1B10单抗和HRP-6F10单抗的A.I.为80.8%,HRP-1C4单抗和HRP-6F10单抗的A.I.为90.1%,均高于50%。因此,这3株单抗所识别的抗原表位两两存在相加效应,即3株单抗各自针对不同的表位。
|
|
表 1 3株JEV EDⅢ单抗的相加ELISA结果(A.I.) Table 1 Result of three JEV EDⅢ MAbs additivity ELISA (A.I.) |
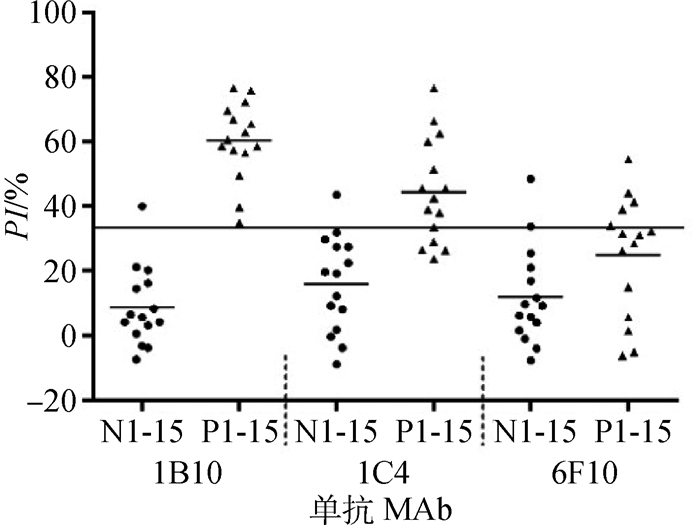
分别以3株酶标JEV单抗作为检测抗体对JEV抗体阴、阳性猪血清进行阻断ELISA检测,结果如图 2所示,HRP-1B10单抗建立的阻断ELISA对15份阳性血清的检测最为敏感,HRP-1C4单抗次之,HRP-6F10单抗相对较差。相比而言,HRP-1B10单抗作为检测抗体时建立的阻断ELISA敏感性和特异性均优于HRP-1C4单抗与HRP-6F10单抗,且阴、阳性血清平均阻断率之间的差异最显著。
|
N1-15.阴性血清1~15; P1-15.阳性血清1~15 N1-15. Negative serum 1-15. P1-15. Positive serum 1-15 图 2 HRP标记JEV单抗的筛选 Figure 2 Selection of HRP conjugated JEV MAb |
通过对各步骤反应条件进行筛选,当JEV EDⅢ蛋白包被浓度为0.05 μg·mL-1且HRP-1B10的稀释度为1:2 000(0.36 μg·mL-1)时阴性血清OD450 nm达到1、阳性血清的阻断率达到最高为74.6%(表 2)。由其他条件的优化结果可知,以2%BSA作为封闭液、以1:1稀释待检血清样品在37 ℃孵育1.5 h、酶标单抗在37 ℃孵育0.5 h时对应的每组阻断率均最高,因此选择以上条件作为建立检测JEV抗体阻断ELISA的条件。
|
|
表 2 最佳抗原包被浓度和酶标单抗稀释度的选择 Table 2 Determination of optimal concentration of antigen and dilution of HRP-MAb |
利用阻断ELISA对100份JEV抗体阴性猪血清检测数据计算可得阻断率平均值x为9.3%,标准差s为8.1%。根据公式x+2s=25%,x+3 s=34%,确定本方法的判定标准:PI≥34%判为阳性;PI≤25%时判为阴性;25% < PI < 34%时判为可疑,需再次复检一次,若仍是PI < 34%判为阴性。
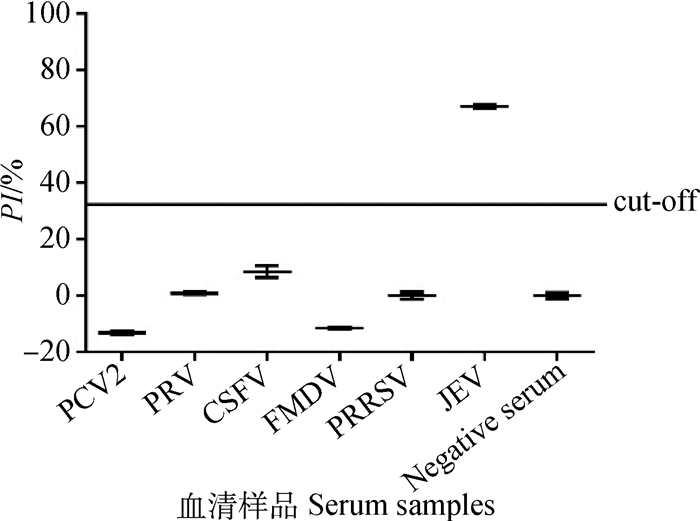
2.5 阻断ELISA的交叉反应性试验以JEV抗体阴、阳性血清为对照,用阻断ELISA对常见猪病毒病抗体阳性血清进行检测,结果如图 3所示,除JEV抗体阳性血清为阳性反应外,其他几种猪病毒病阳性血清均为阴性反应,证明该阻断ELISA方法可特异性检测JEV抗体,与其他几种猪病毒病阳性血清无交叉反应。
|
图 3 阻断ELISA的交叉反应性试验 Figure 3 The results of the cross-reactivity test by blocking ELISA |
选取6份不同阻断率的猪血清样品进行阻断ELISA,根据试验结果可知(表 3),6份猪血清在批内重复性试验的变异系数为0.70%~2.51%,批间重复性试验的变异系数为2.48%~4.92%,均小于5%,证明该阻断ELISA检测方法具有良好的重复性。
|
|
表 3 阻断ELISA方法批内和批间重复性试验 Table 3 The results of intra- and inter- repeatability test by blocking ELISA |
用商品化ELISA试剂盒与本研究建立的阻断ELISA同时对285份临床猪血清样品进行检测,结果经统计分析可知(表 4),用阻断ELISA检测有197份血清样品为阳性,其中商品化ELISA试剂盒检测为JEV抗体阳性的有194份,表明本方法的相对敏感性为98.5%;用阻断ELISA检测有88份血清样品为阴性,其中商品化ELISA试剂盒检测为JEV抗体阴性的有83份,表明本方法的相对特异性为94.3%;阻断ELISA与商品化试剂盒检测结果符合率为97.2%。
|
|
表 4 阻断ELISA与商品化试剂盒检测结果的比较 Table 4 Comparison of the results of JEV antibody detection by blocking-ELISA and commercialization Kit |
采用本研究建立的阻断ELISA对275份临床猪血清和240份临床牛、羊血清进行JEV抗体的检测,结果如表 5所示,275份猪血清中,81份商品猪血清JEV抗体阳性检出率为55.6%,194份种猪血清JEV抗体阳性检出率为82.5%,总检出率为74.5%。120份牛血清样品中JEV抗体阳性检出率为13.3%,120份羊血清样品中JEV抗体阳性检出率为9.2%,表明临床猪、牛和羊血清中均存在不同水平的JEV抗体,其中种猪血清样品的JEV抗体阳性率最高。
|
|
表 5 猪、牛和羊的JEV抗体阻断ELISA检测结果 Table 5 Results of JEV antibodies detection of swine、cattle and sheep serum by blocking ELISA |
由PRNT结果可知,每组的正常细胞对照孔均无空斑形成,JEV抗体阳性血清组的中和抗体效价为1:320,阴性血清组的中和抗体效价小于1:10。将9份血清的阻断率及中和抗体效价汇总如表 6所示,经阻断ELISA判定为JEV抗体阳性的血清对JEV产生50%蚀斑抑制时对应的中和抗体效价在1:80~1:320之间;判定为JEV抗体阴性的血清对JEV无显著的蚀斑抑制作用,中和抗体效价均小于1:10。结果表明,9份临床血清样品的阻断ELISA检测结果和血清中和试验检测结果一致。
|
|
表 6 临床动物血清样品的JEV中和试验结果 Table 6 Results of JEV neutralization test of clinical animal serum samples |
本研究以3株JEV单抗作为基础,进行了阻断ELISA检测抗体筛选。由相加ELISA试验结果可知,3株JEV单抗所识别的JEV EDⅢ蛋白上的抗原表位是不同的。分析3株酶标JEV单抗分别作为检测抗体建立的阻断ELISA检测结果可知,它们对30份JEV抗体阴阳性血清的敏感性和特异性存在一定差异,尤其是对JEV抗体阳性血清的阻断效果差异显著,表明临床猪血清样品中针对这3株单抗识别的抗原表位所产生的抗体水平是不同的。自然状态下病毒感染机体时,一方面由于病毒蛋白上存在众多表位,因此依据各表位的抗原性不同而有优势表位和非优势表位之分,机体会优先产生针对优势抗原表位的抗体;另一方面由于病毒存在不同的基因型或是不同的毒株,因此会导致抗原表位的变异现象,抗原表位在不同病毒上的保守程度是不同的,通常针对保守表位的抗体适用性更加广泛[16]。结合试验结果,本研究选择了对JEV抗体阴阳性猪血清阻断效果最佳的HRP-1B10单抗作为建立JEV抗体阻断ELISA的检测抗体。
相比大多商品化ELISA试剂盒采用JEV全病毒作为包被抗原而会产生相对较高的实验成本及假阳性结果,本研究使用原核系统表达的重组JEV EDⅢ蛋白作为包被抗原,既操作简单、容易大量制备,也降低了实验成本[17]。同时,本研究选用经过筛选的JEV单抗HRP-1B10作为阻断ELISA的检测抗体,一方面,特异性的JEV酶标单抗与血清中JEV抗体竞争结合抗原蛋白,从而减少非特异性反应的发生,提高检测的准确性;另一方面,以特异性的JEV酶标单抗作为检测抗体,还可以不受动物种属的限制,避免了为每种动物血清都配备相应的二抗,从而简化操作步骤,为同时检测多种动物血清JEV抗体提供了可能[18]。在此基础上,通过对阻断ELISA反应条件的优化,保证了对JEV抗体阳性血清检测的灵敏性与特异性。与国产商品化ELISA试剂盒的对比试验中,两者的符合率为97.2%,表明本研究建立的阻断ELISA具有良好应用前景。
运用阻断ELISA对来自5个省份的275份临床猪血清样品和来自江苏地区的120份牛血清样品及120份羊血清样品进行JEV抗体水平的检测,发现经过常规JE疫苗免疫的种猪群中JEV抗体阳性率在82.5%左右,虽然不同省份的猪场疫苗免疫效果存在一定差异,但依旧使种猪群体产生了较高的JEV抗体水平,说明了疫苗免疫对于种猪群预防JEV的感染是十分重要的;商品猪群中JEV抗体阳性率为55.6%,其中部分来自于仔猪群的待检血清出现较高的阳性率可能是由于母源抗体的存在而导致的,而保育和育肥猪群中母源抗体已经逐渐消减,因此出现较高的抗体水平则提示可能存在一定的JEV野毒感染[19-21];临床的牛、羊血清中JEV抗体阳性检出率分别为13.3%和9.2%,表明牛、羊中也存在JEV感染的情况[22-23]。为了进一步评价该阻断ELISA对临床动物血清JEV抗体检测中的可靠性,选取了9份血清样品进行血清中和试验验证,发现两者的符合率为100%,表明本研究建立的阻断ELISA能够适用于同时对大量的猪、牛和羊临床待检血清中JEV抗体的检测。该阻断ELISA不仅为JE流行病学调查、免疫监测和疫病诊断提供了一种新的检测方法,也为多种动物JEV抗体检测阻断ELISA试剂盒的研制奠定了基础。
4 结论成功建立了适用于猪、牛和羊血清中JEV抗体检测的阻断ELISA,相比于常规的ELISA检测方法具有明显的优势。
| [1] |
陈溥言.
兽医传染病学[M]. 5版. 北京: 中国农业出版社, 2006.
CHEN P Y. Veterinary lemology[M]. 5th ed. Beijing: China Agriculture Press, 2006. (in Chinese) |
| [2] | MORITA K. Molecular epidemiology of Japanese encephalitis in East Asia[J]. Vaccine, 2009, 27(50): 7131–7132. DOI: 10.1016/j.vaccine.2009.09.051 |
| [3] | WANG H Y, TAKASAKI T, FU S H, et al. Molecular epidemiological analysis of Japanese encephalitis virus in China[J]. J Gen Virol, 2007, 88(3): 885–894. DOI: 10.1099/vir.0.82185-0 |
| [4] | CHAMBERS T J, HAHN C S, GALLER R, et al. Flavivirus genome organization, expression, and replication[J]. Annu Rev Microbiol, 1990, 44: 649–688. DOI: 10.1146/annurev.mi.44.100190.003245 |
| [5] | YE Q, XU Y P, ZHANG Y, et al. Genotype-specific neutralization determinants in envelope protein:implications for the improvement of Japanese encephalitis vaccine[J]. J Gen Virol, 2015, 96(8): 2165–2175. DOI: 10.1099/vir.0.000160 |
| [6] | LUCA V C, ABIMANSOUR J, NELSON C A, et al. Crystal structure of the Japanese encephalitis virus envelope protein[J]. J Virol, 2012, 86(4): 2337–2346. DOI: 10.1128/JVI.06072-11 |
| [7] | TURTLE L, SOLOMON T. Japanese encephalitis-the prospects for new treatments[J]. Nat Rev Neurol, 2018, 14(5): 298–313. DOI: 10.1038/nrneurol.2018.30 |
| [8] | CSANK T, DRZEWNIOKOVÁ P, KORYTÁR L, et al. A serosurvey of flavivirus infection in horses and birds in slovakia[J]. Vector Borne Zoonotic Dis, 2018, 18(4): 206–213. DOI: 10.1089/vbz.2017.2216 |
| [9] | PIYASENA T B H, SETOH Y X, HOBSON-PETERS J, et al. Differential diagnosis of flavivirus infections in horses using viral envelope protein domain Ⅲ antigens in enzyme-linked immunosorbent assay[J]. Vector Borne Zoonotic Dis, 2017, 17(12): 825–835. DOI: 10.1089/vbz.2017.2172 |
| [10] | GALULA J U, CHANG G J J, CHUANG S T, et al. Establishment of an algorithm using prM/E-and NS1-specific IgM antibody-capture enzyme-linked immunosorbent assays in diagnosis of Japanese encephalitis virus and west nile virus infections in humans[J]. J Clin Microbiol, 2016, 54(2): 412–422. DOI: 10.1128/JCM.02469-15 |
| [11] |
祖立闯, 王金良, 管宇, 等. 流行性乙型脑炎病毒E蛋白的截短表达与间接ELISA诊断方法的建立[J]. 中国预防兽医学报, 2010, 32(3): 200–204, 231.
ZU L C, WANG J L, GUAN Y, et al. Development of an indirect ELISA for detecting antibodies to japanese encephalitis virus using recombinant truncated glycoprotein E expressed in E. coil[J]. Chinese Journal of Preventive Veterinary Medicine, 2010, 32(3): 200–204, 231. (in Chinese) |
| [12] | HIROTA J, SHIMOJI Y, SHIMIZU S. New sensitive competitive enzyme-linked immunosorbent assay using a monoclonal antibody against nonstructural protein 1 of west nile virus NY99[J]. Clin Vaccine Immunol, 2012, 19(2): 277–283. DOI: 10.1128/CVI.05382-11 |
| [13] |
倪慧, 王钰, 毛岩, 等. 日本脑炎病毒囊膜蛋白单克隆抗体的制备及特性分析[J]. 畜牧与兽医, 2016, 48(7): 1–9.
NI H, WANG Y, MAO Y, et al. Preparation and characterization of monoclonal antibodies against envelope protein of Japanese encephalitis virus[J]. Animal Husbandry & Veterinary Medicine, 2016, 48(7): 1–9. (in Chinese) |
| [14] | FRIGUET B, DJAVADI-OHANIANCE L, PAGES J, et al. A convenient enzyme-linked immunosorbent assay for testing whether monoclonal antibodies recognize the same antigenic site. Application to hybridomas specific for the β2-subunit of Escherichia coli tryptophan synthase[J]. J Immunol Methods, 1983, 60(3): 351–358. DOI: 10.1016/0022-1759(83)90292-2 |
| [15] | HOMBACH J, SOLOMON T, KURANE I, et al. Report on a WHO consultation on immunological endpoints for evaluation of new Japanese encephalitis vaccines, WHO, Geneva, 2-3 September, 2004[J]. Vaccine, 2005, 23(45): 5205–5211. DOI: 10.1016/j.vaccine.2005.07.002 |
| [16] | KEDL R M, KAPPLER J M, MARRACK P. Epitope dominance, competition and T cell affinity maturation[J]. Curr Opin Immunol, 2003, 15(1): 120–127. DOI: 10.1016/S0952-7915(02)00009-2 |
| [17] |
马淑娟, 熊益权, 张琼花, 等. 三种ELISA试剂盒检测猪流行性乙型脑炎病毒血清IgG抗体比较[J]. 中国人兽共患病学报, 2015, 31(5): 423–426.
MA S J, XIONG Y Q, ZHANG Q H, et al. Comparison of three commercial ELISA kits for detection of antibodies against Japanese encephalitis virus in swine sera[J]. Chinese Journal of Zoonoses, 2015, 31(5): 423–426. DOI: 10.3969/cjz.j.issn.1002-2694.2015.05.007 (in Chinese) |
| [18] | MAO L, LI W L, ZHOU T C, et al. Development of a blocking ELISA for Caprine parainfluenza virus type 3[J]. J Virol Methods, 2017, 250: 59–65. DOI: 10.1016/j.jviromet.2017.09.028 |
| [19] | CHAI C X, WANG Q, CAO S J, et al. Serological and molecular epidemiology of Japanese encephalitis virus infections in swine herds in China, 2006-2012[J]. J Vet Sci, 2018, 19(1): 151–155. DOI: 10.4142/jvs.2018.19.1.151 |
| [20] | RICKLIN M E, GARCÍA-NICOLÍS O, BRECHBUHL D, et al. Vector-free transmission and persistence of Japanese encephalitis virus in pigs[J]. Nat Commun, 2016, 7: 10832. DOI: 10.1038/ncomms10832 |
| [21] | MANSFIELD K L, HERNÁNDEZ-TRIANA L M, BANYARD A C, et al. Japanese encephalitis virus infection, diagnosis and control in domestic animals[J]. Vet Microbiol, 2017, 201: 85–92. DOI: 10.1016/j.vetmic.2017.01.014 |
| [22] | HUBÁLEK Z, RUDOLF I, NOWOTNY N. Arboviruses pathogenic for domestic and wild animals[J]. Adv Virus Res, 2014, 89: 201–275. DOI: 10.1016/B978-0-12-800172-1.00005-7 |
| [23] | CHOWDHURY S, KHAN S U, CRAMERI G, et al. Serological evidence of henipavirus exposure in cattle, goats and pigs in Bangladesh[J]. PLoS Negl Trop Dis, 2014, 8(11): e3302. DOI: 10.1371/journal.pntd.0003302 |



