家禽通过肉、蛋为人类提供了大量的蛋白来源,近些年来,家禽育种工作一直在进步,但关于家禽的营养需要标准过于陈旧,使得日粮配制所参考的营养需要标准与目前动物机体真正所需要的标准之间在某种程度上存在一定偏差,再加上高度集约化养殖中不可避免的存在的环境管理问题等,导致现阶段家禽养殖中面临很多诸如动物抗应激能力差、免疫功能低下、出现未知代谢性疾病等问题。
肝是机体重要的代谢器官,在营养物质合成、转运和储存,以及外源物质的代谢解毒等方面均发挥重要作用[1]。因此,原代肝细胞体外培养是动物代谢、药理和毒理学研究的良好模型,小鼠原代肝细胞被用来研究纳米金属氧化物对其脂代谢的影响[2],鱼的肝细胞被分离培养用来进行药物毒理学研究[3],鸡的原代肝细胞也被用来进行研究药物代谢、毒物耐受等[4-6]。叶酸是水溶性的B族维生素,有研究表明,胚胎期注射叶酸可通过改变表观遗传修饰来影响基因表达,促进胚胎发育[7],改善免疫功能,进而促进肉鸡生产性能的提高[8]。Allah和Badary[9]研究指出,叶酸可通过降低炎症因子的表达和脂质的过氧化来缓解乙酸铅所诱导的肝细胞损伤。除此之外,叶酸也参与调控鸡原代肝细胞脂质代谢相关基因的表达[10]。综上可知,叶酸参与影响机体的很多代谢过程。
近些年来,组学技术的快速发展和应用为解析科学中的生物学本质进程提供了很多便捷,代谢组学可以检测到一系列低分子量的代谢小分子,为明晰机体特定时间下具体发生的代谢变化指出精准的方向。本试验以鸡原代肝细胞为研究对象,通过给予不同叶酸含量的培养基进行处理,并借助GC-MS技术对细胞进行代谢组检测,旨在探究叶酸对鸡原代肝细胞代谢的影响,为叶酸参与细胞代谢的调控机制及其在家禽养殖中的合理有效应用提供理论基础和科学依据。
1 材料与方法 1.1 主要试剂和仪器叶酸和胶原酶Ⅳ购自Sigma公司;RPMI 1640无叶酸培养基以及青链霉素(双抗)购自Gibco公司;胎牛血清购自南美BIOWEST公司;鸡淋巴细胞分离液购自天津灏洋生物制品科技有限公司。试验仪器主要有:细胞培养六孔板(美国康宁公司)、CO2培养箱、摇床、倒置显微镜等。
1.2 试验设计及样品收集从陕西杨凌巨隆禽业有限公司购买1日龄刚出壳健康海兰褐公鸡,解剖获取肝,并分离得到鸡原代肝细胞,具体方法参照本团队前期的报道[10],分离得到的细胞经形态和染色鉴定符合肝细胞的特性,可用于后续试验,且本试验中所用的叶酸添加剂量并未对细胞产生毒性作用[10]。待细胞长至铺满板底80%左右时,开始换处理培养基,分别为对照组(A组,无叶酸培养基)和叶酸添加组(C组,15 mg·L-1叶酸), 每个处理6个重复,处理时间为12 h。处理完成后,吸除培养基,用PBS缓冲液清洗细胞3次,再加入250 μL冰冷的甲醇,用细胞刮将细胞刮下来并移入1.5 mL离心管中,再加入等体积的水清洗培养皿,并移入离心管,与甲醇溶液混合后超低温冰箱冻存,以供代谢组学检测。同样的细胞培养处理方法,胰酶消化后清洗收集细胞沉淀,并冻存待测细胞内物质含量。
1.3 样品预处理将含有500 μL 50%甲醇的混合溶液在冰水浴中超声15 min,然后-20 ℃静置24 h,离心(12 000 r·min-1,4 ℃,15 min)。取180 μL上清液于GC衍生瓶中,加入10 μL内标(0.05 mg·mL-1 13C3- 15N-L-alanine、13C5-15N-L-valine和13C6-15N-L-isoleucine),在温和氮气下干燥。向衍生瓶中加入30 μL 20 mg·mL-1的甲氧胺盐酸盐吡啶溶液,充分振荡30 s,于37 ℃孵育90 min。向衍生瓶中加入30 μL的BSTFA(含1%TMCS),于70 ℃孵育60 min,室温冷却后,待GC-MS代谢组学分析。
1.4 GC-MS检测及数据分析气相色谱和质谱分析委托上海谱领生物科技有限公司进行,具体设备型号、GC-MS检测条件以及数据分析方法参照刘雪莲等[11]的描述。
1.5 鸡原代肝细胞差异代谢物的筛选与鉴定在峰面积标准化的过程中,差异代谢物的筛选标准是OPLS-DA(VIP>1)和双尾Student’s T检验(P < 0.05)。差异代谢物的鉴定根据其已纯化的质谱,通过比对仪器自带的数据库(NIST)以及商业的Golm Metabolome Database和Fiehn GC/MS Metabolomics RTL Library,最终确定其结构。
1.6 鸡原代肝细胞脂类生化指标测定及数据分析细胞内三酰甘油、游离脂肪酸及总胆固醇的含量采用商品化的试剂盒测定,试剂盒购自南京建成生物有限公司。各指标数据用“mean±SEM”表示,用SPSS统计软件进行分析。组间差异比较采用独立样本T检验,P < 0.05表示差异显著。
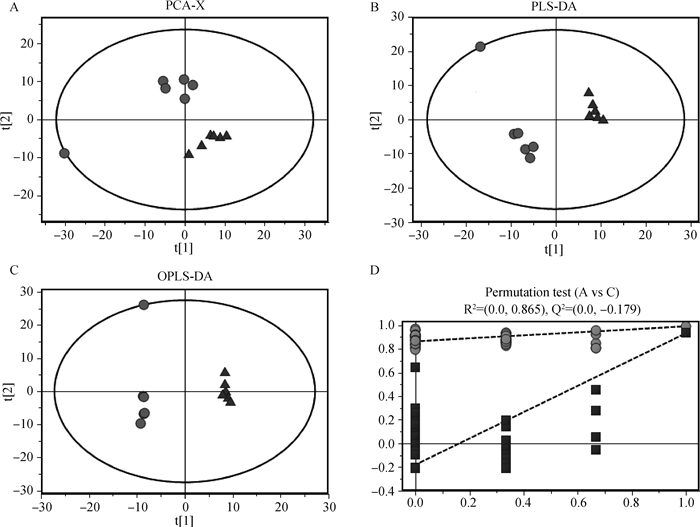
2 结果 2.1 鸡肝细胞GC-MS代谢组多元统计分析采用SIMCA软件(版本13.0)对两组样本进行多元统计分析,如图 1A所示,建立的含2个有效主成分的PCA模型累积解释率R2X=0.573;图 1B建立的含2个有效主成分的PLS-DA模型中,R2Y=0.992,Q2=0.934(当前模型的参数值不看R2X值);图 1C建立的含1个主成分和2个正交成分的OPLS-DA模型中,模型主要质量参数为R2Y=0.998,Q2=0.857 (当前模型的参数值不看R2X值)。各个模型中,两组之间有明显的分离,组内重复聚集紧凑,表明重复性较好。图 1D是对OPLS模型的置换检验结果,R2接近1,说明建立的模型符合样本数据的真实情况,可以很好地解释两组样本之间的显著代谢差异,但对照组A中有一个样品偏离其他组内样品。
|
A、B、C分别代表样本的PCA、PLS-DA和OPLS-DA得分图:圆形代表对照组A组的6个样本,三角形代表叶酸添加组C组的6个样本;横坐标表示第1主成分即PC1,用t[1]表示;纵坐标表示第2主成分即PC2,用t[2]表示。D图是OPLS模型的置换检验:横坐标表示置换检验的置换保留度(1处的点即为原模型的R2和Q2值),纵坐标表示R2或Q2的取值,圆点表示置换检验得到的R2值,方点表示置换检验得到的Q2值 A, B, C show the samples score plots of PCA, PLS-DA and OPLS-DA, respectively: circles mean 6 samples in the control group and triangles mean 6 samples in folic acid addition group; X-axis show the first principal component, t[1], Y-axis show the second principal component, t[2]. D means the permutation test for OPLS-DA model: X-axis show the displacement retention (the point at 1 is R2 and Q2 values of OPLS-DA model), Y-axis mean the value of R2 or Q2, circles are on behalf of R2 value for permutation test and squares for Q2 value 图 1 两组样本得分图 Figure 1 Samples score plots of two groups |
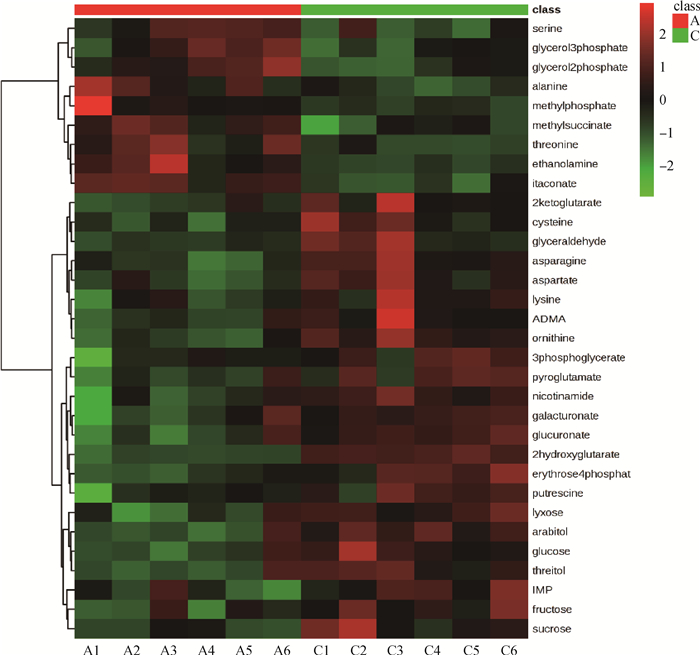
采用OPLS-DA模型第一主成分的VIP值(阈值>1)并结合Student’s T检验(P < 0.05),根据数据库寻找差异性表达的代谢物。如表 1所示,叶酸添加组与对照组相比,共检测到32个差异代谢物,其中23个显著上调,9个显著下调。为了表征两组差异代谢物之间的聚落关系,对这些差异性物质的定量信息进行热图分析,如图 2所示,每行表示差异性代谢物,每列表示样本编号,从热图分析组内各重复的颜色也可看出样品重复性较好,左侧的树状结构表示差异性代谢物之间相似度聚类关系。
|
|
表 1 鸡肝细胞叶酸组与对照组之间的差异代谢物 Table 1 Differential metabolites between control and folic acid groups of chicken hepatocytes |
|
图 2 鸡肝细胞对照组和叶酸组差异代谢物的热图 Figure 2 Heatmap of differential metabolites between control and folic acid groups of chicken hepatocytes |
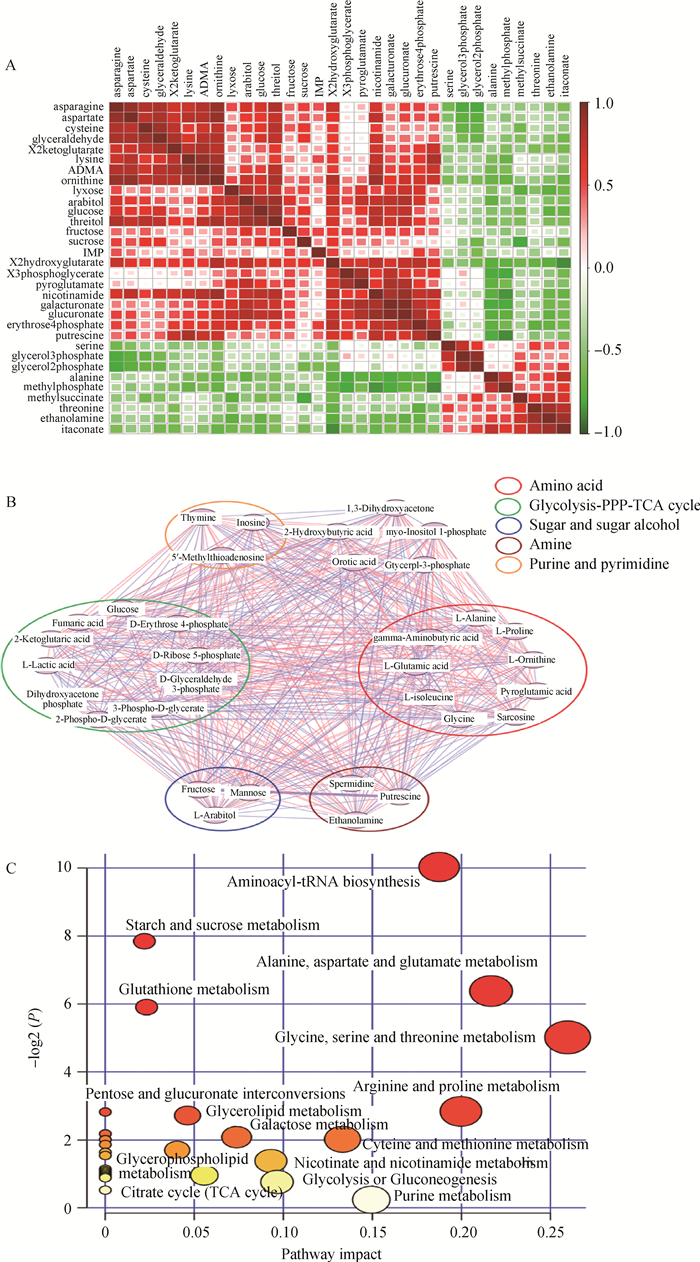
代谢物之间浓度的相关性和功能的相关性分别通过Pearson(图 3A)和Spearman(图 3B)相关进行分析,图 3A中的横纵坐标为差异代谢物,绿色表示负相关,红色表示正相关,颜色越深表明两个代谢物在浓度上变化趋势相似性越高。图 3B中粉色连线代表正相关,蓝色代表负相关,同一彩色圆圈内的差异代谢物表示在功能上属于同一分类。为了进一步解析叶酸对肝细胞代谢的影响,将差异代谢物输入MetaboAnalyst软件进行通路分析,结果显示,共富集到31条通路,其中显著的有19条,综合分析图 3C显示了通路的影响大小及相关P值,圆点越大表明该通路富集到的差异代谢物越多,颜色越深表明P值越小,离坐标圆点越远表明该通路受到的影响越大。可见叶酸主要影响鸡原代肝细胞代谢的氨基酸类通路、碳水化合物通路、甘油酯通路等。
|
图A表示各差异性代谢物之间的(浓度)相关性;图B表示各差异性代谢物功能上的相关性;图C是差异代谢物的富集通路分析 Figure A is the correlation among differential metabolites in terms of concentration; Figure B is the correlation among differential metabolites in terms of functions; Figure C is the KEGG pathway analysis based on differential metabolites 图 3 鸡肝细胞差异代谢物的相关性分析与代谢通路分析 Figure 3 Correlations and pathway analysis of differential metabolites between control and folic acid groups of chicken hepatocytes |
如表 2所示,与对照组相比,培养基中添加叶酸能显著降低鸡原代肝细胞内的三酰甘油和胆固醇含量(P < 0.05),除此之外,叶酸组游离脂肪酸的含量也显著高于对照组(P < 0.05)。
|
|
表 2 叶酸对肝细胞内三酰甘油、游离脂肪酸和总胆固醇含量的影响 Table 2 Effects of folic acid on triglyceride, NEFA and cholesterol contents in chicken hepatocytes |
代谢组最接近机体的本质生物学过程,较基因组、转录组和蛋白组更能直接灵敏地反映机体真正的代谢变化,已被广泛的应用于生命科学研究中。本试验基于GC-MS技术,检测了不同叶酸含量培养基下鸡原代肝细胞内的代谢物变化,结果显示,共有32种代谢物含量表现出了差异。根据差异代谢物本身所属的分类及其所富集的通路分析,可以说明叶酸改变了细胞内的糖代谢、氨基酸代谢和脂类代谢,下面将逐一进行讨论。
糖代谢是机体最重要的代谢之一,其中葡萄糖可氧化供能,糖酵解的终产物丙酮酸是连接三大营养物质糖、脂肪和蛋白质的重要枢纽,三羧酸循环的中间产物也可与氨基酸之间进行互相转化[12]。本试验中,叶酸添加组的α-酮戊二酸、葡萄糖、蔗糖、阿拉伯糖醇、来苏糖、葡萄糖醛酸、半乳糖醛酸、果糖、苏糖醇含量升高,通路分析中富集到了淀粉与蔗糖代谢、戊糖与葡萄糖醛酸酯互变、半乳糖代谢等碳水化合物类的代谢,表明叶酸影响了肝细胞内的糖类代谢过程。3-磷酸甘油酸是糖酵解中氧化放能过程的产物之一,其含量的升高与葡萄糖含量的升高相对应,揭示细胞内糖酵解过程的加强,但终产物丙酮酸的含量并没有改变,这可能与其进入三羧酸循环代谢有关,因为α-酮戊二酸升高,表明细胞内柠檬酸循环过程也加强,两者共同为细胞提供能量来源,代谢过程的中间产物也为糖醇、醛酸等小分子糖类物质的生成提供可能。
叶酸本身的生理代谢过程也涉及到很多氨基酸,甘氨酸和丝氨酸参与四氢叶酸与5, 10亚甲基四氢叶酸的可逆转化过程,苏氨酸和甘氨酸参与5, 10亚甲基四氢叶酸到5甲基四氢叶酸的非可逆转化,5甲基四氢叶酸为同型半胱氨酸提供甲基基团生成蛋氨酸[13]。本试验中,叶酸添加组天冬酰胺、半胱氨酸、天冬氨酸和赖氨酸含量升高,苏氨酸、丙氨酸和丝氨酸含量下降。丙氨酸可由丙酮酸转化而来,糖酵解的加强并没有改变丙酮酸的含量,反而丙氨酸的含量是下降的,进一步说明了糖酵解的终产物丙酮酸主要是进入三羧酸循环过程进行代谢。α-酮戊二酸和草酰乙酸分别是谷氨酸和天冬氨酸的前体物质,三羧酸循环加强但草酰乙酸浓度不变,可能是因为草酰乙酸用来转化生成天冬氨酸和天冬酰胺。虽然细胞中谷氨酸的含量未受到影响,但叶酸组焦谷氨酸的含量增加,有研究指出,焦谷氨酸可能是甘氨酸和α-氨基丁酸的前体物质[14],参与碳水化合物和脂质代谢过程[15]。
通路分析显示,氨酰转移RNA生物合成是细胞受到影响最大的通路,并且差异代谢物也富集到了丙氨酸、天冬氨酸和谷氨酸代谢通路,甘氨酸、丝氨酸和苏氨酸代谢通路,精氨酸和脯氨酸代谢通路,半胱氨酸和蛋氨酸代谢通路。半胱氨酸是谷胱甘肽的前体物[16],有研究指出,谷胱甘肽可清除自由基,有利于肝细胞损伤的修复[17]。叶酸本身也是一种抗氧化剂[18],可以清除自由基防止脂质的过氧化[19],因此,在该试验中,叶酸有可能提高了细胞的抗氧化功能,也有研究表明,叶酸能降低动脉粥样硬化鼠血液中的同型半胱氨酸含量,进而提高机体的抗氧化性能[20]。
另一方面,与哺乳动物不同,家禽的脂质代谢过程主要发生在肝中[21]。有学者基于甲基化作用从肉毒碱合成、磷脂酰胆碱合成、小RNA和脂代谢相关基因表达上阐述了叶酸调控肝脂质代谢的机制[22]。本试验所鉴定到的差异代谢物3磷酸甘油酸、3磷酸甘油、2磷酸甘油、乙醇胺、甘油醛均参与脂代谢通路,甘油酯与甘油磷脂代谢也是通路分析所富集到的被显著影响的通路。李吕木和Peebles[23]的研究指出,在鸡胚发育的后1周,蛋中碳水化合物消化殆尽,卵黄囊被吸收入肝内,肝内的脂质含量持续增加,在出壳当天达到最高。并且在雏鸡出壳后的第1周,采食量低但生长快,主要依靠肝的脂质代谢为机体提供营养和能量以供生长发育的需要[24]。因此雏鸡1日龄肝本身脂质含量多、代谢旺盛。本研究结果显示,叶酸添加组肝细胞中三酰甘油水解加强,胆固醇含量下降,游离脂肪酸含量增加,表明脂质分解代谢加强,脂肪酸氧化供能,甘油通过糖异生作用进入糖酵解和三羧酸过程。母鼠缺乏叶酸能影响子代胎鼠肝内的脂质代谢[25],与本试验中叶酸改变肝细胞脂代谢的现象一致。
4 结论本研究基于GC-MS代谢组学技术分析叶酸对鸡原代肝细胞代谢物变化及代谢通路的影响,共鉴定到32个差异代谢物,代谢通路分析及细胞内的脂类含量结果显示,叶酸促进甘油三酯水解,改变了细胞内的糖代谢和氨基酸代谢,也一定程度上提高了细胞的抗氧化性能。研究结果为今后探究叶酸调控家禽肝代谢机制提供参考,也为叶酸在家禽上的合理有效应用提供理论基础和科学依据。
| [1] | WIŚNIEWSKI J R, VILDHEDE A, NORÉN A, et al. In-depth quantitative analysis and comparison of the human hepatocyte and hepatoma cell line HepG2 proteomes[J]. J Proteomics, 2016, 136: 234–247. DOI: 10.1016/j.jprot.2016.01.016 |
| [2] | TEDESCO S, BAYAT N, DANIELSSON G, et al. Proteomic and lipidomic analysis of primary mouse hepatocytes exposed to metal and metal oxide nanoparticles[J]. J Integr OMICS, 2015, 184: 1–14. |
| [3] | FAN Y H, HE C H, LIU G F, et al. Optimization of the isolation and cultivation of Cyprinus carpio primary hepatocytes[J]. Cytotechnology, 2008, 58(2): 85–92. DOI: 10.1007/s10616-008-9169-5 |
| [4] |
刘腾飞, 田静, 耿智霞, 等. 抗菌药物对LPS诱导鸡肝细胞损伤的影响及复方甘草酸单胺的修复效应[J]. 畜牧兽医学报, 2015, 46(2): 309–316.
LIU T F, TIAN J, GENG Z X, et al. Effects of antibiotics on LPS induced liver cell injury and hepatoprotective activity of compound ammonium glycyrrhizin[J]. Acta Veterinaria et Zootechnica Sinica, 2015, 46(2): 309–316. (in Chinese) |
| [5] |
刘丽, 季辉, 彭麟, 等. 鸡肝原代细胞药物代谢模型的建立与优化[J]. 南京农业大学学报, 2015, 38(1): 127–133.
LIU L, JI H, PENG L, et al. The establishment and optimization of the drug metabolic model of adult chicken primary hepatocytes[J]. Journal of Nanjing Agricultural University, 2015, 38(1): 127–133. (in Chinese) |
| [6] | HOU D X, KUNITAKE T, KUSUDA J, et al. Primary culture of chicken hepatocytes as an in vitro model for determining the influence of dioxin[J]. Biosci Biotechnol Biochem, 2001, 65(1): 218–221. DOI: 10.1271/bbb.65.218 |
| [7] | LIU Y L, ZHI L H, SHEN J, et al. Effect of in ovo folic acid injection on hepatic IGF2 expression and embryo growth of broilers[J]. J Anim Sci Biotechnol, 2016, 7: 40. DOI: 10.1186/s40104-016-0099-3 |
| [8] | LI S Z, ZHI L H, LIU Y L, et al. Effect of in ovo feeding of folic acid on the folate metabolism, immune function and epigenetic modification of immune effector molecules of broiler[J]. Br J Nutr, 2016, 115(3): 411–421. DOI: 10.1017/S0007114515004511 |
| [9] | ALLAH E S H A, BADARY D M. Folic acid protects against lead acetate-induced hepatotoxicity by decreasing NF-κB, IL-1β production and lipid peroxidation mediataed cell injury[J]. Pathophysiology, 2017, 24(1): 39–44. DOI: 10.1016/j.pathophys.2017.02.002 |
| [10] |
刘艳利, 党燕娜, 段玉兰, 等. 鸡原代肝细胞培养及叶酸对脂质代谢相关基因表达的影响[J]. 中国农业科学, 2017, 50(21): 4205–4211.
LIU Y L, DANG Y N, DUAN Y L, et al. Effect of folic acid on lipid metabolism associated gene expression in primarily cultured chickens hepatocytes[J]. Scientia Agricultura Sinica, 2017, 50(21): 4205–4211. DOI: 10.3864/j.issn.0578-1752.2017.21.015 (in Chinese) |
| [11] |
刘雪莲, 张盼盼, 田方圆, 等. 基于GC-MS代谢组学技术对内脂素调控雏鸡采食机制的研究[J]. 畜牧兽医学报, 2017, 48(7): 1251–1259.
LIU X L, ZHANG P P, TIAN F Y, et al. Research of visfatin regulating chicks feed intake based on GC-MS metabolomics[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(7): 1251–1259. (in Chinese) |
| [12] | PILKIS S J, CLAUS T H. Hepatic gluconeogenesis/glycolysis:regulation and structure/function relationships of substrate cycle enzymes[J]. Annu Rev Nutr, 1991, 11: 465–515. DOI: 10.1146/annurev.nu.11.070191.002341 |
| [13] | BROSNAN M E, BROSNAN J T. Formate:the neglected member of one-carbon metabolism[J]. Annu Rev Nutr, 2016, 36: 369–388. DOI: 10.1146/annurev-nutr-071715-050738 |
| [14] |
孙玲伟, 包凯, 李影, 等. 奶牛临床和亚临床酮病的血浆代谢组学研究[J]. 中国农业科学, 2014, 47(8): 1588–1599.
SUN L W, BAO K, LI Y, et al. Plasma metabolomics study of dairy cows with clinical and subclinical ketosis[J]. Scientia Agricultura Sinica, 2014, 47(8): 1588–1599. DOI: 10.3864/j.issn.0578-1752.2014.08.015 (in Chinese) |
| [15] | YOSHINARI O, IGARASHI K. Anti-diabetic effect of pyroglutamic acid in type 2 diabetic Goto-Kakizaki rats and KK-Ay mice[J]. Br J Nutr, 2011, 106(7): 995–1004. DOI: 10.1017/S0007114511001279 |
| [16] | WU G Y, FANG Y Z, YANG S, et al. Glutathione metabolism and its implications for health[J]. J Nutr, 2004, 134(3): 489–492. DOI: 10.1093/jn/134.3.489 |
| [17] | MERRY T L, TRAN M, STATHOPOULOS M, et al. High-fat-fed obese glutathione peroxidase 1-deficient mice exhibit defective insulin secretion but protection from hepatic steatosis and liver damage[J]. Antioxid Redox Sign, 2014, 20(14): 2114–2129. DOI: 10.1089/ars.2013.5428 |
| [18] | GLISZCZYŃSKA-ŚWIGLO A. Folates as antioxidants[J]. Food Chem, 2007, 101(4): 1480–1483. DOI: 10.1016/j.foodchem.2006.04.022 |
| [19] | JOSHI R, ADHIKARI S, PATRO B S, et al. Free radical scavenging behavior of folic acid:evidence for possible antioxidant activity[J]. Free Radic Biol Med, 2001, 30(12): 1390–1399. DOI: 10.1016/S0891-5849(01)00543-3 |
| [20] | CUI S S, LI W, LV X, et al. Folic acid attenuates homocysteine and enhances antioxidative capacity in atherosclerotic rats[J]. Appl Physiol Nutr Meta, 2017, 42(10): 1015–1022. DOI: 10.1139/apnm-2017-0158 |
| [21] | LEVEILLE G A, ROMSOS D R, YEH Y Y, et al. Lipid biosynthesis in the chick.A consideration of site of synthesis, influence of diet and possible regulatory mechanisms[J]. Poult Sci, 1975, 54(4): 1075–1093. DOI: 10.3382/ps.0541075 |
| [22] | DA SILVA R P, KELLY K B, AL RAJABI A, et al. Novel insights on interactions between folate and lipid metabolism[J]. Biofactors, 2014, 40(3): 277–283. DOI: 10.1002/biof.1154 |
| [23] |
李吕木, PEEBLESD. 孵化期间鸡胚、肝脏、卵黄及蛋白组成的变化及其相关关系[J]. 畜牧兽医学报, 2005, 36(6): 574–577.
LI L M, PEEBLES D. Chick embryo, liver, yolk and albumen compositional changes and their relationships during incubation[J]. Acta Veterinaria et Zootechnica Sinica, 2005, 36(6): 574–577. (in Chinese) |
| [24] | NOBLE RC, COCCHI M. Lipid metabolism and the neonatal chicken[J]. Prog Lipid Res, 1990, 29(2): 107–140. DOI: 10.1016/0163-7827(90)90014-C |
| [25] | MCNEIL C J, HAY S M, RUCKLIDGE G J, et al. Maternal diets deficient in folic acid and related methyl donors modify mechanisms associated with lipid metabolism in the fetal liver of the rat[J]. Br J Nutr, 2009, 102(10): 1445–1452. DOI: 10.1017/S0007114509990389 |



