2. 贵州大学贵州省动物遗传育种与繁殖重点实验室, 贵阳 550025;
3. 贵州大学动物科学学院, 贵阳 550025;
4. 贵州大学生命科学学院, 贵阳 550025
2. Key Laboratory of Animal Genetics, Breeding and Reproduction in Guizhou, Guizhou University, Guiyang 550025, China;
3. College of Animal Science, Guizhou University, Guiyang 550025, China;
4. College of Life Science, Guizhou University, Guiyang 550025, China
磷酸化酶激酶(phosphorylase kinase,PHK)是糖原分解过程和糖原代谢途径中的一个关键调节酶,其分解糖原为机体肌肉收缩提供能量以及维持血糖平衡。PHK是由α、β、δ、γ 4个不同的亚基组成的全酶(αβγδ)4,其中α、β、δ 3个亚基均为调节亚基,γ亚基为催化亚基,并且γ亚基含有一个激酶活性域和一个C-末端钙调节蛋白结合域[1-2]。磷酸化酶激酶γ2(phosphorylase kinase gamma 2,PHKG2)基因是PHK基因家族中γ亚基中的一个亚型,在全酶中起着催化作用,受到α、β、δ 3个亚基的调节,同时也是神经元传递通路、代谢通路和激素信号通路激活剂的目标[3]。近年来,多个研究结果表明,PHKG2基因的突变可能会导致肝硬化、糖原代谢病、复发性低血糖、肝纤维化等其他糖代谢相关疾病[4-8]。在家畜相关研究中,王艳[9]筛选出梅山猪和大白猪的候选差异基因PHKG2,并且发现,该基因G785A位点多态性与瘦肉率呈极显著相关。Wang等[10]克隆出巴马小型香猪PHKG2基因CDS区1 221 bp,本课题组前期克隆了从江香猪和大白猪PHKG2基因,并将从江香猪、大白猪、GenBank猪序列(NM_001166317)、巴马香猪(KJ 186785)的PHKG2基因序列分析比较发现,从江香猪存在A614G特殊的突变位点,并且引起了第205位谷氨酸变成了丙氨酸[11]。
研究发现,动物机体内肌肉糖原含量过高会导致屠宰后猪肉最终的pH过低,使蛋白质对水的结合能力降低,从而对猪肌肉的系水力、剪切力、肉色等肉质性状有影响[12-13]。所以,近年来对动物机体中糖原合成和分解代谢过程的研究一直备受关注,以期通过研究猪肌肉糖原代谢的过程探讨影响猪肉品质性状的分子机理[14]。本课题组前期通过重测序方法,筛选出了从江香猪和大白猪的差异表达基因PHKG2、FoxO4等[15]。综上所述,PHKG2基因可能对猪的肉质具有一定的影响。
本试验通过将PHKG2基因导入真核表达载体和RNAi技术使PHKG2基因超表达和沉默,从两方面来探究PHKG2基因的功能,这将对猪肉品质改善,挖掘肉质性状特色基因具有重要意义。
1 材料与方法 1.1 试验材料选取6月龄贵州从江香猪(Sus scrofa)背最长肌组织样;真核表达载体pEGFP-N3;pGPU6/GFP/Neo-;C2C12细胞株;3日龄从江香猪幼崽。
1.2 主要试剂AxyPrep质粒DNA小量试剂盒、AxyPrep DNA凝胶回收试剂盒(康宁生命科学有限公司,苏州);RIPA裂解液、BCA蛋白浓度测定试剂盒、糖原含量检测试剂盒(索莱宝科技有限公司,北京);Endo-free Plasmid Mini KitII(OMEGA);SsoFast TM EVaGreen@Supermix(BIO-RAD,Singapore);Trans2K Plus Ⅱ DNA Marker(北京全式金生物公司);限制性内切酶EcoR Ⅰ、XhoⅠ、KpnⅠ、BamH Ⅰ、Opti-MEM培养基、转染试剂LIPOFECTAMINE 3000、T4 DNA Ligase、TRIzol Regent、Thermo Scientific Revert Aid First Strand cDNA Synthesis Kit(Thermo Fisher Scientific, USA);胎牛血清(Gibco,US Origin)等。
1.3 试验方法 1.3.1 pEGFP-N3-PHKG2表达载体的构建 1.3.1.1总RNA提取以及cDNA第一条链合成:选取6月龄贵州从江香猪,采取背最长肌组织样。利用TRIzol试剂对总RNA进行抽提,超微量紫外分光光度计测定其浓度和OD值,RT-PCR合成cDNA第一条链。
1.3.1.2PHKG2基因CDS区克隆:根据GenBank公布的猪PHKG2基因序列(登录号:NM_001166317),在上游引物引入Kpn I酶切位点,下游引物引入Xho I酶切位点,合成引物如表 1。以cDNA为模板,PCR扩增PHKG2基因,1.0%琼脂糖凝胶电泳检测PCR产物,回收纯化PCR产物。
|
|
表 1 引物序列、退火温度及产物长度 Table 1 Primer sequence, annealing temperature and product size |
PHKG2基因与pEGFP-N3连接、转化和鉴定:将纯化的PCR产物和pEGFP-N3载体同时进行双酶切,37 ℃水浴3 h,然后用1%琼脂糖凝胶电泳检测双酶切效果,进行产物回收。将双酶切产物用T4 DNA连接酶于16 ℃金属浴过夜连接。取10 μL过夜连接产物转化100 μL TOP10感受态细胞,将连接产物与感受态细胞混匀后冰浴30 min,42 ℃热激90 s,立即置冰上放置10 min,加入预热至室温的400 μL LB培养基,200 r·min-1,37 ℃恒温摇床培养1 h,4000 r·min-1离心1 min,弃去400 μL培养上清,剩余100 μL用移液器混匀后均匀涂布于含100 μg·mL-1 Kanamycin抗性的LB平板上,倒置,37 ℃恒温培养箱培养过夜。分别挑取单菌落接种于含5 mL,100 μg·mL-1 Kanamycin抗性的LB培养液中,250 r·min-1,37 ℃恒温摇床培养过夜,用小量质粒抽提试剂盒抽提质粒,并分别用Kpn Ⅰ和Xho Ⅰ做双酶切鉴定,酶切鉴定成功的重组质粒由上海英骏公司测序。
1.3.2 shRNA载体pGPU6/GFP/Neo-ShRNA-sus的构建 1.3.2.1shRNA序列设计合成:根据NCBI上PHKG2基因(NM_001166317)的靶序列,按照shRNA的设计原则, 由上海吉玛公司设计合成4条针对PHKG2基因的DNA模板,其序列:Bbs Ⅰ酶切位点、21 nt正义链、9 nt成环结构、21 nt反义链、RNA酶Ⅲ转录终止位点(6个T)、BamH Ⅰ酶切位点。阴性对照序列: BamH Ⅰ酶切位点、21 nt打乱顺序正义链、9 nt成环结构、21 nt打乱顺序反义链、RNA酶Ⅲ转录终止位点(6个T)、EcoR Ⅰ酶切位点序列见表 2。
|
|
表 2 shRNA及阴性对照序列 Table 2 shRNA and negative control sequences |
shDNA模板的退火:DNA oligo分别用浓度为100 μmol·L-1的TE(pH8.0)溶液溶解,取相应的正义链和反义链oligo溶液,按照如下配比配置退火反应体系:10× shDNA Annealing Buffer 5 μL,sense strand (100 μmol·L-1) 5 μL,antisense strand (100 μmol·L-1) 5 μL,ddH2O 5 μL。PCR反应程序:95 ℃ 5 min;85 ℃ 5 min;75 ℃ 5 min;70 ℃ 5 min;4 ℃保存。
1.3.2.3pGPU6/GFP/Neo-ShRNA-sus载体连接转化:将pGPU6/GFP/Neo载体用Bbs Ⅰ+BamH Ⅰ进行双酶切处理,22 ℃水浴3 h,然后用1%琼脂糖凝胶电泳检测双酶切效果,进行产物回收。将载体双酶切线性化产物与shDNA模板用T4 DNA连接酶于16 ℃金属浴过夜连接,连接产物转化到Top10感受态细胞中,涂板过夜培养,并挑取单菌落进行培养,提取质粒进行酶切鉴定。方法同过表达载体pEGFP-N3-PHKG2连接转化过程,通过DNA测序来确定阳性克隆。
1.3.3 真核表达载体转染至C2C12细胞将C2C12细胞按1×105个·孔-1的密度转种于6孔细胞培养板中,添加DMEM/F12培养液(含10%胎牛血清、100 μL·mL-1卡那霉素、100 μL·mL-1氨苄霉素),37 ℃、5% CO2培养细胞密度至80%左右,分别用pEGFP-N3、pEGFP-N3-PHKG2、pGPU6/GFP/Neo-ShRNA-sus-1(命名为shRNA-1)、pGPU6/GFP/Neo-ShRNA-sus-2(命名为shRNA-2)、pGPU6/GFP/Neo-ShRNA-sus-3(命名为shRNA-3)、pGPU6/GFP/Neo-ShRNA-sus-4(命名为shRNA-4)、pGPU6/GFP/Neo-NC(命名为NC)转染C2C12细胞,以未转染重组载体的C2C12细胞为空白对照组。各转染组每孔重组质粒用量为3 μg,Opti-MEM用量为250 μL,脂质体用量为10 μL,加完样后按十字方向轻轻摇匀,每个转染组3个重复。置于37 ℃、5% CO2培养细胞箱中培养,24 h后于荧光倒置显微镜下观察转染效率。
1.3.4 从江香猪肾细胞培养选取健康3日龄从江香猪幼崽,无菌条件下迅速分离肾细胞,用D-Hanks液清洗,去除结缔组织以及表层膜,将漂洗、修剪干净的组织剪成1~2 mm3小块,转移至无菌的锥形瓶,并加入Ⅳ型胶原酶溶液, 37 ℃水浴中消化30 min,期间每隔10 min摇晃1次。200目细胞筛过滤除去未消化大组织块,保留含细胞的液体。1 500 r·min-1离心5 min去除上清液,4 ℃冰箱中取出红细胞裂解液,按1:3的比例加入细胞沉淀中,轻轻吹打混匀,离心去除上层红色液体,收集沉淀。用DMEM培养液离心漂洗1~2次,去除上清,加含10%胎牛血清(FBS)+100 μL·mL-1卡那霉素+100 μL·mL-1氨苄霉素的DMEM/F12培养液制成细胞悬液,接种细胞培养瓶,于37 ℃,5% CO2培养箱中进行培养,6 h后观察细胞形态,12 h后更换培养基,去除未贴壁细胞,以后每隔24 h观察细胞形态,并进行传代试验。
1.3.5 真核表达载体转染至从江香猪肾细胞将生长状况良好的从江香猪肾细胞按1×105个·孔-1的密度转种于6孔细胞培养板中,待培养细胞密度至80%左右,分别用pEGFP-N3、pEGFP-N3-PHKG2、shRNA-1、shRNA-2、shRNA-3、shRNA-4、NC转染从江香猪肾细胞,以未转染重组载体的细胞空白对照组。各转染组每孔重组质粒用量为3 μg,Opti-MEM用量为250 μL,脂质体用量为10 μL,加完样后按十字方向轻轻摇匀,每个转染组3个重复。置于37 ℃、5% CO2培养细胞箱中培养,24 h后于荧光倒置显微镜下观察转染效率。
1.3.6 qRT-PCR检测mRNA水平转染48 h后用Trizol法提取各组C2C12细胞和肾细胞中总RNA,并测定其浓度和OD值,将RNA定量稀释到同一个水平。RT-PCR合成cDNA第一条链。逆转录后的cDNA置于-80 ℃冰箱保存。采用SYBR Green荧光染料法进行实时荧光定量。反应条件为95 ℃ 30 s;95 ℃ 7 s,59 ℃ 5 s,循环40次后进行熔解曲线分析,以每5 s上升0.5 ℃的速率从65 ℃升高到95 ℃,每个样品检测做3个重复。
1.3.7 细胞中糖原含量测定将转染48 h后的各组细胞去除培养液,用PBS清洗一遍。每孔加入200 μL RIPA裂解液(提前加入蛋白酶抑制剂),用枪吹打数下,使裂解液和细胞充分接触,再利用BCA法测定各组蛋白浓度。收集转染48 h后的各6孔板细胞到离心管内,离心后弃上清;加入0.75 mL提取液超声波破碎细胞(功率20%或200 W,超声3 s,间隔10 s,重复30次);转移至10 mL试管中,置于沸水浴中煮沸20 min(盖紧,防止水分散失),隔5 min振摇试管1次,使充分混匀;取出试管冷却后,用蒸馏水定容到5 mL,混匀,待测。酶标仪预热30 min以上,调节波长至620 nm,蒸馏水调零,调节水浴锅至95 ℃。按比例加样后置沸水浴10 min(盖紧,防止水分散失),冷却,于620 nm波长处,分别读取空白管、标准管和测定管吸光度,分别记为A1、A2和A3。按照公式计算糖原含量:糖原(mg·(mg prot)-1)=1.11×(C标准×V1)×(A3-A1) ÷(A2-A1) ÷(V1×Cpr)=0.111×(A3-A1) ÷(A2-A1) ÷Cpr。其中,1.11是此法测得葡萄糖含量换算为糖原含量的常数,即111 μg糖原用蒽酮试剂显色相当于100 μg葡萄糖用蒽酮所试剂显示的颜色;C标准为标准管浓度(0.1 mg·mL-1);V1为加入反应体系中糖原提取液体积(0.25 mL);Cpr为样本蛋白质浓度(mg·mL-1)。
1.3.8 数据分析实时荧光定量PCR得出的基因原始表达量利用2-△△CT方法计算,2-△△CT表示目的基因的相对表达量。通过SPSS Statistics 19.0软件对试验数据进行单因素方差分析,结果用“mean±SD”表示。
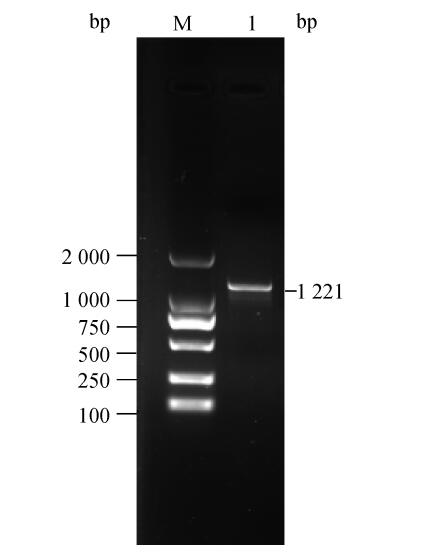
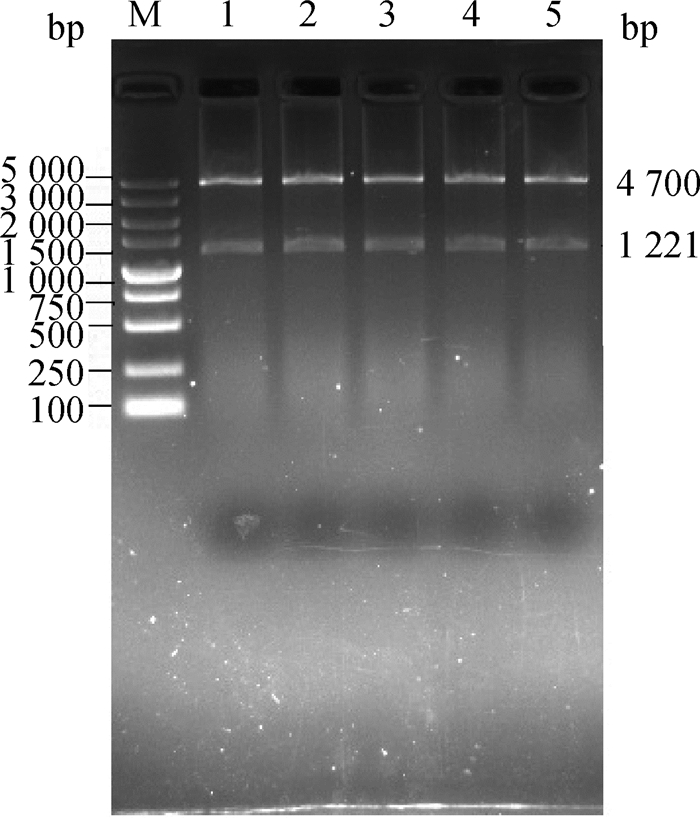
2 结果 2.1 pEGFP-N3-PHKG2表达载体的构建及鉴定从江香猪背最长肌RT-PCR扩增产物经检测,出现单一条带,与预期大小一致(图 1)。再将产物纯化后与pEGFP-N3载体连接、转化,pEGFP-N3-PHKG2重组质粒经Kpn I、Xho I双酶切后,用1%琼脂糖凝胶电泳鉴定,结果在4 700和1 221 bp出现2条带(图 2),将重组质粒测序验证,经DNAstar序列拼接分析,与GenBank发布的猪PHKG2基因完整CDS区序列进行比对,同源性达到99%,即获得贵州从江香猪PHKG2基因长度为1 221 bp的ORF序列,表明pEGFP-N3-PHKG2重组质粒构建成功。
|
M.DNA相对分子质量标准; 1.扩增的PHKG2基因 M. DL 2000 marker; 1.The PCR amplification of PHKG2 gene 图 1 从江香猪PHKG2基因PCR凝胶电泳图 Figure 1 The PCR electropherogram of PHKG2 gene of Cong-jiang pig |
|
M.DNA相对分子质量标准; 1~5.重组质粒pEGFP-N3-PHKG2的双酶切 M.DL 5000 marker; 1-5.Double enzyme digestion of recombinant plasmid pEGFP-N3-PHKG2 图 2 pEGFP-N3-PHKG2重组质粒双酶切鉴定 Figure 2 Identification of double enzyme digestion of recombinant plasmid pEGFP-N3-PHKG2 |
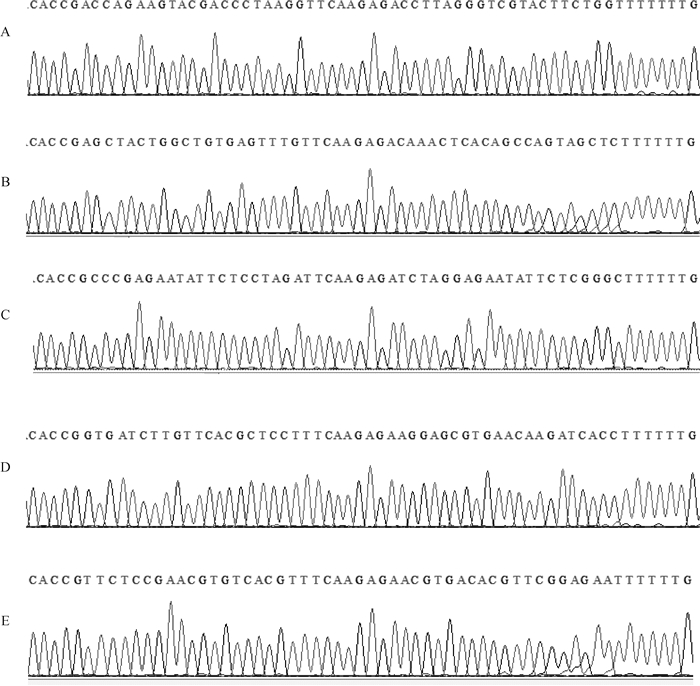
将shRNA-1、shRNA-2、shRNA-3、shRNA-4和NC重组质粒经Bbs Ⅰ和BamH Ⅰ双酶切后,再进行胶回收、连接、转化。将鉴定为阳性的克隆菌液进行测序,DNA测序结果显示,所构建的4个干扰载体及一条阴性对照均含有所设计的目的片段,其序列与设计的靶向寡核苷酸序列完全一致(图 3),进一步证实目的片段已正确插入载体,PHKG2基因shRNA干扰重组载体构建成功。
|
A.shRNA-1;B.shRNA-2;C.shRNA-3;D.shRNA-4;E.NC 图 3 重组载体测序结果 Figure 3 The sequencing results of the recombinant vectors |
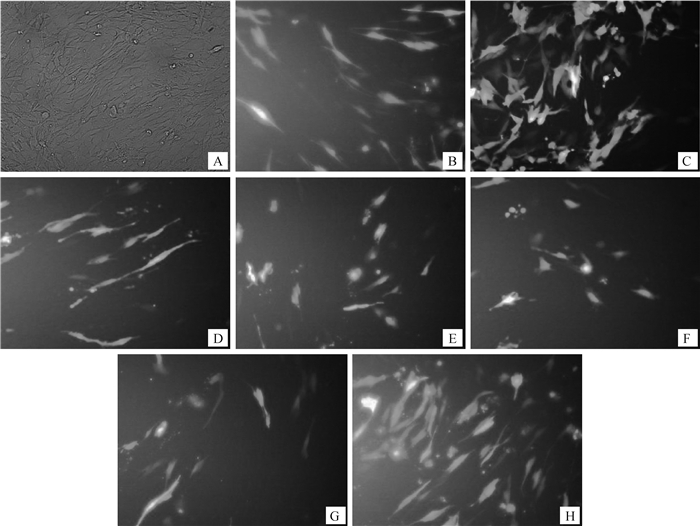
重组载体、阴性对照及空载体转染C2C12细胞后24 h在荧光倒置显微镜下观察细胞发光情况,发现被转染后的细胞发出绿色荧光(图 4),表明构建的重组载体成功转入C2C12细胞中。
|
A.空白对照;B.pEGFP-N3空载体;C.pEGFP-N3-PHKG2重组质粒;D.shRNA-1;E.shRNA-2;F.shRNA-3;G.shRNA-4;H.阴性对照NC A.Blank control; B.Blank vector pEGFP-N3; C. Recombinant plasmid pEGFP-N3-PHKG2; D.shRNA-1;E.shRNA-2;F.shRNA-3;G.shRNA-4;H.Negative control 图 4 各重组质粒转染C2C12细胞荧光图(200×) Figure 4 The results of recombinant plasmids transfected into C2C12 cells(200×) |
重组载体、阴性对照及空载体转染从江香猪肾细胞后24 h在荧光倒置显微镜下观察细胞发光情况,发现被转染后的细胞发出绿色荧光(图 5),表明构建的重组载体成功转入从江香猪肾细胞中。
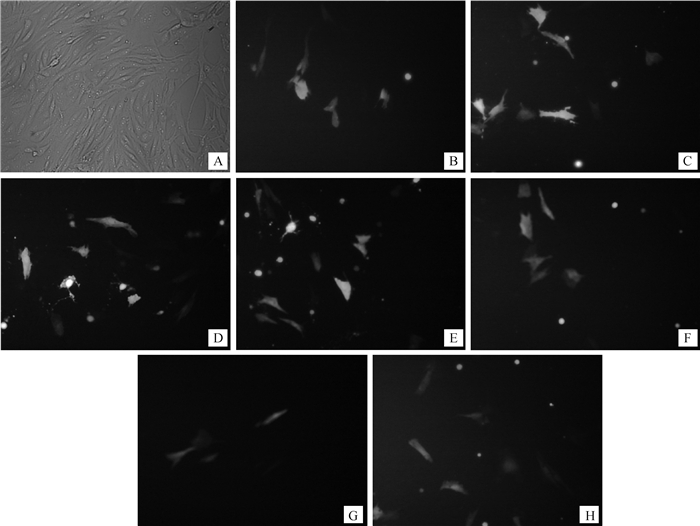
|
A.空白对照;B.pEGFP-N3空载体;C.pEGFP-N3-PHKG2重组质粒;D.shRNA-1;E.shRNA-2;F.shRNA-3;G.shRNA-4;H.阴性对照NC A.Blank control; B.Blank vector pEGFP-N3; C. Recombinant plasmid pEGFP-N3-PHKG2; D.shRNA-1;E.shRNA-2;F.shRNA-3;G.shRNA-4;H.Negative control 图 5 各重组质粒转染从江香猪肾细胞荧光图(200×) Figure 5 The results of recombinant plasmids transfected into kidney cells of Congjiang pig(200×) |
各重组质粒转染C2C12细胞48 h后,提取细胞总RNA,逆转录后进行qRT-PCR检测各组内参基因(GAPDH)和目的基因(PHKG2)mRNA的表达量。结果见表 3,相对于空白对照和阴性对照,超表达载体pEGFP-N3-PHKG2能极显著提高PHKG2基因的表达量(P < 0.01),RNA干扰载体干扰PHKG2基因mRNA的表达量,其中shRNA-1能极显著下调PHKG2的表达量(P < 0.01),shRNA-2、shRNA-3均能显著降低PHKG2 mRNA的表达量(P < 0.05),shRNA-4载体相对于空白对照和阴性对照,降低PHKG2基因的表达效果不明显。
|
|
表 3 各重组载体在C2C12细胞中对PHKG2基因mRNA表达的影响(n=3) Table 3 mRNA expression of PHKG2 gene in each recombinant vector in C2C12 cells (n=3) |
各重组质粒转染从江香猪肾细胞48 h后,提取细胞总RNA,逆转录后利用qRT-PCR检测各组内参基因(GAPDH)、目的基因(PHKG2)、糖原代谢相关基因(PGAM2、PYGM、GYS1)mRNA的表达量。结果如图 6所示,相对于空白对照(Blank)和阴性对照(pEGFP-N3),超表达载体pEGFP-N3-PHKG2转染至细胞后,能极显著提高PHKG2基因的表达量(P < 0.01),同时,对于PGAM2、PYGM基因的表达量显著上调(P < 0.05)。各RNAi载体中,相对于空白对照(Blank)和阴性对照(NC),shRNA-1的干扰效率较高,其极显著下调PHKG2基因的表达量(P < 0.01),显著下调PGAM2、PYGM、GYS1基因的表达量(P < 0.05)。shRNA-2极显著下调PHKG2基因的表达量(P < 0.01),shRNA-3对PHKG2基因的表达也能起到显著的干扰作用(P < 0.05),shRNA-4对于所检测的4个基因干扰效果不明显。
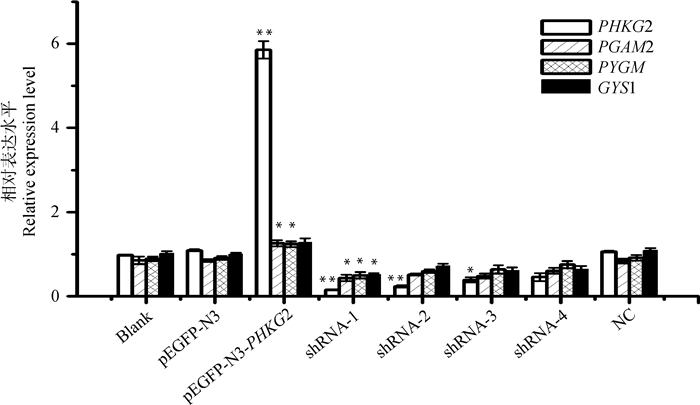
|
不同组间,**表示差异极显著(P < 0.01),*表示差异显著(P < 0.05),下同 ** mean extremely significant difference(P < 0.01), * mean significant difference(P < 0.05) among the groups, the same as the following figure 图 6 相关基因在从江香猪肾细胞中的表达 Figure 6 Expression of related genes in kidney cells of Congjiang pig |
转染48 h后的各组细胞提取细胞总蛋白,利用BCA法测得各组细胞中的蛋白浓度,拟合的回归方程为:Y=1.07X+0.123(R2=0.995),从而计算出各组细胞的蛋白浓度。再测定各组细胞中的糖原含量,结果如图 7所示,超表达载体pEGFP-N3-PHKG2转染至细胞后,细胞中的糖原含量达到(0.055±0.004 8) mg·(mg prot)-1,即每毫克蛋白中含有(0.055±0.004 8)mg糖原,与空白组和阴性对照相比,显著降低糖原的含量(P < 0.05),4个RNAi载体转染至细胞后,与空白组和阴性对照相比,其中shRNA-1显著升高糖原含量(P < 0.05),shRNA-2、shRNA-3、shRNA-4转染细胞后,糖原含量升高水平不明显。
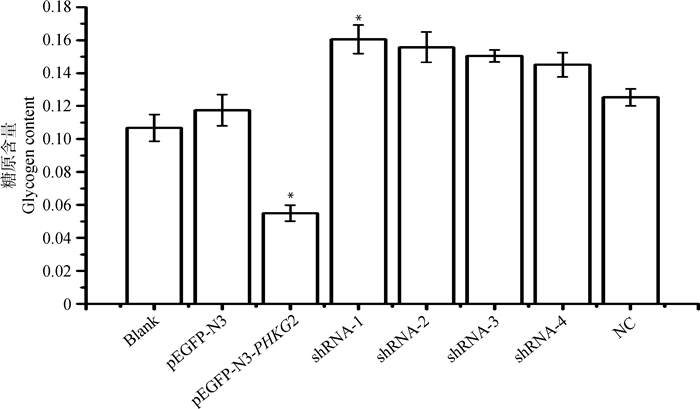
|
图 7 不同重组质粒转染后从江香猪肾细胞中的糖原含量 Figure 7 Glycogen content after different recombinant plasmid transfected into kidney cells of Congjiang pig |
本研究通过构建pEGFP-N3-PHKG2重组载体,使得PHKG2基因超表达,相对于空白对照和阴性对照pEGFP-N3空载体,pEGFP-N3-PHKG2转染细胞后,在C2C12细胞中,PHKG2基因表达量极显著上调;在从江香猪肾细胞中,PHKG2基因表达量也极显著提高,相关基因PYGM、PGAM2、GYS1的表达量也随之提高,进一步证明,该超表达载体pEGFP-N3-PHKG2构建成功,为后续转染试验奠定了基础。
RNAi是指在进化过程中高度保守的、由双链RNA(double-stranded RNA,dsRNA)诱发的、同源mRNA高效特异性降解的现象,它是转录后水平的基因沉默现象[16-17]。本研究在RNAi基础上设计合成4条针对从江香猪PHKG2基因的shRNA序列和1条阴性对照序列,瞬时转染至C2C12细胞和从江香猪肾细胞中,48 h后检测PHKG2和PYGM、PGAM2、GYS1基因mRNA的表达量,发现shRNA-1对PHKG2基因干扰效率最高,shRNA-4的干扰效率却不明显。
糖原的代谢是根据机体的需要来调节的,通过磷酸化和去磷酸化,糖原的代谢才得以进行。磷酸化酶激酶(PHK)激活糖原磷酸化酶将糖原降解为葡萄糖-1-磷酸,一方面为肌肉收缩提供能量,另一方面为维持肝血糖含量[18]。糖原磷酸化酶(PYGM)通常是以去磷酸化状态存在,此状态下没有活性。在PHK和Ca2+存在时,PYGM被磷酸化获得生物活性,催化糖原降解为1-磷酸葡萄糖,然后转化为6-磷酸葡萄糖[19]。研究表明,糖原磷酸化酶的磷酸化位点在第14位的丝氨酸上,此位点的磷酸化和去磷酸化精确地调节着酶的活性。磷酸甘油酸变位酶(PGAM2)基因编码一种磷酸甘油酸盐(或酯)变位酶,该基因特异性地在肌肉中高表达,是糖酵解/糖质新生通路中的重要基因之一,具有磷酸甘油酸盐变位酶活性的分子功能,其编码的蛋白参与糖酵解过程[20]。肌肉糖原合成酶(GYS1)是糖原合成过程的限速酶,关键调控位点,在动物的肌肉和肝的糖原的合成过程中起着重要的作用[21]。研究表明,GYS1基因在控制组织的糖原代谢方面具有重要的作用[22-23]。研究显示,PGAM2、PYGM、GYS1基因缺陷分别引起人类X型,V型/ McArdle氏病,1型多糖贮积性肌病(PSSM1)等糖原贮积病[24-27]。综上表明,PGAM2、PYGM、GYS1基因在机体内糖原代谢中起着重要作用。因此本研究将重组质粒pEGFP-N3-PHKG2和4条RNAi载体瞬时转染至从江香猪肾细胞后,检测糖原代谢相关基因PYGM、PGAM2、GYS1的mRNA表达情况和细
胞中糖原含量,实现了对PHKG2基因的初步研究。本研究发现,超表达载体pEGFP-N3-PHKG2转染至细胞后,对于PGAM2、PYGM、GYS1基因的表达量均有上调,RNAi载体中shRNA-1转染至细胞后,对于PGAM2、PYGM、GYS1基因的表达量均有明显干扰作用。经过测定各组细胞中糖原含量发现,超表达载体pEGFP-N3-PHKG2转染至细胞后,与空白组和阴性对照相比,显著降低糖原的含量,而对于PHKG2基因进行干扰后,发现shRNA-1转染细胞后,糖原含量显著提高,可能因为PHKG2是属于糖原代谢中的一种重要酶,pEGFP-N3-PHKG2转染至细胞后,使得糖原得以分解成单糖,所以细胞中的糖原含量降低;而对PHKG2干扰后,使得PHKG2不能正常表达,并最终影响由代谢引起的糖原水平积累,这与PHKG2基因突变后会引起患者机体内糖原水平积累的说法一致[8]。
本研究将重组质粒pEGFP-N3-PHKG2和4条RNAi载体瞬时转染从江香猪肾细胞后,各糖原代谢相关基因PYGM、PGAM2、GYS1的表达分别上调和下调,从正反两方面研究PHKG2基因的生物学功能,实现了对PHKG2基因功能的初步探究,推测该基因可能是影响从江香猪猪肉品质的重要候选基因,可为后续转基因小鼠模型构建提供分子学依据。
4 结论本研究成功构建了pEGFP-N3-PHKG2载体和4条RNAi载体,在从江香猪肾细胞中超表达和干扰PHKG2基因表达后,发现各糖原代谢相关基因PYGM、PGAM2、GYS1的表达分别上调和下调,从正反两方面研究了PHKG2基因的生物学功能,推测PHKG2基因在猪糖原代谢过程中发挥着重要作用,同时对提高猪肉的营养价值及糖原代谢,调控基因网络的构建均具有重要意义。
| [1] | BRUSHIA R J, WALSH D A. Phosphorylase kinase:the complexity of its regulation is reflected in the complexity of its structure[J]. Front Biosci, 1999, 4: D618–D641. |
| [2] | HANCOCK J M, RICE N A. Characterization of the human PHKG2 promoter[J]. FASEB J, 2006, 20: A957. |
| [3] | LAU C K, HUI J, FONG F N Y, et al. Novel mutations in PHKA2 gene in glycogen storage disease type IX patients from Hong Kong, China[J]. Mol Genet Metab, 2011, 102(2): 222–225. DOI: 10.1016/j.ymgme.2010.11.004 |
| [4] | MAICHELE A J, BURWINKEL B, MAIRE I, et al. Mutations in the testis/liver isoform of the phosphorylase kinase γ subunit (PHKG2) cause autosomal liver glycogenosis in the gsd rat and in humans[J]. Nat Genet, 1996, 14(3): 337–340. DOI: 10.1038/ng1196-337 |
| [5] | BURWINKEL B, SHIOMI S, AL ZABEN A, et al. Liver glycogenosis due to phosphorylase kinase deficiency:PHKG2 gene structure and mutations associated with cirrhosis[J]. Hum Mol Genet, 1998, 7(1): 149–154. DOI: 10.1093/hmg/7.1.149 |
| [6] | BURWINKEL B, ROOTWELT T, KVITTINGEN E A, et al. Severe phenotype of phosphorylase Kinase-deficient liver glycogenosis with mutations in the PHKG2 gene[J]. Pediatr Res, 2003, 54(6): 834–839. DOI: 10.1203/01.PDR.0000088069.09275.10 |
| [7] | ALBASH B, IMTIAZ F, AL-ZAIDAN H. Novel PHKG2 mutation causing GSD IX with prominent liver disease:report of three cases and review of literature[J]. Eur J Pediatr, 2014, 173(5): 647–653. DOI: 10.1007/s00431-013-2223-0 |
| [8] |
周迪禹, 房迪, 邱文娟, 等. 5例糖原贮积症IXc型患儿临床和PHKG2基因突变分析[J]. 临床儿科杂志, 2017, 35(8): 609–612.
ZHOU D Y, FANG D, QIU W J, et al. Clinical features and PHKG2 gene mutation analysis of 5 Chinese patients with glycogen storage disease IXc[J]. Journal of Clinical Pediatrics, 2017, 35(8): 609–612. DOI: 10.3969/j.issn.1000-3606.2017.08.012 (in Chinese) |
| [9] |
王艳.大白猪与梅山猪肝脏组织差异表达基因的分离以及基因功能的研究[D].武汉: 华中农业大学, 2009: 88-97.
WANG Y.Isolation and functional analysis of differentially expressed genes in liver tissue between Large White and Meishan pigs[D].Wuhan: Huazhong Agricultural University, 2009: 88-97.(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10504-2010011261.htm |
| [10] | WANG P, WANG S Q, QIN C, et al. Characterization and expression of PGK2 and PHKG2 in testis tissues from fertile and sterile Banna Mini-pig inbred line (BMI)[J]. Res J Biotechnol, 2015, 10(2): 28–35. |
| [11] |
王圆圆, 许厚强, 陈伟, 等. 从江香猪PHKG1和PHKG2基因克隆及其mRNA在组织中表达水平[J]. 农业生物技术学报, 2017, 25(10): 1643–1652.
WANG Y Y, XU H Q, CHEN W, et al. Cloning of PHKG1 and PHKG2 genes in Congjiang pigs (Sus scrofa) and their mRNA expression in tissues[J]. Journal of Agricultural Biotechnology, 2017, 25(10): 1643–1652. (in Chinese) |
| [12] | GRANLUND A, JENSEN-WAERN M, ESSÉN-GUSTAVSSON B. The influence of the PRKAG3 mutation on glycogen, enzyme activities and fibre types in different skeletal muscles of exercise trained pigs[J]. Acta Vet Scand, 2011, 53: 20. DOI: 10.1186/1751-0147-53-20 |
| [13] |
马现永, 胡友军, 王丽, 等. 肌肉糖原代谢调控对猪肉品质的影响[J]. 广东畜牧兽医科技, 2017, 42(2): 1–4.
MA X Y, HU Y J, WANG L, et al. Effects of muscle glycogen metabolism regulation on pork quality[J]. Guangdong Journal of Animal and Veterinary Science, 2017, 42(2): 1–4. DOI: 10.3969/j.issn.1005-8567.2017.02.001 (in Chinese) |
| [14] | MA J W, YANG J, ZHOU L S, et al. A splice mutation in the PHKG1 gene causes high glycogen content and low meat quality in pig skeletal muscle[J]. PLoS Genet, 2014, 10(10): e1004710. DOI: 10.1371/journal.pgen.1004710 |
| [15] |
孙成娟, 许厚强, 段志强, 等. 从江香猪FoxO4基因真核表达载体的构建及其在皮下脂肪前体细胞中的表达[J]. 畜牧兽医学报, 2017, 48(12): 2268–2276.
SUN C J, XU H Q, DUAN Z Q, et al. Construction of recombinant eukaryotic expression vector of FoxO4 gene from Congjiang xiang pig and its expression in subcutaneous preadipocytes[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(12): 2268–2276. (in Chinese) |
| [16] | XIA H B, MAO Q W, PAULSON H L, et al. siRNA-mediated gene silencing in vitro and in vivo[J]. Nat Biotechnol, 2002, 20(10): 1006–1010. DOI: 10.1038/nbt739 |
| [17] | WILSON R C, DOUDNA J A. Molecular mechanisms of RNA interference[J]. Ann Rev Biophys, 2013, 42: 217–239. DOI: 10.1146/annurev-biophys-083012-130404 |
| [18] | WINCHESTER J S, ROUCHKA E C, ROWLAND N S, et al. In Silico characterization of phosphorylase kinase:evidence for an alternate intronic polyadenylation site in PHKG1[J]. Mol Genet Metab, 2007, 92(3): 234–242. DOI: 10.1016/j.ymgme.2007.06.015 |
| [19] | LEVITAN I B. Modulation of ion channels by protein phosphorylation and dephosphorylation[J]. Ann Rev Physiol, 1994, 56: 193–212. DOI: 10.1146/annurev.ph.56.030194.001205 |
| [20] | KAWASHIMA N, MISHIMA M, SHINDO R, et al. Partial deficiency of phosphoglycerate mutase with diabetic poly neuropathy:the first Japanese patient[J]. Intern Med, 1996, 35(10): 799–802. DOI: 10.2169/internalmedicine.35.799 |
| [21] | KASLOW H R, LESIKAR D D. Isozymes of glycogen synthase[J]. FEBS Lett, 1984, 172(2): 294–298. DOI: 10.1016/0014-5793(84)81144-8 |
| [22] | YANG S P, LI X, LIU X F, et al. Parallel comparative proteomics and phosphoproteomics reveal that cattle myostatin regulates phosphorylation of key enzymes in glycogen metabolism and glycolysis pathway[J]. Oncotarget, 2018, 9(13): 11352–11370. |
| [23] | PEDERSON B A, CHEN H Y, SCHROEDER J M, et al. Abnormal cardiac development in the absence of heart glycogen[J]. Mol Cell Biol, 2004, 24(16): 7179–7187. DOI: 10.1128/MCB.24.16.7179-7187.2004 |
| [24] | NAINI A, TOSCANO A, MUSUMECI O, et al. Muscle phosphoglycerate mutase deficiency revisited[J]. Arch Neurol, 2009, 66(3): 394–398. |
| [25] | QUINLIVAN R, BUCKLEY J, JAMES M, et al. McArdle disease:a clinical review[J]. J Neurol Neurosurg Psychiatry, 2010, 81(11): 1182–1188. DOI: 10.1136/jnnp.2009.195040 |
| [26] | SUKIGARA S, LIANG W C, KOMAKI H, et al. Muscle glycogen storage disease 0 presenting recurrent syncope with weakness and myalgia[J]. Neuromuscul Disord, 2012, 22(2): 162–165. DOI: 10.1016/j.nmd.2011.08.008 |
| [27] | MAILE C A, HINGST J R, MAHALINGAN K K, et al. A highly prevalent equine glycogen storage disease is explained by constitutive activation of a mutant glycogen synthase[J]. Biochim Biophys Acta, 2016, 1861(1 Pt A): 3388–3398. |



