2. 山东农业大学动物科技学院, 泰安 271018
2. College of Animal Science and Technology, Shandong Agricultural University, Tai'an 271018, China
牛病毒性腹泻病毒(bovine viral diarrhea virus, BVDV)是一种含有囊膜的单股正链RNA病毒,属于黄病毒科瘟病毒属。可根据BVDV 5′端非翻译区序列的差异,将BVDV分为BVDV1和BVDV2两种亚型[1],近来也有学者将BVDV分为BVDV1、BVDV2与BVDV3三种亚型[2];另根据病毒是否会导致宿主细胞的裂解或根据病毒NS3蛋白的分解产量,将其分为致细胞病变型(cytopathic biotype, cp)和非致细胞病变型(noncytopathic biotype, ncp)两种生物亚型[3-4]。
BVDV持续感染(persistent infection,PI)牛对牛群的危害很大[5],PI牛是指在妊娠母牛怀孕早期感染了ncp型BVDV,其胎儿能够正常出生、存活,这种胎儿便成为PI牛。PI牛可能本身并没有临床症状,但是终生带毒、排毒。感染BVDV的牛会出现一系列的发病症状,如胃肠疾病、生殖功能不全、免疫抑制、黏膜疾病、出血综合征等。BVDV不仅在牛群上存在严重的平行传播与垂直传播,而且还会在山羊、绵羊等家畜以及骆驼、羚羊、羊驼、鹿等野生动物之间交叉感染[6-8]。在美国,BVDV造成每年超过4亿美元的经济损失,成为该国影响牛健康状况的最为严重的病毒[9]。在世界范围,每个国家因BVDV造成的平均每头奶牛的经济损失约为24.85美元[10]。我国尚未研制出有效针对BVDV的疫苗,如今牧场采取排查并淘汰PI牛的方法来净化该病毒[11-12],但是此法仍不能从根本上提高荷斯坦牛对BVDV的抗病力,且耗费大量人力物力。因此,如何从宿主基因组中筛选出抗BVDV的基因以及进一步筛选出抗病牛显得尤为重要。
小泛素相关修饰物(small ubiquitin-related modifier, SUMO)存在于所有真核细胞中, 哺乳动物SUMO家族含有4个SUMO类似物, 即SUMO1、SUMO2、SUMO3与SUMO4。SUMO是一类高度保守的蛋白质家族, 为大多数真核细胞生存所必需,SUMO蛋白可同时参与转录调节、DNA修复和细胞周期调控等多种功能调节[13-14]。SUMO化是SUMO蛋白参与的一种共价修饰,其在病毒侵染机体的过程中起到至关重要的作用[15]。有研究表明,被流感病毒(具有转录活性的病毒)感染的宿主细胞内部整体的SUMO化水平明显增加[16]。SUMO化循环包括活化、连接、修饰和解离等诸多过程,其中泛素结合酶9(ubiquitin conjugating enzyme 9, UBC9)是SUMO化唯一的E2(enzyme 2)结合酶,在底物的识别过程中发挥着不可替代的作用[17]。有研究者通过干扰胞内UBC9的表达,发现流感病毒的RNA聚集明显增加,证实了SUMO对病毒的修饰作用[18]。Everett等[19]提出病毒蛋白还会影响宿主SUMO化。韩玉霞[20]研究发现,BVDV感染能够影响牛肾细胞(madin-darby bovine kidney cells, MDBK)的SUMO通路。此外,白细胞分化抗原4(cluster of differentiation 4, CD4)的研究大多与人类免疫缺陷病毒(human immunodeficiency virus, HIV)感染人体有关,Catalfamo等[21]发现与未感染的正常人相比,HIV-1感染者CD4+ T淋巴细胞的增殖降低;同时在奶牛疾病方面,CD4基因与奶牛乳房炎等免疫过程存在密不可分的关系[22-24]。本研究选取SUMO类基因的目的是为了探究在荷斯坦犊牛个体水平的SUMOs表达是否也与BVDV侵染机体存在一定的关系,选取CD4基因的目的在于探究BVDV侵染荷斯坦牛的免疫过程是否也与CD4的表达变化存在关系。
1 材料与方法 1.1 试验材料本试验所选用的42头荷斯坦犊牛(2月龄以内)均来自中国北方地区某奶牛场,采用颈静脉采血的方式采集犊牛血液(约8 mL),置于含EDTA的抗凝采血管中。离心分离白细胞并与Trizol试剂混合保存于-80 ℃冰箱,以用于提取RNA。
1.2 主要试剂Trizol试剂和无核酸酶水购自美国Ambion公司;PrimeScriptTM Ⅱ 1st Strand cDNA Synthesis Kit (目录号6210A)、RT reagent Kit with gDNA Eraser (Perfect Real-Time)(目录号RR047A)、6×Loading buffer、Taq酶(目录号R001A)与DNA marker购自TaKaRa公司。
本试验所选用的引物[7, 20]如表 1所示(GenBank暂无牛的SUMO4基因序列)。引物由北京擎科生物技术有限公司合成。
|
|
表 1 引物序列 Table 1 Primer sequence |
提前将样品放在冰上解冻,取200 μL样品运用Trizol法提取总RNA,之后加入适量0.01% DEPC处理水(50~100 μL)使RNA沉淀溶解,最后用分光光度计测定RNA浓度,记录数值后存放于-80 ℃冰箱待用。
1.4 病毒的分子检测及分析有关BVDV的检测方法有很多种,每种方法各有优劣、有各自适用的情况[25]。本试验选取了反转录法来检测BVDV,操作过程如下:
1.4.1 病毒基因组制备cDNA的过程采用TaKaRa公司PrimeScriptTM Ⅱ 1st Strand cDNA Synthesis Kit试剂盒进行病毒基因组cDNA的制备。
1.4.2 巢式PCR反应首先将病毒基因组反转录产物、Taq DNA聚合酶(5 U·μL-1)、外侧上下游引物(BVDV F与BVDV R)、10×PCR buffer、dNTP和双蒸水按照一定比例在Eppendorf管中进行配制。巢式PCR第一轮反应程序:预变性为94 ℃ 2 min、30个循环(变性98 ℃ 30 s、退火55 ℃ 30 s与延伸72 ℃ 30 s)、总延伸72 ℃ 5 min,保存于4 ℃;再将巢式PCR第一轮PCR产物、Taq DNA聚合酶(5 U·μL-1)、内侧上下游引物(BVDV-1 F、BVDV-1 R或BVDV-2 F、BVDV-2 R)、10×PCR buffer、dNTP和双蒸水按照一定比例在Eppendorf管中进行配制。巢式PCR第二轮反应程序同巢式PCR第一轮反应程序相同。巢式PCR产物用2.0%琼脂糖凝胶电泳分离,在紫外灯下成像以检测犊牛样品是否感染BVDV。
1.4.3 测序及序列分析将具有目标条带的巢式PCR产物送检测序,以确定目标条带是否确为BVDV,以及为何种基因型的BVDV;用DNAMAN软件来分析毒株间的同源性,用MEGA6软件构建系统进化树。
1.5 相关候选基因的定量表达分析根据病毒检测的结果,将所有犊牛样品分为两组(BVDV感染组和未感染组),对所选用的5个相关候选基因进行荧光定量PCR分析(GAPDH为内参基因)。首先运用RT reagent Kit with gDNA Eraser (Perfect Real-Time)试剂盒制备cDNA。接下来进行荧光定量PCR反应,按照Blue-SYBR-Green mix 10 μL、Forward primer (10 pmol·μL-1) 1 μL、Reverse primer(10 pmol·μL-1) 1 μL、cDNA溶液2 μL和ddH2O(试剂盒中自带) 6 μL的反应体系以及94 ℃预变性10 min,94 ℃变性40 s,58 ℃退火40 s,72 ℃延伸50 s,变性到延伸循环35次;熔解曲线形成程序:95 ℃ 5 s,65 ℃ 1 min,97 ℃ 10 s,40 ℃ 10 s的反应条件进行荧光定量PCR分析。最终对荧光定量PCR结果进行t-test检验,找出差异表达的基因。
2 结果 2.1 荷斯坦犊牛BVDV分子检测结果对所采集的42头中国荷斯坦犊牛的血液白细胞进行RNA提取、反转录和PCR扩增等,最终发现(图 1)其中13头犊牛含有BVDV-1型病毒,阳性检出率达到30.9%,但所有犊牛样品均没有发现BVDV-2型病毒。
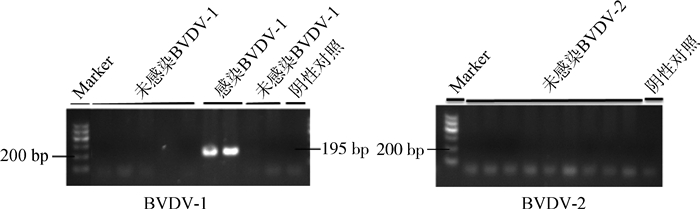
|
图 1 分子检测荷斯坦犊牛感染BVDV-1、BVDV-2电泳示意图 Figure 1 Electrophoresis figures of BVDV-1 or BVDV-2 infection in Holstein calves via molecular detection |
对检测到BVDV感染的13头犊牛样品的巢式PCR产物进行序列测定,对测序结果进行比对分析,发现所扩增序列确为BVDV-1型病毒;同时对这13段扩增所得的5′UTR序列(命名为BJCAU01~BJCAU13)运用DNAMAN软件进行比对分析(图 2a),发现这些序列之间的相似性达到95.80%。进一步将这些5′UTR核酸序列与GenBank上BVDV参考毒株对应的5′UTR核酸序列构建系统进化树,各BVDV参考毒株的基因型与登录号见表 2。运用MEGA6软件最大似然法进行上述序列的统计分析,本研究所构建的系统发生树结果显示,这13段5′UTR均属于BVDV-1亚型,且分别同BJ09_04、605/12-54与BJ09_24参考株具有较高的相似性(图 2b)。
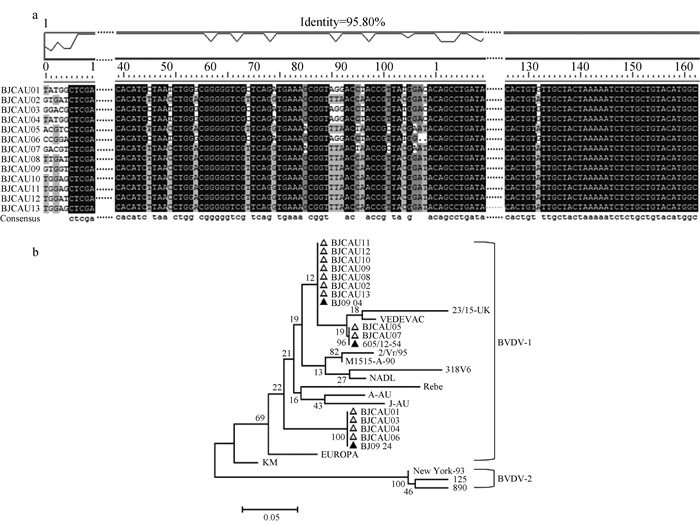
|
△.本研究获得的BVDV; ▲.高同源性的参考毒株 △.BVDV detected in the current study; ▲.Reference strains of high homology 图 2 BVDV病毒5′UTR相似性比较(a)与系统进化树分析(b) Figure 2 Comparison of homology (a) of 5′UTR of BVDV and phylogenetic tree (b) |
|
|
表 2 BVDV参考毒株信息 Table 2 The information of BVDV reference strains |
根据巢式PCR检测结果,将42头犊牛分为BVDV感染组与未感染组,进行宿主相关基因的荧光定量PCR分析,并进行t-test分析。结果发现,所选取的5个BVDV相关候选基因中有3个基因(SUMO1、SUMO2和SUMO3)的表达量在BVDV感染组与未感染组间存在显著差异(P < 0.05,图 3a、3b、3c)。相比于未感染犊牛,UBC9与CD4基因的表达量在BVDV-1感染牛中有下降趋势,但均未达显著性水平(图 3d、3e)。
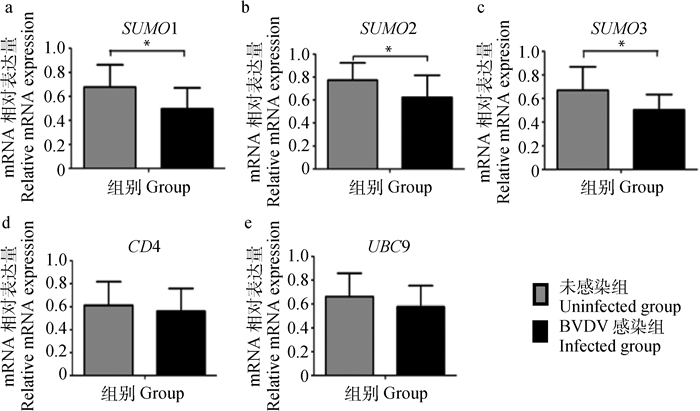
|
*.P < 0.05 图 3 BVDV感染相关候选基因在感染组与未感染组犊牛间的mRNA差异表达 Figure 3 The differences of mRNA expression levels of BVDV-infection related candidate genes between the infected and uninfected calves |
本试验采取的反转录法能够有效检测BVDV以及分析被感染牛BVDV的类型。42头犊牛的BVDV-1阳性检出率为30.9%,试验结果没有发现BVDV-2型病毒的存在,这也符合当前我国BVDV的流行趋势。本研究针对BVDV抗性候选基因的荧光定量结果表明,与未感染BVDV-1犊牛相比,感染BVDV-1犊牛SUMO1、SUMO2与SUMO3基因表达量均呈现显著性下调。
值得注意的是,SUMO1、SUMO2、SUMO3蛋白会与SUMO化的E3连接酶、细胞内的其他蛋白共同组成早幼粒白血病核小体相关蛋白(promyelocytic leukaemia protein nuclear bodies,PML NBs)。PML NBs在基因表达调控、细胞凋亡和抵抗病毒入侵等方面发挥着至关重要的作用;而许多病毒蛋白也会破坏PML NBs来抵抗宿主的免疫过程[19]。韩玉霞[20]发现,沉默MDBK细胞的SUMO1基因会促进BVDV的复制;本研究荧光定量PCR结果表明,相比于健康犊牛而言,BVDV-1感染犊牛SUMO1、SUMO2和SUMO3基因的相对表达量显著下调。结合前人研究与本研究结果是否可以提出这样的假说:机体在受到BVDV-1侵染的过程中,PML NBs很可能参与了抵抗BVDV-1侵染的免疫过程。如果SUMO1、SUMO2、SUMO3被沉默或表达量不足会导致PML NBs合成量的降低,由此BVDV-1病毒就能够免受机体的免疫调控[19-20]。研究表明,许多病毒蛋白自身需要被SUMO化[16, 19]。韩玉霞的试验发现,沉默MDBK细胞UBC9基因会抑制BVDV的复制,这可能是因为UBC9是SUMO化唯一的E2结合酶,若UBC9被沉默或表达量下调,就不能产生足够成熟的SUMO化病毒蛋白,从而抑制了BVDV-1的复制。最后,我们将前人与本试验的研究结果进行整合[19-20, 26],绘制了BVDV-1侵染机体与宿主SUMO化相关基因表达之间的关系示意图(图 4)。
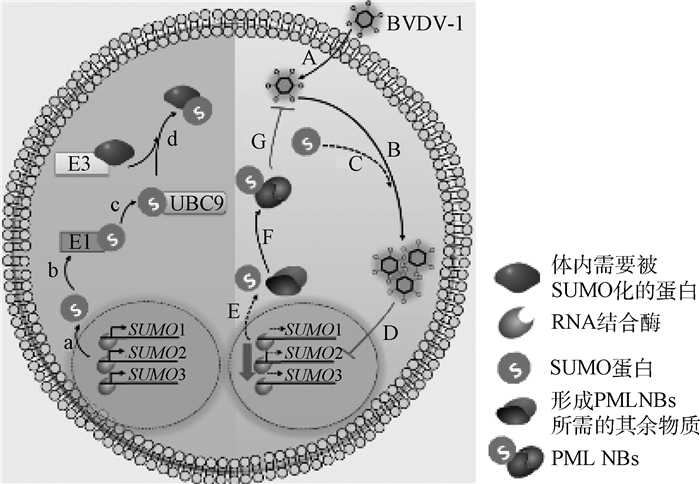
|
左半图为BVDV-1未感染细胞。a~d为体内SUMO化过程[19]:a. SUMO1、SUMO2和SUMO3转录翻译为SUMO蛋白;b. E1酶参与下的SUMO蛋白激活过程;c. UBC9与SUMO蛋白结合;d.在UBC9与E3连接酶的作用下,底物蛋白被SUMO化。右半图为BVDV-1感染细胞。A~G为SUMO化与BVDV-1复制的关系[19-20, 26]:A. BVDV-1病毒通过一系列过程进入宿主细胞;B. BVDV-1病毒复制产生子代病毒;C.病毒产生的蛋白可能需要SUMO化才能形成成熟蛋白;D. BVDV-1病毒的侵染会导致机体内SUMO1、SUMO2和SUMO3转录水平下降;E. SUMO1、SUMO2和SUMO3转录翻译为SUMO蛋白;F. PML NBs形成;G.PML NBs干扰BVDV-1病毒繁殖 Left panel is BVDV-1 uninfected cell: a-d show the process of sumoylation in vivo[19]: a. SUMO1, SUMO2 and SUMO3 are transcribed and translated into SUMO; b. SUMO is activated by E1 enzyme; c. Activated SUMO is transferred to UBC9; d. UBC9 catalyses the conjunction of SUMO to target proteins in concert with SUMO E3 ligase. Right panel is BVDV-1 infected cell: A-G show the relationship between BVDV-1 reproduction and sumoylation[19-20, 26]: A. BVDV-1 enters the cell; B. BVDV-1 reproduces progeny virus; C. Some proteins produced by BVDV-1 need to be sumoylated; D. BVDV-1 infects cell that will reduce the transcription level of SUMO1, SUMO2 and SUMO3 in vivo; E. SUMO1, SUMO2 and SUMO3 are transcribed and translated into SUMO; F. The formation of PML NBs; G. PML NBs can interfere the reproduction of BVDV-1 图 4 BVDV-1侵染机体与宿主SUMO化相关基因表达之间的关系图 Figure 4 The relationship between the BVDV-1 infection and the expression of SUMO genes expression in the host cells |
试验结果显示,CD4基因的mRNA相对表达量在BVDV-1感染组与健康组之间未达到显著性差异,但在感染组有下降的趋势。Falkenberg等[27]检测了在接种BVDV-2后14 d的荷斯坦犊牛组织样品,发现相比于阴性对照的健康组,BVDV-2高毒力感染组的CD4+T细胞数量有上升趋势,而BVDV-2低毒力感染组的CD4+T细胞数量有下降趋势,在大多组织中差异未达到显著性水平。因此,CD4基因与BVDV侵染的关系可能比较复杂,还需进一步深入研究。
4 结论本试验所采用的BVDV检测方法为病原检测方法,能够有效地从犊牛血液中检测BVDV的感染情况。BVDV的相似性较高,在北京地区奶牛场检测到的BVDV-1毒株并未发生大规模的突变现象,未检测到BVDV-2毒株。本研究发现,感染BVDV-1的犊牛其白细胞中的SUMO1、SUMO2与SUMO3表达量显著低于未感染犊牛,表明BVDV-1侵染宿主的过程很可能与宿主体内的SUMO蛋白存在相互作用机制,提示SUMO1、SUMO2与SUMO3可能与BVDV-1侵染机体的细胞通路有关。
| [1] | RIDPATH J F, BOLIN S R. Differentiation of types 1a, 1b and 2 bovine viral diarrhoea virus (BVDV) by PCR[J]. Mol Cell Probes, 1998, 12(2): 101–106. DOI: 10.1006/mcpr.1998.0158 |
| [2] | BAUERMANN F V, RIDPATH J F, WEIBLEN R, et al. HoBi-like viruses:An emerging group of pestiviruses[J]. J Vet Diagn Invest, 2013, 25(1): 6–15. DOI: 10.1177/1040638712473103 |
| [3] | HOUSE H. Epidemiology of bovine viral diarrhea virus[J]. Vet Clin North Am Food Anim Pract, 1995, 11(3): 521–547. DOI: 10.1016/S0749-0720(15)30465-5 |
| [4] | LACKNER T, MÜLLER A, PANKRAZ A, et al. Temporal modulation of an autoprotease is crucial for replication and pathogenicity of an RNA virus[J]. J Virol, 2004, 78(19): 10765–10775. DOI: 10.1128/JVI.78.19.10765-10775.2004 |
| [5] |
王炜, 武华. 牛病毒性腹泻病毒生物学特性、危害及防控[J]. 中国奶牛, 2014(23-24): 22–26.
WANG W, WU H. Biological characteristics, hazards and control of bovine viral diarrhea virus[J]. China Dairy Cattle, 2014(23-24): 22–26. (in Chinese) |
| [6] | DARWEESH M F, RAJPUT M K S, BRAUN L J, et al. Characterization of the cytopathic BVDV strains isolated from 13 mucosal disease cases arising in a cattle herd[J]. Virus Res, 2015, 195: 141–147. DOI: 10.1016/j.virusres.2014.09.015 |
| [7] |
李娜, 韩猛立, 黄新, 等. 新疆石河子地区牛病毒性腹泻病毒的分子流行病学调查[J]. 石河子大学学报:自然科学版, 2009, 27(6): 706–711.
LI N, HAN M L, HUANG X, et al. Epidemiology investigation of bovine viral diarrhea virus in Shihezi, Xinjiang[J]. Journal of Shihezi University:Natural Science, 2009, 27(6): 706–711. (in Chinese) |
| [8] | EVERMANN J F. Pestiviral infection of llamas and alpacas[J]. Small Rumin Res, 2006, 61(2-3): 201–206. DOI: 10.1016/j.smallrumres.2005.07.010 |
| [9] | HANSEN T R, SMIRNOVA N P, WEBB B T, et al. Innate and adaptive immune responses to in utero infection with bovine viral diarrhea virus[J]. Anim Health Res Rev, 2015, 16(1): 15–26. DOI: 10.1017/S1466252315000122 |
| [10] | RICHTER V, LEBL K, BAUMGARTNER W, et al. A systematic worldwide review of the direct monetary losses in cattle due to bovine viral diarrhoea virus infection[J]. Vet J, 2017, 220: 80–87. DOI: 10.1016/j.tvjl.2017.01.005 |
| [11] |
黄凯, 张俊杰, 刘英霞, 等. 北京地区规模化牛场BVDV持续感染牛清除方案的初步实施[J]. 中国动物检疫, 2010, 27(5): 34–35.
HUANG K, ZHANG J J, LIU Y X, et al. Preliminary implemantation of BVDV persistently infected cow eradication program in dairy farms in Beijing area[J]. Chinese Journal of Animal Health Inspection, 2010, 27(5): 34–35. (in Chinese) |
| [12] | RIDPATH J. Preventive strategy for BVDV infection in North America[J]. Jpn J Vet Res, 2012, 60(Sl): S41–S49. |
| [13] |
韦玮, 张浩, 毛建平, 等. 蛋白质SUMO化修饰研究进展[J]. 中国生物工程杂志, 2008, 28(7): 122–126.
WEI W, ZHANG H, MAO J P, et al. Progress on the study of sumoylation[J]. China Biotechnology, 2008, 28(7): 122–126. (in Chinese) |
| [14] |
汪小杰, 毛若雨, 张勇, 等. SUMO在蛋白表达中的应用[J]. 生物技术通报, 2013(10): 28–33.
WANG X J, MAO R Y, ZHANG Y, et al. Application of SUMO protein in fusion expression system[J]. Biotechnology Bulletin, 2013(10): 28–33. (in Chinese) |
| [15] |
刘慧敏, 李文清, 苏丽娟, 等. SUMO化修饰在流感病毒感染中的作用研究进展[J]. 病毒学报, 2015, 31(5): 560–564.
LIU H M, LI W Q, SU L J, et al. Research progress inthe function of SUMOylation during infection by the influenza virus[J]. Chinese Journal of Virology, 2015, 31(5): 560–564. (in Chinese) |
| [16] | PAL S, SANTOS A, ROSAS J M, et al. Influenza a virus interacts extensively with the cellular SUMOylation system during infection[J]. Virus Res, 2011, 158(1-2): 12–27. DOI: 10.1016/j.virusres.2011.02.017 |
| [17] |
周鹏, 张子平, 王艺磊, 等. 大黄鱼ubc9基因的克隆和组织表达[J]. 生物技术通报, 2009(8): 76–82.
ZHOU P, ZHANG Z P, WANG Y L, et al. Cloning and characterization of ubc9 gene of large yellow croaker larimichthys crocea and its expression pattern[J]. Biotechnology Bulletin, 2009(8): 76–82. (in Chinese) |
| [18] | WU C Y, JENG K S, LAI M M C. The SUMOylation of matrix protein M1 modulates the assembly and morphogenesis of influenza a virus[J]. J Virol, 2011, 85(13): 6618–6628. DOI: 10.1128/JVI.02401-10 |
| [19] | EVERETT R D, BOUTELL C, HALE B G. Interplay between viruses and host sumoylation pathways[J]. Nat Rev Microbiol, 2013, 11(6): 400–411. DOI: 10.1038/nrmicro3015 |
| [20] |
韩玉霞. BVDV体外感染与细胞SUMO通路关系的初步研究[D]. 石河子: 石河子大学, 2015.
HAN Y X. Preliminary study of the relationship between bovine viral diarrhea virus infection in vitro and SUMO pathway of cell[D]. Shihezi: Shihezi University, 2015. (in Chinese) |
| [21] | CATALFAMO M, WILHELM C, TCHEUNG L, et al. CD4 and CD8 T cell immune activation during chronic HIV infection:roles of homeostasis, HIV, type Ⅰ IFN, and IL-7[J]. J Immunol, 2011, 186(4): 2106–2116. DOI: 10.4049/jimmunol.1002000 |
| [22] |
张志超. 包被叶酸提高围产期荷斯坦牛免疫力的分子基础研究[D]. 北京: 中国农业大学, 2016.
ZHANG Z C. Study on molecular mechanisms of folic acid to improve the immunity of transition Holstein cow[D]. Beijing: China Agricultural University, 2016. (in Chinese) |
| [23] | HE Y H, CHU Q, MA P P, et al. Association of bovine CD4 and STAT5b single nucleotide polymorphisms with somatic cell scores and milk production traits in Chinese Holsteins[J]. J Dairy Res, 2011, 78(2): 242–249. DOI: 10.1017/S0022029911000148 |
| [24] | CARR B V, LEFEVRE E A, WINDSOR M A, et al. CD4+ T-cell responses to foot-and-mouth disease virus in vaccinated cattle[J]. J Gen Virol, 2013, 94(Pt 1): 97–107. |
| [25] | DUBOVI E J. Laboratory diagnosis of bovine viral diarrhea virus[J]. Biologicals, 2013, 41(1): 8–13. DOI: 10.1016/j.biologicals.2012.06.004 |
| [26] | GOYAL S M, RIDPATH J F. Bovine viral diarrhea virus:diagnosis, management and control[M]. Oxford: Blackwell Publishing Professional, 2005: 190. |
| [27] | FALKENBERG S M, JOHNSON C, BAUERMANN F V, et al. Changes observed in the thymus and lymph nodes 14 days after exposure to BVDV field strains of enhanced or typical virulence in neonatal calves[J]. Vet Immunol Immunopathol, 2014, 160(1-2): 70–80. DOI: 10.1016/j.vetimm.2014.03.018 |



