2. 南京农业大学动物医学院农业部动物细菌学重点实验室, 南京 210095
2. Key Laboratory of Animal Bacteriology of Ministry of Agriculture, College of Veterinary Medicine, Nanjing Agricultural University, Nanjing 210095, China
猪圆环病毒(porcine circovirus, PCV)属于圆环病毒科圆环病毒属成员。该病毒有两个血清型,即PCV1和PCV2[1]。通常认为,PCV1不具有致病性,偶见其引发的繁殖障碍,但其在猪群中广泛感染。PCV2感染可引起断奶仔猪多系统衰竭综合征(post-weaning multisystemic wasting syndrome, PMWS)、猪皮炎肾病综合征(porcine dermatitis nephropathy syndrome, PDNS)、猪呼吸道综合征(porcine respiratory disease complex, PRDC)、母猪繁殖障碍综合征、腹泻及先天性震颤等多种临床疾病,给全球养殖业带来了巨大的经济损失,引起各国养猪业的高度重视[2-3]。近年来,美国学者Phan、Palinski等首先发现繁殖障碍母猪、PDNS、猪心肌炎和多系统炎症病变组织中存在一种新的猪圆环病毒,其Cap基因序列与PCV2的相似性仅24%~26%,命名为PCV3[4-5]。我国学者采用PCR方法从临床发病猪肺和淋巴结组织样品中检出PCV3,证明我国也存在该病毒[6-7]。
环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)具有经济实用、高效、快速和简便等特点,已经用于多种猪病原检测,如猪瘟病毒、猪繁殖与呼吸综合征和猪伪狂犬病毒等[8-9],但尚无PCV3 LAMP检测方法报道。本研究根据PCV3基因序列,设计特异引物,成功建立了一种PCV3 LAMP检测方法,56 ℃恒温条件下35 min内即可直接通过肉眼判定,并具有较高特异性和敏感性。
1 材料和方法 1.1 病毒、重组质粒和病料病毒:PCV3、PCV1、PCV2a、PCV2b、猪伪狂犬病毒(PRV)、猪瘟病毒(CSFV)、猪流行性腹泻病毒(PEDV)等均由本实验室分离保存。
重组质粒:pMD19-T-Cap,含PCV3 ORF2基因,浓度为1.89×10-7ng·μL-1,基因拷贝数为5.22×1010copies·μL-1,由南京金思瑞生物技术有限公司构建并提供。
猪临床样品:来源于2016—2017年江苏、山东、浙江和福建省38个猪场,临床上表现呼吸道症状,淋巴结和肺组织样品68份。-20 ℃保存备用。
1.2 病毒核酸提取按照DNA提取试剂盒说明书进行抽提,采用TRIZOL试剂说明书方法提取病毒核酸,置-20 ℃保存。
1.3 LAMP引物设计与合成根据PCV3 MO毒株(NCBI登录号:KX778720.1)Cap基因保守序列,运用在线生物软件(https://primere explorer.jp/)设计特异性引物,引物序列见表 1,包括一对外引物F3和B3、一对内引物FIP和BIP以及一对环引物LoopF和LoopB,引物由Invitrogen公司合成。
|
|
表 1 LAMP扩增引物 Table 1 Primers used in LAMP amplification |
LAMP反应体系25 μL,含10×Thermopol Buffer(NEB公司)2.5 μL、MgSO4(100 mmol·L-1)(NEB公司)1.5 μL、dNTP(10 mmol·L-1)(NEB公司)3.5 μL,内引物FIP/BIP(40 μmol·L-1)各为1 μL,外引物F3/B3(5 μmol·L-1)各1 μL,环引物LoopF/LoopB(10 μmol·L-1)各为1 μL,Bst DNA聚合酶(8 000 U·mL-1)(NEB公司)1.5 μL,甜菜碱(Betaine)(Sigma公司)2.0 μL,灭菌ddH2O 6.5 μL,模板DNA 1.5 μL。
1.5 LAMP反应体系和条件优化按下列成分的浓度进行反应体系优化:dNTP浓度梯度4、6、8、10和12 mmol·L-1;Mg2+浓度120、100、80、60和40 mmol·L-1;甜菜碱量4.0、3.0、2.0、1.0和0 μL;内、外引物(μmol·L-1)比12:1、10:1、8:1、6:1和4:1。
反应温度优化:温度设置(67、65、63、61、59和57 ℃);反应时间设置为(40、38、36、34和32 min)5个梯度,反应结束后取5 μL反应产物于1.5%琼脂糖凝胶电泳鉴定结果,根据条带扩增效果确定最佳反应条件。
1.6 LAMP敏感性试验将重组质粒pMD19-T-Cap阳性质粒标准品稀释至106copies·μL-1,按10倍倍比稀释至100.1copies·μL-1,用优化好的PCV3-LAMP方法和常规RT-PCR方法同步进行敏感性比较。并对以上结果分别用SYBR Green Ⅰ染料进行显色,筛选最佳染料。
1.7 LAMP特异性试验取PRRSV、PRV、PCV1、PCV2和猪瘟病毒样品,提取病毒基因组,用LAMP方法检测,用1.5%琼脂糖凝胶电泳鉴定。
用Olige软件分析LAMP目的片段中的酶切位点,筛选单一的HaeⅡ(识别GCGC),进行酶切反应。20 μL酶切反应体系包括:HaeⅡ(TaKaRa公司) 1.5 μL,LAMP产物1 μL,10×Buffer 2 μL,15.5 μL ddH2O。37 ℃反应2 h,取15 μL的酶切产物在1.5%琼脂糖凝胶进行鉴定,酶切产物大小应为184 bp。
1.8 PCR方法检测PCV3按Palinski等[5]方法进行。PCR反应体系为:94 ℃预变性4 min;94 ℃变性20 s,50 ℃退火30 s,72 ℃延伸1 min,进行40个循环;最后72 ℃延伸5 min。引物为5′-CCACAGAAGGCGCTATGTC-3′和5′-CCGCATAAGGGTCGTCTTG-3′,PCR产物经1.5%琼脂糖凝胶电泳观察。
2 结果 2.1 LAMP反应体系和条件优化采用LAMP体系内不同浓度组分,进行反应条件优化,结果见图 1,确定25 μL最佳反应体系成分为:10×Thermopol Buffer 2.5 μL,MgSO4(100 mmol·L-1)1.5 μL,dNTP(10 mmol·L-1)3.5 μL,外引物F3/B3(4 μmol·L-1)各1 μL,内引物FIP/BIP(40 μmol·L-1)各为1 μL,环引物LF/LB(10 μmol·L-1)各为1 μL,Bst DNA聚合酶(8 000 U·mL-1)1.5 μL,甜菜碱(Betaine)2 μL,灭菌ddH2O 6.5 μL,模板cDNA 1.5 μL。最佳反应温度为59 ℃,最短反应时间为36 min。

|
A. dNTP浓度优化; B.Mg2+优化;C.甜菜碱优化;D.内外引物浓度比优化;E.温度优化;F.时间优化;M.DNA相对分子质量标准;N.阴性对照 A. Optimization of dNTP concentration; B. Mg2+ concentration; C. Betaine concentration; D. Ratio of forward and reverse primers concentration; E. Temperature; F. Reaction time; M. DNA marker DL2000;N. Negative control 图 1 PCV3 LAMP反应体系和条件优化结果 Figure 1 Optimization of the reaction system and conditions of LAMP for detection of PCV3 |
反应产物用SYBR Green Ⅰ(Invitrogen公司)染料进行显色比较。
2.2 可视性结果观察LAMP反应过程中,dNTP析出的焦磷酸根离子与反应溶液中的Mg2+结合,产生焦磷酸镁白色沉淀(图 2A)。SYBR Green Ⅰ则通过结合到双链DNA的小沟产生绿色荧光,而阴性呈现黄色(图 2B)。
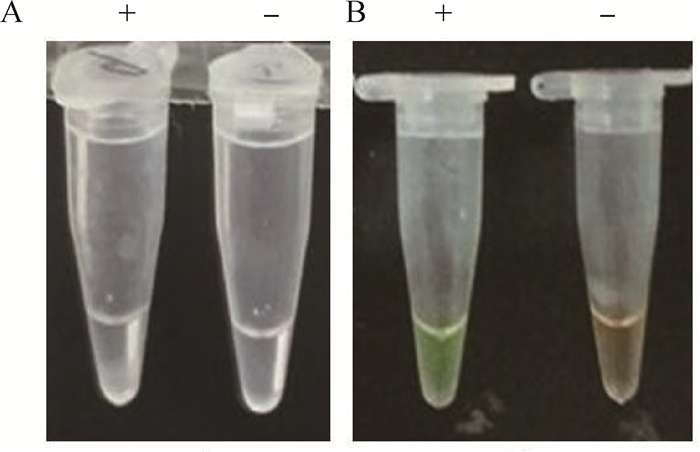
|
A.不加染料观察;B. SYBR Green Ⅰ显色结果 A. LAMP positive products without stain components; B. LAMP positive products by adding SYBR Green Ⅰ 图 2 LAMP两种染料可视化效果比较 Figure 2 Observation of LAMP amplification products by adding 2 staining components |
取PCV3重组质粒pMD19-T-Cap(浓度为1.89×10-7ng·μL-1,基因拷贝数为5.22×1010copies·μL-1),用蒸馏水做10倍梯度稀释,采用LAMP和PCR检测PCV3,结果为:常规PCR方法可检测102copies·μL-1浓度的质粒,LAMP反应可检测到10拷贝·μL-1浓度的质粒,比常规PCR方法敏感10倍。
2.4 LAMP特异性试验取PCV3、PRRSV、PRV、PCV1、PCV2和猪瘟病毒样品进行PCV3 LAMP检测,结果显示,PCV3样品LAMP扩增可见梯形条带,其他病原检测均未见条带(图 4A)。
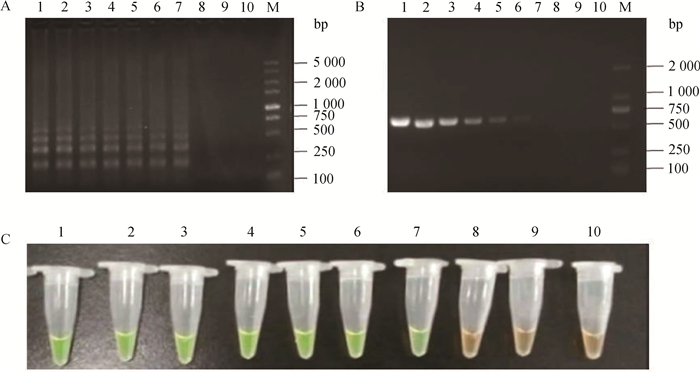
|
A.LAMP电泳结果; B.RT-PCR; C.LAMP-SYBR Green Ⅰ显色。1~9. 107 ~100.01基因拷贝·μL-1; 10.阴性对照;M. DL2000 DNA相对分子质量标准 A. LAMP results; B. RT-PCR; C. Visual of SYBR Green Ⅰ. 1-9. 107 ~100.01 copies·μL-1; 10. Negative control; M. DL2000 DNA marker 图 3 LAMP反应敏感性试验 Figure 3 Sensitivity of LAMP |
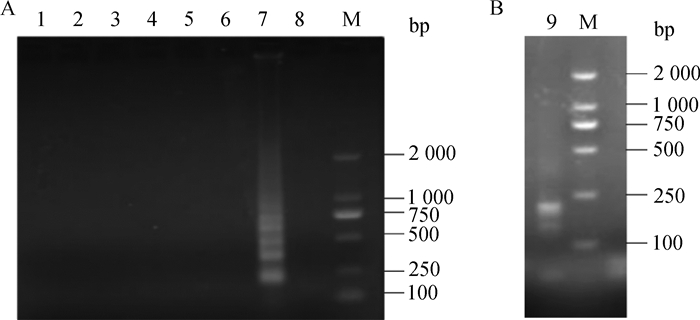
|
A.不同病原的LAMP检测结果;B. LAMP反应产物鉴定结果;1.阴性对照;2.猪瘟病毒;3.猪流行性腹泻病毒;4.猪圆环病毒1型;5.猪圆环病毒2a和2b型;6.猪伪狂犬病毒;7.猪圆环病毒3型;8.猪繁殖与呼吸综合征;9. Hae Ⅱ酶切LAMP产物结果;M. DL2000 DNA相对分子质量标准 A. LAMP detection of different pathogens results; B. Identification results of LAMP reaction products; 1. Negative control; 2. CSFV; 3. PEDV; 4. PCV1; 5. PCV2a+2b; 6. PRV; 7.PCV3; 8.PRRSV; 9. LAMP products digested with Hae Ⅱ; M. DL2000 DNA marker 图 4 LAMP特异性试验结果 Figure 4 Spicificity assay of LAMP |
取PCV3 LAMP扩增产物,采用Hae Ⅱ酶切,1.5%琼脂糖凝胶电泳结果显示,出现约184 bp条带和126 bp(图 4B),与预期计算结果相符,证明扩增正确。
2.5 临床样品检测取68份临床发病猪组织样品,采用LAMP显色法与常规PCR同时检测,结果见表 2,表明LAMP检测PCV3阳性检出率为30.9%(21/68),常规PCR阳性率为26.5%(18/68),LAMP方法检出率高于常规PCR检测结果,LAMP与常规PCR符合率为95.6%(65/68)。
|
|
表 2 LAMP与PCR检测临床样品PCV3结果的比较 Table 2 Comparison of LAMP with PCR results for PCV3 in clinical samples |
在2003年以前PCV2a为主要流行毒株,而近年来PCV2b感染较为普遍。猪圆环病毒3型(PCV3)是一种新的病原,2016年10月,Palinski等[5]报道了从流产胎猪中检测到高拷贝的PCV3基因组。国外报道该病毒感染可能与猪皮炎和母猪繁殖障碍相关,但其致病性还不十分清楚。该病毒的检测方法主要有PCR方法、real-time PCR方法和核酸探针方法[10-12]。PCR方法具有灵敏性和特异性高的特点。我国学者采用PCR方法进行了大量样品检测[12],但需要价格昂贵的PCR检测仪器。Real-time PCR及核酸探针方法条件要求更高,很难普及推广。
环介导的恒温扩增(loop-mediated isothermal amplification,LAMP),是Notomi等[13]于2000年发明的一种体外恒温核酸扩增技术,不需要昂贵的仪器设备,在等温条件下就能快速完成反应[14-15]。目前该项技术已被广泛用于细菌、病毒、寄生虫和动物胚胎鉴定等检测。本研究所建立LAMP检测方法只需在恒温59 ℃条件下反应36 min即可完成扩增,通过在反应管中加入染料经颜色变化判定结果,达到快速检测的目的。在筛选荧光染料、提高检测结果灵敏度的研究结果上发现,SYBR Green Ⅰ比HNB显色效果更直观,敏感性也更佳。该方法同样具备较好的特异性,灵敏度与real-time PCR相当。临床样品检测结果显示,LAMP与传统的PCR有较高的符合率,与庞笑语等[16]报道的结果相符。这表明PCV3已经普遍存在于我国猪群体内,因此加强该病流行病学监测显得至关重要。本研究建立的针对PCV3的LAMP检测方法快速简便,可用于PCV3临床检测,具有较好的应用前景。
由于该技术具备极高的灵敏度,故在检测过程中会不可避免出现假阳性污染问题。因此LAMP的检测环境需要严格分区,操作规程一定要严谨,多通风。针对此类问题,我们在以后的研究中也会继续寻找改进的措施。
4 结论根据PCV3 ORF2基因保守序列,设计特异性引物并优化反应条件,建立了PCV3 LAMP检测方法,该方法最低检测限为1.0×101copies·μL-1,与PRRSV、PRV、CSFV、PCV1和PCV2等均无交叉反应。临床样品检测发现,PCV3阳性率占30.9%,与PCR检测结果符合率为95.6%(65/68)。提示相对传统PCR方法而言,该方法敏感特异,简便快速,可用于PCV3检测和临床诊断。
| [1] | GRAU-ROMA L, FRAILE L, SEGALES J. Recent advances in the epidemiology, diagnosis and control of diseases caused by porcine circovirus type 2[J]. Vet J, 2011, 187(1): 23–32. DOI: 10.1016/j.tvjl.2010.01.018 |
| [2] | ALARCON P, RUSHTON J, WIELAND B. Cost of post-weaning multi-systemic wasting syndrome and porcine circovirus type-2 subclinical infection in England-an economic disease model[J]. Prev Vet Med, 2013, 110(2): 88–102. DOI: 10.1016/j.prevetmed.2013.02.010 |
| [3] | FINSTERBUSCH T, MANKERTZ A. Porcine circoviruses—Small but powerful[J]. Virus Res, 2009, 143(2): 177–183. DOI: 10.1016/j.virusres.2009.02.009 |
| [4] | PHAN T G, GIANNITTI F, ROSSOW S, et al. Detection of a novel circovirus PCV3 in pigs with cardiac and multi-systemic inflammation[J]. Virol J, 2016, 13: 184. DOI: 10.1186/s12985-016-0642-z |
| [5] | PALINSKI R, PIÑEYRO P, SHANG P C, et al. A novel porcine circovirus distantly related to known circoviruses is associated with porcine dermatitis and nephropathy syndrome and reproductive failure[J]. J Virol, 2016, 91(1): e01879–16. |
| [6] | KU X, CHEN F, LI P, et al. Identification and genetic characterization of porcine circovirus type 3 in China[J]. Transbound Emerg Dis, 2017, 64(3): 703–708. DOI: 10.1111/tbed.2017.64.issue-3 |
| [7] | ZHENG S, WU X, ZHANG L, et al. The occurrence of porcine circovirus 3 without clinical infection signs in Shandong Province[J]. Transbound Emerg Dis, 2017, 64(5): 1337–1341. DOI: 10.1111/tbed.2017.64.issue-5 |
| [8] | ZHANG C F, CUI S J, ZHU C. Loop-mediated isothermal amplification for rapid detection and differentiation of wild-type pseudorabies and gene-deleted virus vaccines[J]. J Virol Methods, 2010, 169(1): 239–243. DOI: 10.1016/j.jviromet.2010.07.034 |
| [9] |
陈伯祥, 杨明, 常亮, 等. 环介导等温扩增技术在动物传染病诊断中的应用进展[J]. 动物医学进展, 2012, 33(4): 90–96.
CHEN B X, YANG M, CHANG L, et al. Progress on loop-mediated isothermal ampplification in diagnosis of animal infectious disease[J]. Progress in Veterinary Medicine, 2012, 33(4): 90–96. (in Chinese) |
| [10] | KIM H R, PARK Y R, LIM D R, et al. Multiplex real-time polymerase chain reaction for the differential detection of porcine circovirus 2 and 3[J]. J Virol Methods, 2017, 250: 11–16. DOI: 10.1016/j.jviromet.2017.09.021 |
| [11] | WANG J C, ZHANG Y N, WANG J F, et al. Development of a TaqMan-based real-time PCR assay for the specific detection of porcine circovirus 3[J]. J Virol Methods, 2017, 248: 177–180. DOI: 10.1016/j.jviromet.2017.07.007 |
| [12] |
湛洋, 王东亮, 王乃东, 等. 猪圆环病毒3型检测及其Cap结构序列和抗原性预测分析[J]. 畜牧兽医学报, 2017, 48(6): 1076–1084.
ZHAN Y, WANG D L, WANG N D, et al. Survey on detection and analyses of cap antigenicity prediction of porcine circovirus type 3 isolated from partial provinces of Southern China[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(6): 1076–1084. (in Chinese) |
| [13] | NOTOMI T, OKAYAMA H, MASUBUCHI H, et al. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Res, 2000, 28(12): e63. DOI: 10.1093/nar/28.12.e63 |
| [14] |
黄火清, 郁昂. 环介导等温扩增技术的研究进展[J]. 生物技术, 2012, 22(3): 90–94.
HUANG H Q, YU A. Advances of loop-mediated isothermal amplification[J]. Biotechnology, 2012, 22(3): 90–94. (in Chinese) |
| [15] |
戴婷婷, 陆辰晨, 郑小波. 环介导等温扩增技术在病原物检测上的应用研究进展[J]. 南京农业大学学报, 2015, 38(5): 695–703.
DAI T T, LU C C, ZHENG X B. Application research progress of loop-mediated isothermal amplification in the pathogenic microorganism[J]. Journal of Nanjing Agricultural University, 2015, 38(5): 695–703. DOI: 10.7685/j.issn.1000-2030.2015.05.001 (in Chinese) |
| [16] |
庞笑语, 王建昌, 韩庆安, 等. 河北省猪群中检出猪圆环病毒3型[J]. 中国动物检疫, 2017, 34(11): 70–73.
PANG X Y, WANG J C, HAN Q A, et al. Porcine circovirus type 3 was detected from swine herds in Hebei province[J]. China Animal Health Inspection, 2017, 34(11): 70–73. DOI: 10.3969/j.issn.1005-944X.2017.11.019 (in Chinese) |



