2. 成都大熊猫繁育研究基地, 成都 610081
2. Chengdu Research Base of Giant Panda Breeding, Chengdu 610081, China
犬瘟热(canine distemper,CD)是由副黏病毒科(Paramyxoviridae)麻疹病毒属(Morbillivirus)的犬瘟热病毒(canine distemper virus, CDV)引起的在食肉目动物中广泛传播的急性高度接触性传染病[1-3]。CDV给犬、貂等经济动物养殖业和大熊猫等特种动物的保护及生物多样性带来极大损失,其社会公共危害性越来越受到人们重视[4]。犬瘟热病毒对外界环境特别敏感,分离病毒不易,严重制约对CDV的深入研究。有学者利用Vero细胞系、MDCK细胞系和仓鼠细胞系BHK21分离CDV,需要盲传多代才有可能观察到细胞病变(cytopathic effect, CPE),且不是所有CDV毒株感染Vero细胞和BHK21细胞后都能产生CPE,能适应Vero细胞生长的CDV多为疫苗株(如Onderstepoort株),野毒株很少能适应Vero细胞和BHK21细胞[4]。也有报道称随着野毒株适应以上细胞生长,会导致天然毒力丢失[5],且在Vero、MDCK和BHK21等细胞上传代的CDV基因容易发生突变[6]。近年来研究人员发现信号淋巴激活分子(signaling lymphocyte activation molecule,SLAM又称CD150)是麻疹病毒属的病毒受体[5, 7]。Seki等[8]构建表达犬SLAM受体的Vero细胞系(Vero.DogSLAMtag),更容易使犬源的CDV在Vero.DogSLAMtag细胞系上产生病变,并且不会导致病毒变异,表达犬SLAM受体的Vero细胞系可以在接种病料24 h后高效率地分离到CDV,利用Vero.DogSLAMtag细胞和B95a细胞对野生型CDV的分离率分别为71%和43%,表明存在较大差异。
SLAM主要在人和动物的胸腺、激活淋巴细胞、成熟树突状细胞、巨噬细胞等细胞中表达[9],在未成熟树突状细胞、粒细胞、单核细胞、红细胞和血小板中无法有效进行检测[10]。在非淋巴器官(如小肠、肾、脑和心)中也都没有检测到SLAM mRNA的表达[11]。有学者报道,麻疹病毒的感染可引起SLAM的表达水平上调[12],但麻疹病毒感染过程中SLAM表达量趋于稳定[13],表达量不会随着感染时间变化而变化。另一项研究感染组SLAM表达量显著高于未感染对照组,表明CDV感染引起SLAM表达的上调[14]。本研究拟从CDV阳性犬外周血中分离淋巴细胞,获取SLAM基因,构建稳定表达CDV受体SLAM的Vero细胞系和BHK21细胞系,比较两者对于临床CDV分离的敏感性,确定能够在体外快速分离CDV野毒株的细胞系,为其毒力及致病性等相关研究提供可靠的生物材料和研究基础。
1 材料与方法 1.1 材料 1.1.1 生物材料Vero细胞系、BHK21细胞系、pcDNA3.1(-)质粒均由本实验室保存,2017年来源于四川省成都市区、大邑县、都江堰的3份犬CDV的阳性病料由本实验室保存于-80 ℃冰箱。Pcaggs-HA真核表达载体购自西南地区淼灵质粒生物公司。
1.1.2 主要试剂和仪器XhoⅠ、BglⅡ、EcoRⅠ、SalⅠ等限制性内切酶、mini BEST Universal RNA Extraction Kit、高保真聚合酶、反转录试剂盒、PCR扩增体系Premix-Taq酶(TaKaRa公司);Histopaque-1077淋巴细胞分离液(SIGAMA公司);One step Cloning Kit(vazyme公司);无内毒素质粒提取试剂盒(OMEGA公司);胎牛血清、DMEM和G418(Invitrogen公司);琼脂糖凝胶回收试剂盒(WizardSV Gel and PCR Clean-up system)(Promega公司);转染试剂Lipofectamine 2000(Life Technologies公司);CDV-NP-MAB(VMRD公司);兔anti-HA-tag抗体(Abcam公司);FITC(Fluorescein Isothiocyanate)异硫氰酸荧光素标记山羊抗兔IgG(生工公司);PAGE凝胶制备试剂盒(佰合科技公司);凝胶成像系统(BIO-RAD);荧光倒置显微镜(尼康)。
1.1.3 引物的合成犬SLAM受体引物、扩增Neo基因引物和鉴定CDV特异性引物均由TaKaRa公司合成。引物序列如表 1所示。
|
|
表 1 引物序列 Table 1 Sequence of primers |
以pcDNA3.1(-)为模板,以Neo-F-SalⅠ和Neo-R-SalⅠ为引物进行PCR扩增含SV40启动子的Neo基因,PCR反应体系:高保真聚合酶12.5 μL,上下游引物各1.5 μL,质粒模板2 μL,ddH2O补齐25 μL。扩增程序:95 ℃ 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min 40 s,34个循环;72 ℃ 10 min。获取Neo基因PCR扩增产物,并利用纯化试剂盒纯化PCR产物。限制性内切酶SalⅠ单酶切线性化Pcaggs-HA载体并纯化,利用同源重组的方法将纯化产物Neo基因插入单酶切线性化Pcaggs-HA载体的SalⅠ酶切位点。反应体系与试验步骤按One step Cloning Kit说明书操作。将反应产物冷却后转化入大肠杆菌DH5α感受态细胞中,将转化获得的菌液涂于含抗生素的培养基中培养12 h,挑单个细菌至LB培养基中扩大培养,并通过PCR和酶切的方法鉴定插入片段正确后,在Pcaggs-Neo-HA载体的多克隆位点EcoRⅠ和XhoⅠ之间插入含有Igk链信号肽和HA标签的28个氨基酸(H2-METDTLLLWVLLLWVPGSTGDYPYDVPD-COOH)的基因片段GAATTCGCCACCATGGAGACAGA-CACACTCCTGCTATGGGTACTGCTGCTCTGG-GTTCCAGGTTCCACTGGTGACTATCCATATG-ATGTTCCAGATTATGCTGGGGCCCTCGAG,构建Pcaggs-Neo-HA-Igk-HA载体。
1.2.2 SLAM基因的克隆和Pcag-SLAM真核表达载体的构建无菌采集CDV阳性犬外周抗凝血20 mL,按照Histopaque-1077淋巴细胞分离液说明书操作分离外周血淋巴细胞。按TaKaRa的RNA提取试剂盒说明书提取犬外周血淋巴细胞总mRNA,应用反转录试剂合成cDNA后,用S-F/S-R引物对扩增犬SLAM基因。将犬SLAM基因克隆到pMD18-T Simple载体上,克隆的基因片段送生工生物工程公司测序后与NCBI GenBank已经发表的犬SLAM的DNA序列(AF325357)比对正确后,通过网站(http://www.cbs.dtu.dk/services/SignalP/)预测出SLAM基因的信号肽,然后设计去信号肽的引物no-S-F和S-R扩增去信号肽的SLAM基因片段,将克隆的去信号肽的SLAM基因片段插入到Pcaggs-Neo-HA-Igk-HA的多克隆位点XhoⅠ和BglⅡ之间,通过PCR、酶切等方法鉴定插入片段的方向正确后,构建得到Pcaggs-Neo-HA-Igk-HA-SLAM真核表达载体,命名为Pcag-SLAM。
1.3 G418筛选浓度的确定在25 cm2细胞瓶培养生长状态良好的Vero细胞和BHK21细胞,经胰酶消化、离心后弃去上清液,用12 mL含10% FBS的DMEM培养基重悬细胞,将细胞悬液加至12孔细胞培养板,5% CO2,37 ℃培养箱培养待细胞长满单层,弃去培养基,用PBS清洗2次,更换不同质量浓度梯度G418的DMEM筛选培养基(质量浓度依次为0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3.0 mg·mL-1),每个梯度设4个重复孔。每3 d更换一次筛选培养基,连续培养14 d,每天观察细胞死亡情况,以第7天细胞全部死亡的最低G418浓度为最适筛选浓度。以第14天细胞全部死亡的G418浓度的1/2为维持培养浓度。
1.4 Vero细胞和BHK21细胞的转染及克隆筛选 1.4.1 Vero细胞和BHK21细胞转染Pcag-SLAM真核表达载体无血清无抗生素DMEM培养基稀释Pcag-SLAM重组质粒,质量浓度达到1 500 ng·μL-1以后,参照Lipofectamine® 2000 Reagent转染试剂说明书同时转染长至90%的Vero细胞和BHK21单层细胞,转染24 h后更换含2% FBS和筛选浓度G418的DMEM培养基,同时设置转染对照组,待对照组细胞全部死亡,对转染的细胞消化传代,通过RT-PCR鉴定细胞是否转染成功。
1.4.2 SLAM-Vero细胞及SLAM-BHK21细胞单克隆筛选PCR鉴定SLAM阳性的SLAM-Vero细胞和SLAM-BHK21细胞分别铺于96孔板,每孔添加筛选浓度的G418,2% FBS DMEM培养基,用稀释筛选法筛选出单克隆的SLAM-Vero细胞和SLAM-BHK21细胞,经间接免疫荧光法鉴定,确定筛选出稳定表达SLAM受体的Vero细胞和BHK21细胞,分别命名为SLAM-Vero细胞和SLAM-BHK21细胞。
1.4.3 SLAM-Vero细胞和SLAM-BHK21细胞间接免疫荧光鉴定在12孔板中分别接种筛选得到的单克隆SLAM-Vero细胞和SLAM-BHK21细胞,以及普通Vero细胞、BHK21细胞,弃去培养液,用PBS清洗2次,每孔加入500 μL 4% PFA(多聚甲醛)固定液4 ℃固定12 h,弃上清,PBS清洗3次,弃上清,每孔加入500 μL 0.25% TritonX 100/PBS 4 ℃作用12 h,弃上清,PBST清洗3次;用300 μL 5% BSA封闭液,4 ℃封闭12 h,之后对抗兔anti-HA一抗进行稀释,每孔加入350 μL稀释好的一抗,4 ℃作用12 h;用PBS稀释的FITC标记山羊抗兔IgG二抗,每孔加入350 μL的二抗,37 ℃作用45 min,弃上清,PBST清洗3次,每孔滴加10 μL含DAPI封片剂。用荧光显微镜观察并且存照。
1.4.4 SLAM基因转录和蛋白表达的鉴定选取间接免疫荧光鉴定结果最亮的SLAM-Vero细胞和SLAM-BHK21细胞克隆株连续传代,将第10、20、50代细胞冻存。冻存细胞复苏传代后提取其mRNA,反转录后,用no-S-F/S-R引物对检测SLAM基因mRNA,并用HA-tag MAb对SLAM-Vero细胞和SLAM-BHK21细胞的SLAM基因融合蛋白表达进行Western blot鉴定。
1.5 利用不同组织分离CDV的情况比较选择3只不同时间不同地点来源CDV阳性犬,取其肺、脑、脾、淋巴、肠内容物这5种病料加液氮研磨,然后加双抗和DMEM(体积比1:1:8)制成细胞悬液,经3冻3融处理后4 ℃、10 000 r·min-1离心15 min,将上清转入新离心管,用0.22 μm的滤器过滤除菌,分别取1 mL滤液接种SLAM-Vero细胞、Vero细胞、SLAM-BHK21细胞和BHK21细胞,置于CO2培养箱37 ℃孵育1.5 h后,弃上清,PBS洗2次,更换含2% FBS,维持浓度G418的DMEM培养基,培养5 d收毒后继续接毒传代,同时设置不经处理的SLAM-Vero细胞、Vero细胞、SLAM-BHK21细胞和BHK21细胞作为对照组。每代收毒后均用引物(A1/A2和P1/P2)进行RT-PCR鉴定,结果为阳性的一直传代, 直至出现稳定的CPE。
1.6 CDV分离株间接免疫荧光鉴定(IFA)将本研究分离到的三株CDV接种到SLAM-Vero单层细胞中,并设置阴性对照组,于37 ℃,5% CO2培养48 h后,弃细胞培养液将细胞单层固定,通透和封闭后,以抗CDV-NP MAb为一抗,FITC标记山羊抗鼠IgG为二抗进行IFA鉴定,最后滴加DAPI进行细胞核染色。
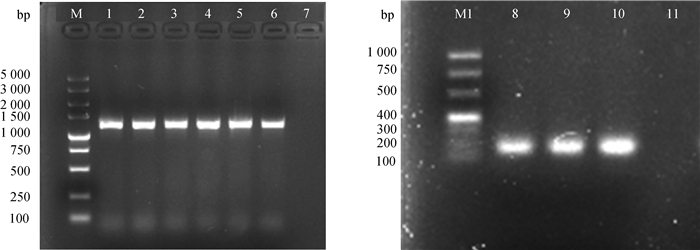
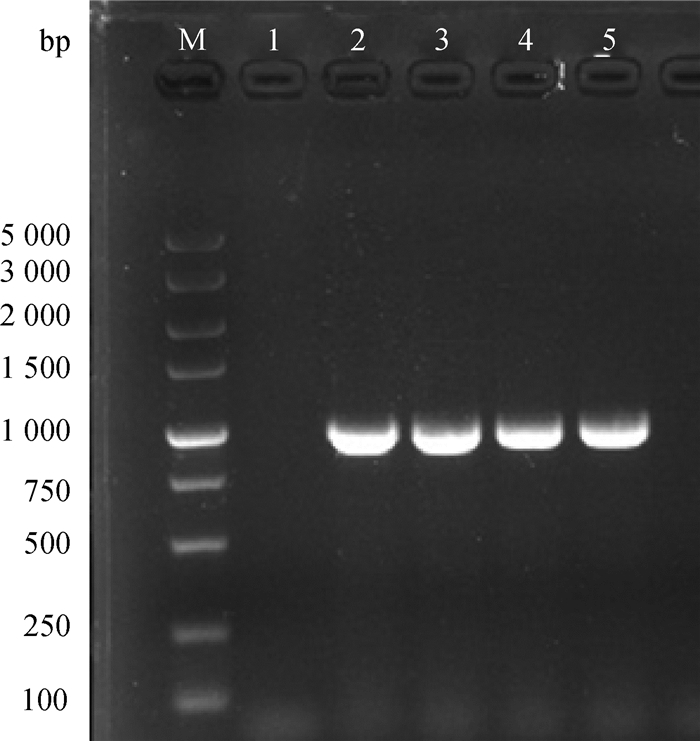
2 结果 2.1 Pcag-SLAM表达载体的构建按“1.2.1 ”的方法将扩增到的含SV40启动子的Neo基因和Igk-HA氨基酸的编码序列插入到Pcaggs-HA表达载体,用PCR方法扩增Neo基因和Igk-HA基因,并将产物进行2%琼脂糖凝胶电泳检测,结果表明在1 259 bp处出现Neo特异性扩增片段,在120 bp处出现Igk-HA特异性扩增片段,二者均与预期结果相符(图 1)。Pcaggs-Neo-HA-Igk-HA载体具有抗新霉素活性,能用于转染后阳性细胞筛选;含有的HA标签可用于外源蛋白鉴定;Igk链信号肽能增强外源蛋白表达,并使表达外源蛋白锚定在细胞膜表面。按照“1.2.2”的方法从CDV阳性犬的外周血内提取到SLAM受体,并将其克隆到pMD18-T Simple载体上,经生工生物公司测序正确后再扩增去信号肽的SLAM基因片段,并将其插入到Pcaggs-Neo-HA-Igk-HA载体内,构建得到Pcaggs-Neo-HA-Igk-HA-SLAM真核表达载体,命名为Pcag-SLAM。SLAM基因cDNA PCR扩增结果如图 2所示。
|
M、M1. DNA相对分子质量标准;1~6. SV40 Neo基因片段(1 259 bp);8~10. Igk-HA基因片段(120 bp);7、11.阴性对照 M. DNA marker DL5000; M1. DNA marker DL1000; 1-6. SV40 Neo gene fragment; 8-10. Igk-HA gene fragment; 7, 11. Negative control 图 1 含SV40启动子的Neo基因扩增和Igk-HA基因扩增结果 Figure 1 Amplification of Neo gene with SV40 promoter and amplification of Igk-HA gene |
|
M. DNA相对分子质量标准;1.阴性对照;2~5.去信号肽的SLAM基因cDNA M. DNA marker DL5000; 1. Negative control; 2-5. SLAM gene without signaling peptide cDNA 图 2 去信号肽的SLAM基因RT-PCR产物电泳结果 Figure 2 Electrophoresis results of SLAM gene without signaling peptide RT-PCR products |
Vero细胞加入含不同质量浓度G418的培养液,培养至第4天,1.6 mg·mL-1组30%的细胞死亡,2.2 mg·mL-1组60%的细胞死亡,2.4 mg·mL-1组90%的细胞死亡,2.8 mg·mL-1组98%的细胞死亡,3.0 mg·mL-1组细胞全部死亡;培养至第14天,2.0 mg·mL-1组细胞全部死亡,则确定Vero细胞的G418最适筛选浓度为3.0 mg·mL-1,G418维持浓度为1.0 mg·mL-1。用同样的方法得到确定BHK21细胞G418最适筛选浓度为2.2 mg·mL-1,维持浓度为0.8 mg·mL-1。
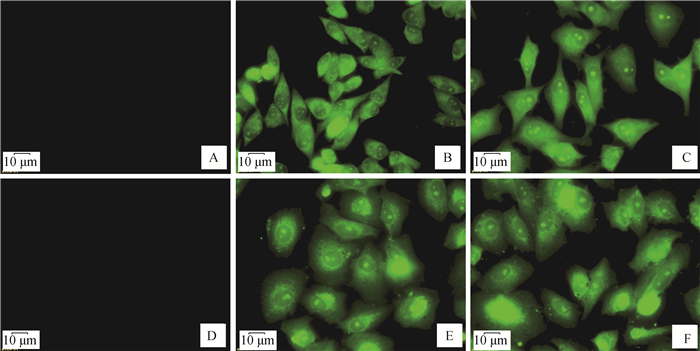
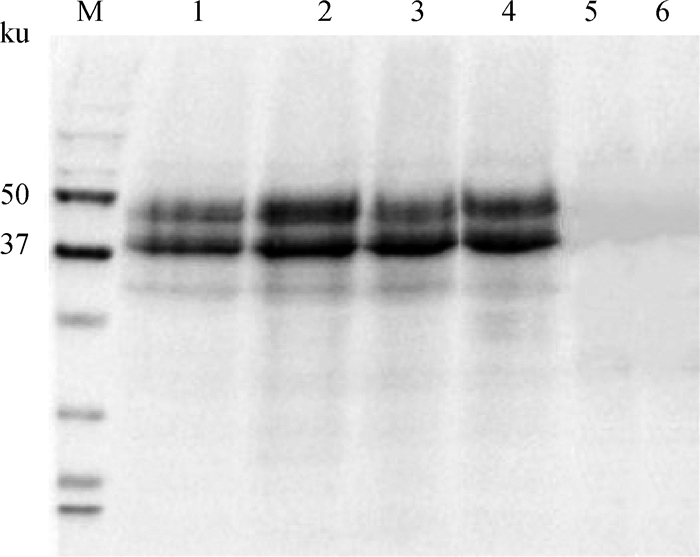
2.3 Vero细胞和BHK21细胞转染及克隆筛选Pcag-SLAM重组质粒转染至Vero细胞和BHK21细胞后通过RT-PCR的方法初次鉴定SLAM基因的表达后,通过G418压力筛选与稀释筛选法结合,筛选出稳定表达SLAM受体的Vero细胞和BHK21细胞,以HA-tag MAb为一抗,通过间接免疫荧光法(图 3)和Western blot(图 4)鉴定SLAM受体的表达。间接免疫荧光法结果显示SLAM基因传代至F50代都可以稳定地表达,Western blot结果表明在49.5和39 ku处可以检测到2个蛋白质,蛋白质大小与预期结果一致。
|
A. BHK21细胞(60×);B. SLAM-BHK21细胞(60×);C. F50代SLAM-BHK21细胞(60×);D. Vero细胞(60×;E. SLAM-Vero细胞(60×);F. F50代SLAM-Vero细胞(60×);Bar=10 μm A. BHK21 cell (60×); B. SLAM-BHK21 cell (60×); C. The F50 passage of SLAM-BHK21 cells transfected stably (60×); D. Vero cell (60×); E. SLAM-Vero cell (60×); F. The F50 passage of SLAM-Vero cells transfected stably (60×); Bar=10 μm 图 3 SLAM基因融合蛋白IFA鉴定 Figure 3 SLAM gene fusion protein expression in SLAM-Vero cell and SLAM-BHK21 cell based on HA MAb Indirect immunofluorescence assay |
|
M.蛋白质相对分子质量标准;1. SLAM-BHK21细胞;2. F50代SLAM-BHK21细胞;3. SLAM-Vero细胞;4. F50代SLAM-Vero细胞;5. BHK21细胞;6. Vero细胞 M. Protein molecular weight marker; 1. SLAM-BHK21 cells; 2. The F50 passage of SLAM-BHK21 cells; 3. SLAM-Vero cells; 4. The F50 passage of SLAM-Vero cells; 5. BHK21 cells; 6. Vero cells 图 4 Western blot法鉴定SLAM-BHK21细胞和SLAM-Vero细胞的SLAM基因融合蛋白表达情况 Figure 4 Western blot identification of SLAM gene fusion protein in SLAM-BHK21 cells and SLAM-Vero cells |
3只CDV阳性犬分别命名DJY-5.4、CD-5.7和DY-6.3,每只犬取肺、脾、脑、淋巴、肠内容物5种共15份病料按“1.5”的方法分别接种在SLAM-Vero细胞、Vero细胞、SLAM-BHK21细胞和BHK21细胞上分离CDV,最终CD-5.7-肺,DY-6.3-肺和DY-6.3-脾在SLAM-Vero细胞分离到CDV,且分离株均可以在细胞上产生明显稳定的病变(图 5), SLAM-Vero细胞在接毒后12 h出现融合体细胞,呈现多核巨细胞样,第24小时细胞融合处出现星状收缩,培养至72 h有细胞脱落。CD-5.7-肺和DY-6.3-肺在传代第6代出现明显病变,DY-6.3-脾在第3代出现明显病变,分离株通过引物A1A2和引物P1P2进行鉴定,结果与预期相符,证实其为CDV(图 6)。而其余组织(脑、淋巴、肠内容物)在SLAM-Vero细胞上传代2次后RT-PCR检测结果均为阴性,无法继续传代。所有15份病料在SLAM-BHK21细胞、BHK21细胞以及Vero细胞上均无法进行增殖传代。
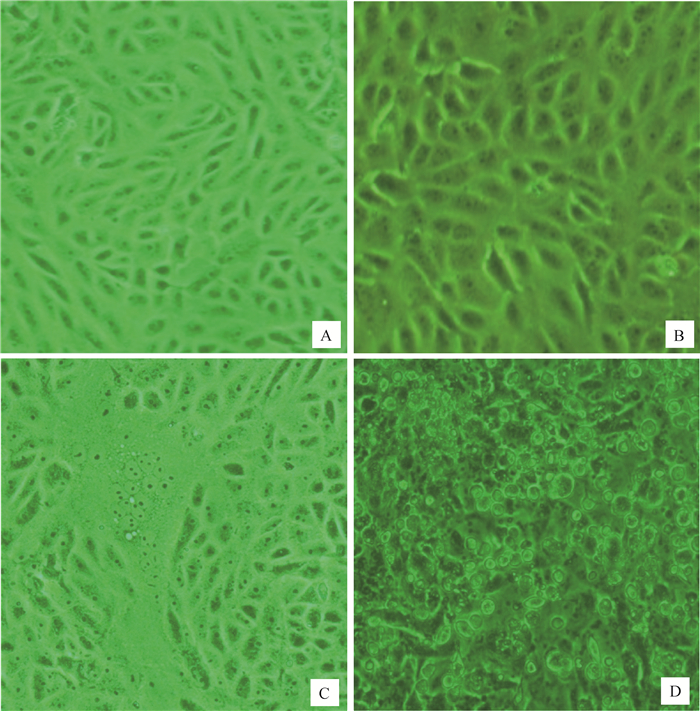
|
A. SLAM-Vero细胞对照组120 h;B. Vero细胞接毒后120 h;C. SLAM-Vero细胞接毒后12 h;D. SLAM-Vero细胞接毒后120 h A. SLAM-Vero cell negative control 120 hpi; B. Vero cell inoculated with CDV 120 hpi; C. SLAM-Vero cell inoculated with CDV 12 hpi; D. SLAM-Vero cell inoculated with CDV 120 hpi 图 5 Vero细胞和SLAM-Vero细胞接种犬瘟热病毒后CPE图(20×) Figure 5 CPE of Vero and SLAM-Vero cell inoculated by CDV positive samples (20×) |
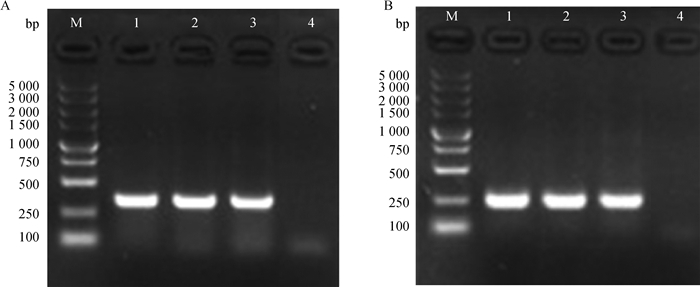
|
A. A1A2引物鉴定CDV(335 bp);B. P1P2引物鉴定CDV(242 bp);M. DNA相对分子质量标准;1. CD-5.7-肺;2. DY-6.3-肺;3. DY-6.3-脾;4.阴性对照 A. Identification of CDV by A1A2 primer (335 bp); B. Identification of CDV by P1P2 primer (242 bp); M. DL5000 DNA marker; 1. CD-5.7-lung; 2. DY-6.3-lung; 3. DY-6.3-spleen; 4. Negative control 图 6 CDV的RT-PCR电泳结果 Figure 6 Electrophoresis of RT-PCR product of CDV |
以CDV-NP MAb作为一抗,FITC标记山羊抗小鼠IgG为二抗,对分离株进行IFA鉴定,结果显示分离株感染SLAM-Vero细胞出现绿色荧光(图 7),普通Vero细胞接毒后无特异性荧光,正常SLAM-Vero对照组细胞无特异性荧光,进一步表明该分离株为CDV。
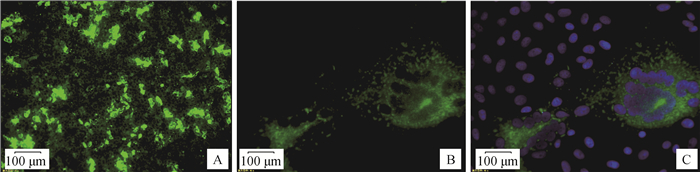
|
A. CDV感染SLAM-Vero细胞(10×);B、C. CDV感染SLAM-Vero细胞(40×),蓝色为细胞核 A. SLAM-Vero inoculated with CDV(10×); B, C. SLAM-Vero inoculated with CDV(40×), the nucleus DAPI stained blue 图 7 CDV的IFA鉴定结果 Figure 7 IFA identification results of CDV |
CDV的分离通常通过原代细胞和传代细胞来进行,原代细胞包括犬巨噬细胞、犬淋巴细胞等,但原代细胞可传代次数少且不容易获得,不利于病毒的保存[15];传代细胞主要有Vero细胞、MDCK细胞、BHK21细胞等,通常适应了这些细胞的毒株多数为疫苗株,例如Onderstepoort株和Rockborn株,但这些细胞不利于野毒株的分离[16]。通常,当CDV野毒株适应了没有CDV受体SLAM的细胞进行培养,会导致病毒的天然毒力丢失[17]。近年来许多研究已经证实,SLAM是表达在宿主免疫细胞膜上的一种糖蛋白[18],是麻疹病毒属病毒的淋巴细胞趋向性、宿主特异性和组织趋向性的主要决定因素之一[19-20]。Seki等[8]证明表达SLAM的Vero细胞比B95a细胞对CDV更敏感,表达SLAM的Vero细胞系是CDV的理想宿主。他们构建的表达SLAM的Vero细胞可以利用脾分离到CDV[8],本研究构建的SLAM-Vero细胞系利用脾和肺均可以分离到CDV。目前在国内表达SLAM受体的SLAM-Vero细胞系仍未商品化,在此之前,本人利用无SLAM受体的Vero细胞分离CDV,很长时间一直未分离到CDV野毒株,构建成功该细胞系后,很顺利地分离到2株野生型CDV,因此构建一株SLAM-Vero细胞系对CDV的研究显得尤为重要。
本研究从犬瘟热阳性犬的外周血中提取淋巴细胞,并成功扩增到SLAM基因。通过分子克隆技术将去信号肽的SLAM基因片段插入到Pcaggs-Neo-HA-Igk-HA载体,构成Pcaggs-HA-Neo-Igk-HA-SLAM真核表达载体,命名为Pcag-SLAM。该载体存在两个HA-tag用于SLAM-HA融合蛋白表达情况的检测,每个HA-tag前各有一个启动子,两个HA-tag和SLAM基因共用一个终止子,若SLAM基因无法表达,则检测不到任何蛋白;当SLAM-HA融合蛋白完全表达的情况下可检测到与预期一致,大小分别是39和49.5 ku的2个HA蛋白。
本研究在培养时间、分离方法均相同的条件下,利用两种表达SLAM受体的细胞系分离CDV野毒株,比较两种细胞在CDV野毒株分离时的敏感性,结果表明,3例犬瘟热病例中有2例可以利用SLAM-Vero细胞分离到CDV,且在接毒后12 h就可看到明显的细胞病变。而这三例CDV均无法在SLAM-BHK21细胞上生长。出现这一结果可能的原因是CDV有两个包膜糖蛋白,分别是血凝素蛋白(H)和融合蛋白(F),这两个蛋白共同介导病毒与细胞受体结合以及膜融合[21-22],由于CDV野毒株基因的不同,导致对不同细胞的亲和性有差异[20]。本研究分离到的2株CDV野毒株可以在SLAM-Vero细胞上稳定地生长,而无法在SLAM-BHK21细胞上生长,说明还有未知的蛋白或者氨基酸位点影响CDV对不同细胞系的亲和力。本实验室仍继续利用这两种细胞系分离野毒株,根据现有研究的结果显示表达SLAM受体的Vero细胞系较表达SLAM受体的BHK21细胞系对本地区CDV野毒株的分离率相对较高。
Qiao等[23]利用一只犬的肺分离出一株CDV强毒株。赵建军等[24]利用犬的肺和脾在表达犬SLAM受体的Vero细胞分离出一株CDV。本研究将3只CDV阳性犬的肺、脾、淋巴结、大脑、肠内容物经处理后,将上清接种于SLAM-Vero细胞和SLAM-BHK21细胞,最终从肺和脾分离出病毒,而淋巴结、大脑和肠内容物虽然可以通过RT-PCR检测到特异性扩增片段,但体外分离效果不理想,这也许与病毒的组织趋向性有关。
4 结论成功构建了表达犬瘟热病毒受体SLAM的SLAM-Vero细胞系和SLAM-BHK21细胞系,通过对其接种3株不同来源的犬瘟热临床样本的5种不同组织,发现在分离CDV野毒株时选择肺和脾更容易在表达SLAM受体的细胞系上分离出病毒。同时发现SLAM-Vero细胞比SLAM-BHK21细胞对CDV野毒株的分离率高,且病变明显,为CDV野毒株的快速分离与研究提供了有效的工具。
| [1] | APPEL M J G, SUMMERS B A. Pathogenicity of morbilliviruses for terrestrial carnivores[J]. Vet Microbiol, 1995, 44(2-4): 187–191. DOI: 10.1016/0378-1135(95)00011-X |
| [2] | APPEL M J, YATES R A, FOLEY G L, et al. Canine distemper epizootic in lions, tigers, and leopards in North America[J]. J Vet Diagn Invest, 1994, 6(3): 277–288. DOI: 10.1177/104063879400600301 |
| [3] | TAN B, WEN Y J, WANG F X, et al. Pathogenesis and phylogenetic analyses of canine distemper virus strain ZJ7 isolate from domestic dogs in China[J]. Virol J, 2011, 8: 520. DOI: 10.1186/1743-422X-8-520 |
| [4] |
岳进华, 刘鹤媛, 周铭, 等. 大熊猫犬瘟热病毒LG株的分离鉴定[J]. 动物医学进展, 2016, 37(10): 60–63.
YUE J H, LIU H Y, ZHOU M, et al. Identification of canine distemper virus LG strain isolated from giant panda[J]. Progress in Veterinary Medicine, 2016, 37(10): 60–63. DOI: 10.3969/j.issn.1007-5038.2016.10.013 (in Chinese) |
| [5] | TATSUO H, ONO N, YANAGI Y. Morbilliviruses use signaling lymphocyte activation molecules (CD150) as cellular receptors[J]. J Virol, 2001, 75(13): 5842–5850. DOI: 10.1128/JVI.75.13.5842-5850.2001 |
| [6] | LEDNICKY J A, MEEHAN T P, KINSEL M J, et al. Effective primary isolation of wild-type canine distemper virus in MDCK, MV1 Lu and Vero cells without nucleotide sequence changes within the entire haemagglutinin protein gene and in subgenomic sections of the fusion and phospho protein genes[J]. J Virol Methods, 2004, 118(2): 147–157. DOI: 10.1016/j.jviromet.2004.02.004 |
| [7] |
蒙学莲, 窦永喜, 朱学亮, 等. 小反刍兽疫病毒血凝素蛋白与受体蛋白SLAM的相互作用[J]. 畜牧兽医学报, 2014, 45(3): 426–433.
MENG X L, DOU Y X, ZHU X L, et al. Interaction between hemagglutinin protein of Peste des petits ruminants virus and signalling lymphocyte activation molecule[J]. Acta Veterinaria et Zootechnica Sinica, 2014, 45(3): 426–433. (in Chinese) |
| [8] | SEKI F, ONO N, YAMAGUCHI R, et al. Efficient isolation of wild strains of canine distemper virus in Vero cells expressing canine SLAM (CD150) and their adaptability to marmoset B95a cells[J]. J Virol, 2003, 77(18): 9943–9950. DOI: 10.1128/JVI.77.18.9943-9950.2003 |
| [9] | AVERSA G, CHANG C C, CARBALLIDO J M, et al. Engagement of the signaling lymphocytic activation molecule (SLAM) on activated T cells results in IL-2-independent, cyclosporin A-sensitive T cell proliferation and IFN-gamma production[J]. J Immunol, 1997, 158(9): 4036–4044. |
| [10] | KRUSE M, MEINL E, HENNING G, et al. Signaling lymphocytic activation molecule is expressed on mature CD83+ dendritic cells and is up-regulated by IL-1β[J]. J Immunol, 2001, 167(4): 1989–1995. DOI: 10.4049/jimmunol.167.4.1989 |
| [11] | ROMERO X, MARTIN M, ZAPATER N. Expression of CD150 on human leukocytes. Production and characterization of a new CD150 monoclonal antibody[J]. Original, 2001, 20(2): 57–66. |
| [12] | TANAKA K, MINAGAWA H, XIE M F, et al. The measles virus hemagglutinin downregulates the cellular receptor SLAM (CD150)[J]. Arch Virol, 2002, 147(1): 195–203. DOI: 10.1007/s705-002-8312-0 |
| [13] |
苏建青, 褚秀玲, 马秀亮, 等. 稳定表达犬信号淋巴细胞激活因子基因细胞株的建立与鉴定[J]. 安徽农业科学, 2012, 40(14): 8077–8079.
SU J Q, CHU X L, MA X L, et al. Construction and identification of a Vero cell line stably expressing canine SLAM gene[J]. Journal of Anhui Agricultural Sciences, 2012, 40(14): 8077–8079. DOI: 10.3969/j.issn.0517-6611.2012.14.024 (in Chinese) |
| [14] |
黄娟, 王聪, 张洪亮, 等. 水貂犬瘟热病毒受体——信号淋巴细胞激活因子的细胞定位及组织分布[J]. 畜牧兽医学报, 2014, 45(2): 289–294.
HUANG J, WANG C, ZHANG H L, et al. Cellular localization and immunohistochemical demonstration of a sort of canine distemper virus receptor named Signalling lymphocyte activation molecule in minks[J]. Acta Veterinaria et Zootechnica Sinica, 2014, 45(2): 289–294. (in Chinese) |
| [15] | POSTE G. The growth and cytopathogenicity of virulent and attenuated strains of canine distemper virus in dog and ferret macrophages[J]. J Comp Pathol, 1971, 81(1): 49–54. DOI: 10.1016/0021-9975(71)90054-5 |
| [16] | ROCKBORN G. An attenuated strain of canine distemper virus in tissue culture[J]. Nature, 1959, 184(S11): 822. |
| [17] | METZLER A E, HIGGINS R J, KRAKOWKA S, et al. Virulence of tissue culture-propagated canine distemper virus[J]. Infect Immun, 1980, 29(3): 940–944. |
| [18] | HASHIGUCHI T, OSE T, KUBOTA M, et al. Structure of the measles virus hemagglutinin bound to its cellular receptor SLAM[J]. Nat Struct Mol Biol, 2011, 18(2): 135–141. DOI: 10.1038/nsmb.1969 |
| [19] | SARKAR J, BALAMURUGAN V, SEN A, et al. Sequence analysis of morbillivirus CD150 receptor-signaling lymphocyte activation molecule (SLAM) of different animal species[J]. Virus Genes, 2009, 39(3): 335–341. DOI: 10.1007/s11262-009-0391-9 |
| [20] | SATO H, YONEDA M, HONDA T, et al. Morbillivirus receptors and tropism:Multiple pathways for infection[J]. Front Microbiol, 2012, 3: 75. |
| [21] | SAWATSKY B, BENTE D A, CZUB M, et al. Morbillivirus and henipavirus attachment protein cytoplasmic domains differently affect protein expression, fusion support and particle assembly[J]. J Gen Virol, 2016, 97(5): 1066–1076. DOI: 10.1099/jgv.0.000415 |
| [22] | AVILA M, KHOSRAVI M, ALVES L, et al. Canine distemper virus envelope protein interactions modulated by hydrophobic residues in the fusion protein globular head[J]. J Virol, 2015, 89(2): 1445–1451. DOI: 10.1128/JVI.01828-14 |
| [23] | QIAO J, MENG Q, CHEN C, et al. Characterization of a new dog isolate of canine distemper virus from China[J]. Acta Virol, 2011, 55(4): 303–310. |
| [24] |
赵建军, 闫如勋, 张海玲, 等. 稳定表达貉犬瘟热病毒细胞受体SLAM的Vero细胞系的建立及应用[J]. 微生物学报, 2012, 52(12): 1515–1523.
ZHAO J J, YAN R X, ZHANG H L, et al. Establishment and application of a Vero cell line stably expressing raccoon dog SLAM, the cellular receptor of canine distemper virus[J]. Acta Microbiologica Sinica, 2012, 52(12): 1515–1523. (in Chinese) |



