口蹄疫(foot-and-mouth disease,FMD)是由口蹄疫病毒(foot-and-mouth disease virus,FMDV)引起的急性、烈性、高度接触性传染病,易感动物是牛、羊、猪等偶蹄动物。FMDV属于小RNA病毒科(Picornaviridae)口蹄疫病毒属(Aphthovirus)的单股正链RNA病毒[1]。已知FMDV有七种血清型FMDV(A、O、Asia1、C、SAT1、SAT2和SAT3)和多个亚型[2-3]。口蹄疫病毒包含RNA基因组,其由二十面体衣壳包围,衣壳由四种结构蛋白VP1、VP2、VP3和VP4各60个分子构成。FMDV基因组全长约为8.5 kb,包含一个大的开放阅读框,被翻译为一个多聚蛋白前体。病毒的多聚蛋白被病毒编码的蛋白酶(Lpro和3Cpro)处理,产生15种不同的蛋白以及多种前体物质[4],其中包括3种结构蛋白(VP0、VP1和VP3)以及8种非结构蛋白(L、2A、2B、2C、3A、3B、3C、3D)[5]。
丝裂原活化蛋白激酶(MAPKs)级联反应,是细胞内主要的信号转导途径。MAPKs在大量炎症和疾病的发病机制中扮演至关重要的角色,同时也是免疫、癌变和细胞凋亡途径的调节剂[6]。MAPK信号转导在病原诱导宿主保护性反应中发挥重要功能,研究发现许多病毒可以直接利用这些途径利于其自身复制[7]。TPL2(tumor progression locus 2)又称COT(cancer Osaka thyroid)/MAP3K8,是一种丝氨酸-苏氨酸激酶。TPL2信号转导在先天性和适应性免疫以及在癌症中作为潜在的原癌基因起着重要作用[6]。研究表明TPL2在稳态条件下结合p50(NF-κB1)的前体蛋白p105,其可以阻断TPL2的激活[8-9]。Toll样受体或TNF受体超家族的配体,可以激活IKKα/β也能导致p105蛋白的水解,释放TPL2,并允许未知激酶激活TPL2[10-11]。活化的TPL2直接磷酸化MAP2K MEK,然后激活MAPK ERK[12]。除了这个主要功能之外,TPL2还涉及MAPK8(JNK)、MAPK14(p38)和转录因子NFAT和NF-κB的活化[13]。因此,TPL2可以在转录或转录后调控一些基因表达包括促炎细胞因子和二级介质,以及抗炎性细胞因子[14]。在LPS刺激巨噬细胞中,TPL2的缺失会使TNF-α的产生减少;TPL2-/-小鼠同WT小鼠相比,对李斯特菌、结核分枝杆菌和流感病毒的易感程度增加[15-16];同时也发现LPS或TLR9的配体CpG刺激TPL2缺失的巨噬细胞和树突状细胞导致IL-1β的产生减少[17];TPL2可能通过调节抗原呈递细胞APC中IL-12和IL-23的表达从而参与平衡Th1/ Th17分化[18]。TPL2在先天免疫中的作用仅限于细菌感染模型,使用病毒病原体进行的相关研究比较少。
TPL2与FMDV的致病性仍不清楚,为明确TPL2在FMDV致病过程中发挥的作用,本研究对FMDV易感BHK-21细胞的TPL2基因进行感染试验,利用实时定量PCR技术评价FMDV感染BHK-21细胞,又分别进行过表达和RNAi,利用实时定量PCR和Western blotting技术评价FMDV的复制,证实TPL2可以促进FMDV复制,为进一步深入研究FMDV的免疫机制积累了数据。
1 材料与方法 1.1 材料口蹄疫毒株A/GDMM/CHA/2013和BHK-21细胞由本实验室提供;兔抗TPL2多抗购于Abcam公司(ab137589);鼠抗Flag单抗、HRP标记山羊抗鼠IgG二抗和HRP标记山羊抗兔IgG二抗均购于Santa Cruz公司;鼠抗β-actin单抗购于Thermo Scientific公司(MA1-140);抗FMDV全血清由本实验室制备,Western blotting检测可显出VP0、VP1和VP3蛋白条带。
大肠杆菌Trans5α感受态、LA Taq DNA聚合酶、限制性核酸内切酶KpnⅠ和 XbaⅠ、T4 DNA连接酶、Trizol试剂、RNA酶抑制剂(RRI)、Oligo(dT)引物、随机引物、脱氧核糖核苷三磷酸(dNTPs)、SYBR Permix Ex Taq Ⅱ和蛋白预染Marker均购于宝生物工程大连有限公司;5×First Buffer、0.1 mol·L-1 DTT、反转录酶M-MLV和LipofectamineTM3000转染试剂均购于Invitrogen公司;Opti-MEM、0.25% EDTA胰酶和新生牛血清(FBS)均购于Gibco公司;MEM细胞培养液和PBS溶液购于Hyclone公司;ECL显色剂购于Thermo Scientific公司;NP-40裂解液和PMSF购于碧云天公司;TPL2干扰序列由上海吉玛制药有限公司合成。
1.2 方法 1.2.1 TPL2真核表达质粒的构建设计并合成TPL2引物,引入酶切位点KpnⅠ和XbaⅠ,以真核表达质粒pCMV3-N-Flag为载体,构建pCMV3-TPL2-Flag表达质粒,进行PCR扩增、酶切和序列测定。
1.2.2 TPL2 RNAi设计与合成设计并合成TPL2 RNAi序列。分别设计了3对针对TPL2基因的RNAi序列,引物序列见表 1,由上海吉玛制药有限公司合成。
|
|
表 1 本试验用到的干扰、引物序列 Table 1 RNAi and primer sequences used in this study |
将细胞消化后铺于细胞板中,置于37 ℃、5%CO2培养箱中,待细胞长至70%~90%时,将质粒与LipofectamineTM 3000中的LipofectamineTM 3000试剂(两者按照比例为1 μg:2 μL)分别加至Opti-MEM中,同时还需将LipofectamineTM 3000中的P3000试剂加至有质粒的Opti-MEM中(两者按照比例为1 μg:2 μL),如果转染为siRNA无需将P3000试剂加至有siRNA的Opti-MEM,之后直接将两者混合,静止15 min;将Opti-MEM混合物直接加至细胞中;将细胞重新置于37 ℃、5%CO2培养箱中进行培养24 h。
转染24 h后,用无血清的MEM将细胞清洗两遍,以去除细胞中残留的血清,用1 MOI FMDV感染BHK-21细胞,置于37 ℃、5%CO2培养箱孵育1 h之后,弃去含有病毒的培养基,换成2%FBS MEM维持液,继续培养。
1.2.4 RNA的提取及反转录采用Triozl裂解法提取细胞的总RNA,并反转录为cDNA模板用于实时定量PCR,反转录体系20.0 μL:4 μL 5×First buffer,2 μL 0.1 mol·L-1 DTT,1 μL oligo(dT),0.5 μL Radom primers,1 μL RNA酶抑制剂RRI,1 μL M-MLV反转录酶,1 μL dNTPs,4.5 μL DEPC水,5 μL RNA模板。反应程序:25 ℃ 10 min,37 ℃ 60 min,70 ℃ 15 min。
1.2.5 TPL2过表达试验将细胞消化后铺于细胞板中,待细胞长至60%~70%时,分别转染不同剂量的TPL2真核表达质粒,同时在转染过程中转入pCMV3-N-Flag空载体来设置对照。在转染后24 h,用1 MOI FMDV感染BHK-21细胞,感染10 h收取两份细胞样品;一份用于实时定量PCR,以GAPDH作为内参,分别检测TPL2和FMDV转录水平的变化;另一份用于Western blotting,以β-Actin作为内参,分别检测Flag-TPL2和FMDV蛋白水平的变化。
1.2.6 TPL2 siRNA干扰试验将细胞消化后铺于细胞板中,待细胞长至50%~60%时,分别转染NC siRNA和TPL2 siRNA,转染36 h后,感染1 MOI FMDV,分别在感染后0、4、8和12 h收取两份细胞样品;一份用于实时定量PCR,以GAPDH作为内参,分别检测TPL2和FMDV转录水平的变化;另一份用于Western blotting,以β-actin作为内参,分别检测TPL2和FMDV蛋白水平的变化。
1.2.7 Western blotting细胞蛋白样品的制备:弃去培养液,用1×PBS漂洗细胞2次,去除细胞碎片;加入适量的NP-40裂解液,并在使用前数分钟内加入PMSF,使PMSF的最终浓度为1 mol·L-1;充分裂解后,12 000 r·min-1离心10 min,将样品上清收集于新准备的EP管中,再加入5×SDS Loading Buffer(已加β-巯基乙醇),100 ℃煮样10~15 min。
SDS-PAGE蛋白凝胶电泳及转印:配制10%聚丙烯酰胺蛋白胶;取适量的蛋白样品上样,同时加上蛋白预染Marker作为大小的指示;电泳电压先调80 V跑30 min,待蛋白样品跑出浓缩胶进入分离胶后,将电压调至120 V,直至电泳结束; 电泳结束后200 mA,转膜2 h;转膜结束后,利用5%脱脂奶粉室温封闭2 h;封闭之后,TBST洗2次,每次5 min;孵育一抗,4 ℃过夜(一抗可以回收利用);TBST快洗3次,每次10 min;孵育二抗,室温孵育2 h;TBST快洗3次,每次10 min;用高分辨图像采集系统进行ECL显影并保存结果。
1.2.8 实时定量PCR实时定量PCR的反应体系(20 μL):10 μL SYBR Permix Ex Taq Ⅱ,0.8 μL上游引物,0.8 μL下游引物,7 μL DEPC水,ROXⅡ0.4 μL和1 μL cDNA。反应程序:95 ℃预变性3 min,95 ℃变性10 s,60 ℃退火加延伸34 s,共40个循环。定量引物序列见表 1所列,引物序列由金唯智公司合成。
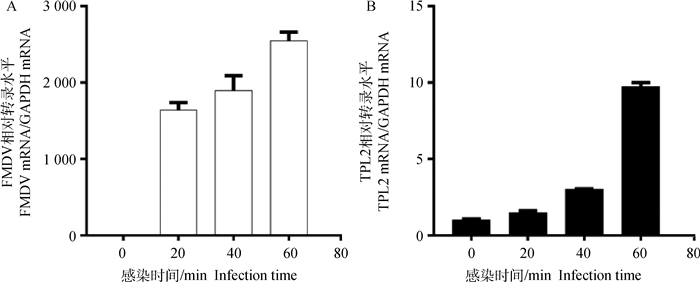
2 结果 2.1 FMDV感染BHK-21细胞致内源性TPL2转录水平上调将BHK-21细胞铺于35 mm小皿中,待细胞长至80%~90%时,根据试验方法“1.2.3 ”进行感染试验,分别在0、20、40、60 min收取细胞样品,进行实时定量PCR,以GAPDH作为内参,分别检测TPL2和FMDV转录水平的变化。结果表明随着FMDV的转录水平的上升,TPL2的转录水平也呈现显著的上调(图 1)。
|
A.实时定量检测FMDV转录水平的变化;B.实时定量检测TPL2转录水平的变化 A.The mRNA level of FMDV was detected by qPCR; B. The mRNA level of TPL2 was detected by qPCR 图 1 FMDV感染诱导TPL2转录水平上调 Figure 1 FMDV infection induced an increase of TPL2 transcriptional level |
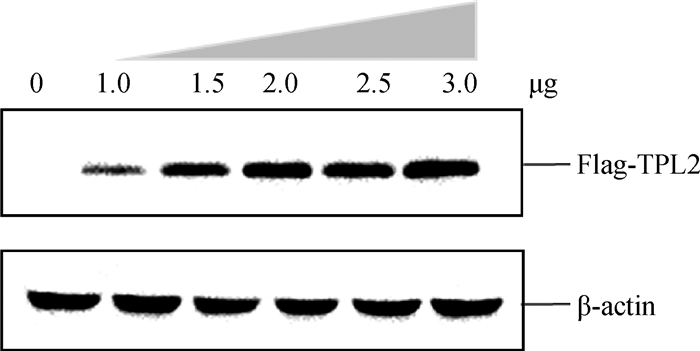
构建Flag-TPL2真核质粒,进行PCR扩增、酶切和序列鉴定正确(图略),将构建的Flag-TPL2真核质粒以不同的剂量转染BHK-21细胞,转染后24 h,收取细胞样品,Western blotting验证Flag-TPL2真核质粒的表达。结果表明,构建的Flag-TPL2真核质粒可以在BHK-21细胞中表达,并且呈现剂量依赖性(图 2)。
|
图 2 Western blotting验证TPL2蛋白在BHK-21细胞表达 Figure 2 Verification the expression of TPL2 protein by Western blotting in BHK-21 cells |
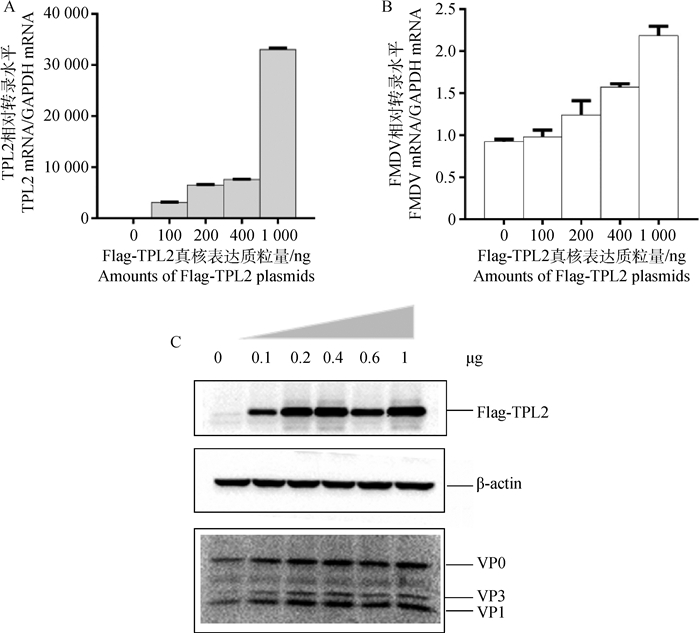
按照试验方法“1.2.5”,转染不同剂量Flag-TPL2真核表达质粒,发现随着TPL2转录水平的上升(图 3A),FMDV的转录水平也呈现上调的趋势(图 3B);同时检测了蛋白水平的变化,与转录水平变化一致,随着TPL2蛋白表达的增加,FMDV蛋白的表达水平呈现明显上调的趋势,并且呈现剂量依赖性(图 3C)。结果表明,过表达TPL2促进FMDV在BHK-21细胞中的复制。
|
A.实时定量检测TPL2转录水平变化;B.实时定量检测FMDV转录水平变化;C.Western blotting检测TPL2和FMDV蛋白水平变化 A.TPL2 transcription was detected by qPCR; B.FMDV transcription was detected by qPCR; C.TPL2 and FMDV proteins were detected by Western blotting 图 3 过表达TPL2促进FMDV在BHK-21细胞中复制 Figure 3 Overexpression of TPL2 enhanced FMDV replication in BHK-21 cells |
将siRNA-354、siRNA-855、siRNA-1500和NC siRNA分别转染BHK-21细胞,设置不同的转染剂量和作用时间后收集细胞样品,同时用qRT-PCR和Western blotting检测不同TPL2 RNAi序列对TPL2转录水平及表达水平的干扰作用。结果表明,编号为TPL2-1500的干扰序列在转染浓度为150 pmol·mL-1以及作用时间为36 h时,TPL2转录水平(图 4A)及蛋白表达水平(图 4B)干扰效果最佳。
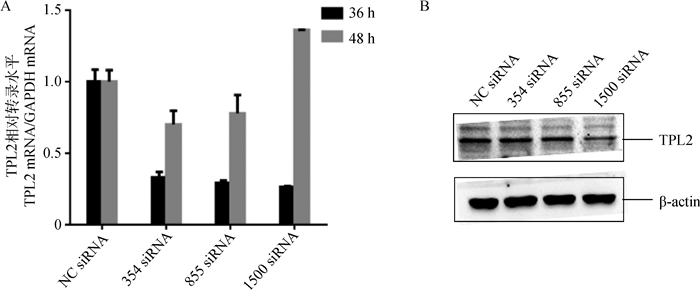
|
A.实时定量检测TPL2转录水平变化;B. Western blotting检测TPL2蛋白水平变化 A.TPL2 transcriptional level was evaluated by qPCR; B.TPL2 protein level was evaluated by western blotting 图 4 鉴定BHK-21细胞中TPL2 siRNA的干扰效率 Figure 4 Evaluation of the efficiency of TPL2 siRNA in BHK-21 cells |
利用siRNA干扰技术,下调内源性TPL2蛋白表达,观察FMDV在BHK-21细胞中复制的变化。结果表明,在不同时间点与对照组相比,TPL2转录水平下调(图 5A),FMDV的mRNA水平也呈现下调的趋势(图 5B);同时检测蛋白水平的变化,在不同时间点与对照组相比,发现TPL2蛋白表达下调,FMDV的蛋白表达水平也是呈现下降的趋势(图 5C),即下调表达内源性TPL2抑制FMDV在BHK-21细胞中的复制。
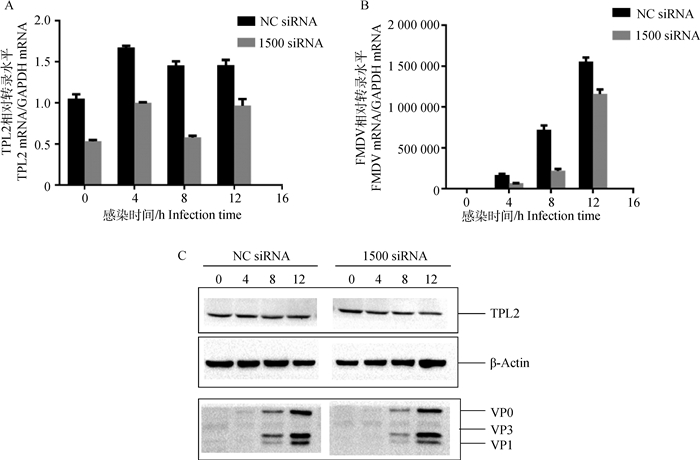
|
A.实时定量检测TPL2转录水平变化;B.实时定量检测FMDV转录水平上的变化;C.Western blotting检测TPL2和FMDV蛋白水平变化 A.TPL2 transcriptional level was detected by qPCR; B.FMDV transcriptional level was detected by qPCR; C.TPL2 and FMDV protein levels were detected by Western blotting 图 5 下调表达内源性TPL2抑制FMDV的复制 Figure 5 Downregulation of endogenous TPL2 inhibited FMDV replication |
病原体为了自身在宿主中进行复制和传播,会破坏宿主的防御机能,以抵抗天然免疫系统,比如FMDV在体外可以主动抑制宿主干扰素的产生[19-20]。另外,FMDV或者FMDV合成的一些蛋白质可以通过抑制宿主蛋白的翻译或转录水平来拮抗宿主的先天性反应[21]。FMDV的前导蛋白酶Lpro通过破坏干扰素(IFN)信号通路抑制宿主先天免疫应答从而来促进病毒的复制[21],FMDV的3Cpro通过剪切干扰素信号通路中接头蛋白NEMO来抑制病毒刺激产生IFN-α/β[22],另外它还能阻断IFN信号通路中STAT1和STAT2的入核[23], 近期有研究表明3Cpro可以通过溶酶体途径诱导双链RNA活化蛋白激酶(PKR)降解,从而拮抗宿主PKR介导的抗病毒作用[24]。FMDV的结构蛋白VP1也可以抑制Ⅰ型IFN的诱导,FMDV的非结构蛋白2B蛋白可以与RIG-Ⅰ相互作用,降低RIG-Ⅰ在宿主细胞中的表达,来抵抗宿主的抗病毒机制[25]。FMDV的非结构蛋白3A通过与干扰素信号通路中的接头蛋白RIG-Ⅰ,MDA5和VISA相互作用,此外3A还破坏RIG-Ⅰ、MDA5和VISA的mRNA水平的变化,表明3A抑制RLR介导的IFN-β[26]。总之,FMDV通过自身的一些结构蛋白或者非结构蛋白与宿主蛋白作用,从而来逃避宿主的免疫系统。
TPL2在天然免疫中起着关键的作用,在调节TNF-α,Toll样受体和G蛋白偶联受体信号中起着重要的作用[27]。TPL2通过促进ERK依赖性诱导c-fos(AP-1异二聚体转录因子的组成成分),在调节IFN产生起重要作用[28]。同时TPL2是以细胞类型特异性方式针对模式病毒配体的刺激有差异地调节IFN产生[16]。在浆细胞样树突状细胞(pDCs)中通过TPL2诱导产生IFN-α,而在TPL2-/-的CD4+ T细胞中分泌IFN-γ的能力显著减弱,但是在巨噬细胞和DCs中,TPL2却是IFN-β有效的负调节因子[28-29]。TPL2在不同的组织中都有广泛的表达,但是在各组织中具体的功能报道较少,对于其与病毒之间的相互作用以及具体分子机制相关的报道也是所知甚微。有研究表明TPL2以细胞类型特异性方式差异性地调控流感病毒感染所涉及的PRRs下游的IFN产生,在TPL2-/-的巨噬细胞和上皮细胞,TPL2抑制Ⅰ型干扰素的产生,而在pDCs中是促进Ⅰ型和Ⅲ型干扰素的产生[28]。TPL2在调节IFN-α/β和IFN-λ产生过程中至关重要,在流感病毒的研究当中,发现在pDCs中TPL2是通过激活Akt和ERK诱导IFN-λ的产生来抵抗流感病毒的感染[17]。在有关丙型肝炎病毒(HCV)的研究报告中,miR-17-5p和miR-17-5p靶向TPL2 3′UTR来抑制TPL2蛋白表达从而抑制HCV的复制[30]。FMDV可以通过各种方式来逃避宿主的天然免疫系统,而TPL2在天然免疫的过程中也发挥着至关重要的作用,所以,关于TPL2是否调节IFN的产生进而影响FMDV在BHK-21细胞中复制将是下一步的研究方向和重点。
4 结论首先使用FMDV感染BHK-21细胞,发现TPL2的转录水平显著上调,表明TPL2与FMDV感染复制之间有着必然的联系。其次,本研究成功构建Flag-TPL2真核质粒,并且通过Western blotting验证了其能够正常表达。通过过表达TPL2蛋白,可以显著促进FMDV在BHK-21细胞中复制,同时下调表达TPL2会抑制FMDV在BHK-21细胞中复制。本研究表明在FMDV易感的BHK-21细胞中,FMDV的复制和TPL2的表达呈正相关性,即TPL2是促进FMDV在BHK-21细胞中复制,通过FMDV感染试验,以及过表达和干扰两个试验,从转录水平和蛋白质水平两个方面证明TPL2可以促进FMDV在BHK-21细胞中复制。
| [1] | JAMAL S M, BELSHAM G J. Foot-and-mouth disease:Past, present and future[J]. Vet Res, 2013, 44: 116. DOI: 10.1186/1297-9716-44-116 |
| [2] | DOMINGO E, ESCARMÍS C, BARANOWSKI E, et al. Evolution of foot-and-mouth disease virus[J]. Virus Res, 2003, 91(1): 47–63. DOI: 10.1016/S0168-1702(02)00259-9 |
| [3] | KNOWLES N J, SAMUEL A R. Molecular epidemiology of foot-and-mouth disease virus[J]. Virus Res, 2003, 91(1): 65–80. DOI: 10.1016/S0168-1702(02)00260-5 |
| [4] | GRUBMAN M J, BAXT B. Foot-and-mouth disease[J]. Clin Microbiol Rev, 2004, 17(2): 465–493. DOI: 10.1128/CMR.17.2.465-493.2004 |
| [5] | BELSHAM G J. Distinctive features of foot-and-mouth disease virus, a member of the picornavirus family; Aspects of virus protein synthesis, protein processing and structure[J]. Prog Biophys Mol Biol, 1993, 60(3): 241–260. DOI: 10.1016/0079-6107(93)90016-D |
| [6] | VOUGIOUKALAKI M, KANELLIS D C, GKOUSKOU K, et al. Tpl2 kinase signal transduction in inflammation and cancer[J]. Cancer Lett, 2011, 304(2): 80–89. DOI: 10.1016/j.canlet.2011.02.004 |
| [7] | PLESCHKA S. RNA viruses and the mitogenic Raf/MEK/ERK signal transduction cascade[J]. Biol Chem, 2008, 389(10): 1273–1282. |
| [8] | DAS S, CHO J, LAMBERTZ I, et al. Tpl2/cot signals activate ERK, JNK, and NF-κB in a cell-type and stimulus-specific manner[J]. J Biol Chem, 2005, 280(25): 23748–23757. DOI: 10.1074/jbc.M412837200 |
| [9] | WATERFIELD M R, ZHANG M Y, NORMAN L P, et al. NF-κB1/p105 regulates lipopolysaccharide-stimulated MAP kinase signaling by governing the stability and function of the Tpl2 kinase[J]. Mol Cell, 2003, 11(3): 685–694. DOI: 10.1016/S1097-2765(03)00070-4 |
| [10] | DUMITRU C D, CECI J D, TSATSANIS C, et al. TNF-α induction by LPS is regulated posttranscriptionally via a Tpl2/ERK-dependent pathway[J]. Cell, 2000, 103(7): 1071–1083. DOI: 10.1016/S0092-8674(00)00210-5 |
| [11] | ELIOPOULOS A G, WANG C C, DUMITRU C D, et al. Tpl2 transduces CD40 and TNF signals that activate ERK and regulates IgE induction by CD40[J]. EMBO J, 2003, 22(15): 3855–3864. DOI: 10.1093/emboj/cdg386 |
| [12] | ELIOPOULOS A G, DUMITRU C D, WANG C C, et al. Induction of COX-2 by LPS in macrophages is regulated by Tpl2-dependent CREB activation signals[J]. EMBO J, 2002, 21(18): 4831–4840. DOI: 10.1093/emboj/cdf478 |
| [13] | CHIARIELLO M, MARINISSEN M J, GUTKIND J S. Multiple mitogen-activated protein kinase signaling pathways connect the cot oncoprotein to the c-jun promoter and to cellular transformation[J]. Mol Cell Biol, 2000, 20(5): 1747–1758. DOI: 10.1128/MCB.20.5.1747-1758.2000 |
| [14] | XIAO N M, EIDENSCHENK C, KREBS P, et al. The Tpl2 mutation Sluggish impairs type Ⅰ IFN production and increases susceptibility to group B streptococcal disease[J]. J Immunol, 2009, 183(12): 7975–7983. DOI: 10.4049/jimmunol.0902718 |
| [15] | MCNAB F W, EWBANK J, RAJSBAUM R, et al. TPL-2-ERK1/2 signaling promotes host resistance against intracellular bacterial infection by negative regulation of type Ⅰ IFN production[J]. J Immunol, 2013, 191(4): 1732–1743. DOI: 10.4049/jimmunol.1300146 |
| [16] | KURIAKOSE T, TRIPP R A, WATFORD W T. Tumor progression locus 2 promotes induction of IFNλ, interferon stimulated genes and antigen-specific CD8+ T cell responses and protects against influenza virus[J]. PLoS Pathog, 2015, 11(8): e1005038. DOI: 10.1371/journal.ppat.1005038 |
| [17] | MIELKE L A, ELKINS K L, WEI L, et al. Tumor progression locus 2 (Map3k8) is critical for host defense against Listeria monocytogenes and IL-1β production[J]. J Immunol, 2009, 183(12): 7984–7993. DOI: 10.4049/jimmunol.0901336 |
| [18] | KAKIMOTO K, MUSIKACHAROEN T, CHIBA N, et al. Cot/Tpl2 regulates IL-23 p19 expression in LPS-stimulated macrophages through ERK activation[J]. J Physiol Biochem, 2010, 66(1): 47–53. DOI: 10.1007/s13105-010-0007-9 |
| [19] | SELLERS R F, BENNETT J H, MOWAT G N, et al. Some factors affecting interferon production by foot-and-mouth disease virus in bovine tissue cultures[J]. Arch Gesamte Virusforsch, 1968, 23(1-2): 1–11. DOI: 10.1007/BF01242108 |
| [20] | CHINSANGARAM J, PICCONE M E, GRUBMAN M J. Ability of foot-and-mouth disease virus to form plaques in cell culture is associated with suppression of alpha/beta interferon[J]. J Virol, 1999, 73(12): 9891–9898. |
| [21] | DE LOS SANTOS T, DE AVILA BOTTON S, WEIBLEN R, et al. The leader proteinase of foot-and-mouth disease virus inhibits the induction of beta interferon mRNA and blocks the host innate immune response[J]. J Virol, 2006, 8 0(4): 1906–1914. |
| [22] | WANG D, FANG L R, LI K, et al. Foot-and-mouth disease virus 3C protease cleaves NEMO to impair innate immune signaling[J]. J Virol, 2012, 86(17): 9311–9322. DOI: 10.1128/JVI.00722-12 |
| [23] | DU Y J, BI J S, LIU J Y, et al. 3Cpro of foot-and-mouth disease virus antagonizes the interferon signaling pathway by blocking STAT1/STAT2 nuclear translocation[J]. J Virol, 2014, 88(9): 4908–4920. DOI: 10.1128/JVI.03668-13 |
| [24] | LI C T, ZHU Z X, DU X L, et al. Foot-and-mouth disease virus induces lysosomal degradation of host protein kinase PKR by 3C proteinase to facilitate virus replication[J]. Virology, 2017, 509: 222–231. DOI: 10.1016/j.virol.2017.06.023 |
| [25] | ZHU Z X, WANG G Q, YANG F, et al. Foot-and-mouth disease virus viroporin 2B antagonizes RIG-I-mediated antiviral effects by inhibition of its protein expression[J]. J Virol, 2016, 90(24): 11106–11121. DOI: 10.1128/JVI.01310-16 |
| [26] | LI D, LEI C Q, XU Z S, et al. Foot-and-mouth disease virus non-structural protein 3A inhibits the interferon-β signaling pathway[J]. Sci Rep, 2016, 6: 21888. DOI: 10.1038/srep21888 |
| [27] | MENON M B, GAESTEL M. TPL2 meets p38MAPK:Emergence of a novel positive feedback loop in inflammation[J]. Biochem J, 2016, 473(19): 2995–2999. DOI: 10.1042/BCJ20160672C |
| [28] | KAISER F, COOK D, PAPOUTSOPOULOU S, et al. TPL-2 negatively regulates interferon-β production in macrophages and myeloid dendritic cells[J]. J Exp Med, 2009, 206(9): 1863–1871. DOI: 10.1084/jem.20091059 |
| [29] | WATFORD W T, HISSONG B D, DURANT L R, et al. Tpl2 kinase regulates T cell interferon-γ production and host resistance to Toxoplasma gondii[J]. J Exp Med, 2008, 205(12): 2803–2812. DOI: 10.1084/jem.20081461 |
| [30] | TSUBOTA A, MOGUSHI K, AIZAKI H, et al. Involvement of MAP3K8 and miR-17-5p in poor virologic response to interferon-based combination therapy for chronic hepatitis C[J]. PLoS One, 2014, 9(5): e97078. DOI: 10.1371/journal.pone.0097078 |



