2. 天津农学院动物科学与动物医学学院, 天津 300384;
3. 中国农业科学院北京畜牧兽医研究所, 北京 100193;
4. 中国农业科学院深圳农业基因组研究所, 深圳 518120
2. College of Animal Science and Veterinary Medicine, Tianjin Agricultural University, Tianjin 300384, China;
3. Institute of Animal Science, Chinese Academy of Agricultural Sciences, Beijing 100193, China;
4. Agricultural Genomics Institute at Shenzhen, Chinese Academy of Agricultural Sciences, Shenzhen 518120, China
猪生长激素(porcine growth hormone, pGH)是猪垂体前叶分泌的调节机体生长发育、由190个氨基酸组成的单链多肽类激素,生长激素在体内呈脉冲式分泌,具有广泛的调节生长的生理功能,它能够影响体内几乎所有的组织类型和细胞,包括免疫组织、脑组织及造血系统[1-5]。在机体的生长轴中,生长激素是调控动物生长发育的核心,其作用方式类似于胰岛素和甲状腺激素,能明显促进骨、软骨及其他组织生长,刺激蛋白质与胶原的合成,促进组织细胞对循环氨基酸的摄取与利用[3, 5]。在生命过程中,生长激素的急剧减少与衰老有关,同时伴随骨和肌肉密度的减少和脂肪组织的增加[6]。由于生长激素在医学、畜牧生产和渔业生产中的重要作用,研究者很早就开始了对其基因结构和基因转录调控的研究,其cDNA序列在人、大鼠、小鼠、鸡、鸭、火鸡、大马哈鱼、鲤鱼中相继被测定。目前为止,由各种各样异源启动子启动生长激素过表达的转基因动物均表现出生长速度明显加快,但是同时也能观察到由于长期处于该激素高表达压力下,机体表现出繁殖障碍、关节炎、器官受损、免疫机能失调等不良反应[7-11]。
基因表达调控技术是现代分子生物学研究的重要手段,也是近年来开展转基因研究,成功制备各种转基因动、植物的理论基础,基因的可控表达已成为研究热点[12]。利用ZFN、TALEN与CRISPR/Cas9技术,我国在基因组编辑猪、牛、羊方面研究进展迅速。中国农业科学院北京畜牧兽医研究所利用ZFN技术成功制备并培育出具有“双肌”表型的MSTN双等位基因编辑梅山猪新种群。目前该MSTN基因编辑猪已经获准进入农业转基因生物安全评价的环境释放阶段[13]。同时,该团队改造了Tet-on调控表达系统,实现外源GH基因表达的安全、可控,并通过该系统制备了可控表达外源GH的转基因猪[14]。此外,多重转基因技术在生物学和医学研究上优于单基因技术,利用多重转基因技术我国获得了转11βHSD1-CHOP-hIAPP三基因猪[15-16]。目前存在的调控系统很多, 其中研究较多、应用最为广泛的是四环素调控系统(简称Tet调控系统)[17-18]。Tet调控基因表达系统的建立是以大肠杆菌Tn10特异的抗性操纵子(resistance operon)为基础,通过诱导底物四环素(teTc)及其衍生物强力霉素(doxycycline,DOX)的添加来调控基因表达,该诱导系统有着诱导效率高、毒性低、条件范围宽等优点,在目前动、植物转基因研究中有着广泛的应用[19-21]。
本研究为实现猪生长激素基因(pGH)在小鼠体内特定时间表达,利用课题组前期成功构建并在PK15细胞系中验证的整合型诱导表达pGH四环素(Tet-on)载体系统获得可控表达猪生长激素的转基因小鼠模型。利用PCR和Southern blot技术进行整合检测,筛选转基因小鼠。对3~10周龄转基因小鼠及对照组小鼠进行强力霉素诱导试验,利用RT-qPCR技术检测外源基因表达水平;利用放射性免疫检测方法对小鼠血液中pGH水平进行定量检测;同时称重,评估转入基因对小鼠机体表型的影响。
1 材料与方法 1.1 主要试剂及试剂盒地高辛DNA标记试剂盒及Southern blot检测试剂盒购自深圳莱伯克公司;定量检测试剂SYBR® Premix Ex TaqTM购自大连宝生物公司;内切酶Hind Ⅲ、AhdⅠ、Ssp购自MBI公司;Ex-Tag E购自大连宝生物公司;TOYOBO反转录试剂盒购自TOYOBO公司;总RNA提取试剂盒购自Bioteck公司;DL100、DL1000 Marker购自TRANS gen公司;凝胶回收试剂盒、质粒抽提试剂盒购自Omega公司;SYBR Green Ⅰ购自Molecular Probes公司;QIAGEN纯化试剂盒,TOYOBO反转录试剂盒购自TOYOBO公司;Tris-饱和酚、氯仿、无水乙醇、异丙醇、氯化钠等均为国产分析纯;强力霉素(DOX)购自Clone tech公司。
1.2 转基因小鼠的制备将前期成功构建并在PK15细胞表达验证准确的pTTGH载体用限制性内切酶AhdⅠ及Ssp双酶切[22-23],凝胶电泳回收9.2 kb大片段,纯化后的pTTGH质粒用TE稀释到终浓度为2~5 ng·μL-1通过显微注射到C57小鼠受精卵中,将受精卵重新植入假孕母鼠输卵管中,原核显微注射转基因小鼠的制备由北京协和医院实验动物研究中心完成。
1.3 F1代转基因小鼠制备将原核显微注射获得的转基因阳性公鼠分别于8、9、10周龄与正常性成熟母鼠交配,每周与3只正常母鼠合笼1周;将原核显微注射获得的转基因阳性母鼠于8周龄开始与正常公鼠交配,产生的仔鼠定义为F1代小鼠。
1.4 F1代小鼠基因整合检测通过PCR反应初步鉴定胚胎移植后出生的C57小鼠及其F1代,取10日龄小鼠尾尖,用组织DNA提取试剂盒提取DNA后以此为模板,扩增rtTA和pGH基因(表 1),进行小鼠外源基因检测。对经过PCR扩增检测为阳性小鼠,再次提取高浓度基因组,进行rtTA和pGH基因Southern blot杂交检测。
|
|
表 1 鉴定转基因小鼠的引物信息 Table 1 Primer sequence information used to identify transgenic mice |
将经过PCR、Southern blot检测为阳性的F1代转基因小鼠统计,提取尾组织,按照试剂盒说明书提取组织总RNA。根据TOYOBO的RevertAidTM First Strand cDNA Synthesis Kit使用说明书完成总RNA第一链的合成,以此cDNA为模板,梯度稀释模板,验证选定最佳模板浓度,以小鼠β-actin基因为内参,根据实时荧光定量检测试剂盒SYBR® Premix Ex TaqTM Ⅱ使用说明书,利用Real-time PCR测定rtTA和pGH表达活性。按照ABI定量试剂说明书上样,利用7500 System SDS Software V 1.4.0,根据2-ΔΔCT方法,对定量结果进行分析。
1.6 F1代小鼠诱导试验及生长性能测定将F1代转基因小鼠分为3组,每组14只(公母各半),进行强力霉素(DOX)诱导试验及体重表型鉴定。诱导分组:转基因小鼠诱导组、转基因小鼠非诱导组、同日龄同窝非转基因小鼠对照组。诱导条件:2 g·L-1强力霉素,2.5 g·L-1糖精,饮水供给。诱导时间:3~10周龄。诱导时段内每周同一时间对所有试验组及对照组小鼠称重,同时观察小鼠的健康状况。
1.7 F1代小鼠血清中外源GH放免测定诱导试验结束后,对诱导组和对照组小鼠采用眼腔静脉采血法收集血液,4 ℃ 1 000 r·min-1离心1 h,取上清-80 ℃保存。购买美国Linco公司放免试剂盒(Cat:pGH-46HK)对转基因小鼠血清样品进行pGH定量测定。放免操作委托北京中同蓝博临床检验所完成。
1.8 试验动物及饲养环境C57小鼠在本实验室SPF级鼠房饲养。温度(25±1) ℃,相对湿度(70±4)%,苏州市苏杭实验动物设备厂制造苏杭智能独立送回风净化笼系统,饲养密度≤5只·笼-1。笼具、垫料、饮水均高压灭菌处理,从北京协和医院实验动物研究中心购买真空包装饲料。2周更换鼠笼1次,小鼠自由采食、饮水,自动光控(12 h明/12 h暗)。
试验小鼠的使用符合动物保护、动物福利和伦理原则,符合国家实验动物福利伦理相关规定,并通过中国农业科学院实验动物伦理委员会审核。
1.9 数据分析试验数据采用EXCEL 2010软件初步整理,用SPSS 19.0统计软件进行单因素方差分析,并用LSD法进行多重比较,结果以“平均值±标准差”来表示,以P<0.05作为差异显著的判断标准。
2 结果 2.1 原核显微注射质粒基因的酶切和纯化将pTTGH载体用限制性内切酶AhdⅠ及Ssp双酶切,回收9.2 kb大片段,用于显微注射转基因小鼠的制备,载体结构如图 1所示。
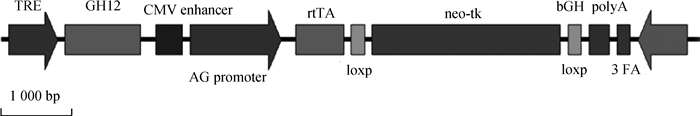
|
图 1 载体结构图 Figure 1 Figure of the vector structure |
将2.1中pTTGH载体显微注射到C57小鼠的受精卵中,并移植到代孕母鼠中。代孕母鼠共产下22只Founder鼠,提取22只小鼠基因组DNA,通过PCR-GH-F、PCR-GH-R和PCR-rtTA-1F、PCR-rtTA-1R基因特异性引物,经2%琼脂糖凝胶电泳检测,可见GH基因整合鼠PCR扩增产物大小为280 bp,rtTA基因整合鼠PCR扩增产物大小为459 bp,与预期的片段大小基本一致(图 2)。经PCR检测发现,有4只为转基因阳性个体(♂:T34和T63,♀:T43和T81)。21日龄将转基因Founder鼠公母分开,单独饲养,除去♂T63不育, ♀T81不孕外,待8周龄性成熟时开始与正常的C57小鼠交配,扩繁建系,F1代小鼠21日龄断奶。取10日龄小鼠尾组织,提取基因组DNA,检测rtTA、GH基因整合情况。
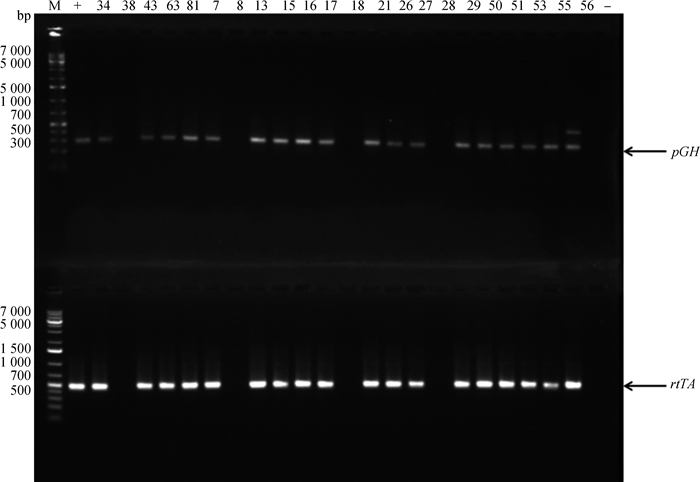
|
M.DNA相对分子质量标准;-.阴性对照;+.阳性对照; 数字.动物个体,图 3同 M.DL1000 DNA marker; -.Negative control; +.Positive control; Number. Animal number, the same as Figure3 图 2 转基因小鼠pGH基因和rtTA基因PCR鉴定 Figure 2 PCR results of pGH and rtTA genes of transgenic mice |
将经过PCR鉴定的粗筛阳性鼠进一步做Southern blot鉴定。提取尾组织基因组DNA 20 μg,EcoR Ⅰ酶切过夜,45 v电泳10 h,转移到Hybond-N+尼龙膜上,进行Southern杂交。以同窝非转基因鼠为阴性对照,pTTGH EcoRⅠ酶切质粒作为阳性对照,杂交探针分别设计在rtTA和GH片段上。结果显示,35只小鼠与PCR检测结果一致,外源rtTA、GH基因杂交带型一致(图 3)。
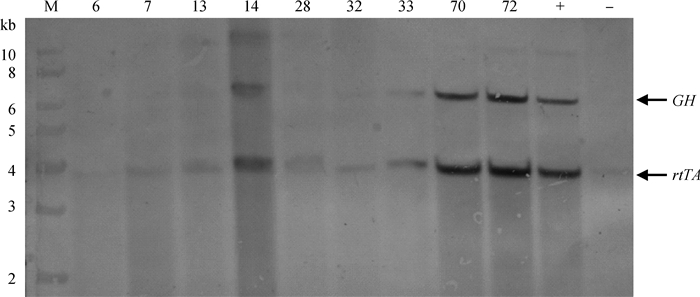
|
图 3 Southern blot鉴定转基因鼠 Figure 3 Southern blot analysis of transgenic mouse |
F1代转基因小鼠诱导试验结束后,提取诱导组和对照组尾尖组织总RNA, 选用β-actin基因做内参,通过RT-qPCR检测后代转基因小鼠中rtTA、GH基因的表达情况,筛选rtTA和GH基因能同时高表达的转基因小鼠留种做下游试验(图 4)。
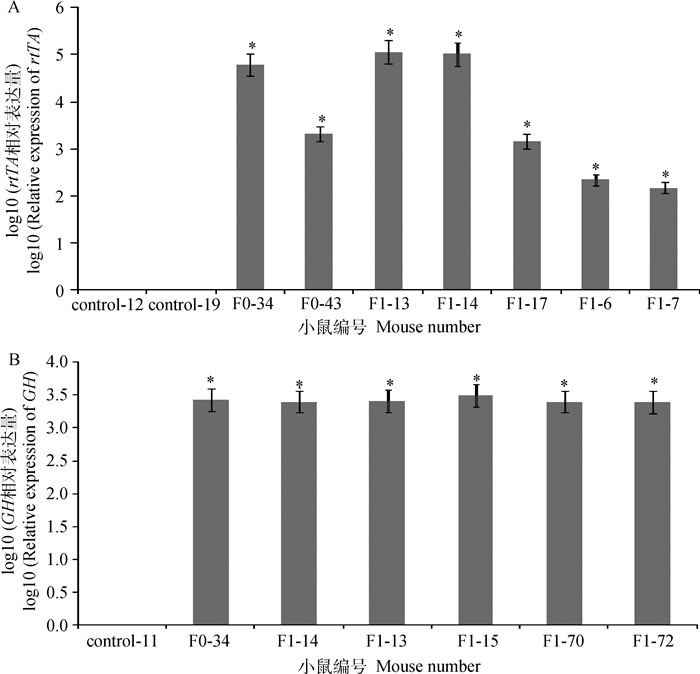
|
A. rtTA基因表达检测结果;B. GH基因表达检测结果。*.代表差异显著(P<0.05),下同 A. rtTA gene expression results; B.GH gene expression results. *. Means significant difference between treatments(P < 0.05), the same as below 图 4 F1代转基因小鼠基因表达检测 Figure 4 RT-qPCR analysis of rtTA and GH genes expression of F1 transgenic mice |
将F1代小鼠分为3组,每组14只(公母各半),进行强力霉素(DOX)诱导试验及体重表型鉴定。诱导分组:转基因小鼠诱导组(DOX-TM)、转基因小鼠非诱导组(NO-DOX-TM)、同日龄同窝非转基因小鼠对照组(Control)。诱导条件:2 g·L-1强力霉素,2.5 g·L-1糖精,饮水供给。诱导时间:3~10周龄。诱导时段内每周同一时间称1次体重。结果显示,饮水中加入诱导药物DOX之后,诱导组转基因小鼠体重在诱导期内持续增加,生长速度显著高于转基因小鼠无药物诱导组和非转基因对照组(P<0.05,图 5)。
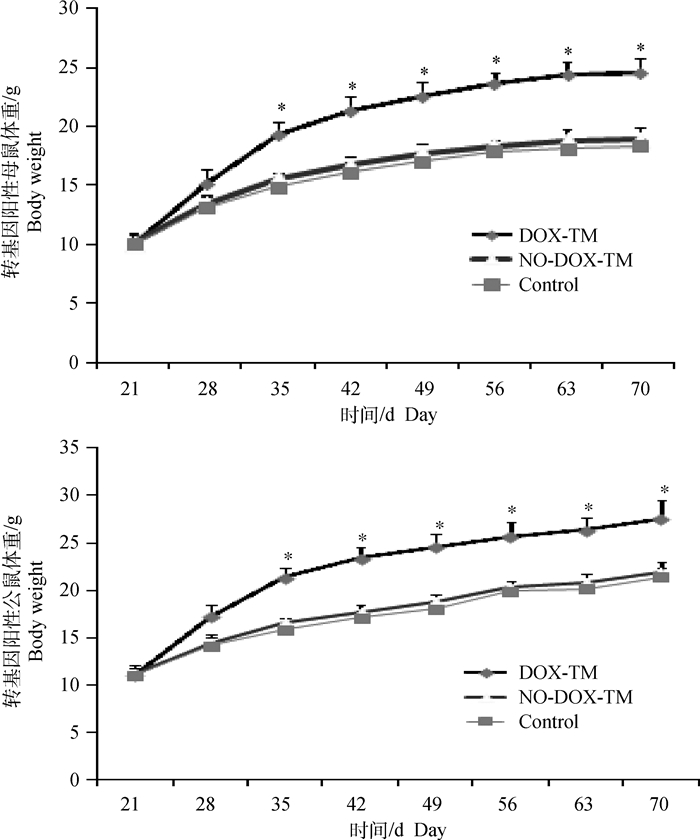
|
图 5 转基因小鼠强力霉素诱导后体重表型变化 Figure 5 Body weight variation of transgenic mice after supplying DOX by water |
为进一步检测转基因小鼠基因组中整合pGH基因是否能够正常发挥生理学功能,用放免法检测F1代转基因小鼠和对照组小鼠血清样本中pGH水平。诱导试验结束后,对诱导组和对照组小鼠采用眼腔静脉采血法收集血液。将收集到的血清样品-80 ℃低温保存送至北京中同蓝博临床检验所统一检测。结果显示,诱导组转基因组小鼠血清中pGH水平显著高于对照组小鼠(P<0.05,图 6)。
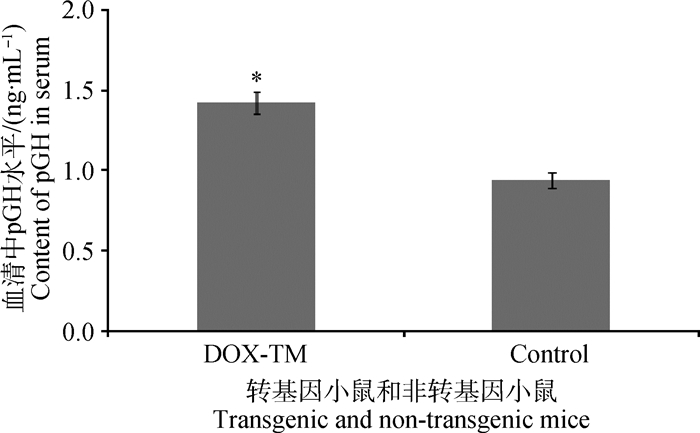
|
图 6 放免法检测转基因与同窝非转基因小鼠血清中pGH含量 Figure 6 The concentration of pGH in the serum of transgenic and non-transgenic mice |
转基因动物是以分子遗传学和试验胚胎学为基础发展起来的生物新技术,是在分子水平对发育生物学进行深入研究的重要手段。自Palmiter等[24]的超级小鼠试验成功后,转基因动物的研究就没有中断过,到目前为止,世界各国的优秀科学家已经培育出多种具有优质、高产、抗逆等优良品质的动物新品系。通过原核显微注射等基因转移技术,将各种不同来源的生长激素基因导入到小鼠、大鼠、兔、羊、牛、猪基因组内,培育出了除体重增大外携带其他各种表型的转基因模型,研究结果显示,这些外源基因不仅可以整合到转基因动物染色体中,而且有相当一部分还可在转基因动物体内表达并发挥出生物学效应[25-30]。生长激素可以通过刺激结缔组织、肌肉和骨骼的生长发育而促进机体生长,Palmiter等[24]和Mathews等[31]考虑到生长激素蛋白产物所具有的多种生物学效应,把MT-Ⅰ启动子与大鼠和人的生长激素基因融合,分别导入小鼠受精卵。结果显示,两种结构形式的基因都分别在转基因鼠体内得到了整合和有效的调控表达而培育出“超级鼠”。该试验成功开辟了生长激素结构与功能、表达与调控研究的新纪元,并通过生长激素为其它真核基因在机体发育中的时空调控提供了良好模式。
已有文献报道了成功转入GH基因的动物,大部分都是全身过表达GH基因,而且外源GH基因从胚胎期到成年都持续发挥生物学效应,其机体发育的异常很可能和GH在全身多个组织器官中的自分泌异常有关,这也和临床上发现的GH分泌失常引发动物机体疾病、癌症等病理现象相似[32-35]。本试验首先将四环素调控系统中两个载体核心元件整合到pCAGGS一个载体上,并在前期的细胞水平试验中证明了培养液中添加不同浓度诱导底物强力霉素(DOX)诱导外源基因表达的效率不同[22-23]。本研究利用整合型可控表达GH载体系统制备了转基因小鼠模型,通过在饮水中添加强力霉素(DOX)研究GH对机体作用的时效、量效关系,有望大大减少生长激素长期过高表达给机体带来的负面影响。
本研究中,目的基因GH是对动物机体生长发育极为重要的基因,本课题组前期的研究结果表明,制备转GH基因动物可以用于提高动物的生长速度、减少饲喂成本,同时还有助于研究GH基因功能,通过控制GH基因的表达有助于了解传统过表达GH方法制备转基因动物常出现的一些发育异常现象,本课题后续通过控制GH的表达时间和表达量来减少GH过早表达产生的副作用,大大提高了转基因动物的存活率,也有助于研究GH对机体发育的影响。
本研究利用原核显微注射法制备出可控表达GH基因的转基因小鼠,通过饮水中添加诱导底物强力霉素(DOX)以后,转基因小鼠的体重与同窝非转基因小鼠相比明显增大,血清中pGH水平明显上升,说明外源GH可以正常表达并通过机体生长轴发挥调节功能。同时发现,转基因小鼠和正常鼠交配后能够稳定产生转基因后代小鼠,F1代至F3代获得的小鼠,外源基因经PCR和Southern blot检测,F1代整合效率48%(35/73),F2代整合效率51%(45/88),F3代整合效率49%(50/102), 在后代的扩繁培育中外源基因的遗传遵循孟德尔遗传规律。本研究构建的整合型诱导表达载体在能达到研究目的前提下大大简化了试验流程、提高了研究效率。
4 结论本研究结果提示,可控表达pGH基因转基因小鼠模型的建立有助于深入研究GH对机体发育的影响以及机体中影响GH分泌的分子机制和信号通路,促进GH在家畜生产中的应用,也为制备安全、高效的GH转基因大家畜奠定理论基础。
| [1] | CANNATA D, VIJAYAKUMAR A, FIERZ Y, et al. The GH/IGF-1 axis in growth and development:new insights derived from animal models[J]. Adv Pediatr, 2010, 57(1): 331–351. DOI: 10.1016/j.yapd.2010.09.003 |
| [2] | FRANK S J. Growth hormone, insulin-like growth factor Ⅰ, and growth:local knowledge[J]. Endocrinology, 2007, 148(4): 1486–1488. |
| [3] |
朱孔芹. 生长激素和胰岛素相互作用对信号通路的影响及机制[D]. 广州: 南方医科大学, 2014.
ZHU K Q. The interaction of growth hormone and insulin on both signaling pathways and its molecular mechanisms[D]. Guangzhou: Southern Medical University, 2014. (in Chinese) |
| [4] | QIU H, YANG J K, CHEN C. Influence of insulin on growth hormone secretion, level and growth hormone signalling[J]. Acta Physiologica Sinica, 2017, 69(5): 541–556. |
| [5] |
岳敏, 田雨光, 万斌, 等. 生长激素受体基因突变对西藏藏猪生长迟缓的影响[J]. 畜牧兽医学报, 2016, 47(5): 882–887.
YUE M, TIAN Y G, WAN B, et al. The impact of GHR mutation on suppressing the growth in Tibet mini-pig[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(5): 882–887. (in Chinese) |
| [6] | ABDELAZIZ H, VASSILYADI M, VENTUREYRA E C. Late-onset erythema along a sterile functioning ventriculoperitoneal shunt:case report and review of the literature[J]. Child's Nerv Syst, 2002, 18(5): 235–237. DOI: 10.1007/s00381-002-0570-7 |
| [7] | LIU H, BRAVATA D M, OLKIN I, et al. Systematic review:the safety and efficacy of growth hormone in the healthy elderly[J]. Ann Intern Med, 2007, 146(2): 104–115. DOI: 10.7326/0003-4819-146-2-200701160-00005 |
| [8] | PURSEL V G, BOLT D J, MILLER K F, et al. Expression and performance in transgenic pigs[J]. J Reprod Fertil Suppl, 1990, 40: 235–245. |
| [9] | KIM Y, HONG J W, CHUNG Y S, et al. Efficacy and safety of sustained-release recombinant human growth hormone in Korean adults with growth hormone deficiency[J]. Yonsei Med J, 2014, 55(4): 1042–1048. |
| [10] | CUNEO R C, WALLACE J D. Skeletal and cardiac muscle in adults with growth hormone deficiency[J]. Front Horm Res, 2005, 33: 121–145. |
| [11] | KANN P H, BERGMANN S, BIDLINGMAIER M, et al. Design of the growth hormone deficiency and efficacy of treatment (GET) score and non-interventional proof of concept study[J]. BMC Endocr Disord, 2018, 18: 10. |
| [12] | RUAN J X, XU J, CHEN-TSAI R Y, et al. Genome editing in livestock:are we ready for a revolution in animal breeding industry?[J]. Transgenic Res, 2017, 26(6): 715–726. DOI: 10.1007/s11248-017-0049-7 |
| [13] | QIAN L L, TANG M X, YANG J Z, et al. Targeted mutations in myostatin by zinc-finger nucleases result in double-muscled phenotype in Meishan pigs[J]. Sci Rep, 2015, 5: 14435. |
| [14] | JU H M, ZHANG J Q, BAI L J, et al. The transgenic cloned pig population with integrated and controllable GH expression that has higher feed efficiency and meat production[J]. Sci Rep, 2015, 5: 10152. |
| [15] | KONG S Y, RUAN J X, XIN L L, et al. Multi-transgenic minipig models exhibiting potential for hepatic insulin resistance and pancreatic apoptosis[J]. Mol Med Rep, 2016, 13(1): 669–680. |
| [16] | KONG SY, LI L, ZHU W J, et al. Genetic characteristics of polycistronic system-mediated randomly-inserted multi-transgenes in miniature pigs and mice[J]. Mol Med Rep, 2018, 17(1): 37–50. |
| [17] | GOSSEN M, FREUNDLIEB S, BENDER G, et al. Transcriptional activation by tetracyclines in mammalian cells[J]. Science, 1995, 268(5218): 1766–1769. |
| [18] | PAPAEVANGELOU E, WHITLEY G S, JOHNSTONE A P, et al. Investigating the role of tumour cell derived iNOS on tumour growth and vasculature in vivo using a tetracycline regulated expression system[J]. Int J Cancer, 2016, 138(11): 2678–2687. DOI: 10.1002/ijc.v138.11 |
| [19] | HALTERMAN M W. An improved method for the study of apoptosis-related genes using the tet-on system[J]. J Biomol Screen, 2011, 16(3): 332–337. |
| [20] | SHIOTA M, ZARDAN A, TAKEUCHI A, et al. Clusterin mediates TGF-β-induced epithelial-mesenchymal transition and metastasis via Twist1 in prostate cancer cells[J]. Cancer Res, 2012, 72(20): 5261–5272. DOI: 10.1158/0008-5472.CAN-12-0254 |
| [21] | WEYLER M, MORSCHHÄUSER J. Tetracycline-inducible gene expression in Candida albicans[J]. Methods Mol Biol, 2012, 845: 201–210. |
| [22] |
白立景, 周荣, 敖红, 等. 诱导表达猪生长激素pGH载体系统构建及其在PK15细胞中表达验证[J]. 农业生物技术学报, 2013, 21(4): 483–488.
BAI L J, ZHOU R, AO H, et al. Conditional expression vector of pig growth hormone leads to regulatable expression in PK15 cells by Tetracycline (Tet-on) system[J]. Journal of Agricultural Biotechnology, 2013, 21(4): 483–488. (in Chinese) |
| [23] |
鞠辉明, 白立景, 姜星, 等. 整合型诱导表达猪生长激素(pGH)载体的构建及表达研究[J]. 畜牧兽医学报, 2013, 44(7): 1008–1013.
JU H M, BAI L J, JIANG X, et al. Construction and expression study of integrated pGH inducible expression vector[J]. Acta Veterinaria et Zootechnica Sinica, 2013, 44(7): 1008–1013. (in Chinese) |
| [24] | PALMITER R D, BRINSTER R L, HAMMER R E, et al. Dramatic growth of mice that develop from eggs microinjected with metallothionein-growth hormone fusion genes[J]. Nature, 1982, 300(5893): 611–615. |
| [25] | MARTINEZ C S, PIAZZA V G, GONZÁLEZ L, et al. Mitogenic signaling pathways in the liver of growth hormone (GH)-overexpressing mice during the growth period[J]. Cell Cycle, 2016, 15(5): 748–759. DOI: 10.1080/15384101.2016.1148844 |
| [26] | SCHNIEKE A E, KIND A J, RITCHIE W A J, et al. Human factor Ⅸ transgenic sheep produced by transfer of nuclei from transfected fetal fibroblasts[J]. Science, 1997, 278(5346): 2130–2133. DOI: 10.1126/science.278.5346.2130 |
| [27] | CIBELLI J B, STICE S L, GOLUEKE P J, et al. Cloned transgenic calves produced from nonquiescent fetal fibroblasts[J]. Science, 1998, 280(5367): 1256–1258. |
| [28] | WAN Y J, DENG M T, ZHANG G M, et al. Analysis of H19/Igf2 methylation status in the sperm of cloned goats and their offspring[J]. Cell Reprogram, 2018, 20(1): 66–75. |
| [29] |
李碧春, 孙怀昌, 陈国宏, 等. 鸡胚盘内转染外源基因的研究[J]. 畜牧兽医学报, 2004, 35(5): 481–486.
LI B C, SUN H C, CHEN G H, et al. Transfect of exogenous in vivo of chickens germinal disc[J]. Acta Veterinaria et Zootechnica Sinica, 2004, 35(5): 481–486. (in Chinese) |
| [30] | ROGERS C S, STOLTZ D A, MEYERHOLZ D K, et al. Disruption of the CFTR gene produces a model of cystic fibrosis in newborn pigs[J]. Science, 2008, 321(5897): 1837–1841. |
| [31] | MATHEWS L S, HAMMER R E, BRINSTER R L, et al. Expression of insulin-like growth factor Ⅰ in transgenic mice with elevated levels of growth hormone is correlated with growth[J]. Endocrinology, 1988, 123(1): 433–437. |
| [32] | CHIA D J. Minireview:mechanisms of growth hormone-mediated gene regulation[J]. Mol Endocrinol, 2014, 28(7): 1012–1025. |
| [33] | MIQUET J G, FREUND T, MARTINEZ C S, et al. Hepatocellular alterations and dysregulation of oncogenic pathways in the liver of transgenic mice overexpressing growth hormone[J]. Cell Cycle, 2013, 12(7): 1042–1057. DOI: 10.4161/cc.24026 |
| [34] | HOEFLICH A, NEDBAL S, BLUM W F, et al. Growth inhibition in giant growth hormone transgenic mice by overexpression of insulin-like growth factor-binding protein-2[J]. Endocrinology, 2001, 142(5): 1889–1898. |
| [35] | GAGLIARDI A D, KUO E Y W, RAULIC S, et al. Human stanniocalcin-2 exhibits potent growth-suppressive properties in transgenic mice independently of growth hormone and IGFs[J]. Am J Physiol Endocrinol Metab, 2005, 288(1): E92–E105. |



