毛囊是哺乳动物皮肤中普遍存在的衍生器官[1],由毛球、连接组织鞘、外根鞘、内根鞘和毛干等部分构成,并始终发生着周期性的变化:生长期、退行期和休止期[2]。毛囊中大约包含20多种细胞,这些细胞在体内通过复杂的相互作用,共同参与毛囊生长、发育、分化与周期性调节[3]。外根鞘(outer root sheat, ORS)由厚的细胞层组成,包裹在内根鞘和毛干的外侧,成为毛囊与真皮层的分界线[4]。外根鞘细胞(outer root sheath cells, ORSCs)是成熟毛囊在分化过程中幸存下来的,形态学上类似于上皮的角质化细胞[5],在毛囊周期、毛发生长和创伤愈合期间起重要的作用[6]。生长期阶段,外根鞘细胞可以产生终止生长期的信号并使得毛囊进入退行期[5];皮肤损伤时,外根鞘细胞会分化形成上皮细胞[7]。
血管内皮生长因子(vascular endothelial cell growth factor, VEGF)是一类多功能的细胞因子,可促进内皮细胞增殖、促进血管生成以及增加血管的通透性[8],并在创伤愈合、胚胎发育、视网膜血管新生风湿性关节以及肿瘤的生长和转移中都起重要的作用[9]。近些年研究发现,VEGF在毛囊中表达并作用于毛囊。Yano等[10]以转基因小鼠为试验模型,过表达毛囊外根鞘中的VEGF,发现相同时间内VEGF转基因小鼠比野生型小鼠的毛发生长快,同时通过石蜡切片组织学观察发现VEGF转基因小鼠的毛囊更密更大。Wu等[11]利用MTT法检测外根鞘细胞的增殖,发现在培养液中添加VEGF可以促进人毛囊外根鞘细胞的增殖。增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)基因是鉴定体外培养细胞增殖的一个基因,是细胞增殖的特异性标记;角蛋白10(keratin 10,K10)是细胞分化的特异性标记。PCNA和K10均在外根鞘细胞中特异性表达。成纤维细胞生长因子5(fibroblast growth factor 5,FGF 5)与哺乳动物毛发生长密切相关。本试验以体外培养的绒山羊次级毛囊外根鞘细胞为对象,研究培养液中添加VEGF对次级毛囊外根鞘细胞的增殖、分化及PCNA、K10和FGF5基因表达量的影响,为进一步研究绒山羊次级毛囊发育机制提供理论支持。
1 材料与方法 1.1 试验动物及样品采集选取临床健康的雌性成年陕北白绒山羊(陕西省陕北白绒山羊原种场,榆林市横山县),采取体侧部约0.5 cm×2.0 cm的皮肤样品,置于无菌PBS中,4 ℃条件下带回实验室。
1.2 主要试剂及其配制EpiLife Medium with 60 μmol·L-1 calcium, HKGS, Coating Matrix, 胎牛血清, 0.25%胰蛋白酶(g·dL-1), 1×PBS粉末(Gibco, 美国);DispaseII(Roche, 瑞士);双抗(青霉素、链霉素, HyClone,美国);DMSO、VEGF、MTT粉末(Sigma, 美国);Cell-LightTM EdU Apollo® 488 in vitro Imaging Kit(100T)(RiboBio,广州);纯RNA提取试剂盒(Ultrapure RNA Kit北京康为世纪公司);反转录试剂盒(PrimeScriptTM RT Master Mix)及荧光定量试剂盒(TaKaRa,日本)。
0.25%中性蛋白酶消化液(dispase Ⅱ):使用前,0.25 g DispaseⅡ粉末溶于100 mL无血清DMEM/F12培养液中,充分溶解混匀后,过滤除菌。
PBS:1×PBS粉末溶解于1 L的去离子水中,加入1 mL双抗(100 IU),过滤除菌,分装保存。
MTT液:称取0.5 g MTT粉末,充分溶解于100 mL PBS中,过滤除菌,-20 ℃保存。
细胞培养液:EpiLifeTM培养基90 mL添加HKGS(包含0.2%BPE(v/v),5 μg·mL-1牛胰岛素,0.18 μg·mL-1氢化可的松,5 μg·mL-1牛转铁蛋白, 0.2 ng·mL-1人表皮生长因子) 0.9 mL、胎牛血清9 mL,双抗(100 IU·mL-1)0.1 mL,总体积为100 mL。
1.3 样品处理将置于无菌PBS中的皮肤样品带入细胞操作间,用75%的酒精浸泡进行样品表面灭菌,无菌PBS液冲洗4~5次,在体视镜下将样品切成宽度为0.2 cm左右的皮肤组织片、浸泡在无菌0.25% dispaseⅡ中,4 ℃消化4.5 h,在PBS液中清洗2~3次。消化结束的样品在体视镜下,用眼科镊子顺毛囊方向将毛囊剥离出来,此时的毛囊无真皮鞘。
1.4 原代培养和传代培养与纯化将剥离的毛囊分离初级和次级毛囊, 分别放入2 mL离心管中,加入300~400 μL的0.25%胰蛋白酶溶液消化20~25 min,消化过程中可在显微镜下观察消化情况;消化结束时,加入含有血清的培养液终止消化,吹打10~15次;去除多余的毛囊,1 000 r·min-1离心5 min,弃上清;加入新的培养液1 mL重悬细胞,移入预先铺有Coating Matrix的培养皿中,再加入1 mL培养液,在培养箱中静置培养4~5 d,发现有贴壁细胞后,更换培养液,之后每2~3 d更换1次培养液。
当原代细胞生长汇合时,进行传代。首先弃旧培养液,PBS清洗两次,加入适量0.25%胰蛋白酶,处理细胞数十秒,弃胰酶液体,然后加入1 mL新的0.25%胰蛋白酶(g·dL-1)消化3~4 min,含血清培养液终止消化,并吹打成细胞悬液,移入2 mL离心管中,1 000 r·min-1离心5 min,收集细胞,加入新的培养皿中,每2~3 d更换1次培养液。前3代细胞传代时,新的培养皿中都需要预先铺好涂层培养基(coating matrix)。
在原代细胞和初次传代细胞贴壁后,采用细胞时间差酶消化法纯化。
1.5 细胞生长曲线的测定收集第5代处于对数生长期次级毛囊外根鞘细胞,制成细胞悬液。计数调整细胞密度为0.5×104·mL-1,将细胞悬液接种于24孔细胞培养板中,每孔1 mL。每隔24 h, 取3个孔的细胞分别进行计数,取平均值。以培养时间为横坐标,每隔24 h的细胞数平均值为纵坐标作图,即得次级毛囊外根鞘细胞的生长曲线。
1.6 毛囊外根鞘细胞的免疫细胞化学鉴定对绒山羊毛囊外根鞘细胞采用镜下观察和选用CK17、CK15进行免疫荧光染色鉴定。免疫荧光染色步骤参考文献[12],在荧光显微镜下观察并拍照记录。
1.7 次级毛囊外根鞘细胞的活性检测选择第5代次级毛囊外根鞘细胞,使96孔板中每孔的细胞密度为3×104·mL-1,待细胞长至70%~80%, 加入不同质量浓度VEGF(0、1、10、50和100 ng·mL-1)的培养液,其中0 ng·mL-1为对照组,每个浓度分别处理24和48 h后,每孔加入20 μL的MTT (5 mg·mL-1),于28 ℃、5%CO2条件下,继续培养4 h,吸弃培养液,用PBS洗1次,每孔加入150 μL二甲基亚砜(dimethyl sulfoxide, DMSO),28 ℃孵育10 min,溶解细胞中的甲臢。使用酶标仪于490 nm波长处测定吸光度值,每组6个重复。
1.8 次级毛囊外根鞘细胞的增殖检测选择第5代次级毛囊外根鞘细胞,使96孔板中每孔的细胞密度为3×104·mL-1,待细胞长至70%~80%后,加入不同质量浓度VEGF(0、1、10、50和100 ng·mL-1)的培养液,其中0 ng·mL-1为对照组,每个浓度处理48 h后,每孔加入100 μL的EdU培养液,于37 ℃、5%CO2饱和湿度条件下继续培养2 h后,进行Apollo染色和Hoechst33342染色。使用荧光显微镜观察并记录,每个孔随机选择5个视野拍照。
1.9 次级毛囊外根鞘细胞中与增殖和分化相关基因mRNA表达的检测选择第5代次级毛囊外根鞘细胞,使96孔板中每孔的细胞密度为3×105·mL-1,待细胞长至70%~80%后,加入不同质量浓度VEGF(0、10、100 ng·mL-1),其中0 ng·mL-1为对照组,每个浓度分别处理24和48 h,根据试剂盒说明书提取RNA,反转录成cDNA,-80 ℃保存。
以NCBI上山羊β-actin作为内标基因,同时参照山羊PCNA、K10、FGF5 mRNA的CDS区序列,使用Primier 5.0软件设计跨内含子的特异性引物(表 1),由南京金斯瑞生物科技有限公司合成。
|
|
表 1 实时荧光定量PCR引物序列 Table 1 Primer sequences for Real-time quantitative PCR |
采用TaKaRa公司的荧光染料SYBR®Premix Ex TaqTMⅡ,以β-actin为内标基因,利用Bio-Rad iQ5实时定量PCR仪对各待测cDNA样品中PCNA、K10、FGF 5 mRNA的表达量进行测定,每个样品3次重复。q-PCR反应体系及反应条件参考文献[13]。
1.10 数据分析所有样品用β-actin进行归一化处理,同时以内标基因β-actin作为参照基因,用2-ΔΔCt法计算PCNA、K10、FGF 5 mRNA的相对表达量。所有数据均以“平均值±标准误(mean±SE)”表示。采用SPSS18.0统计软件进行独立样本t检验(one sample t test),*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。
2 结果 2.1 陕北白绒山羊毛囊外根鞘细胞体外培养陕北白绒山羊毛囊外根鞘细胞体外培养情况如图 1所示,分离出的毛囊可以明显的看到外根鞘(图 1A, B);培养5~7 d后镜下观察外根鞘细胞成群贴壁(图 1C, D);培养10~12 d后,外根鞘细胞增殖迅速,并排列紧密规则(图 1E, F)。外根鞘细胞呈多角形、短棒形或卵圆形,分布均匀,细胞间连接紧密,呈典型的铺路石状。

|
A.初级毛囊;B.次级毛囊;C.培养6 d的初级毛囊外根鞘细胞;D.培养6 d的次级毛囊外根鞘细胞;E.培养12 d的初级毛囊外根鞘细胞;F.培养12 d的次级毛囊外根鞘细胞 A. Primary hair follicle; B. Secondary hair follicle; C. Primary hair follicle ORSCs cultured 6 d; D. Secondary hair follicle ORSCs cultured 6 d; E. Primary hair follicle ORSCs cultured 12 d; F. Secondary hair follicle ORSCs cultured 12 d 图 1 毛囊外根鞘细胞体外培养(40×) Figure 1 The hair follicle outer root sheath cells in vitro cultured (40×) |
CK17是外根鞘细胞的特异性标记[20],如图 2所示,CK17的细胞免疫组化结果呈阳性,表明培养细胞为次级毛囊外根鞘细胞。CK15是毛囊干细胞的特异性标记[22],图 3显示,CK15的细胞免疫组化结果呈阳性,表明外根鞘细胞中有毛囊干细胞。
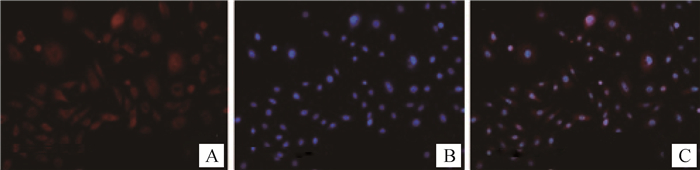
|
A.CK17;B.DAPI; C.Overlay 图 2 细胞免疫荧光鉴定(CK17) (200×) Figure 2 Cytoimmunochemistry of CK17 (200×) |
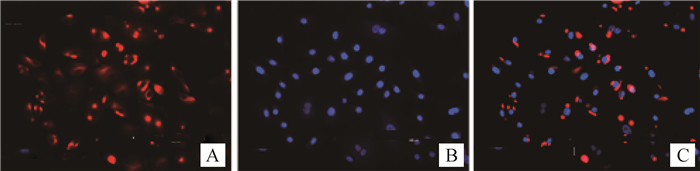
|
A.CK15;B.DAPI; C.Overlay 图 3 细胞免疫荧光鉴定(CK15) (200×) Figure 3 Cytoimmunochemistry of CK15 (200×) |
次级毛囊外根鞘细胞生长曲线见图 4。由图 4可知,体外培养1 d左右,细胞贴壁并开始缓慢增殖;培养2~3 d,细胞增殖速度缓慢增加;3~5 d,细胞进入快速增殖期,呈现对数生长;培养5 d后,细胞进入平稳期并很快进入衰退期。细胞生长曲线呈典型的“S”型。
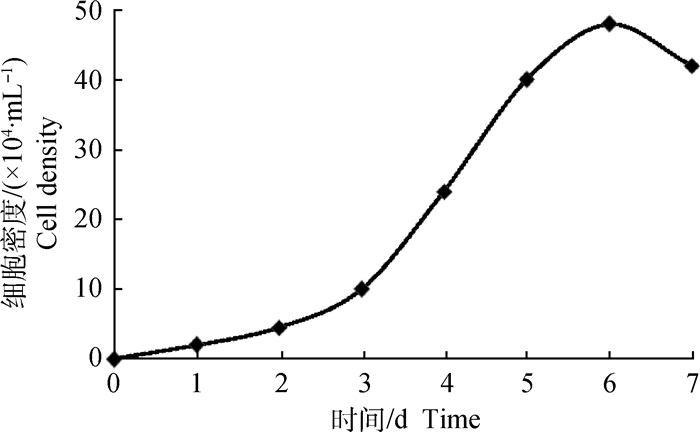
|
图 4 次级毛囊外根鞘细胞生长曲线 Figure 4 Secondary hair follicle ORSCs growth curve |
MTT法检测次级毛囊外根鞘细胞的增殖结果见图 5。如图 5所示,VEGF浓度和处理时间对次级毛囊外根鞘细胞增殖均有影响。相同处理时间(处理24或48 h),50 ng·mL-1组和100 ng·mL-1组的细胞活力均显著或极显著高于对照组、1 ng·mL-1组和10 ng·mL-1组(P<0.05和P<0.01);VEGF处理48 h时,100 ng·mL-1组的细胞活力显著高于50 ng·mL-1组(P<0.05)。相同浓度VEGF,处理48 h的细胞活力均极显著高于处理24 h(P<0.01)。
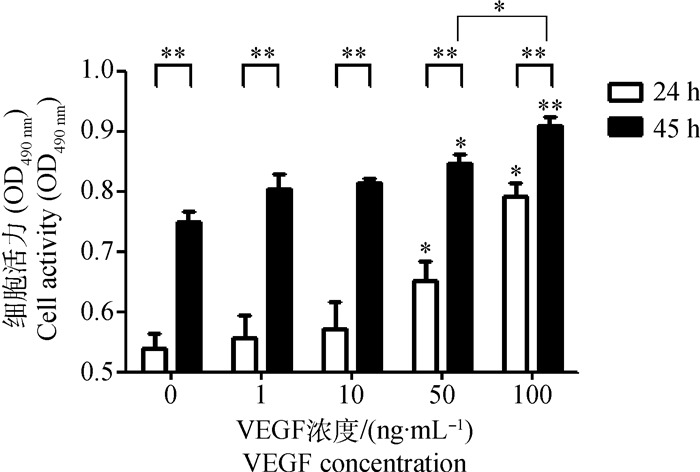
|
*与**.同色柱或连线色柱之间比较差异显著或极显著(P<0.05或P<0.01)。下同 * and ** means significant difference(P < 0.05 and P < 0.01)between columns with same color or with connecting line respectively. The same as follows 图 5 VEGF处理的细胞活力检测 Figure 5 Detection of cell activity treated with VEGF |
EdU检测次级毛囊外根鞘细胞的增殖结果见图 6和图 7。图 6为VEGF处理48 h后1个视野中EdU标记的次级毛囊外根鞘增殖细胞染色照片,图 7为染色增殖细胞计数结果。如图 7所示,VEGF处理48 h,100 ng·mL-1组和50 ng·mL-1组的细胞计数极显著高于对照组、1 ng·mL-1组、10 ng·mL-1组(P<0.01),100 ng·mL-1组的细胞计数显著高于50 ng·mL-1组(P<0.05)。
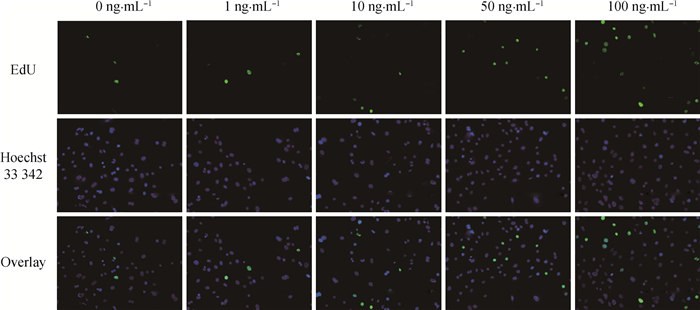
|
图 6 VEGF处理48 h EdU标记的增殖细胞染色照片(200×) Figure 6 EdU mark the staining pattern of proliferation cells treated with VEGF for 48 h (200×) |
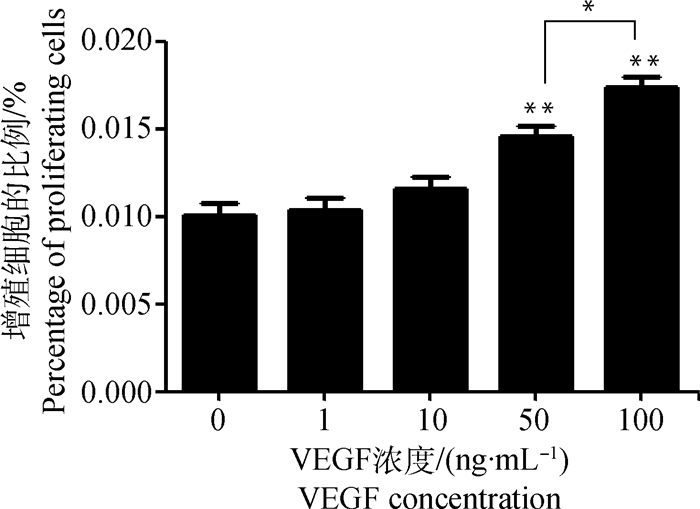
|
图 7 EdU标记增殖细胞计数(48 h) Figure 7 Counting of EdU mark proliferating cells (48 h) |
PCNA、K10和FGF 5基因mRNA在次级毛囊外根鞘细胞中的表达情况见图 8。图 8A显示,PCNA mRNA在次级毛囊外根鞘细胞中有表达,表达量随VEGF浓度的增加而增加。相同处理时间(处理24或48 h),PCNA mRNA表达量均以100 ng·mL-1组的最高,极显著高于对照组(P<0.01),显著高于10 ng·mL-1组(P<0.05)。VEGF处理24 h,10 ng·mL-1组PCNA mRNA的表达量显著高于对照组(P<0.05)。由图 8B可知,角蛋白K10 mRNA在次级毛囊外根鞘细胞中有表达,VEGF处理可降低其表达量。VEGF处理24 h,100 ng·mL-1组K10 mRNA的表达量显著低于对照组(P<0.05);处理48 h,10 ng·mL-1组和100 ng·mL-1 K10 mRNA的表达量极显著低于对照组(P<0.01)。VEGF处理时间对K10 mRNA的表达量也有影响,100 ng·mL-1组处理48 h的表达量显著低于处理24 h的表达量(P<0.05)。
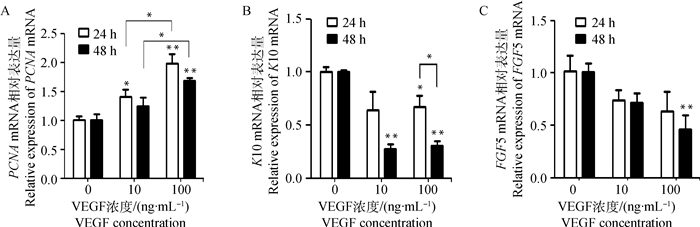
|
图 8 PCNA、K10和FGF 5 mRNA在次级毛囊外根鞘细胞中的表达 Figure 8 Expression of PCNA, K10 and FGF 5 mRNA in secondary hair follicle ORSCs |
FGF 5基因在次级毛囊外根鞘细胞中的表达情况见图 8C。由图 8C可知,FGF 5 mRNA在次级毛囊外根鞘细胞中有表达,VEGF处理可抑制其表达,随着VEGF浓度增大,FGF 5 mRNA表达量呈下降趋势。VEGF处理48 h,100 ng·mL-1组FGF 5 mRNA的表达量极显著低于对照组(P<0.01)。
3 讨论 3.1 绒山羊次级毛囊外根鞘细胞的体外培养和鉴定绒山羊具有异质的双重被毛,由无髓的绒毛和髓质发达的粗毛组成。山羊绒是毛被下层无髓毛,由次级毛囊生成[14]。初级毛囊不随季节发生周期变化,与初级毛囊相比较,次级毛囊呈现出周期性的季节变化[15]。外根鞘是次级毛囊的主要组成部分,外根鞘细胞可以产生终止生长期的信号并使得毛囊进入退行期[5],对次级毛囊的周期发育起到重要的作用。因此,本研究选择培养绒山羊次级毛囊外根鞘细胞。
外根鞘细胞的培养方法多采用组织法和消化法。二者相比较,组织法的细胞增殖快不易传代;消化法的细胞可以传8~10代[16]。本试验采用消化培养法,选择处于生长期的毛囊,此时的外根鞘最厚。崔正军等[17]通过对比DispaseⅡ和胰酶消化法对大鼠皮肤角朊细胞分离的研究发现,在相同消化时间下,DispaseⅡ消化法可以分离皮肤的表皮和真皮结合处,并获得活力较高的角朊细胞,因此本试验中也采用DispaseⅡ消化皮肤样品。由于试验中需要剥离出带有外根鞘的毛囊,因此在DispaseⅡ的消化时间不需要太长,经优化后皮肤样品剪成厚度0.2 cm左右的长条,DispaseⅡ的消化时间为4.5 h左右;外根鞘细胞属于上皮样细胞,在原代培养时较难贴壁。Aasen等[18]通过在培养皿中铺入Coating Matrix成功培养出了皮肤中的角质细胞,且细胞活性很高,因此本研究中也选择在培养皿中铺一层Coating Matrix,以促进次级毛囊外根鞘细胞很好的贴壁生长。Cui等[19]用无血清培养液(K-SFM)培养外根鞘细胞,且细胞能够稳定健康的生长,而本研究中发现用无血清培养液培养(epilife medium)的细胞虽然可以传代,但细胞形态上会变为梭形且逐渐凋亡,所以选择在培养液中添加血清,存在这样差异的原因可能是所用无血清培养液的成分不同。外根鞘细胞是一种未分化的角质化细胞[18],细胞内表达多种角蛋白,所以在外根鞘细胞的表面存在许多特异性标记,Vidal等[20]发现角蛋白17在外根鞘中特异表达,认为是外根鞘细胞的特异性标记,可用CK17鉴定外根鞘细胞。毛囊外根鞘隆突部是毛囊干细胞的重要储存点[21],角蛋白K15是隆突部毛囊干细胞的特异性标记,在人和小鼠的毛囊隆突部均有高表达[22],经CK15鉴定,发现培养的绒山羊外根鞘细胞中包含有毛囊干细胞。就目前的技术条件而言,分离培养外根鞘细胞的方法存在杂有毛囊干细胞的缺陷,进一步分离可以采用流式细胞仪分离及纯化外根鞘细胞。
3.2 VEGF对次级毛囊外根鞘细胞增殖、分化的影响次级毛囊外根鞘在毛囊周期中的变化:生长期,外根鞘细胞向下迁移与毛乳头结合开启毛囊重建,新的外根鞘出现并增殖变厚;退行期,外根鞘开始凋亡并持续变薄;静止期,外根鞘最薄且形态持续不变[23]。从外根鞘在毛囊周期中的变化可以看出,外根鞘细胞在生长期持续增殖,促进外根鞘细胞增殖的因子有IGF-Ⅰ、HGF、VEGF和TGF-β1[24]。Li等[25]利用q-PCR、WB和免疫组化法研究发现,VEGFR-2受体在人外根鞘细胞中表达;在人外根鞘细胞体外培养液中添加不同浓度VEGF发现,高浓度VEGF可以促进人外根鞘细胞增殖。VEGF对绒山羊次级毛囊外根鞘细胞增殖同样有促进作用。MTT的检测结果显示,VEGF浓度为100 ng·mL-1,处理48 h时,对次级毛囊外根鞘细胞的促进效果极显著高于对照组(P<0.01)。EdU标记检测显示了同样结果:处理48 h时,VEGF浓度为100 ng·mL-1时对细胞增殖的促进效果极显著高于对照组(P<0.01)。PCNA是鉴定体外培养细胞增殖的一个基因,是细胞增殖的特异性标记,且在外根鞘细胞中特异性表达[26]。q-PCR显示PCNA mRNA在VEGF浓度为100 ng·mL-1时表达量最高且极显著高于对照组(P<0.01),说明VEGF对绒山羊次级毛囊外根鞘细胞的增殖具有促进作用。外根鞘细胞是未分化的角质化细胞,当皮肤受损时,外根鞘细胞会向上迁移并分化为上皮细胞[7]。因此,外根鞘是如何分化及影响其分化的分子机制需要深入研究。角蛋白K10是细胞分化的特异性标记,在外根鞘细胞中特异性表达[26]。q-PCR显示,VEGF处理48 h时,K10 mRNA在VEGF浓度为10和100 ng·mL-1时表达量极显著低于对照组(P<0.01),说明VEGF对绒山羊次级毛囊外根鞘细胞的分化具有抑制作用,目前国内有关VEGF影响外根鞘细胞分化分子机理的研究鲜有报道,有待深入研究。
3.3 VEGF对次级毛囊外根鞘细胞中FGF 5基因mRNA表达的影响国内外研究发现,FGF5基因自发突变与人[27]、小鼠[28]、猫[29]、狗[30]等哺乳动物呈现较长毛发的表型相关。Hébert等[31]通过转基因技术构建FGF5基因敲除小鼠,该小鼠也出现类似毛发增长的表型,通过免疫组化及mRNA原位杂交的技术对FGF5 mRNA及蛋白表达进行定位,发现FGF5表达于外根鞘细胞。Yano等[10]通过原位杂交技术发现VEGF mRNA高表达于毛囊生长期中期的外根鞘中;以转基因小鼠为试验模型,过表达毛囊外根鞘中的VEGF,发现相同时间内VEGF转基因小鼠比野生型小鼠的毛发生长快;敲除VEGF基因后发现抑制了毛发的生长。说明VEGF通过作用于毛囊外根鞘促进小鼠毛发的生长。本研究结果显示,随着VEGF浓度的升高,体外培养的毛囊外根鞘细胞中,FGF5 mRNA的表达量呈下降趋势;处理48 h,VEGF浓度为100 ng·mL-1时,次级毛囊外根鞘细胞中FGF5 mRNA的表达量极显著低于对照组(P<0.01),说明VEGF可以抑制FGF5的表达。FGF5基因参与诱导次级毛囊退行期的发生,Housley等[30]通过体外培养人毛囊发现,在培养基中添加FGF5重组蛋白,可诱导毛囊退行期的提前发生。因此,推测VEGF可以通过抑制FGF5的表达促进毛囊生长,而VEGF是如何通过抑制FGF5来促进毛囊生长的相关分子机制需要进一步的研究证实。
4 结论本研究成功分离并培养出陕北白绒山羊次级毛囊外根鞘细胞;VEGF能够促进次级毛囊外根鞘细胞增殖,抑制外根鞘细胞分化;VEGF抑制外根鞘细胞中FGF5基因的表达。
| [1] | SCHNEIDER M R, SCHMIDT-ULLRICH R, PAUS R. The hair follicle as a dynamic miniorgan[J]. Curr Biol, 2009, 19(3): R132–R142. DOI: 10.1016/j.cub.2008.12.005 |
| [2] | MVLLER-RÖVER S, FOITZIK K, PAUS R, et al. A comprehensive guide for the accurate classification of murine hair follicles in distinct hair cycle stages[J]. J Investig Dermatol, 2001, 117(1): 3–15. DOI: 10.1046/j.0022-202x.2001.01377.x |
| [3] | KUMAMOTO T, SHALHEVET D, MATSUE H, et al. Hair follicles serve as local reservoirs of skin mast cell precursors[J]. Blood, 2003, 102(5): 1654–1660. DOI: 10.1182/blood-2003-02-0449 |
| [4] | KRAUSE K, FOITZIK K. Biology of the hair follicle:The basics[J]. Semin Cutan Med Surg, 2006, 25(1): 2–10. DOI: 10.1016/j.sder.2006.01.002 |
| [5] | PENA J C, KELEKAR A, FUCHS E V, et al. Manipulation of outer root sheath cell survival perturbs the hair-growth cycle[J]. EMBO J, 1999, 18(13): 3596–3603. DOI: 10.1093/emboj/18.13.3596 |
| [6] | PAUS R, COTSARELIS G. The biology of hair follicles[J]. New Engl J Med, 1999, 341(7): 491–497. DOI: 10.1056/NEJM199908123410706 |
| [7] | LENOIR M C, BERNARD B A, PAUTRAT G, et al. Outer root sheath cells of human hair follicle are able to regenerate a fully differentiated epidermis in vitro[J]. Dev Biol, 1988, 130(2): 610–620. DOI: 10.1016/0012-1606(88)90356-9 |
| [8] |
李京佳, 林相国, 许涛, 等. VEGF家族及其在肿瘤生长中作用的研究[J]. 现代生物医学进展, 2012, 12(4): 777–779, 701.
LI J J, LIN X G, XU T, et al. VEGF and the role of VEGF in tumor growth[J]. Progress in Modern Biomedicine, 2012, 12(4): 777–779, 701. (in Chinese) |
| [9] |
蔡源源. 血管内皮生长因子的调控及其作用研究进展[J]. 组织工程与重建外科杂志, 2011, 7(1): 51–54.
CAI Y Y. Advances in the regulation and role of VEGF[J]. Journal of Tissue Engineering and Reconstructive Surgery, 2011, 7(1): 51–54. (in Chinese) |
| [10] | YANO K, BROWN L F, DETMAR M. Control of hair growth and follicle size by VEGF-mediated angiogenesis[J]. J Clin Investig, 2001, 107(4): 409–417. DOI: 10.1172/JCI11317 |
| [11] | WU X J, ZHU J W, JING J, et al. VEGF165 modulates proliferation, adhesion, migration and differentiation of cultured human outer root sheath cells from central hair follicle epithelium through VEGFR-2 activation in vitro[J]. J Dermatol Sci, 2014, 73(2): 152–160. DOI: 10.1016/j.jdermsci.2013.10.002 |
| [12] |
袁超. 绒山羊次级毛囊周期性变化相关microRNA的鉴定及miR-125b在毛乳头细胞中的功能研究[D]. 杨凌: 西北农林科技大学, 2014.
YUAN C. Identification of microRNAs in secondary hair follicle cycling and functional analysis of miR-125b in dermal papilla cells of cashmere goats[D]. Yangling: Northwest A&F University, 2014. (in Chinese) |
| [13] |
周英昊, 高晔, 刘林丽, 等. 山羊y+L碱性氨基酸转运系统转录水平表达的研究[J]. 畜牧兽医学报, 2015, 46(8): 1308–1316.
ZHOU Y H, GAO Y, LIU L L, et al. Study on transcriptional level of y+L cationic amino acid transporter system in goat[J]. Acta Veterinaria et Zootechnica Sinica, 2015, 46(8): 1308–1316. (in Chinese) |
| [14] |
王丽, 彭丽琴, 张文彬, 等. 内蒙古白绒山羊皮肤毛囊发生发育规律的研究[J]. 畜牧兽医学报, 1996, 27(6): 524–530.
WANG L, PENG L Q, ZHANG W B, et al. Initiation and development of skin follicles in the inner mongolian cashmere goat[J]. Acta Veterinaria et Zootechnica Sinica, 1996, 27(6): 524–530. (in Chinese) |
| [15] |
刘志红, 任立明, 郭英, 等. 毛囊的周期性变化和分子调控及其在绒山羊上的研究进展[J]. 中国畜牧兽医, 2009, 36(4): 103–107.
LIU Z H, REN L M, GUO Y, et al. The cyclical variation and regulation of hair follicles and the study on cashmere goat[J]. China Animal Husbandry & Veterinary Medicine, 2009, 36(4): 103–107. (in Chinese) |
| [16] |
唐建兵, 李勤, 陈璧, 等. 两种人毛囊外根鞘细胞培养方法的比较[J]. 广东医学, 2005, 26(1): 44–46.
TANG J B, LI Q, CHEN B, et al. A comparison of two different methods for the culture of human hari follicle outer root sheath cells[J]. Guangdong Medical Journal, 2005, 26(1): 44–46. (in Chinese) |
| [17] |
崔正军, 陈壁, 汤朝武, 等. Dispase Ⅱ和胰酶消化法分离大鼠皮肤角朊细胞的对比研究[J]. 第四军医大学学报, 1998, 19(3): 349–350.
CUI Z J, CHEN B, TANG C W, et al. Comparative study of rat skin keratinocytes isolated Dispase Ⅱ and trypsin digestion[J]. Journal of the Fourth Military Medical University, 1998, 19(3): 349–350. (in Chinese) |
| [18] | AASEN T, BELMONTE J C I. Isolation and cultivation of human keratinocytes from skin or plucked hair for the generation of induced pluripotent stem cells[J]. Nat Protoc, 2010, 5(2): 371–382. DOI: 10.1038/nprot.2009.241 |
| [19] | CUI Z F, HU Y X, WANG H, et al. Establishment and characterization of outer root sheath (ORS) cell line from Jining grey goat[J]. Biotechnol Lett, 2012, 34(3): 433–440. DOI: 10.1007/s10529-011-0799-x |
| [20] | VIDAL V P I, CHABOISSIER M C, LVTZKENDORF S, et al. Sox9 is essential for outer root sheath differentiation and the formation of the hair stem cell compartment[J]. Curr Biol, 2005, 15(15): 1340–1351. DOI: 10.1016/j.cub.2005.06.064 |
| [21] | OHYAMA M, TERUNUMA A, TOCK C L, et al. Characterization and isolation of stem cell-enriched human hair follicle bulge cells[J]. J Clin Invest, 2006, 116(1): 249–260. |
| [22] | HSU C K, YANG C C, SHIEH S J. Skin stem cells and their roles in skin regeneration and disorders[M]//WARBURTON D. Stem cells, Tissue engineering and regenerative medicine. New Jersey: World Scientific Publishin, 2014: 125. |
| [23] |
李玉荣, 范文斌, 李长青, 等. 内蒙古绒山羊次级毛囊组织形态周期性变化研究[J]. 中国农业科学, 2008, 41(11): 3920–3926.
LI Y R, FAN W B, LI C Q, et al. Histomotphology research of the secondary follicle cycling of Inner Mongolia cashmere goat[J]. Scientia Agricultura Sinica, 2008, 41(11): 3920–3926. DOI: 10.3864/j.issn.0578-1752.2008.11.065 (in Chinese) |
| [24] | FUJIE T, KATOH S, OURA H, et al. The chemotactic effect of a dermal papilla cell-derived factor on outer root sheath cells[J]. J Dermatol Sci, 2001, 25(3): 206–212. DOI: 10.1016/S0923-1811(00)00130-4 |
| [25] | LI W, LU Z F, MAN X Y, et al. VEGF upregulates VEGF receptor-2 on human outer root sheath cells and stimulates proliferation through ERK pathway[J]. Mol Biol Rep, 2012, 39(9): 8687–8694. DOI: 10.1007/s11033-012-1725-6 |
| [26] | COMPOSTO G, KIM S, HECK D, et al. Nitrogen mustard induces DNA damage and structural changes in mouse skin hair follicles[J]. FASEB J, 2015, 29(S1): 766.7. |
| [27] | OTA Y, SAITOH Y, SUZUKI S, et al. Fibroblast growth factor 5 inhibits hair growth by blocking dermal papilla cell activation[J]. Biochem Biophys Res Commun, 2002, 290(1): 169–176. DOI: 10.1006/bbrc.2001.6140 |
| [28] | SUZUKI S, KATO T, TAKIMOTO H, et al. Localization of rat FGF-5 protein in skin macrophage-like cells and FGF-5S protein in hair follicle:Possible involvement of two Fgf-5 gene products in hair growth cycle regulation[J]. J Investig Dermatol, 1998, 111(6): 963–972. DOI: 10.1046/j.1523-1747.1998.00427.x |
| [29] | DRÖGEMÜLLER C, RÜFENACHT S, WICHERT B, et al. Mutations within the FGF5 gene are associated with hair length in cats[J]. Anim Genet, 2007, 38(3): 218–221. DOI: 10.1111/age.2007.38.issue-3 |
| [30] | HOUSLEY D J, VENTA P J. The long and the short of it:Evidence that FGF5 is a major determinant of canine 'hair'-itability[J]. Anim Genet, 2006, 37(4): 309–315. DOI: 10.1111/age.2006.37.issue-4 |
| [31] | HÉBERT J M, ROSENQUIST T, GÖTZ J, et al. FGF5 as a regulator of the hair growth cycle:Evidence from targeted and spontaneous mutations[J]. Cell, 1994, 78(6): 1017–1025. DOI: 10.1016/0092-8674(94)90276-3 |



