禽沙门菌病是一类重要的禽传染病,可以造成幼雏大量死亡、产蛋鸡产蛋下降、种蛋孵化率、出雏率下降,弱雏率增加,该病具有水平传播和垂直传播的特性。该类病分为三种类型:鸡白痢、禽伤寒、禽副伤寒,对应的病原分别为鸡白痢沙门菌、鸡伤寒沙门菌,以及鸡白痢沙门菌与鸡伤寒沙门菌之外的其他沙门菌[1]。其中鸡白痢沙门菌和禽伤寒沙门菌有宿主特异性,主要感染禽类,而禽副伤寒沙门菌能广泛感染各种动物和人,引起食物中毒。沙门菌的多重耐药性问题也日益突出, 既困扰着畜牧业的发展也威胁到了人类的公共卫生健康[2]。我国对禽沙门菌病非常重视,将其列为16种优先防治的动物疫病之一。《国家中长期动物疫病防治规划(2012~2020年)》提出,2015年全国祖代以上种鸡场的鸡白痢沙门菌病达到净化标准,2020年全国所有种鸡场的鸡白痢沙门菌病达到净化标准。
三黄鸡是我国最著名的土鸡之一。从20世纪80年代开始,河南省郑州地区新郑市及其周边地区发展为三黄鸡北繁南养的集中区,并逐步转为商品代三黄鸡苗供应基地。2014年11月—2015年1月,选择郑州及许昌地区有代表性的四个父母代三黄种鸡场,在其自带孵化场采集孵化后期死胚样品进行沙门菌的分离鉴定,并对其耐药表型及相关耐药基因进行检测,以了解死亡鸡胚中沙门菌的感染状况,初步掌握鸡胚源沙门菌的耐药情况,为该病的综合防控乃至净化提供参考。
1 材料与方法 1.1 主要试剂和标准菌株大肠杆菌ATCC25922,鸡白痢标准株C79-13由扬州大学人兽共患病学江苏省重点实验室惠赠。2×Taq Master Mix、DNA Marker DL2000均购自南京诺唯赞生物科技有限公司;普通营养肉汤、营养琼脂、SS琼脂均购自北京奥博星有限责任公司;沙门菌属诊断血清购自宁波天润生物药业有限公司;麦氏比浊管购自广东环凯微生物科技有限公司;MH琼脂购自英国Oxoid公司;所用引物由生工生物工程(上海)股份有限公司合成。
1.2 药敏纸片试验用药敏纸片卡那霉素(K,30 μg·片-1,CT0026B)、庆大霉素(CN,10 μg·片-1,CT0024B)、阿米卡星(AK,30 μg·片-1,CT0107B),氨苄西林(AMP,10 μg·片-1,CT0003B),阿莫西林-克拉维酸(AMC,30 μg·片-1,CT0223B),头孢他啶(CAZ,30 μg·片-1,CT0412B)、头孢曲松(CRO,30 μg·片-1,CT0417B)、头孢唑林(KZ,30 μg·片-1,CT0011B),美罗培南(MEM,10 μg·片-1,CT0774B)、亚胺培南(IPM,10 μg·片-1,CT0455B),氨曲南(ATM,30 μg·片-1,CT0264B),四环素(TE,30 μg·片-1,CT0054B)、土霉素(OT,30 μg·片-1,CT0041B),多黏菌素E (CT,10 μg·片-1,CT0017B),氯霉素(C,30 μg·片-1,CT0013B),恩诺沙星(ENR,5 μg·片-1,CT0639B)、环丙沙星(CIP,5 μg·片-1,CT0425B),磺胺甲噁唑/甲氧苄啶(19:1)(SXT,25 μg·片-1,CT0052B)、磺胺异噁唑(SF,300 μg·片-1,CT0075B),呋喃妥因(F,300 μg·片-1,CT0036B)购自英国Oxoid公司;头孢噻肟(CTX,30 μg·片-1,21027)、头孢噻肟/克拉维酸(3:1)(CTX/CA,30/10 μg·片-1,21092)、头孢他啶(CAZ,30 μg·片-1,21028)、头孢他啶/克拉维酸(3:1) (CAZ/CA,30/10 μg·片-1,21091)均购自北京天坛药物生物技术开发公司。
1.3 主要仪器立式压力蒸汽灭菌器购自上海申安医疗器械厂,恒温空气浴摇床购自赛默飞世尔科技有限公司,梯度PCR仪购自Biometra公司,凝胶电泳成像分析系统购自BIO-RAD公司。
1.4 样品的采集在河南省郑州地区及许昌地区共选取4个父母代三黄种鸡场(存栏量均在5万套以上,标记为郑州一场、郑州二场、郑州三场、许昌一场),在其自带孵化场随机抽样法采集同一批次孵化后期死胚样品360份,除去破损、变质等不适于试验的,剩余356份,采样时确保采集的每枚死胚来源于不同个体的种鸡,增加了样品的代表性。
1.5 细菌的分离、鉴定与血清分型将死胚体表消毒后无菌采集卵黄液按常规方法分离沙门菌。参考文献[3]合成沙门菌肠毒素Stn基因引物,进行PCR初步鉴定,用全自动细菌鉴定系统进一步鉴定。采用玻片凝集法进行血清分型,根据Kauffmann-White抗原表[4]检索沙门菌分离株的血清型。
1.6 药敏试验及ESBLs确证试验按照K-B法和美国临床实验室标准化协会(Clinical Laboratory Standards Institute,CLSI)手册[5]进行抗菌药物的敏感性试验和ESBLs阳性菌的筛选及确证试验。以E. coli (ATCC25922)为质控菌株,试验结果按照手册[5]要求进行判读。
1.7 耐药基因的检测根据耐药表型不同,扩增相应的37种耐药基因。引物设计参考相关文献,具体如下:超广谱β-内酰胺酶类(Extended-Spectrum Beta-Lactamases,ESBLs)12种:TEM[6]、SHV[6]、CTX-M-1[6]、CTX-M-2[7]、CTX-M-3[8]、CTX-M-8[9]、CTX-M-9[10]、CTX-M-25[9]、OXA-1[8]、OXA-2[8]、OXA-10[8]、PSE[8]、氨基糖苷类10种:armA[11]、rmtA[11]、rmtB[11]、rmtC[11]、rmtD[11]、rmtE[11]、npmA[12]、aac(3)-Ⅳ[13]、aac6′-Ib[14]、aadA1-like[13];头孢菌素类6种:MOX[15]、CIT[15]、DHA[15]、ACC[15]、EBC[15]、FOX[15];磺胺类3种:sul1[16]、sul2[16]、sul3[16];四环素类6种:tet A[16]、tet G[16]、tet X[16]以及tet B、tet C、tet R,后三种引物序列自行设计,退火温度均为55 ℃,序列如下,tet B 正向引物5′-AAATAACAGCAAACAGTAATGG-3′, 反向引物5′-AAGTAGGGGTTGAGACGCAGCTA-3′,扩增片段长度493 bp;tet C正向引物5′-TCTAACAATGCGCTCATCGT-3′,反向引物5′-GGTTGAAGGCTCTCAAGGGC-3′,扩增片段长度589 bp;tet R正向引物5′-AGGACGACGGTGCTTGCT-3′,反向引物5′-ATGAGGACTGGCGGGTGT-3′,PCR扩增后随机选取扩增产物进行测序和序列比较。
2 结果 2.1 细菌分离鉴定共分离到173株沙门菌,包括5种血清型,分别为鸡白痢沙门菌(162株)、布利丹沙门菌(5株)、塞罗沙门菌(4株)、肠炎沙门菌(1株),菲尔摩雷沙门菌(1株)。不同场沙门菌的分离率差异较大,详见表 1。
|
|
表 1 不同来源死胚样品沙门菌的分离结果 Table 1 Isolation of Salmonella from different sources dead embryos |
由表 2可以看出,173株沙门菌总体上对磺胺异噁唑(82.1%)、氨苄西林(74.0%)、四环素(49.1%)、土霉素(48.6%)耐药较严重。对于氨苄西林,郑州一场(0)、郑州二场(2.9%)分离菌株几乎全为敏感,而郑州三场分离的94株沙门菌耐药率高达100%。对于四环素、土霉素,许昌一场分离菌株的耐药率分别仅为5.1%和7.7%,远低于其他3个场。经双纸片协同法进行ESBLs初筛和确证试验,有1株菲尔摩雷沙门菌(编号14-2)为ESBLs阳性。
|
|
表 2 173株沙门菌药敏试验结果 Table 2 Drug sensitivity test of 173 Salmonella strains |
由表 3可知,呈现5重和6重耐药的菌株各有1株,呈现4重耐药的菌株有15株,有75株菌株(43.4%)呈现多重耐药(耐三类或三类以上药物)。其中耐药谱为青霉素类-四环素类-磺胺类的菌株数量最多,有53株细菌。
|
|
表 3 173株沙门菌的耐药谱 Table 3 Drug resistance of 173 Salmonella isolates |
共检测出13种耐药基因。本次分离的1株ESBLs阳性菌株共检测出TEM、CTX-M-3 2种耐药基因;2株耐氨基糖苷类的菌株共检出aac(3)-Ⅳ、aac6′-Ib、aadA1-like 3种耐药基因;19株耐头孢类的菌株共检出MOX、ACC、DHA 3种耐药基因;143株耐磺胺类的菌株共检出sul1、sul2、sul3 3种耐药基因;84株耐四环素类的菌株共检出tet A、tet R 2种耐药基因;耐药基因检出率详见图 1。
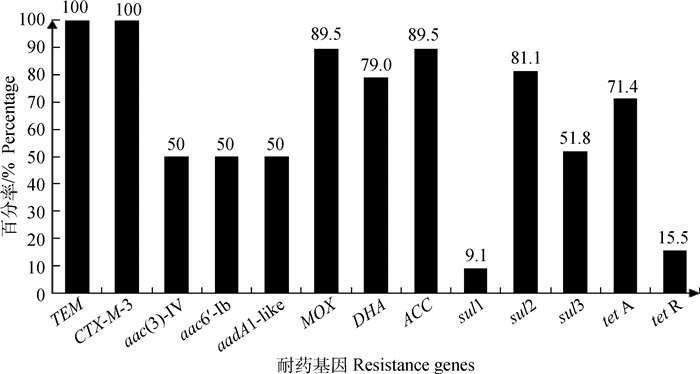
|
图 1 13种耐药基因的检出情况 Figure 1 Detection results of 13 resistance genes |
本研究中五类抗菌药物的耐药表型和基因型的符合率均在72%以上,其中ESBLs类、氨基糖苷类、头孢类的耐药表型与基因型符合率为100%,详见表 4。
|
|
表 4 沙门菌耐药基因型的分析结果 Table 4 Results of Salmonella isolates antimicrobial resistant genotype |
从356份三黄鸡商品代死胚中分离到173株沙门菌,平均分离率为48.6%。郑州一场分离率最低,为8.6%,郑州二场、郑州三场、许昌一场分离率分别为58.3%、79.7%、32.5%,比张莒等[17]报道的分离率(16.7%)和张丽芳等[18]报道的分离率(15.4%)高。由于本研究是以死胚而不是正常种蛋作为样品,实际生产中携带沙门菌的种蛋比例应低于本结果。
仅从鸡白痢沙门菌的分离情况比较,郑州一场最低,为5.2%,郑州二场、郑州三场、许昌一场分别为55.0%、78.8%、27.5%。经了解,郑州一场曾进行过鸡白痢净化,其他场则没有净化,表明检疫净化对鸡白痢控制效果显著。
本次调查以鸡白痢沙门菌(93.6%,162/173)为优势血清型。其他研究者报道[19-21](不显示鸡的品种)从河南省的发病鸡采集病料或肉鸡肛拭子和环境样品分离沙门菌,以肠炎沙门菌为优势血清型,与本研究结果不完全一致。分析可能是沙门菌血清型的分布与鸡的种源、鸡场环境、饲料、鼠类及其他媒介生物携带沙门菌等生物安全措施有关。本次分离到11株副伤寒沙门菌(6.36%,11/173),副伤寒沙门菌能通过种鸡群垂直传播扩散,对鸡群健康和食品安全带来潜在威胁,需引起关注。
本次所分离的173株沙门菌对卡那霉素、庆大霉素、阿米卡星、阿莫西林-克拉维酸、头孢曲松、头孢他啶、氨曲南、呋喃妥因耐药率较低,可能是生产中较少使用该类药物所致。分离菌株对兽医禁用的美罗培南、亚胺培南、氯霉素敏感,说明加强兽药管理可以有效降低细菌的耐药性。本次研究中磺胺异噁唑的耐药率达到82.1%,而磺胺甲噁唑/甲氧苄啶耐药率仅为8.1%,这可能反映出临床上的药物使用习惯,即在使用磺胺类药物时一般都不使用增效剂[22]。氨苄西林极易产生耐药性,四个场分离的菌株对氨苄西林耐药率差异显著;对于四环素、土霉素,郑州一场、二场、三场分离菌株耐药率远高于许昌一场;本次所有分离菌株对氟喹诺酮类药物恩诺沙星、环丙沙星均为敏感,与其他报道[22-24]不完全一致,可能与养殖场的用药习惯有关。本次分离菌株对磺胺异噁唑、氨苄西林、四环素及土霉素耐药率较高,这些药物长期以来被广泛用于我国的畜禽养殖中,药物的选择压力使细菌产生了相当高的耐药性,临床上应减少使用。
本研究中耐四环素类的84株沙门菌共检出tet A (71.4%)、tet R(15.5%)两种耐药基因,tet A检出率与朱顺等[22]的报道(72.55%)基本一致,与赖海梅等[25]的报道(40.54%)及廖成水等[26]的报道(7.55%)不一致。对耐磺胺类的143株沙门菌,sul1(9.1%)、sul2(81.1%)、sul3(51.8%)的检出率与朱顺等[22]的报道(60.78%,78.43%,35.29%)和廖成水等[26]的报道(58.7%,41.3%,21.74%)有所差异。表明在沙门菌对抗菌药物产生耐药性过程中不同耐药基因的参与程度存在差异。本研究中沙门菌的耐药基因与耐药表型的符合率大于72%,表明耐药基因广泛存在于耐药菌株中。另外,少部分具有耐药表型的菌株没有检测到本文所列的耐药基因,表明耐药机制较为复杂,有待于进一步研究。许多耐药基因可在动物和人类病原菌间水平传播。了解该地区流行株耐药基因流行规律,对防控沙门菌病具有重要意义。
4 结论河南省三黄鸡父母代群沙门菌的感染较为严重,以鸡白痢沙门菌感染为主,也有少部分副伤寒沙门菌的感染。沙门菌多重耐药严重,且耐药基因普遍存在于耐药菌株中。
| [1] |
陈溥言.
兽医传染病学[M]. 6版. 北京: 中国农业出版社, 2015.
CHEN P Y. Veterinary epidemiology[M]. 6th ed. Beijing: China Agriculture Press, 2015. (in Chinese) |
| [2] | HUT J, JAWALE C, LEE J H. Antimicrobial resistance of Salmonella isolated from food animals: A review[J]. Food Res Int, 2012, 45(2): 819–830. DOI: 10.1016/j.foodres.2011.05.014 |
| [3] |
刘蓓蓓. 沙门菌PCR检测方法的建立及其初步应用[D]. 扬州: 扬州大学, 2009.
LIU B B. Development and preliminary application of a PCR assay for the detection of Salmonella spp. [D]. Yangzhou: Yangzhou University, 2009. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-11117-2009193024.htm |
| [4] |
朱超, 许学斌.
沙门菌属血清型诊断[M]. 上海: 同济大学出版社, 2009.
ZHU C, XU X B. Serological diagnosis of Salmonella-species[M]. Shanghai: Tongji University Press, 2009. (in Chinese) |
| [5] | Clinical and Laboratory Standards Institute (CLSI). M100-S25 Performance standards for antimicrobial susceptibility testing; 25th informational supplement[S]. Wayne, PA: CLSI, 2015. |
| [6] | GONZÁLEZ-SANZ R, HERRERA-LEÓN S, DE LA FUENTE M, et al. Emergence of extended-spectrum β-lactamases and AmpC-type β-lactamases in human Salmonella isolated in Spain from 2001 to 2005[J]. J Antimicrob Chemother, 2009, 64(6): 1181–1186. DOI: 10.1093/jac/dkp361 |
| [7] | DE OLIVEIRA GARCIA D, DOI Y, SZABO D, et al. Multiclonal outbreak of Klebsiella pneumoniae producing extended-spectrum β-lactamase CTX-M-2 and novel variant CTX-M-59 in a neonatal intensive care unit in Brazil[J]. Antimicrob Agents Chemother, 2008, 52(5): 1790–1793. DOI: 10.1128/AAC.01440-07 |
| [8] | RIAÑO I, MORENO M A, TESHAGER T, et al. Detection and characterization of extended-spectrum β-lactamases in Salmonella enterica strains of healthy food animals in Spain[J]. J Antimicrob Chemother, 2006, 58(4): 844–847. DOI: 10.1093/jac/dkl337 |
| [9] | ELLER C, SIMON S, MILLER T, et al. Presence of β-lactamases in Extended-spectrum-cephalosporin-resistant Salmonella enterica of 30 different serovars in Germany 2005-11[J]. J Antimicrob Chemother, 2013, 68(9): 1978–1981. DOI: 10.1093/jac/dkt163 |
| [10] | COQUE T M, OLIVER A, PÉREZ-DÍAZ J C, et al. Genes encoding TEM-4, SHV-2, and CTX-M-10 Extended-Spectrum β-lactamases are carried by multiple Klebsiella pneumoniae clones in a single hospital (Madrid, 1989 to 2000)[J]. Antimicrob Agents Chemother, 2002, 46(2): 500–510. DOI: 10.1128/AAC.46.2.500-510.2002 |
| [11] | GRANIER S A, HIDALGO L, SAN MILLAN A, et al. ArmA methyltransferase in a monophasic Salmonella enterica isolate from food[J]. Antimicrob Agents Chemother, 2011, 55(11): 5262–5266. DOI: 10.1128/AAC.00308-11 |
| [12] | FRITSCHE T R, CASTANHEIRA M, MILLER G H, et al. Detection of methyltransferases conferring high-level resistance to aminoglycosides in enterobacteriaceae from Europe, North America, and Latin America[J]. Antimicrob Agents Chemother, 2008, 52(5): 1843–1845. DOI: 10.1128/AAC.01477-07 |
| [13] | GUERRA B, JUNKER E, MIKO A, et al. Characterization and localization of drug resistance determinants in multidrug-Resistant, integron-carrying Salmonella enterica serotype typhimurium strains[J]. Microb Drug Resist, 2004, 10(2): 83–91. DOI: 10.1089/1076629041310136 |
| [14] | DE TORO M, ROJO-BEZARES B, VINUÉ L, et al. In vivo selection of aac(6′)-Ib-cr and mutations in the gyrA gene in a clinical qnrS1-positive Salmonella enterica serovar Typhimurium DT104B strain recovered after fluoroquinolone treatment[J]. J Antimicrob Chemother, 2010, 65(9): 1945–1949. DOI: 10.1093/jac/dkq262 |
| [15] | PÉREZ-PÉREZ F J, HANSON N D. Detection of plasmid-mediated AmpC β-lactamase genes in clinical isolates by using multiplex PCR[J]. J Clin Microbiol, 2002, 40(6): 2153–2162. DOI: 10.1128/JCM.40.6.2153-2162.2002 |
| [16] |
孙璐, 王娟, 黄秀梅, 等. 肉鸡屠宰生产链中的沙门氏菌耐药基因检测及耐药相关性分析[J]. 中国动物检疫, 2017, 34(1): 35–39, 42.
SUN L, WANG J, HUANG X M, et al. Drug-resistant gene detection of salmonella in broiler slaughtering production chain and correlation analysis on drug resistance[J]. China Animal Health Inspection, 2017, 34(1): 35–39, 42. (in Chinese) |
| [17] |
张莒, 蒲琪, 赵瑾, 等. 藏鸡和彭县黄鸡鸡胚、弱雏中沙门氏菌的分离鉴定与耐药性分析[J]. 四川农业大学学报, 2016, 34(3): 354–358.
ZHANG J, PU Q, ZHAO J, et al. Isolation and identification of Salmonella and analysis of antimicrobial susceptibility in chicken embryo and weak chicken from Tibet and Pengxian[J]. Journal of Sichuan Agricultural University, 2016, 34(3): 354–358. (in Chinese) |
| [18] |
张丽芳, 肖桥, 罗薇. 成都某种禽场鸡胚沙门氏菌的检测[J]. 中国畜牧兽医, 2015, 42(6): 1571–1579.
ZHANG L F, XIAO Q, LUO W. Detection of Salmonella in chicken embryos in a breeding poultry field of Chengdu[J]. China Animal Husbandry & Veterinary Medicine, 2015, 42(6): 1571–1579. (in Chinese) |
| [19] |
廖成水, 程相朝, 吴庭才, 等. 河南省鸡源沙门菌新近流行株的分离鉴定及其耐药性分析[J]. 中国家禽, 2010, 32(17): 31–35.
LIAO C S, CHENG X C, WU T C, et al. Isolation, identification and antimicrobial resistance analysis of recently isolates of Salmonella from chickens in Henan[J]. China Poultry, 2010, 32(17): 31–35. (in Chinese) |
| [20] |
崔莹, 李艳芬, 张秀丽, 等. 2013年河南省肉鸡产业链中沙门菌污染状况调查[J]. 中国卫生检验杂志, 2014, 24(20): 3000–3003, 3009.
CUI Y, LI Y F, ZHANG X L, et al. A survey on salmonella contamination in meat chicken industry chain in Henan province in 2013[J]. Chinese Journal of Health Laboratory Technology, 2014, 24(20): 3000–3003, 3009. (in Chinese) |
| [21] |
白莉, 张秀丽, 甘辛, 等. 肉鸡养殖场中环丙沙星和头孢噻肟双重耐药沙门菌耐药机制的研究[J]. 中国食品卫生杂志, 2015, 27(5): 487–494.
BAI L, ZHANG X L, GAN X, et al. Molecular characteristics of ciprofloxacin and cefotaxime co-resistant Salmonella isolates in broiler flocks[J]. Chinese Journal of Food Hygiene, 2015, 27(5): 487–494. (in Chinese) |
| [22] |
朱顺, 彭忠, 王帅, 等. 我国部分地区猪沙门菌的耐药性[J]. 中国兽医学报, 2017, 37(7): 1283–1287.
ZHU S, PENG Z, WANG S, et al. Antimicrobial resistance of pig originated Salmonellae isolates[J]. Chinese Journal of Veterinary Science, 2017, 37(7): 1283–1287. (in Chinese) |
| [23] |
查华, 石火英, 吉贞颖, 等. 2010~2012年苏皖两省鸡白痢沙门菌的分离鉴定及耐药性分析[J]. 中国家禽, 2013, 35(4): 17–20.
ZHA H, SHI H Y, JI Z Y, et al. Characterization and antimicrobial resistance analysis of Salmonella pullorum isolates from Jiangsu and Anhui Province from 2010 to 2012[J]. China Poultry, 2013, 35(4): 17–20. (in Chinese) |
| [24] |
査华, 石火英, 尚竟, 等. 江苏安徽地区鹅源沙门菌的分离鉴定及耐药性分析[J]. 中国兽医杂志, 2014, 50(3): 63–65.
ZHA H, SHI H Y, SHANG J, et al. Characterization and antimicrobial resistance analysis of goose source Salmonella isolates from Jiangsu and Anhui Province[J]. Chinese Journal of Veterinary Medicine, 2014, 50(3): 63–65. (in Chinese) |
| [25] |
赖海梅, 邹立扣, 刘书亮, 等. 肉鸡屠宰生产链中沙门氏菌耐药基因检测与耐药相关性分析[J]. 食品工业科技, 2015, 36(7): 187–191.
LAI H M, ZOU L K, LIU S L, et al. Drug resistance gene detection and the resistance correlation analysis in Salmonella isolated from broiler slaughterhouse production chain[J]. Science and Technology of Food Industry, 2015, 36(7): 187–191. (in Chinese) |
| [26] |
廖成水, 程相朝, 张春杰, 等. 鸡源致病性沙门氏菌新近分离株的耐药性与耐药基因[J]. 中国兽医科学, 2011, 41(7): 751–755.
LIAO C S, CHENG X C, ZHANG C J, et al. Antimicrobial resistance and resistance genes of pathogenic Salmonella recently isolated from chicken[J]. Chinese Veterinary Science, 2011, 41(7): 751–755. (in Chinese) |



