金黄色葡萄球菌(Staphylococcus aureus)是一种重要的人畜共患病病原菌,广泛存在于动物和人的呼吸道、消化道、体表等部位。金黄色葡萄球菌有多种感染途径,不同感染途径导致的临床症状也不同。在兽医临床上常造成乳房炎、关节炎、脐炎、局部脓肿等疾病;也可引起人的皮肤化脓和败血症,其产生的肠毒素是造成人类食物中毒的一大元凶[1]。自1961年K. R. Eriksen[2]检出第一株耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus,MRSA)开始,关于金黄色葡萄球菌对各种抗菌药物耐药的报道越来越频繁,至今已经发现耐环丙沙星、红霉素、庆大霉素、四环素、万古霉素等的耐药菌株[3-4],特别是多重耐药现象越来越严重[5],由此造成的一系列公共卫生问题已成为全世界关注的焦点之一。
超广谱β-内酰胺酶(extended-spectrum β-lactamases,ESBLs)是一种能够水解青霉素,第一、第二、第三代和部分第四代头孢菌素类抗生素和氨曲南,其活性又能够被β-内酰胺酶抑制剂(如克拉维酸)抑制的酶类。多种ESBL基因编码的蛋白均具有ESBLs活性。除TEM-12由染色体介导外,其余ESBL基因由质粒介导。目前世界各地发现的ESBL基因已经超过200种[6]。ESBL基因常常存在于革兰阴性菌,如大肠杆菌和克雷伯菌,目前尚未见金黄色葡萄球菌携带ESBL基因的报道。
本研究分离了重庆市部分养殖场中的金黄色葡萄球菌,测定了其对多种药物的耐药性,并检测了菌株中是否携带ESBL基因,为了解重庆市动物源性金黄色葡萄球菌的耐药情况提供了基础数据。
1 材料与方法 1.1 材料 1.1.1 菌株金黄色葡萄球菌菌株ATCC 25923和分离菌株由本实验室保存。
1.1.2 主要试剂甘露醇氯化钠培养基、Mueller-Hinton液体培养基购自杭州微生物试剂有限公司,溶菌酶购自BBI生命科学有限公司,溶葡菌素购自Biosharp公司,PrimeSTAR®Max DNA Polymerase购自宝生物工程(大连)有限公司,质粒提取试剂盒购自Omega公司。
1.1.3 药敏试纸片24种抗生素药敏纸片购自杭州微生物试剂有限公司。
1.2 方法 1.2.1 样品采集和处理 1.2.1.1 样品采集所有样品于2014.03-2017.12采集于重庆市的部分牛、鸡、山羊、猪和兔养殖场。采集的所有样品均置于有冰袋的泡沫箱中,6 h之内运回实验室进行处理。共采集样品1 371份。
1.2.1.2 样品处理样品经增菌后,将菌液或脓汁划线接种于甘露醇氯化钠平板,37 ℃培养20 h后置于4 ℃ 3~4 d。每个平板挑取3~5个浅黄色、黄色或橙色疑似金黄色葡萄球菌菌落划线于LB平板,37 ℃培养20 h。挑取单个菌落,革兰染色,观察细菌形态。
1.2.2 临床菌株的PCR检测 1.2.2.1 引物设计与合成根据GenBank中公布的金黄色葡萄球菌nuc基因序列,用Primer Premier 5.0设计特异性引物nuc-F:5′-AGGGATGGCTATCAGTAATGTTTC-3′和nuc-R:5′-CATCAGCATAAATATACGCTAAGCCAC-3′。引物由英潍捷基(上海)贸易有限公司合成。
1.2.2.2 分离菌株的PCR鉴定水煮法提取菌液DNA,随后进行PCR扩增。反应体系:2×Taq Master Mix 10 μL,nuc-F(10 μmol·L-1)0.5 μL,nuc-R(10 μmol·L-1)0.5 μL,模板DNA 0.5 μL,ddH2O 8.5 μL,总反应体系20 μL。反应条件:94 ℃预变性5 min;94 ℃变性20 s,58 ℃退火20 s,72 ℃延伸30 s,共30个循环;最后72 ℃延伸6 min。经1.5%琼脂糖凝胶电泳,凝胶成像系统观察结果。以金黄色葡萄球菌ATCC 25923作为阳性对照。
1.2.3 药物敏感性试验根据美国临床和实验室标准协会(CLSI)抗菌药物敏感性试验标准,采用K-B纸片法对金黄色葡萄球菌临床分离株进行药物敏感性试验。以金黄色葡萄球菌ATCC25923作为质控菌株。
1.2.4 金黄色葡萄球菌ESBL基因检测 1.2.4.1 质粒的提取取4 mL菌液,12 000 r·min-1室温离心1 min,弃上清,加入250 μL solution Ⅰ重悬后加入终质量浓度为5 μg·mL-1的溶葡菌素和10 μg·mL-1的溶菌酶,37 ℃反应至液体澄清后,按照试剂盒说明书提取质粒。
1.2.4.2 ESBL基因的PCR扩增以提取的质粒为模板,使用PrimeSTAR®Max DNA Polymerase PCR扩增8个ESBL基因,包括blaTEM[7]F-5′- TCCGCTCATGAGACAATAACC -3′, R-5′-TTGGTCTGACAGTTACCAATGC-3′,退火温度55 ℃、blaCTX-M[7]F-5′-TCTTCCAGAATAAGGAATCCC -3′,R-5′-CCGT-TTCCGCTATTACAAAC -3′,退火温度50 ℃、blaSHV[8]F-5′- TGGTTATGCGTTATATTCGCC -3′,R-5′-GGTTA-GCGTTGCCAGTGCT-3′,退火温度61 ℃、blaOXA-2[9]F-5′-AAGAAACGCTACTCGCCTGC-3′,R-5′-CCAC-TCAACCCATCCTACCC-3′,退火温度58 ℃、blaOXA-10[10]F-5′-GTCTTTCGAGTA CGGCATTA-3′,R- 5′-ATTTTCTTAGCGGCAACTTAC -3′,退火温度53 ℃、blaVEB[11]F-5′-GATAGGAGTACAGACATA-TG-3′,R -5′-TTTATTCAAATAGTAATTCCACG -3′,退火温度47 ℃、blaPER[12]F-5′-ATGAATGTCAT CACAAAATG-3′,R-5′-TCAATCCGGACTCACT-3′,退火温度49 ℃和blaGES[13]F- 5′-ATGCGCTTCATTCACGCAC-3′,R-5′-CTATTTGTCCGTGCTCAGG-3′,退火温度55 ℃,引物由英潍捷基(上海)贸易有限公司合成。扩增的PCR产物送北京六合华大基因科技有限公司测序,测序结果经BLAST比对后进行基因分型。
2 结果 2.1 菌株分离本研究在1 371份样品中,通过选择性培养基的培养和增菌,并通过PCR鉴定共分离到金黄色葡萄球菌89株(图 1),分离率为6.5%(表 1)。其中在牛、猪、鸡、羊和兔场各分离到6株(1.7%)、25株(7.3%)、32株(6.7%)、10株(11.4%)、16株(15.2%)菌株。兔场的分离率最高,其次为羊场、猪场、鸡场,奶牛场的分离率最低。
|
M.相对分子质量标准marker Ⅲ;1. ATCC25923;2~23.临床分离菌株;24. ddH2O M. Marker Ⅲ; 1. ATCC25923; 2-23. Isolates; 24. ddH2O 图 1 金黄色葡萄球菌特异性nuc基因的检测 Figure 1 Detection of S. aureus specific nuc gene |
|
|
表 1 金黄色葡萄球菌菌株分离鉴定情况 Table 1 Isolation and identification of S. aureus strains from different animals |
89株金黄色葡萄球菌临床分离株对24种抗菌药物的敏感性结果见表 2。分离菌株对青霉素类药物耐药最为严重,其次为四环素类、大环内酯类和喹诺酮类。
|
|
表 2 金黄色葡萄球菌临床分离株的药物敏感性 Table 2 Antimicrobial susceptibility of S. aureus isolates |
从菌株来源来看,猪源和鸡源菌株的耐药情况较羊源、牛源和兔源菌株严重。
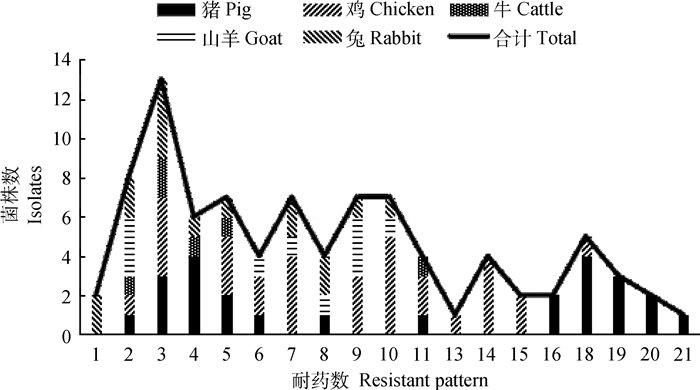
由图 2可见,不同动物来源菌株和同一动物来源不同菌株对所测定药物的耐药数量不同。最高的1株猪源菌株耐21种药物,最低的2株兔源菌株耐1种药物,耐15种及以上药物的菌株有15株,占总菌株数的16.8%。猪源菌株中耐16种及以上药物的有12株,占猪源菌株数的48%。鸡源菌株的耐药数为2~18种不等;牛源菌株有5株耐5种及以下药物,1株菌耐11种药物;羊源菌株的耐药数为2~10种不等;兔源菌株耐药数为2~9种不等。
|
图 2 金黄色葡萄球菌临床分离株的多重耐药情况 Figure 2 The number of multidrug-resistance S. aureus isolates |
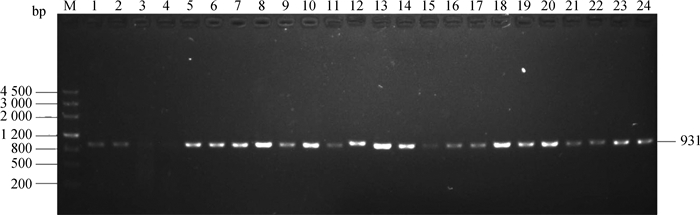
通过对blaTEM、blaCTX-M、blaSHV、blaOXA-2、blaOXA-10、blaVEB、blaPER和blaGES8个ESBL基因的PCR检测发现,只有blaTEM基因能被扩增出来(图 3),该基因存在于86株临床分离菌株,占所有分离菌株的96.6%。通过BLAST序列比对分析,所有86个blaTEM基因均为TEM-1a基因型。
|
M.相对分子质量标准marker Ⅲ;1~24.临床分离菌株 M. Marker Ⅲ; 1-24. Clinical isolates 图 3 blaTEM基因PCR扩增 Figure 3 Amplification of blaTEM gene by PCR |
金黄色葡萄球菌是自然界、人和动物的体表、消化道、呼吸道广泛存在的细菌,当机体抵抗力降低、环境条件恶劣、体表或外科手术创面暴露时,金黄色葡萄球菌可乘机感染这些部位。由于金黄色葡萄球菌可能造成广泛的感染,在人和兽医临床上通常使用抗菌药物来预防和治疗金黄色葡萄球菌感染,这也造成了金黄色葡萄球菌对抗菌药物的广泛耐药,如对β-内酰胺类、氨基糖苷类、大环内酯类、四环素类等耐药,特别是MRSA菌株在人源和动物源性菌株的广泛存在[14-15],除此之外,在一些国家还分离到了动物源性耐万古霉素金黄色葡萄球菌[16]。
在中国,金黄色葡萄球菌特别是MRSA不仅成为医院和社区感染的重要病原菌,也是造成畜牧业重大经济损失的重要病原之一,耐药金黄色葡萄球菌通过食物链向人的传播成为严重的公共卫生问题。关于动物源性金黄色葡萄球菌耐药的报道呈逐年上升趋势,但对重庆市金黄色葡萄球菌的耐药情况还知之甚少。本研究在重庆市部分养殖场随机采样分离到了89株金黄色葡萄球菌,这些菌株分离自牛、猪、鸡、山羊和兔。牛源菌株的分离率较低,这可能是由于金黄色葡萄球菌不是引起重庆地区奶牛乳房炎的主要病原,因为本研究采集的牛奶超过三分之一存在乳房炎。
从耐药情况来看,分离菌株对青霉素类药物严重耐药,对四环素类药物耐药也较为严重,对大环内酯类、氨基糖苷类、酰胺醇类、林可胺类、喹诺酮类、磺胺类药物也存在不同程度的耐药,这可能与养殖场在饲料和饮水中添加此类药物作为日常预防用药有关,也与部分养殖场经常使用抗生素有关。山羊和家兔养殖中一般不在饲料和饮水中添加预防性抗菌药物,这可能是羊源和兔源菌株的耐药率远远低于其他来源菌株的重要原因。
本研究分离的多重耐药菌株极为常见,特别是猪源多重耐药菌株,这与在养猪生产中抗菌药物的使用最为频繁有关。羊源和兔源菌株多重耐药情况较轻微,在养羊及养兔生产中,由于其细菌性疾病的发病率一般低于猪、牛和鸡,因此一般很少在饲料和饮水中添加抗菌药物,用于治疗的频率也低于上述两种动物,因此羊源和兔源菌株的多重耐药情况远远低于猪源和鸡源菌株。
本研究分离的菌株对青霉素类和头孢菌素类药物广泛耐药,说明这些菌株可能为产ESBLs金黄色葡萄球菌。目前CSLI没有金黄色葡萄球菌ESBLs筛选和确证试验标准,故未进行金黄色葡萄球菌ESBLs表型筛选和确证。但这些菌株可能携带ESBL基因,故检测了8个大类的ESBL基因。检测的ESBL基因经BLAST序列比对,均为blaTEM-1a基因,说明在重庆市分离的动物源性金黄色葡萄球菌中blaTEM-1a基因型流行比较广泛。在今后的研究中,还要加强对重庆地区金黄色葡萄球菌人源菌株和其他地区菌株中ESBL基因的检测,以明确金黄色葡萄球菌主要携带的ESBL基因的基因型。
4 结论通过对重庆不同畜禽养殖场金黄色葡萄球菌的分离鉴定及药物敏感性试验,初步分析重庆市不同动物来源的金黄色葡萄球菌的耐药规律,对临床用药具有一定的指导意义。同时通过对金黄色葡萄球菌中ESBL基因的检测,发现了ESBLs在金黄色葡萄球菌中的流行,且广泛存在blaTEM-1a基因型。
| [1] | SATO'O Y, OMOE K, NAITO I, et al. Molecular epidemiology and identification of a Staphylococcus aureus clone causing food poisoning outbreaks in Japan[J]. J Clin Microbiol, 2014, 52(7): 2637–2640. DOI: 10.1128/JCM.00661-14 |
| [2] | ERIKSEN K R. "Celbenin"-resistant staphylococci[J]. Ugeskr Laeger, 1961, 123: 384–386. |
| [3] | SEINIGE D, VON ALTROCK A, KEHRENBERG C. Genetic diversity and antibiotic susceptibility of Staphylococcus aureus isolates from wild boars[J]. Comp Immunol Microbiol Infect Dis, 2017, 54: 7–12. DOI: 10.1016/j.cimid.2017.07.003 |
| [4] | VELLAPPALLY S, DIVAKAR D D, Al KHERAIF A A, et al. Occurrence of vancomycin-resistant Staphylococcus aureus in the oral cavity of patients with dental caries[J]. Acta Microbiol Immunol Hung, 2017, 64(3): 343–351. DOI: 10.1556/030.64.2017.033 |
| [5] | ASSIS L M, NEDELJKOVIĆ M, DESSEN A. New strategies for targeting and treatment of multi-drug resistant Staphylococcus aureus[J]. Drug Resist Updat, 2017, 31: 1–14. DOI: 10.1016/j.drup.2017.03.001 |
| [6] | GHAFOURIAN S, SADEGHIFARD N, SOHEILI S, et al. Extended spectrum beta-lactamases: definition, classification and epidemiology[J]. Curr Issues Mol Biol, 2015, 17: 11–21. |
| [7] | STVRENBURG E, KVHN A, MACK D, et al. A novel extended-spectrum β-lactamase CTX-M-23 with a P167T substitution in the active-site omega loop associated with ceftazidime resistance[J]. J Antimicrob Chemother, 2004, 54(2): 406–409. DOI: 10.1093/jac/dkh334 |
| [8] | PAI H, LYU S, LEE J H, et al. Survey of extended-spectrum β-lactamases in clinical isolates of Escherichia coli and Klebsiella pneumoniae:prevalence of TEM-52 in Korea[J]. J Clin Microbiol, 1999, 37(6): 1758–1763. |
| [9] | YAN J J, TSAI S H, CHUANG C L, et al. OXA-type beta-lactamases among extended-spectrum cephalosporin-resistant Pseudomonas aeruginosa isolates in a university hospital in southern Taiwan[J]. J Microbiol Immunol Infect, 2006, 39(2): 130–134. |
| [10] | BERT F, BRANGER C, LAMBERT-ZECHOVSKY N. Identification of PSE and OXA β-lactamase genes in Pseudomonas aeruginosa using PCR-restriction fragment length polymorphism[J]. J Antimicrob Chemother, 2002, 50(1): 11–18. DOI: 10.1093/jac/dkf069 |
| [11] | PASTERÁN F, RAPOPORT M, PETRONI A, et al. Emergence of PER-2 and VEB-1a in Acinetobacter baumannii strains in the Americas[J]. Antimicrob Agents Chemother, 2006, 50(9): 3222–3224. DOI: 10.1128/AAC.00284-06 |
| [12] | CELENZA G, PELLEGRINI C, CACCAMO M, et al. Spread of blaCTX-M-type and blaPER-2 β-lactamase genes in clinical isolates from Bolivian hospitals[J]. J Antimicrob Chemother, 2006, 57(5): 975–978. DOI: 10.1093/jac/dkl055 |
| [13] | VOURLI S, GIAKKOUPI P, MIRIAGOU V, et al. Novel GES/IBC extended-spectrum β-lactamase variants with carbapenemase activity in clinical enterobacteria[J]. FEMS Microbiol Lett, 2004, 234(2): 209–213. |
| [14] | LI J, JIANG N S, KE Y B, et al. Characterization of pig-associated methicillin-resistant Staphylococcus aureus[J]. Vet Microbiol, 2017, 201: 183–187. DOI: 10.1016/j.vetmic.2017.01.017 |
| [15] |
宋敏艳, 韦艺媛, MuhammadZahoor Khan, 等. 耐甲氧西林金黄色葡萄球菌诱导牛乳腺上皮细胞炎症反应的分子标志物研究[J]. 畜牧兽医学报, 2016, 47(10): 1995–2002.
SONG M Y, WEI Y Y, KHAN M Z, et al. Molecular marker study of inflammatory reaction in bovine mammary epithelium cell line induced by methicillin-resistant Staphylococcus aureus[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(10): 1995–2002. (in Chinese) |
| [16] | BHATTACHARYYA D, BANERJEE J, BANDYOPADHYAY S, et al. First report on vancomycin-resistant Staphylococcus aureus in bovine and caprine milk[J]. Microb Drug Resist, 2016, 22(8): 675–681. DOI: 10.1089/mdr.2015.0330 |



