研究证实,快速生长发育期间,大脑特别容易受到外界因素的损伤,在此期间单次或多次暴露于麻醉药能够显著引起大脑广泛的神经元凋亡(apoptosis),并伴随脑功能的长期性损害[1]。2013年,在英国麻醉学杂志举办研讨会上专家也曾就麻醉神经毒性进行了深入的探讨,并指出机体暴露于麻醉药的时期(年龄,时长)和暴露于麻醉药的深度(包括次数和剂量),是造成快速生长发育期神经毒性的重要因素[2]。细胞自噬(autophagy)是指某些需降解的蛋白质或细胞器等细胞质成分被包裹,并最终被运送至溶酶体进行降解的过程。在正常情况下,自噬的主要作用是对受损细胞器进行降解,从而促进细胞对营养物质的循环利用,是细胞为了适应内、外界环境变化的一种自我保护反应[3]。相关的研究还发现,在某些相同因素诱导下,细胞自噬和细胞凋亡可先后出现或同时存在于同一细胞中,表现的作用是相互促进或互相拮抗[4]。在病理状态早期,自噬起到的是保护作用,能及时清除受损的细胞器和蛋白以促进物质、能量的循环利用及维持细胞内环境的稳定[5];而到病理状态晚期,自噬已不能逆转细胞死亡时,细胞器被大量降解必然导致自噬性细胞死亡[6]。
相关研究发现,多次注射低剂量氯胺酮可以引起成年SD大鼠海马发生自噬,并指出自噬的增强是对氯胺酮毒性作用的保护性反应[7],提示全麻药物可引起海马神经元自噬,且自噬的发生可能是种保护作用。另有研究表明,骨骼肌细胞暴露于全身麻醉药巴比妥钠或异氟醚后均可以引起自噬水平的增强;且在相同时长下,麻醉药浓度越高越容易引起自噬[8]。还有学者指出,20月龄的老龄SD大鼠,在经历1.5%异氟醚麻醉4 h后,可以显著性引起海马LC3-Ⅱ/Ⅰ表达增加,同时水迷宫测试提示学习能力下降,表明异氟醚引起的细胞自噬可能具有一定的毒性作用[9]。因此,自噬在麻醉过程中究竟起到何种作用还有待进一步研究。因此,本试验通过建立异氟醚麻醉模型,探讨不同时间异氟醚麻醉对幼龄大鼠海马神经元凋亡及自噬的影响。
1 材料与方法 1.1 实验动物7日龄SD幼鼠(P7)40只,总共4窝,每窝10只,由哈尔滨医科大学实验动物中心提供。
1.2 主要药物与试剂异氟醚购自深圳瑞沃德有限公司;戊巴比妥钠购自Sigma(St. Louis, MO);TUNEL细胞凋亡原位检测试剂盒购自南京建成生物工程研究所;Caspase-3、LC3 A/B及Beclin-1抗体购自Cell Signaling Technology公司;Bcl-2、β-actin、辣根酶标记山羊抗兔IgG(H+L)抗体及SV超敏两步法组化试剂盒购自武汉博士德生物科技有限公司;Western及IP细胞裂解液、BCA蛋白浓度测定试剂盒(增强型)及SDS-PAGE凝胶配制试剂盒等购自碧云天生物技术研究所。
1.3 试验方法 1.3.1 模型建立和样品采集40只P7幼鼠随机分为对照组和1.5%异氟醚麻醉2、3、4、6 h组(n=8),建立试验模型。将大鼠置于自制透明麻醉箱内,使用加热垫保持盒内温度在37 ℃左右,以60%空氧混合气体作为载体给大鼠吸入1.5%的异氟醚。对照组不进行麻醉处理,其他操作步骤与各异氟醚麻醉组相同。使用气体监护仪监测麻醉箱内麻醉气体以及氧气的浓度。幼鼠分别于麻醉相应时间点后腹腔注射150 mg·kg-1戊巴比妥钠处死。安乐死后每组取3只幼鼠用4%多聚甲醛进行心脏灌流,然后取脑,再浸入4%多聚甲醛(pH=7.4)固定,用于石蜡包埋;其余5只迅速取出脑组织,并置于冰盘上用4 ℃中性PBS进行冲洗,分离海马组织,取出后立即放入1.5 mL EP管,并置于液氮迅速冷冻后,转入-80 ℃冰箱中保存。
1.3.2 TUNEL染色1) 组织固定后,进行常规脱水及浸蜡,然后进行切片,厚度4~6 μm,常规脱蜡、水合。2)按试剂盒说明书分别将切片浸入蛋白酶K工作液、3% H2O2封闭液、TdT酶反应液和Streptavidin-HRP工作液,按要求孵育并漂洗。3)随机选2张切片,作为对照,阳性对照滴加蛋白酶K工作液后加100 μL DNase I反应液;阴性对照不加TdT酶反应液;4)滴加DAB工作液,室温显色,镜下控制反应时间,30 s~10 min;PBS中终止反应,最后用苏木素染液复染,光学显微镜下在同一参数下拍照观察,每一张切片随机选取8个(CA1、CA2、CA3和DG区各2个)高倍视野(400×)。
1.3.3 LC3-Ⅱ免疫组化1) 组织固定后,进行常规脱水及浸蜡,然后进行切片,厚度4~6 μm;2)切片经常规脱蜡、水合后用3% H2O2(现配现用)室温孵育10 min;3)切片浸入0.01 mol·L-1柠檬酸缓冲液,进行高压热修复抗原4 min;4)切片经5% BSA封闭20 min后,滴加LC3 B抗体(1:400)湿盒中4 ℃孵育过夜;5)样本漂洗后滴加聚合HRP标记抗兔IgG室温孵育30 min;6)DAB显色,室温镜下控制反应时间(5~10 min),然后用PBS终止显色,然后用苏木素染液复染;光学显微镜下在同一参数下拍照观察,每一张切片随机选取8个(CA1、CA2、CA3和DG区各2个)高倍视野(400×)。
1.3.4 Western blot分析1) 海马组织加入适量Western及IP细胞裂解液充分裂解,于4 ℃离心机12 000 g离心10 min,取上清;2)采用BCA蛋白浓度测定试剂盒检测所分离上清液蛋白浓度;3)参照总蛋白质浓度,加入上样缓冲液和稀释液后,将样品总质量浓度确定为3 μg·μL-1,煮沸10 min,-80 ℃冻存样品备用;4)按照SDS-PAGE凝胶快速配制试剂盒说明,分别配制分离胶和浓缩胶,进行电泳;5)低温条件下恒流300 mA进行湿转转膜;6)将转完膜的PVDF膜放入5%脱脂奶粉-TBST封闭液中,37 ℃恒温摇床封闭90 min;7)用5%脱脂奶粉-TBST分别按β-actin 1:600,Cleaved-caspase-3 1:1 000,Bcl-2 1:500,LC3-Ⅱ/Ⅰ 1:1 200和Beclin-1 1:800的比例稀释一抗,混匀,4 ℃孵育过夜;8)分别按β-actin 1:8 000,Cleaved-caspase-3 1:4 000,Bcl-2 1:5 000,LC3-Ⅱ/Ⅰ 1:6 000和Beclin-1 1:8 000的比例稀释二抗,37 ℃摇床孵育1.5 h;9)用ECL法对PVDF膜进行目的蛋白发光检测,用Tanon 5200全自动化学发光图像分析系统,获取曝光结果,Gel-Pro analyzer软件对蛋白质条带进行灰度值分析。
1.3.5 数据处理数据均采用SPSS 23.0进行差异显著性分析,结果用“x±s”表示,各组数据间的比较采用单因素方差分析,有统计学差异后再进行两两比较的q检验,选取最小有意义差异(LSD)检验法。采用GraphPad Prism 7进行作图。P<0.05表示差异显著,具有统计学意义。
2 结果 2.1 海马组织TUNEL染色不同组别麻醉各时间点海马CA1区TUNEL染色结果(图 1),光镜下阳性细胞显示核固缩,染色质凝聚,呈棕黄色或黄褐色,而阴性细胞则成淡蓝色。在麻醉2 h时,可见少量黄褐色深染细胞核,3、4和6 h时阳性细胞逐渐增多,且在4和6 h时海马锥体细胞排列松散,紊乱,说明海马区损伤较为严重。
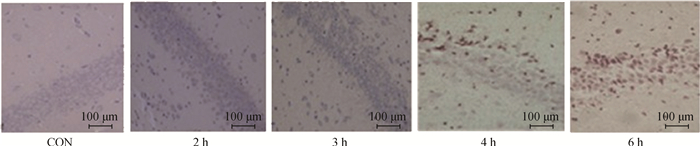
|
图 1 麻醉各时间点海马CA1区TUNEL染色结果 Figure 1 Results of TUNEL-staining at each anesthesia time point in hippocampus CA1 area |
从图 2可见,不同组别麻醉各时间点LC3-Ⅱ表达结果,阳性细胞在光镜下呈棕黄色或黄褐色,而阴性细胞则呈淡蓝色。免疫组化结果显示,在麻醉2 h时间点,可见少量黄褐色细胞核深染,3 h时阳性细胞比例最高。
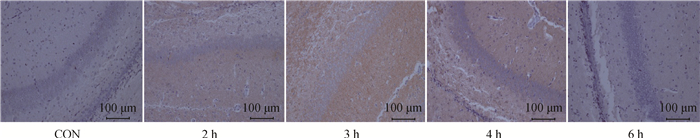
|
图 2 麻醉各时间点海马CA1区LC3-Ⅱ免疫组化结果 Figure 2 Results of LC3-Ⅱ immunostaining at each anesthesia time point in hippocampus CA1 area |
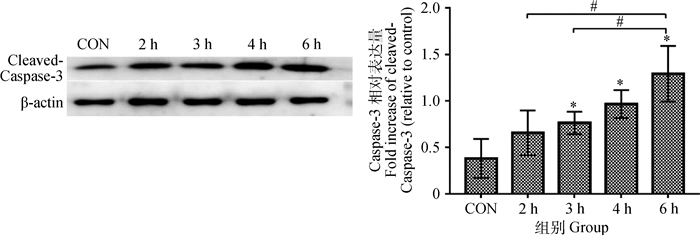
|
与对照组比较,*. P < 0.05;与其他麻醉组比较,#. P < 0.05。下同 Compared with the control group, *. P < 0.05; Compared with other anesthesia group, #.P < 0.05. The same as below 图 3 Caspase-3在幼龄大鼠海马神经元中的表达量 Figure 3 Expression of cleaved-Caspase-3 in hippocampus of young rats |
由图 3可知:随着异氟醚作用时间的增加,Caspase-3表达逐渐增强;与对照组比较,3、4和6 h组Caspase-3表达增强明显,差异显著(P < 0.05);与2、3 h组比较,6 h组Caspase-3表达增强明显,差异显著(P < 0.05)。
由图 4可知:随着异氟醚作用时间的增加,Bcl-2表达量随着麻醉时间的延长逐渐下降,其中在3、4和6 h时与对照组相比差异显著(P < 0.05)。
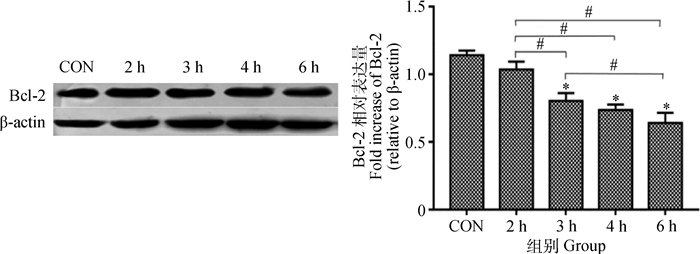
|
图 4 Bcl-2在幼龄大鼠海马神经元中的表达量 Figure 4 Expression of Bcl-2 in hippocampus of young rats |
随着异氟醚作用时间的增加,LC3-Ⅱ/Ⅰ表达量先升高后下降;与对照组比较,3 h组LC3-Ⅱ/Ⅰ表达增强明显,差异显著(P < 0.05);与2 h组比较,3 h组LC3-Ⅱ/Ⅰ表达增强明显,差异显著(P < 0.05);与3 h组比较,4和6 h组LC3-Ⅱ/Ⅰ表达减少明显,差异显著(P < 0.05)(图 5)。
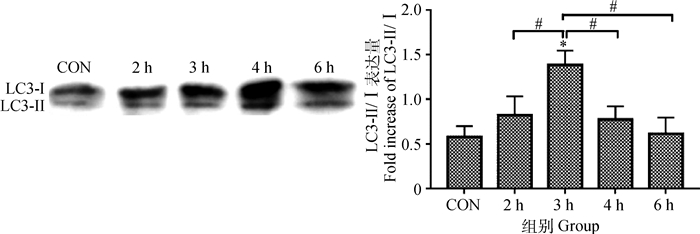
|
图 5 LC3-Ⅱ/Ⅰ在幼龄大鼠海马神经元中的表达量 Figure 5 Expression of LC3-Ⅱ/Ⅰ in hippocampus of young rats |
由图 6可见:随着异氟醚作用时间的增加,Beclin-1表达量先上升后下降;与对照组比较,2、3和4 h组Beclin-1表达增强明显,差异显著(P < 0.05);与2、3和4 h组比较,6 h组Beclin-1表达减少明显,差异显著(P < 0.05)。
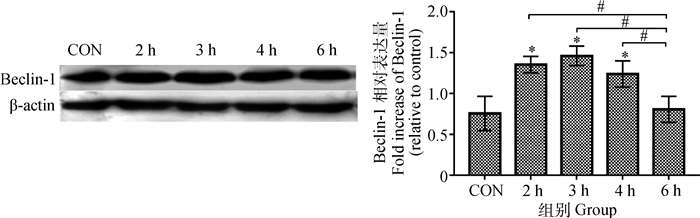
|
图 6 Beclin-1在幼龄大鼠海马神经元中的相对表达量 Figure 6 Expression of Beclin-1 in hippocampus of young rats |
近年来关于全麻药能诱导脑神经元凋亡,同时伴随脑功能的长期性损害受到了世界各国的广泛关注[10-12]。Bcl-2是目前发现的最重要的抗凋亡基因,它具有抑制凋亡的作用[13]。Caspase-3是细胞凋亡途径的最后效应子,能够导致细胞凋亡[14]。脑内的海马组织是参与学习或记忆神经回路的重要部分。学习记忆的系统中任何环节的缺陷都可能损害记忆功能。本试验通过P7幼鼠建立临床常用浓度的异氟醚麻醉模型来检测麻醉药对海马神经元的毒性作用。试验结果表明,随着异氟醚作用时间的增加,与对照组相比,活化的Caspase-3表达量逐渐增加;Bcl-2随着麻醉时间的延长逐渐下降。这表明异氟醚能诱导幼年SD大鼠海马神经元的凋亡,并随着麻醉时间的加长凋亡水平逐渐升高,这与前人的研究结果类似[15]。
研究认为自噬在细胞营养缺乏,或者应激条件存在时有效地保护了细胞,实现了细胞的自体稳态。LC3和Beclin-1是自噬的特定生物化学标记,正常细胞中LC3-Ⅰ和LC3-Ⅱ均能被发现,当自噬发生时,LC3-Ⅰ会向LC3-Ⅱ转化,而使LC3-Ⅱ表达升高并牢牢固定在自噬体膜上。一旦自噬体与溶酶体发生融合,自噬体膜上的LC3-Ⅱ就会被溶酶体水解酶降解,因此LC3-Ⅱ的表达量可以反映自噬形成和降解之间的平衡关系。因此,通过检测LC3-Ⅱ/Ⅰ、Beclin-1含量变化可判断自噬活动的强度[16]。本研究结果显示,随着异氟醚作用时间的增加,与对照组相比,LC3-Ⅱ/Ⅰ表达含量先升高后下降,并且在异氟醚作用3 h时表达含量明显升高;Beclin-1表达含量也是先升高后下降,在异氟醚作用2、3和4 h时含量明显升高,并且在3 h时升高最明显。说明在异氟醚的作用下,幼龄SD大鼠海马神经元伴随着自噬的激活。综合LC3和Beclin-1的表达结果来看,异氟醚麻醉2~4 h后自噬水平显著提高,其中麻醉3 h自噬水平最高,然后随着麻醉时间的延长自噬水平逐渐减弱。但也有研究表明PD7幼龄大鼠接受1.5%异氟醚麻醉6 h不会引起大脑皮层Beclin-1的表达升高[17]。而成年小鼠接受1%异氟醚麻醉3 h可以引起成年小鼠皮层显著自噬,但不会引起海马区自噬的显著增强[18]。这种与本试验不一致的结果,可能与麻醉浓度的选择有关,也可能与幼龄大鼠在麻醉过程中不同脑区对麻醉敏感程度不同有关。
自噬和凋亡可先后出现或同时存在,表现出相互促进或互相拮抗的作用,并且自噬和凋亡的因子存在着相互影响和交叉。适度的自噬能保护细胞免受损伤,而过度的自噬又将加速细胞死亡,所以自噬的调控可能对细胞产生不同的作用。研究发现,在酒精致PC12细胞损伤过程中,其自噬受到了抑制,Caspase-3表达含量升高,而激活自噬则相反。S. Y. Hung等[19]研究指出,增强自噬能抑制Aβ诱导的细胞死亡,增加海马神经元的存活。秀丽隐杆线虫发育过程中,Beclin-1下调引起了Caspase-3依赖的凋亡增加和凋亡细胞数目增多[20]。在一些重金属中毒或缺血缺氧模型中,也发现适当的自噬可对神经元产生保护作用[21]。近年来,有关麻醉药对自噬的调节也陆续被报道[22],且不同的试验结果也有一定差异,并且不同异氟醚麻醉时间点对自噬及凋亡的影响及自噬在其中发挥着怎样的作用还不明确。本研究结果显示,随着异氟醚作用时间的增加,与对照组相比,Beclin-1在2、3 h表达含量明显升高,而Bcl-2表达含量逐渐降低;与幼年SD大鼠海马神经元在异氟醚作用3、4 h相比,在6 h时Beclin-1表达含量明显下降,而Caspase-3表达含量明显升高。通过结果推断,异氟醚能够诱发幼年SD大鼠海马神经元自噬的活化,进而起到抑制凋亡的作用;而异氟醚引起的自噬不能逆转异氟醚导致的海马神经元凋亡,或过高凋亡抑制幼年SD大鼠海马神经元自噬的活化,而使神经元最终凋亡。
4 结论异氟醚不仅可以引起幼龄SD大鼠海马神经元广泛凋亡,而且还能诱导海马神经元自噬,但凋亡水平随麻醉时间延长逐渐加强,而自噬水平先升高后降低。自噬在异氟醚诱导的海马区神经元凋亡中可能发挥着保护性作用。
| [1] |
张建峰, 马莉. 全麻药对幼龄动物脑神经细胞凋亡的影响[J]. 国际麻醉学与复苏杂志, 2013, 34(2): 171–176.
ZHANG J F, MA L. Effects of general anesthetics on neuroapoptosis in infant animal's brain[J]. International Journal of Anesthesiology and Resuscitation, 2013, 34(2): 171–176. (in Chinese) |
| [2] | JEVTOVIC-TODOROVIC V, ABSALOM A R, BLOMGREN K, et al. Anaesthetic neurotoxicity and neuroplasticity: An expert group report and statement based on the BJA Salzburg Seminar[J]. Br J Anaesth, 2013, 111(2): 143–151. DOI: 10.1093/bja/aet177 |
| [3] | YANG Z F, KLIONSKY D J. Eaten alive: A history of macroautophagy[J]. Nat Cell Biol, 2010, 12(9): 814–822. DOI: 10.1038/ncb0910-814 |
| [4] | XUE L Z, FLETCHER G C, TOLKOVSKY A M. Autophagy is activated by apoptotic signalling in sympathetic neurons: An alternative mechanism of death execution[J]. Mol Cell Neurosci, 1999, 14(3): 180–198. DOI: 10.1006/mcne.1999.0780 |
| [5] | ZHAO D X, YUAN H P, YI F, et al. Autophagy prevents doxorubicin-induced apoptosis in osteosarcoma[J]. Mol Med Rep, 2014, 9(5): 1975–1981. DOI: 10.3892/mmr.2014.2055 |
| [6] | JIANG Q, LI F, SHI K J, et al. ATF4 activation by the p38MAPK-eIF4E axis mediates apoptosis and autophagy induced by selenite in Jurkat cells[J]. FEBS Lett, 2013, 587(15): 2420–2429. DOI: 10.1016/j.febslet.2013.06.011 |
| [7] |
张阳, 曹甲甲, 陆俊龙, 等. 腹腔连续注射低剂量氯胺酮后大鼠海马LC3和Beclin1的表达[J]. 中国法医学杂志, 2012, 27(2): 101–104.
ZHANG Y, CAO J J, LU J L, et al. Expression of LC3 and Beclin1 in rat hippocampus after repeated intraperitoneal administration of low dose of ketamine[J]. Chinese Journal of Forensic Medicine, 2012, 27(2): 101–104. (in Chinese) |
| [8] | KASHIWAGI A, HOSOKAWA S, MAEYAMA Y, et al. Anesthesia with disuse leads to autophagy upregulation in the skeletal muscle[J]. Anesthesiology, 2014, 122(5): 1075–1083. |
| [9] | LI Z Q, LI L X, MO N, et al. Duration-dependent regulation of autophagy by isoflurane exposure in aged rats[J]. Neurosci Bull, 2015, 31(4): 505–513. DOI: 10.1007/s12264-015-1549-1 |
| [10] |
滕清宇, 李玮伟, 袁红斌, 等. 全麻药发育期神经毒性机制的研究进展[J]. 临床麻醉学杂志, 2016, 32(9): 929–931.
TENG Q Y, LI W W, YUAN H B, et al. The research progress of neurotoxic mechanism in the development of total anesthetic[J]. Journal of Clinical Anesthesiology, 2016, 32(9): 929–931. (in Chinese) |
| [11] |
裴爱月. 海藻糖对异氟醚诱导转APP基因小鼠海马氧化应激损伤的影响[D]. 长春: 吉林大学, 2016.
PEI A Y. Impact of trehalose on hippocampal oxidative stress injury induced by lsoflurane in APP Trangenic mice[D]. Changchun: Jilin University, 2016. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10183-1016089875.htm |
| [12] | WANG Q, SHEN F Y, ZOU R, et al. Ketamine-induced apoptosis in the mouse cerebral cortex follows similar characteristic of physiological apoptosis and can be regulated by neuronal activity[J]. Mol Brain, 2017, 10: 24. DOI: 10.1186/s13041-017-0302-2 |
| [13] |
剧世强, 郭慧利, 王利勤, 等. 猪体细胞克隆胚胎体外发育过程中的凋亡规律[J]. 畜牧兽医学报, 2010, 41(6): 678–684.
JU S Q, GUO H L, WANG L Q, et al. Apoptotic law of porcine cloned embryos during development in vitro[J]. Acta Veterinaria et Zootechnica Sinica, 2010, 41(6): 678–684. (in Chinese) |
| [14] |
杨申. P38MAPK抑制剂对血管性痴呆大鼠海马细胞凋亡、Bcl-2、Caspase-3表达及其学习记忆能力的影响[D]. 济南: 山东大学, 2013.
YANG S. The effect of P38MAPK inhibitor on hippocampus cells apoptosis BCL-2, Caspase-3 and learning memory ability in vascular dementia rat[D]. Jinan: Shandong University, 2013. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10422-1014124244.htm |
| [15] | PENG J, DROBISH J K, LIANG G, et al. Anesthetic preconditioning inhibits isoflurane-mediated apoptosis in the developing rat brain[J]. Anesth Analg, 2014, 119(4): 939–946. DOI: 10.1213/ANE.0000000000000380 |
| [16] |
康恺, 林鸷, 高海慧, 等. 猪瘟病毒促进细胞自噬并利于病毒增殖[J]. 畜牧兽医学报, 2014, 45(9): 1481–1487.
KANG K, LIN Z, GAO H H, et al. Classical swine fever virus promotes cell autophagy which facilitates virus proliferation[J]. Acta Veterinaria et Zootechnica Sinica, 2014, 45(9): 1481–1487. (in Chinese) |
| [17] | XIONG J W, KONG Q Y, DAI L Y, et al. Autophagy activated by tuberin/mTOR/p70S6K suppression is a protective mechanism against local anaesthetics neurotoxicity[J]. J Cell Mol Med, 2017, 21(3): 579–587. DOI: 10.1111/jcmm.2017.21.issue-3 |
| [18] | SHENG R, ZHANG T T, FELICE V D, et al. Preconditioning stimuli induce autophagy via sphingosine kinase 2 in mouse cortical neurons[J]. J Biol Chem, 2014, 289(30): 20845–20857. DOI: 10.1074/jbc.M114.578120 |
| [19] | HUNG S Y, HUANG W P, LIOU H C, et al. Autophagy protects neuron from Aβ-induced cytotoxicity[J]. Autophagy, 2009, 5(4): 502–510. DOI: 10.4161/auto.5.4.8096 |
| [20] | TAKACS-VELLAI K, VELLAI T, PUOTI A, et al. Inactivation of the autophagy genebec-1 triggers apoptotic cell death in C. elegans[J]. Curr Biol, 2005, 15(16): 1513–1517. DOI: 10.1016/j.cub.2005.07.035 |
| [21] |
邵明玉. 自噬诱导剂海藻糖对铅暴露幼鼠海马神经元损伤的保护作用[D]. 长春: 吉林大学, 2013.
SHAO M Y. Protective role of an autophagic inducer trehalvse on hippocampal neurons damaged by lead exposure in young rats[D]. Changchun: Jilin University, 2013. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10183-1013195099.htm |
| [22] |
张彤彤. 鞘氨醇激酶-2在原代鼠皮层神经元激活自噬介导缺血耐受[D]. 苏州: 苏州大学, 2015.
ZHANG T T. Sphingosine kinase-2 induced autophagy activation mediates ischemic tolerance in primary cortical neurons[D]. Suzhou: Suzhou University, 2015. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10285-1015401139.htm |



