2. 山西农业大学实验中心, 太谷 030801;
3. 山西农业大学生命科学院, 太谷 030801
2. Shanxi Agricultural University Experimental Center, Taigu 030801, China;
3. College of Life Science, Shanxi Agricultural University, Taigu 030801, China
受集约化养殖过程中饲养环境、饲养方式、糖皮质激素的应用以及饲料质量等问题的影响,骨质疏松(osteoporosis,OP)引起的动物健康和动物福利问题广受关注[1-3]。OP是一种常见的骨代谢疾病,以骨脆性增加、骨量减少、微观结构退化、高骨转换、破骨细胞(osteoclasts, OC)形成和骨吸收活性异常增加为特征[4-7]。OPG/RANK/RANKL系统是OC形成过程中的一个重要信号通路[8-10],是骨骼生理研究领域的一个重大进展[8]。该系统包括核因子-κB受体活化因子(receptor activator of nuclear factor-κB, RANK),核因子κB受体活化因子配体(receptor activated nuclear factor kappa B ligand, RANKL)和骨保护素(osteoprotegerin,orthopantomography, OPG)。多种因素通过OPG/RANK/RANKL系统引起骨量丢失,导致OP发生[11],许多细胞因子也通过该系统发挥对骨代谢的调节作用[12]。鉴于其在OP发生机制中的重要作用,该信号系统成为治疗OP药物设计的新靶点[3]。
课题组前期研究结果表明以羊骨胶原肽(sheep bone collagen peptide, SBCP)和氯化钙为原料制备的钙螯合羊骨胶原多肽(SBCP-Ca)对去卵巢大鼠的骨质改善效果比雌激素更为安全和有效[13],为进一步了解SBCP-Ca防治OP的作用机制,本研究建立OP动物模型,探讨SBCP-Ca对OPG/RANK/RANKL系统的影响,为骨破坏性疾病治疗药物的研发提供依据。
1 材料与方法 1.1 试剂及仪器SBCP-Ca由本实验室以羊骨胶原肽和氯化钙为原料制备[14]。Trizol(Life公司)、反转录PCR试剂盒和SYBRTMPremix Ex TaqTMⅡ为TaKaRa产品;大鼠血清Ⅰ型前胶原氨基端前肽(procollagen type Ⅰ N-terminal propeptide, PINP)和Ⅰ型胶原羧基端肽(C-terminal cross-linking telopeptide of type Ⅰ collagen, β-CTx)ELISA试剂盒购自Elabscience Biotechnology有限公司;原子吸收光谱仪(AA7020,北京东西分析仪器有限公司);SpectraMax M5多功能酶标仪(Molecular Devices);扫描电子显微镜(JEOL JEM-6490LV,日本电子光学实验室);荧光定量PCR仪(Mx 3005PTM, 美国Stratagene)等。
1.2 实验动物10周龄雌性未孕SD大鼠和啮齿类动物标准颗粒饲料均由山西医科大学动物实验中心[SCXK(晋) 2015-0001]提供,大鼠体重(203±20) g,自由饮水,环境条件符合GB14923-2001要求,适应性饲喂2周后,模型组和SBCP-Ca组大鼠以10%水合氯醛进行麻醉(4 mL·kg-1,腹腔注射),背部去毛区(3 cm×5 cm)经聚维酮碘消毒后,再用75%酒精脱碘,再沿背中线向下做长2~3 cm的纵行切口,暴露卵巢及与其紧密相连的子宫角,结扎子宫角并将其切断,摘除双侧卵巢,缝合背部肌肉及皮肤。假手术组的手术过程同上,但不切除卵巢组织。术后连续5 d肌注青霉素以防感染,康复1周后,分组试验(n=8)。SBCP-Ca组以100 mg·mL-1的SBCP-Ca连续灌胃8周,剂量为10 mL·(kg·d)-1,假手术组和模型组灌服同体积蒸馏水,8周后断食12 h,乙醚浅麻醉,摘除眼球眼眶取血,脱颈处死大鼠,采集股骨样本。血样经3 000 r·min-1离心10 min后,收集并分装血清,置-20 ℃保存备用。
1.3 血清PINP和β-CTx的测定大鼠血清PINP和β-CTx含量按照ELISA试剂盒所描述的夹心ELISA和竞争ELISA法测定。
1.4 骨钙和羟脯氨酸含量的测定大鼠股骨在液氮中研磨成粉,风干至恒重,准确称取并置于瓷坩埚中,马弗炉300 ℃预灰化1 h,550 ℃继续灰化3 h,关掉电源,待温度降至110 ℃以下,取出坩埚,样品若有黑色,则加1~2滴硝酸继续消化1 h,直至出现白色结晶。将灰分用2 mL盐酸(1:5)溶解,再加入18 mL去离子水混匀,取4 mL用去离子水定容至50 mL,再取定容好的溶液10 mL,加5%氯化锶溶液0.2 mL,用原子吸收光谱仪测定钙含量。羟脯氨酸按试剂盒(南京建成生物工程研究所)说明操作测定。
1.5 骨微观结构观察大鼠左侧股骨经戊二醛固定和EDTA脱钙处理后,取股骨远端干骺端横切面制作切片,进行扫描电镜(scanning electron microscopy, SEM)分析。
1.6 qRT-PCRTrizol法提取各组大鼠右侧股骨总RNA[15],1%琼脂糖凝胶电泳检测其完整性并测定浓度。cDNA合成参照文献进行[16]。根据SYBRTM Premix Ex TaqTM Ⅱ试剂盒说明进行荧光定量PCR,反应体系(10 μL):SYBRTM Premix Ex TaqTMⅡ(2×)5 μL,上下游引物(10 μmol·L-1)各0.4 μL,ROX Reference Dye Ⅱ(50×)0.2 μL,模板100 ng,补充ddH2O至10 μL。设置程序:预变性95 ℃ 10 min;变性95 ℃ 30 s,延伸60 ℃ 30 s,72 ℃ 10 s[17],45个循环。待反应结束后,用扩增曲线的Ct值计算定量结果。以β-actin为内参基因,通过2-ΔΔCt法计算RANK、RANKL、OPG在各组大鼠股骨中的相对表达水平[18]。引物参照NCBI上已公开发表的序列进行设计并由生工生物工程(上海)股份有限公司合成(表 1)。
|
|
表 1 qRT-PCR引物及预期产物大小 Table 1 Primers and the expected sizes of PCR product |
荧光定量PCR产物送至生工生物工程(上海)股份有限公司进行测序。测序结果与各基因的标准序列进行比对,验证PCR扩增产物是否为对应的目的基因片段。
1.8 统计方法所有结果均用“x±s”表示,试验数据用SPSS 21.0软件进行方差分析,柱状图用SigmaPlot 10.0软件绘制。
2 结果 2.1 OP模型的建立由表 2可知,模型组的PINP水平和β-CTx水平均极显著高于假手术组(P < 0.01),说明骨转换加快,成骨活性和破骨活性均增强,符合骨质疏松的特点。模型组钙和羟脯氨酸的含量均极显著低于假手术组(P < 0.01),说明模型组骨质流失严重。SEM观察结果显示假手术组(图 1A)骨髓腔面积较小,骨小梁(trabecular bone,TB)结构清晰,排列紧密,粗而延续,骨质致密。而模型组(图 1B)TB变得薄而断续,TB间距变宽,骨髓腔变得大而空洞,细胞很少,骨质变得疏松。以上结果表明本研究OP造模成功。
|
|
表 2 SBCP-Ca对去卵巢大鼠血清PINP、β-CTx水平及骨组织钙和羟脯氨酸含量的影响(x±s) Table 2 Effects of SBCP-Ca on the level of PINP, β-CTx in serum and the content of Ca and hydroxyproline in bone of ovariectomized rats(x±s) |

|
A.假手术组;B.模型组;C.SBCP-Ca组;TB为骨小梁;BM为骨髓腔 A. Sham group; B. Model group; C.SBCP-Ca group; TB represents bone trabecula; BM represents bone marrow 图 1 各组大鼠股骨远端干骺端扫描电镜观察 Figure 1 SEM observation for metaphysis of distal femur by different treatments |
表 2显示,去卵巢大鼠灌服SBCP-Ca后,PINP与β-CTx水平极显著低于模型组(P < 0.01),并且与假手术组无统计学差异(P>0.05),说明骨转换正常;钙与羟脯氨酸含量均极显著高于模型组(P < 0.01),且钙含量还极显著高于假手术组(P < 0.01),说明SBCP-Ca可防止骨质流失并可促进钙盐在骨的沉积而增加骨的硬度。
2.3 SBCP-Ca对去卵巢大鼠骨微观结构的影响SBCP-Ca组(图 1C)骨小梁排列较为紧凑,连续性好,与模型组相比,大为改善,骨髓腔内充满细胞,说明SBCP-Ca可防止骨质疏松的发生,具有改善骨质的作用。
2.4 SBCP-Ca对去卵巢大鼠RANK、RANKL和OPG转录的影响由图 2可知,RANK和RANKL的相对转录量在模型组和假手术组之间差异极显著(P < 0.01),说明在骨质疏松骨中,受体RANK在OC及OC前体细胞中的相对转录量极显著升高,是假手术组的73.19倍;由骨髓基质细胞和成骨细胞(osteoblasts, OB)表达的RANKL在模型组的相对表达量也极显著升高,是假手术组的38.68倍。上调表达的RANK和RANKL使更多的OC成熟,抑制OC凋亡,并增强OC的骨吸收活性,因此引发骨质疏松。图 2中,模型组的OPG转录水平与假手术组差异不显著(P>0.05),说明卵巢切除和骨质疏松并不影响OB分泌OPG的能力。SBCP-Ca组的RANK和RANKL的相对转录水平极显著低于模型组(P < 0.01),说明SBCP-Ca对OC的形成和骨吸收活性有显著抑制作用。SBCP-Ca组的OPG相对转录水平极显著高于模型组和假手术组(P < 0.01),是假手术组的1.62倍,模型组的1.74倍,说明SBCP-Ca还可促进去卵巢大鼠OB分泌超过正常水平的OPG,从而阻断骨吸收,防止骨质疏松的发生。
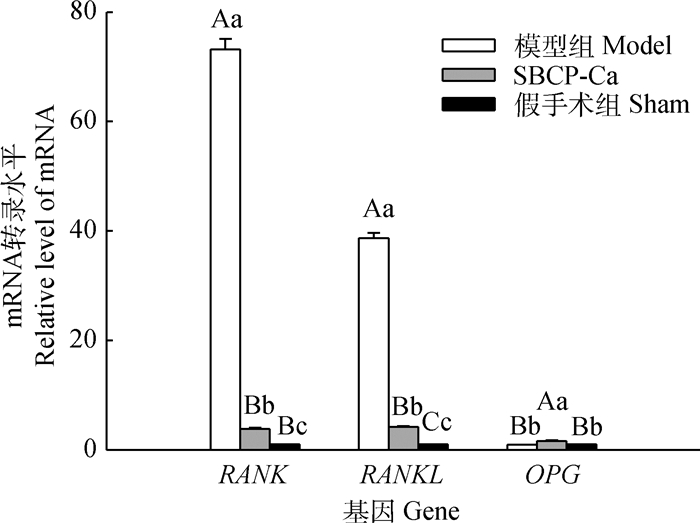
|
图 2 各组大鼠股骨组织中RANK、RANKL和OPG的mRNA转录情况 Figure 2 Relative expression level of RANK, RANKL and OPG mRNA in rat femur by different treatment |
图 3中,模型组的RANKL/OPG比值是假手术组的41.71倍,差异极显著(P < 0.01),而SBCP-Ca组的RANKL/OPG比值极显著低于模型组(P < 0.01),且和假手术组差异不显著(P>0.05)。
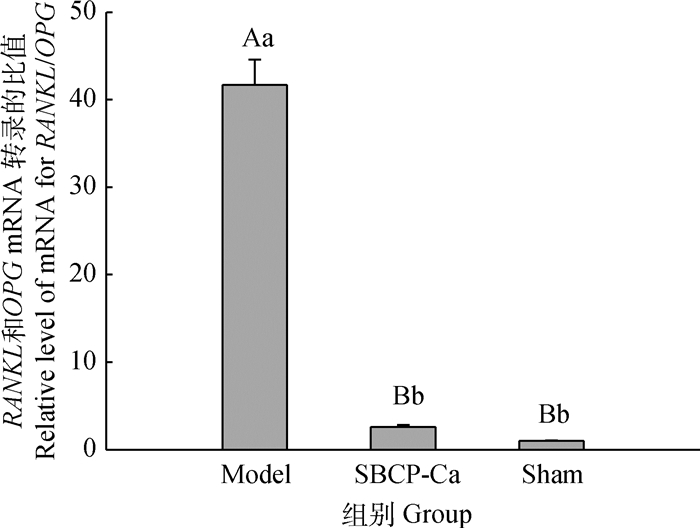
|
图 3 各组大鼠股骨中RANKL和OPG mRNA相对转录量的比值 Figure 3 Ratio of relative level of mRNA of RANKL to OPG (RANKL/OPG) |
2%琼脂糖凝胶电泳显示(图 4),荧光定量PCR产物的大小与预期一致,分别为100(RANK)、134(RANKL)、83(OPG)、114(β-actin)bp。对测序结果与各基因的标准序列进行比对,RANK和RANKL各有一个碱基的差异,OPG序列100%吻合,说明本研究所设计的引物特异性强,结果可靠。
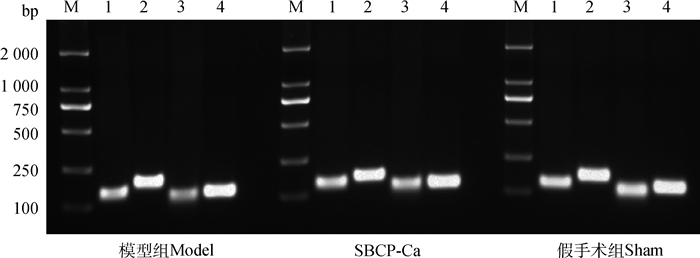
|
M. DL2000 DNA marker; 1. RANK; 2. RANKL; 3. OPG; 4. β-actin 图 4 各组大鼠股骨中RANKL、RANK和OPG荧光定量PCR扩增结果 Figure 4 Real-time PCR results of RANKL, RANK and OPG mRNA in femur of different groups |
骨代谢生化标志物是在骨转换过程中产生的一些物质,反映骨的代谢速率、OC的骨吸收活性和OB的骨形成活性。PINP和β-CTx存在于血液中,是国际骨质疏松基金会、国际临床化学和实验室医学联盟推荐使用的标志物[19-21],分别反映骨形成(PINP)和骨吸收(β-CTx)活性,是评价骨质疏松发生和药物疗效的骨代谢生化标志物,具有灵敏度高、特异性强、准确性较高的特点,在高转换骨质疏松模型中显著升高。本研究模型组的PINP和β-CTx水平均极显著高于假手术组,说明疏松骨质中的骨形成速率和骨吸收速率均很高,属高转换骨,而SBCP-Ca可使去卵巢大鼠的PINP和β-CTx水平维持在假手术组水平,并使股骨中的羟脯氨酸含量和钙含量增加,避免了高骨转换引起的骨量丢失,有效抑制了骨质疏松的发生,骨组织病理切片也证实如此。
RANK主要表达于单核/巨噬细胞系,在OC前体细胞和成熟OC细胞表面高度表达,是RANKL的唯一已知受体。骨组织中的OC和骨髓基质细胞都有分泌和合成RANKL的能力[10-12]。RANK(受体)与RANKL(配体)的结合将直接促进OC的分化成熟,增强其骨吸收活性并阻止其凋亡[12, 22]。OPG是由OB分泌的一种可溶性糖蛋白,广泛存在于骨组织中[12],是骨重建的关键因子[6],是RANKL的诱骗受体,竞争性结合RANKL,从而阻断RANK与RANKL的结合,抑制OC的分化成熟和功能的发挥[22]。与OPG功能相似或促进OPG表达的药物开发将可带来良好经济收益和社会效益[8]。
本研究结果表明SBCP-Ca通过减少OC前体细胞表面的RANK受体数量、抑制OB和骨髓基质细胞分泌配体RANKL,增强OB分泌OPG的三重作用来抑制OC的形成和骨吸收活性,防止骨质疏松的发生。
RANKL/OPG比值可直接影响OC的分化和骨代谢[23], 是调节骨吸收和骨形成平衡的重要因素[24]。本研究中,骨质疏松发生时,尽管OPG水平没有变化,但RANKL/OPG比值极显著升高,而SBCP-Ca可使该比值与假手术组相似。可见在骨形成与骨吸收的动态平衡关系中,RANKL/OPG是一个重要的调节杠杆,可作为判断骨质疏松发生和药物作用的一个较为客观和准确的指标。
4 结论SBCP-Ca通过抑制RANK在破骨前体细胞和成熟破骨细胞的表达,抑制成骨细胞合成和分泌RANKL,促进成骨细胞分泌OPG的三重作用来抑制破骨细胞的形成和骨吸收活性,从而抑制去卵巢大鼠骨质疏松的发生。
| [1] |
吕文亭, 马利芹, 杨永红, 等. 低钙日粮添加依普黄酮对笼养蛋鸡骨组织显微结构和形态计量学的影响[J]. 畜牧兽医学报, 2012, 43(11): 1818–1824.
LV W T, MA L Q, YANG Y H, et al. Effects of adding ipriflavone to low-calcium diet on microstructure and histomorphometry of bone in cage layers[J]. Acta Veterinaria et Zootechnica Sinica, 2012, 43(11): 1818–1824. (in Chinese) |
| [2] | DVORAK G, GRUBER R, HUBER C D, et al. Trabecular bone structures in the edentulous diastema of osteoporotic sheep[J]. J Dent Res, 2008, 87(9): 866–870. DOI: 10.1177/154405910808700918 |
| [3] | WEBSTER A B. Welfare implications of avian osteoporosis[J]. Poult Sci, 2004, 83(2): 184–192. DOI: 10.1093/ps/83.2.184 |
| [4] |
赵文韬, 张晓刚, 王志鹏. 自噬与骨质疏松症的相关性[J]. 中国生物化学与分子生物学报, 2017, 33(4): 337–341.
ZHAO W T, ZHANG X G, WANG Z P. Relationship between autophagy and osteoporosis[J]. Chinese Journal of Biochemistry and Molecular Biology, 2017, 33(4): 337–341. (in Chinese) |
| [5] |
元宇, 仝晓阳, 邹军. miR-214对骨形成的抑制作用[J]. 中国生物化学与分子生物学报, 2017, 33(2): 133–137.
YUAN Y, TONG X Y, ZOU J. The Roles of miR-214 in inhibition of bone formation[J]. Chinese Journal of Biochemistry and Molecular Biology, 2017, 33(2): 133–137. (in Chinese) |
| [6] | GUÉGUEN L, POINTILLART A. The bioavailability of dietary calcium[J]. J Am Coll Nutr, 2000, 19(2 Suppl): 119S–136S. |
| [7] | BROŃSKY J, PRŮŠA R, NEVORAL J. The role of amylin and related peptides in osteoporosis[J]. Clin Chim Acta, 2006, 373(1-2): 9–16. DOI: 10.1016/j.cca.2006.05.009 |
| [8] |
刘继中, 纪宗玲, 陈苏民. OPG/RANKL/RANK系统与骨破坏性疾病[J]. 生物工程学报, 2003, 19(6): 655–660.
LIU J Z, JI Z L, CHEN S M. The OPG/RANKL/RANK system and bone resorptive disease[J]. Chinese Journal of Biotechnology, 2003, 19(6): 655–660. (in Chinese) |
| [9] | VARLEY I, HUGHES D C, GREEVES J P, et al. RANK/RANKL/OPG pathway: genetic associations with stress fracture period prevalence in elite athletes[J]. Bone, 2015, 71: 131–136. DOI: 10.1016/j.bone.2014.10.004 |
| [10] | TU P, DUAN P, ZHANG R S, et al. Polymorphisms in genes in the RANKL/RANK/OPG pathway are associated with bone mineral density at different skeletal sites in post-menopausal women[J]. Osteoporos Int, 2015, 26(1): 179–185. DOI: 10.1007/s00198-014-2854-7 |
| [11] | OHLSSON C, VANDENPUT L. The role of estrogens for male bone health[J]. Eur J Endocrinol, 2009, 160(6): 883–889. DOI: 10.1530/EJE-09-0118 |
| [12] |
尹鑫, 于海龙, 李青春, 等. 补肾中药对OPG/RANK/RANKL系统调控作用的研究进展[J]. 承德医学院学报, 2016, 33(2): 126–129.
YIN X, YU H L, LI Q C, et al. Research progress on regulation of kidney-tonifying herbs on OPG /RANK/RANKL system[J]. Journal of Chengde Medical College, 2016, 33(2): 126–129. (in Chinese) |
| [13] |
高文伟, 申勇涛, 程稚玲, 等. 钙螯合胶原多肽与雌激素对去卵巢大鼠骨质改善作用的比较[J]. 中国实验动物学报, 2017, 25(3): 256–262.
GAO W W, SHEN Y T, CHENG Z L, et al. Comparison of the ameliorating effect of collagen peptide chelated calcium and estrogen on the bone quality in ovariectomized rats[J]. Acta Laboratorium Animalis Scientia Sinica, 2017, 25(3): 256–262. (in Chinese) |
| [14] |
韩克光, 甄守艳, 范华, 等. 钙螯合羊骨胶原多肽的制备及表征分析[J]. 农业工程学报, 2015, 31(21): 301–307.
HAN K G, ZHEN S Y, FAN H, et al. Preparation and characteristic analysis of calcium-chelated ossein peptide[J]. Transactions of the Chinese Society of Agricultural Engineering, 2015, 31(21): 301–307. DOI: 10.11975/j.issn.1002-6819.2015.21.040 (in Chinese) |
| [15] |
张铁军, 张伟, 边立功, 等. 白藜芦醇对去卵巢大鼠骨质疏松症的保护作用[J]. 解剖学报, 2012, 43(5): 679–684.
ZHANG T J, ZHANG W, BIAN L G, et al. Protective effects and mechanisms of resveratrol on the rats suffering with osteoporosis[J]. Acta Anatomica Sinica, 2012, 43(5): 679–684. (in Chinese) |
| [16] |
何蕾, 薛仁宇, 曹广力, 等. 基于RNA-Seq技术分析家蚕卵巢培养细胞(BmN)高表达基因[J]. 蚕业科学, 2014, 40(3): 409–421.
HE L, XUE R Y, CAO G L, et al. Analysis of highly expressed genes in Bombyx mori ovarian culture cells(BmN)based on RNA-Seq technology[J]. Science of Sericulture, 2014, 40(3): 409–421. (in Chinese) |
| [17] |
李艳敏, 李翠翠, 郑航, 等. 雌激素通过ER-α调控CYP2C8在鸡肝中的表达[J]. 畜牧兽医学报, 2016, 47(12): 2362–2369.
LI Y M, LI C C, ZHENG H, et al. Expression of CYP2C8 is regulated by estrogen through ER-α in liver of chicken[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(12): 2362–2369. (in Chinese) |
| [18] |
赵兵令, 王海东, 陈天直, 等. 小鼠毛囊不同生长周期中MITF下游色素相关基因的定位表达及相关性分析[J]. 中国生物化学与分子生物学报, 2017, 33(2): 198–206.
ZHAO B L, WANG H D, CHEN T Z, et al. Localization and correlation analysis of MITF downstream pigmentation-related genes at different growth cycle of mouse hair follicle[J]. Chinese Journal of Biochemistry and Molecular Biology, 2017, 33(2): 198–206. (in Chinese) |
| [19] |
陈玮. 中青年Graves病患者血清PINP及β-CTx与骨代谢关系分析[D]. 合肥: 安徽医科大学, 2013.
CHEN W. Analysis of the relationship between PINP、β-CTx and bone metabolism in young adult patients with Graves' disease [D]. Hefei: Anhui Medical University, 2013. (in Chinese) http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=D387081 |
| [20] | KOIVULA M K, RISTELI L, RISTELI J. Measurement of aminoterminal propeptide of type Ⅰ procollagen (PINP) in serum[J]. Clin Biochem, 2012, 45(12): 920–927. DOI: 10.1016/j.clinbiochem.2012.03.023 |
| [21] | VASIKARAN S, COOPER C, EASTELL R, et al. International osteoporosis foundation and international federation of clinical chemistry and laboratory medicine position on bone marker standards in osteoporosis[J]. Clin Chem Lab Med, 2011, 49(8): 1271–1274. |
| [22] |
黄云梅. 基于RANKL/RANK/OPG轴的绝经后骨质疏松症发病机制及健骨颗粒干预研究[D]. 福州: 福建中医药大学, 2014.
HUANG Y M. Study on pathogenesis of postmenopausal osteoporosis and effect of Jiangu granule based on OPG/RANKL/RANK System[D]. Fuzhou: Fujian University of Traditional Chinese Medicine, 2014. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10393-1014241390.htm |
| [23] |
刘康, 吴风晴, 吴连国, 等. 骨碎补总黄酮对骨质疏松模型大鼠OPG/RANKL/RANK轴系统的影响[J]. 中国现代应用药学, 2015, 32(6): 652–656.
LIU K, WU F Q, WU L G, et al. Effect on OPG/RANKL/RANK axial system in osteoporotic rats by total flavones of drynariae rhizoma[J]. Chinese Journal of Modern Applied Pharmacy, 2015, 32(6): 652–656. (in Chinese) |
| [24] |
李子怡, 李玉坤. OPG/RANK/RANKL信号通路在骨质疏松症中的研究进展和应用[J]. 中华老年骨科与康复电子杂志, 2017, 3(2): 124–128.
LI Z Y, LI Y K. Researching progress and application of OPG-RANK-RANKL signaling pathway in osteoporosis[J]. Chinese Journal of Geriatric Orthopaedics and Rehbilitation (Electronic Edition), 2017, 3(2): 124–128. (in Chinese) |



